_Sem_01_Overview+Thermodynamics.pptx
- Количество слайдов: 24

ВВЕДЕНИЕ Общая схема биохимии Метаболизм Структура курса Как учить?

Биохимия – это наука о химических превращениях веществ и переносе энергии в живых системах
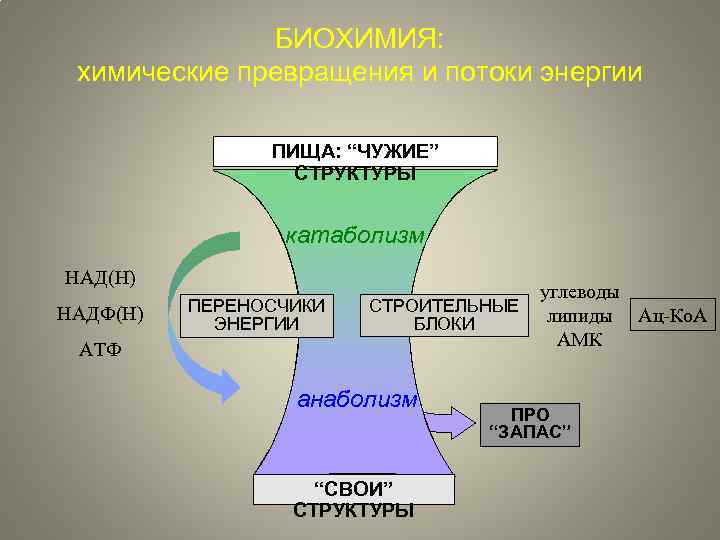
БИОХИМИЯ: химические превращения и потоки энергии ПИЩА: “ЧУЖИЕ” СТРУКТУРЫ катаболизм НАД(Н) НАДФ(Н) ПЕРЕНОСЧИКИ ЭНЕРГИИ СТРОИТЕЛЬНЫЕ БЛОКИ AТФ анаболизм “СВОИ” СТРУКТУРЫ углеводы липиды Ац-Ко. А АМК ПРО “ЗАПАС”

Метаболизм ЭТО выучить невозможно !

Узлы и Связи Количество узлов (интермедиатов) в метаболических путях и линий (ферментов), связанных с ними.
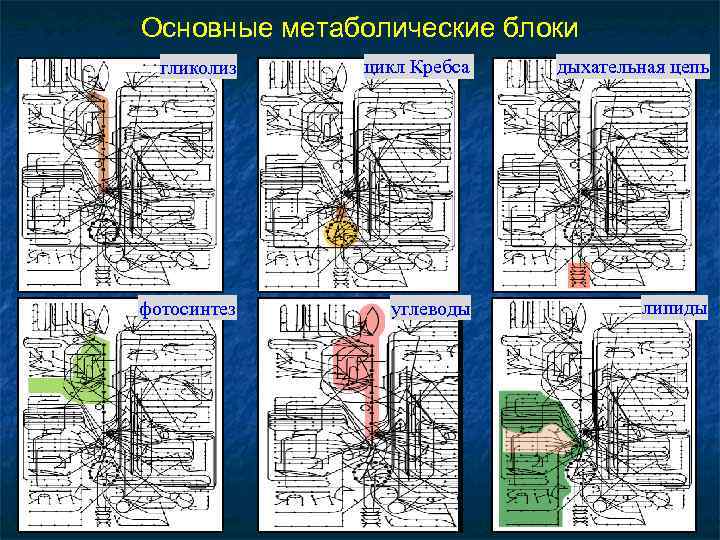
Основные метаболические блоки гликолиз цикл Кребса дыхательная цепь фотосинтез углеводы липиды
Метаболоны 1 2 3
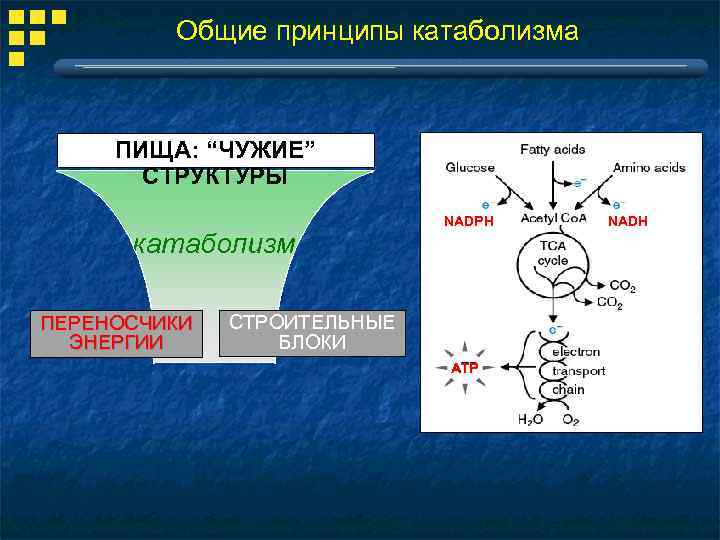
Общие принципы катаболизма ПИЩА: “ЧУЖИЕ” СТРУКТУРЫ катаболизм ПЕРЕНОСЧИКИ ЭНЕРГИИ NADPH СТРОИТЕЛЬНЫЕ БЛОКИ ATP NADH
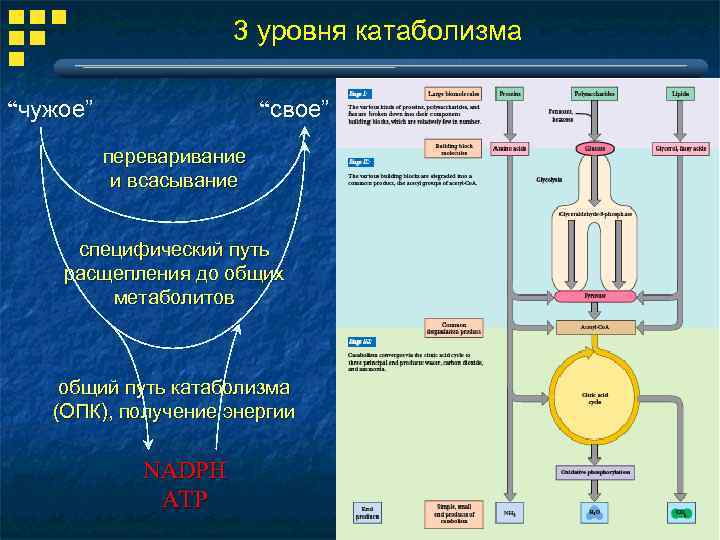
3 уровня катаболизма “чужое” “свое” переваривание и всасывание специфический путь расщепления до общих метаболитов общий путь катаболизма (ОПК), получение энергии NADPH ATP

Структура курса ØТермодинамика и физико-химические основы Ø Белки Ø структура определяет функцию Ø энзимология Ø Метаболизм: углеводный обмен Ø Общий путь катаболизма ØМетаболизм: липидный обмен ØМетаболизм: обмен аминокислот Ø Интеграция: гормоны и регуляция

Главные составляющие каждого раздела ØКлассификация и представители (статическая б/х) Ø Поступление в организм (переваривание и всасывание) Ø Химические превращения (динамическая б/х) Ø Потоки энергии (энергетический баланс) ØРегуляция (физиологическая интеграция)

ТРАНСФОРМАЦИЯ ЭНЕРГИИ Термодинамика Свободная энергия Гиббса Стандартное состояние
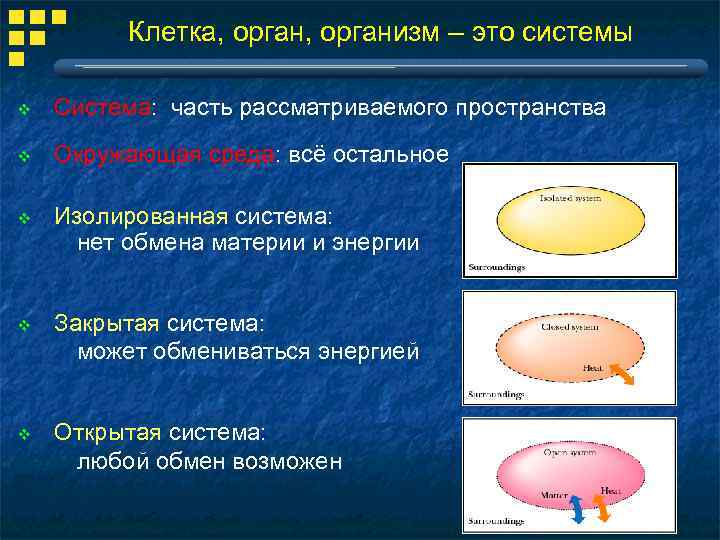
Клетка, организм – это системы v Система: часть рассматриваемого пространства v Окружающая среда: всё остальное v Изолированная система: нет обмена материи и энергии v Закрытая система: может обмениваться энергией v Открытая система: любой обмен возможен

Первый закон термодинамики Общая энергия изолированной системы постоянна U( внутренняя энергия системы) - это функция данного состояния, для описания его переходов (тепла и работы), онане зависит от способа достижения этого состояния и изменяется только тогда, когда системаобменивается с окружающей средой энергией в виде тепла или работы. U = Q– Aили. Q = U +A Q - тепло, поглощенное в систему A- работа, совершенная системой

Энтальпия (Н) - это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту H = U + PV В биохимических процессах давлениеобычно не меняется: H = U + P V = q + w + P V = q - P V + P V = q Т. е. , изменение энтальпии Н - это тепло, поглощенное системой при постоянном давлении

Второй закон термодинамики Невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от тела с низкой температурой к телу с более высокой температурой Общее свойство всех необратимых процессов - они протекают в термодинамически неравновесной системе. В результате этих процессов замкнутая система стремится к состоянию термодинамического равновесия. Все обратимые процессы являются квазистатическими.

Энтропия (S) – термодинамическая функция состояния, которая служит мерой беспорядка (неупорядоченности) системы. S = k ln W Система свободно изменяетсяв сторону увеличения беспорядка и хаотичности (энтропии) ( Энтропия не меняется в обратимых процессах и возрастает в необратимых ) ΔS ≥ 0

Третий закон термодинамики При стремлении температуры к абсолютному нулю энтропия термодинамической системы стремится к постоянному минимуму. Точка отсчета и абсолютная шкала энтропии. Энтропия любого упорядоченного кристалла стремится к нулю при Т -> 00 K при T = 00 K энтропия равна 0

Свободная энергия Гиббса Самопроизвольное протекание процесса определяется изобарно-изотермическим потенциалом или свободной энергией Гиббса G : G = H - TS При постоянном давлении и температуре: ΔG = ΔH - TΔS ЕслиΔG = 0, реакция находится в равновесии ЕслиΔG < 0, реакция протекает как написана вечный двигатель невозможен
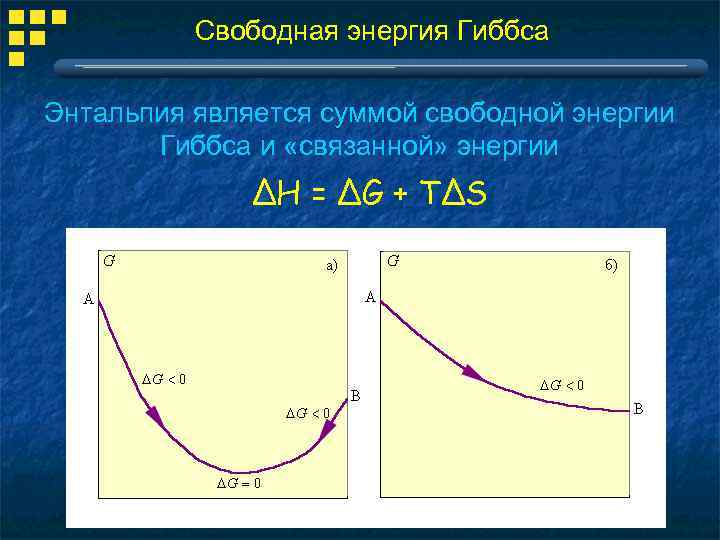
Свободная энергия Гиббса Энтальпия является суммой свободной энергии Гиббса и «связанной» энергии ΔH = ΔG + TΔS

Стандартное состояние Для сравнения параметров различных реакций Стандартное состояние определяется как сосоятние вещества при давлении 1 бар, заданной температуре и концентрациях веществ(а) 1 М Н 0 G 0 Е 0
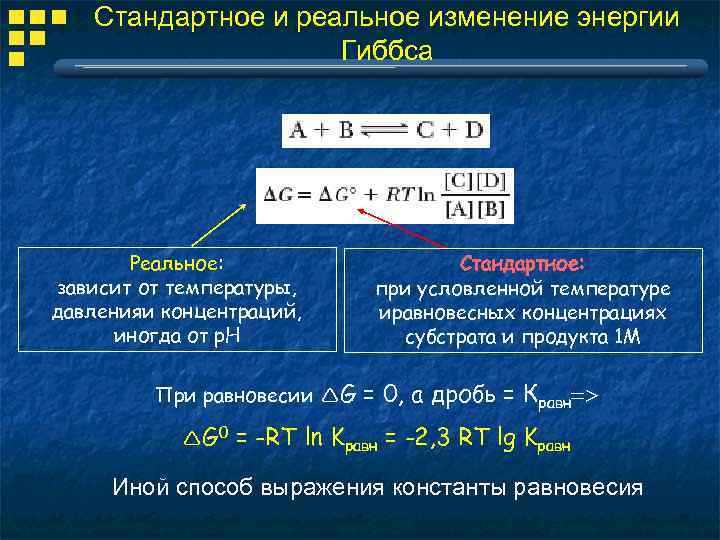
Стандартное и реальное изменение энергии Гиббса Реальное: зависит от температуры, давленияи концентраций, иногда от р. Н При равновесии G G 0 Стандартное: при условленной температуре иравновесных концентрациях субстрата и продукта 1 М = 0, а дробь = Кравн = -RT ln Kравн = -2, 3 RT lg Kравн Иной способ выражения константы равновесия

Дальше – хуже : ΔG, ΔG’, ΔG 0 и ΔG 0’ Стандартное состояние ΔG 0 не имеет смысла для биохимических реакций с участием Н+ (р. Н = 0) Для р. Н = 7 и Р = 1 атм используется измененное стандартное состояние, обозначаемое ΔG 0’

ΔG’ основная энергетическая характеристика биохимических реакций
_Sem_01_Overview+Thermodynamics.pptx