
Введение Галоге ны (от греч. ἁλός — соль и γένος — рождение, происхождение; иногда употребляется устаревшее название гало иды) — элементы главной подгруппы VII группы.
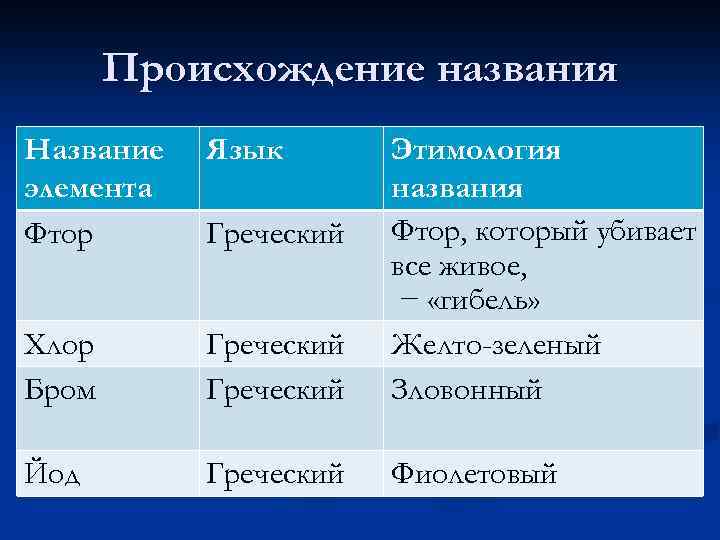
Происхождение названия Название элемента Фтор Язык Хлор Бром Греческий Этимология названия Фтор, который убивает все живое, − «гибель» Желто-зеленый Зловонный Йод Греческий Фиолетовый Греческий
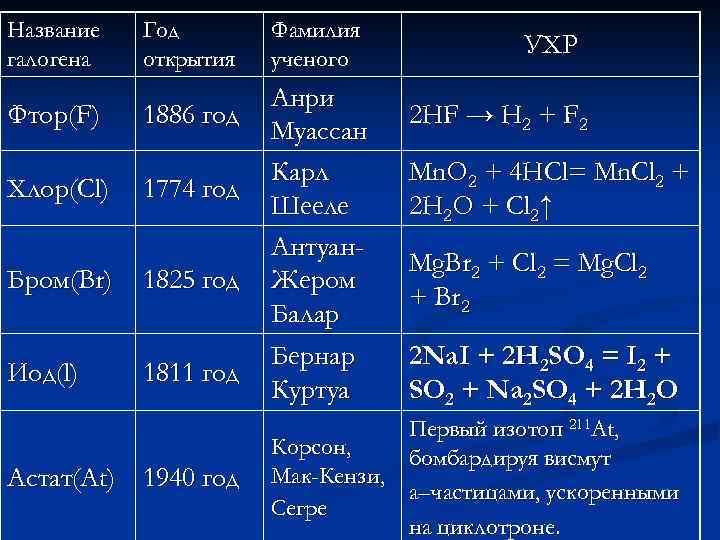
Название галогена Фтор(F) Хлор(Cl) Бром(Br) Иод(l) Год открытия 1886 год 1774 год 1825 год 1811 год Астат(At) 1940 год Фамилия ученого Анри Муассан Карл Шееле Антуан. Жером Балар Бернар Куртуа УХР 2 HF → H 2 + F 2 Mn. O 2 + 4 HCl= Mn. Cl 2 + 2 H 2 O + Cl 2↑ Mg. Br 2 + Cl 2 = Mg. Cl 2 + Br 2 2 Na. I + 2 H 2 SO 4 = I 2 + SO 2 + Na 2 SO 4 + 2 H 2 O Первый изотоп 211 At, Корсон, бомбардируя висмут Мак-Кензи, a–частицами, ускоренными Сегре на циклотроне.

q. Где расположены галогены в периодической системе? q. Какой можно сделать вывод о строении внешнего энергетического уровня атомов галогенов и их свойствах? q. Как изменяются свойства атомов галогенов в подгруппе? q. Как изменяется значение относительной ЭО в подгруппе?
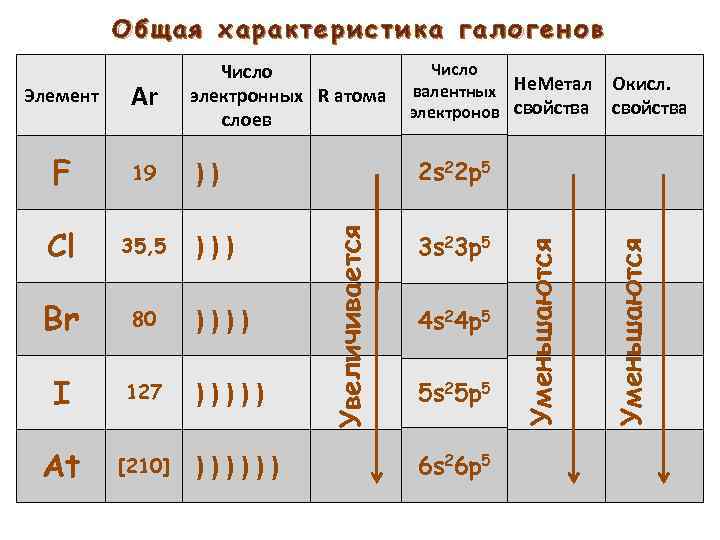
Общая характеристика галогенов 19 Cl 35, 5 Br 80 80 I I 127 At At [210] 2 s 22 p 5 )) )))))) 3 s 23 p 5 4 s 24 p 5 5 s 25 p 5 6 s 26 p 5 Уменьшаются F Уменьшаются Ar Увеличивается Элемент Число Не. Метал Окисл. электронных R атома валентных электронов свойства слоев
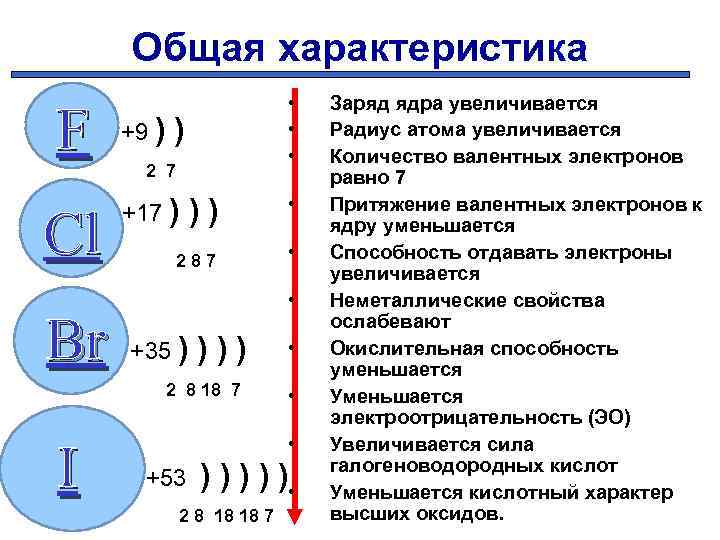
Общая характеристика F Cl Br +9 ) • • • ) 2 7 +17 ) )) 287 • • +35 ) ))) 2 8 18 7 I • • +53 ) ) ) • 2 8 18 18 7 Заряд ядра увеличивается Радиус атома увеличивается Количество валентных электронов равно 7 Притяжение валентных электронов к ядру уменьшается Способность отдавать электроны увеличивается Неметаллические свойства ослабевают Окислительная способность уменьшается Уменьшается электроотрицательность (ЭО) Увеличивается сила галогеноводородных кислот Уменьшается кислотный характер высших оксидов.
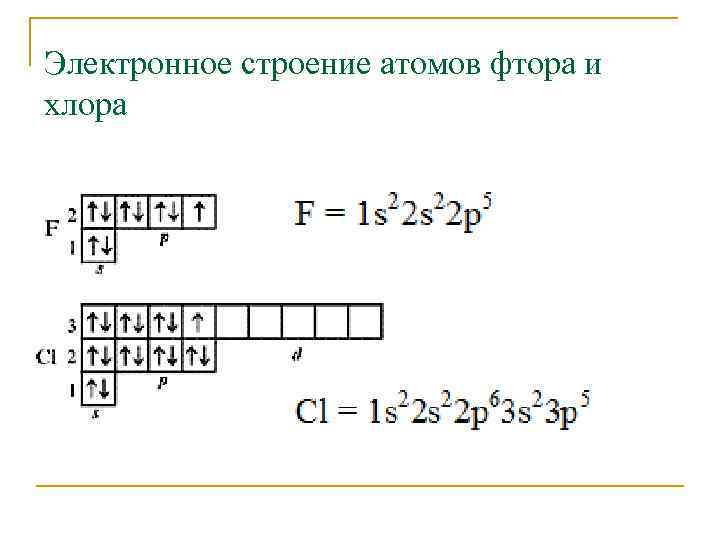
Электронное строение атомов фтора и хлора

Основное состояние, а также первое, второе и третье возбужденные состояния атома хлора Cl* (валентность 1, основное состояние) 1 s 22 p 63 s 23 p 53 d 0 (валентность 3) Cl* 1 s 22 p 63 s 23 p 43 d 1 (валентность 5) Cl* 1 s 22 p 63 s 23 p 33 d 2 Cl* (валентность 7) 1 s 22 p 63 s 13 p 33 d 3

Устойчивые степени окисления хлора

р о т Фтор – от греческого «фторос» – Ф что означает разрушение, гибель. В 1886 году Анри Муассану удалось получить фтор электролизом безводного фторида водорода и в 1906 году ему была присуждена Нобелевская премия Когда Муассан докладывал Парижской академии наук о своем открытии, один глаз ученого был закрыт черной повязкой Славу этого открытия и звание лауреата Нобелевской премии по праву должны были разделить предшественники Анри Муассана: Томас и Георг Нокс – члены Ирландской академии наук, бельгийский химик Лайет, французский химик Джером Никлес – принявший мучительную смерть при проведении опытов, получили серьезные ожоги французские химики Жозеф Гей – Люссак и Луи Теннар, Эдмон Ферми, английский электрохимик Георг Гор и даже

р о л Х В свободном состоянии хлор впервые был получен в 1774 году шведским химиком Карлом Вильгельмом Шееле Mn. O 2 + 4 HCl → Mn. Cl 2 + 2 H 2 O + Cl 2 Этот газ Гэмфри Дэви, английский химик, в 1810 году назвал хлорином. По древнегречески «хлорос» - желто -зеленый Современное название этому газу «хлор» дал в 1812 году французский химик Гей-Люссак

р Б м о «Точь-в-точь как ртуть есть единственный металл, который имеет жидкую фазу при комнатной температуре, бром есть единственный жидкий неметалл» – писал Антуан. Жером Балар, открывший бром в 1825 году. Й д о Йод был открыт в 1811 году французским химикомтехнологом Бернаром Куртуа. Название элемента происходит от греческого «iodes, ioeides» – похожий на фиалку, фиолетовый. 2 Na. I + 2 H 2 SO 4 = I 2 + SO 2 + Na 2 SO 4 + 2 H 2 O