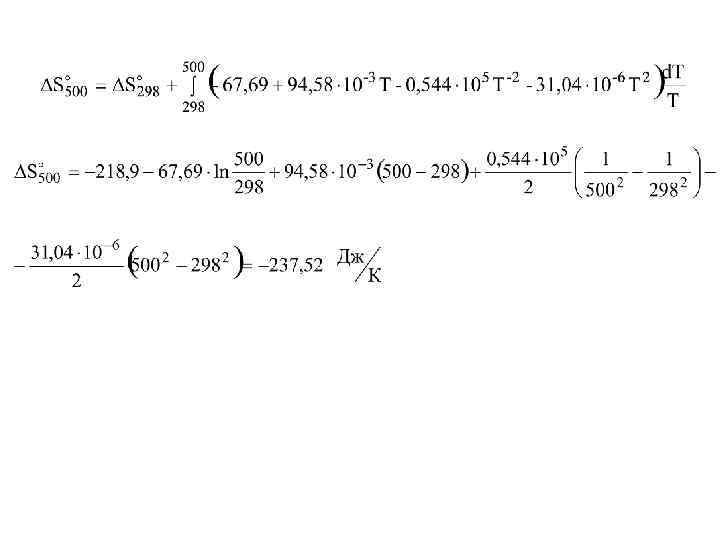2 закон термодинамики.ppt
- Количество слайдов: 29
 Второй закон термодинамики • 1747 г. М. В. Ломоносов «…холодное тело В, погруженное в теплое тело А, не может воспринять большую степень теплоты, чем какую имеет А» • 1824 г. Сади Карно – условия превращения теплоты в полезную работу
Второй закон термодинамики • 1747 г. М. В. Ломоносов «…холодное тело В, погруженное в теплое тело А, не может воспринять большую степень теплоты, чем какую имеет А» • 1824 г. Сади Карно – условия превращения теплоты в полезную работу
 • 1850 г. Клаузиус • 1854 г. Томсон (Лорд Кельвин) • Формулировка Клаузиуса: «Невозможен самопроизвольный переход тепла от менее нагретого тела к более нагретому» • «Невозможно создать вечный двигатель второго рода, т. е. машину, которая периодически превращает тепло среды при постоянной температуре в работу»
• 1850 г. Клаузиус • 1854 г. Томсон (Лорд Кельвин) • Формулировка Клаузиуса: «Невозможен самопроизвольный переход тепла от менее нагретого тела к более нагретому» • «Невозможно создать вечный двигатель второго рода, т. е. машину, которая периодически превращает тепло среды при постоянной температуре в работу»
 Необратимые и обратимые процессы • Необратимые процессы – процессы, в которых энтропия увеличивается. - переход тепла от теплого тела к холодному; - расширение газа в пустоту; - взаимная диффузия газов или жидкостей
Необратимые и обратимые процессы • Необратимые процессы – процессы, в которых энтропия увеличивается. - переход тепла от теплого тела к холодному; - расширение газа в пустоту; - взаимная диффузия газов или жидкостей
 • Обратимые процессы – процессы, при которых энтропия остается постоянной. • Обратимым называется процесс посредством которого можно вернуть систему в исходное состояние, не произведя никаких изменений ни в самой системе, ни в окружающей среде.
• Обратимые процессы – процессы, при которых энтропия остается постоянной. • Обратимым называется процесс посредством которого можно вернуть систему в исходное состояние, не произведя никаких изменений ни в самой системе, ни в окружающей среде.

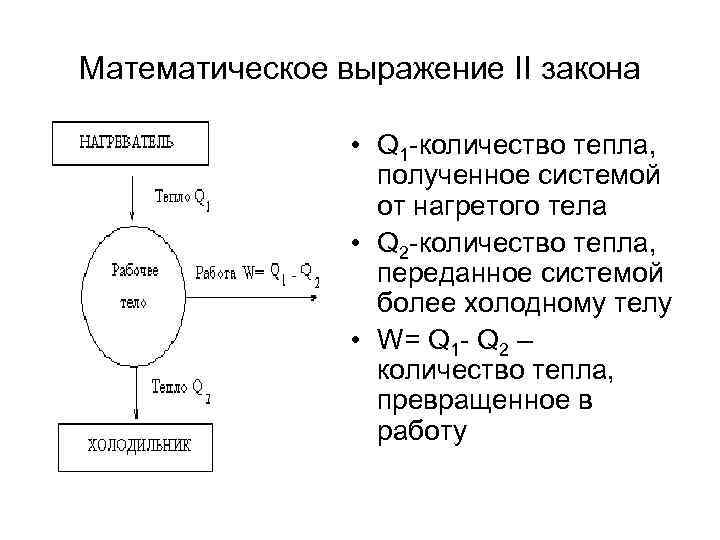 Математическое выражение II закона • Q 1 -количество тепла, полученное системой от нагретого тела • Q 2 -количество тепла, переданное системой более холодному телу • W= Q 1 - Q 2 – количество тепла, превращенное в работу
Математическое выражение II закона • Q 1 -количество тепла, полученное системой от нагретого тела • Q 2 -количество тепла, переданное системой более холодному телу • W= Q 1 - Q 2 – количество тепла, превращенное в работу
 • Коэффициент полезного действия
• Коэффициент полезного действия
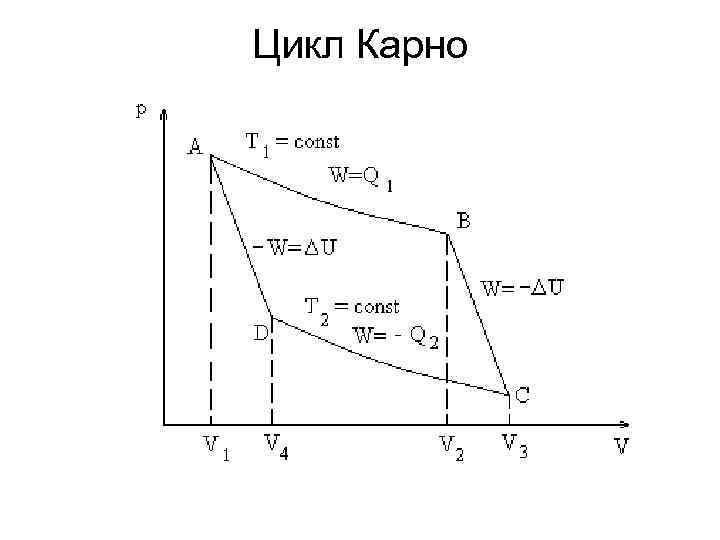 Цикл Карно
Цикл Карно
 • А В Производство работы, совершаемой за счет подводимого к системе тепла. (1) • В С Убыль внутренней энергии (2)
• А В Производство работы, совершаемой за счет подводимого к системе тепла. (1) • В С Убыль внутренней энергии (2)
 • С D Работа, затраченная на сжатие, переходит в отдаваемое окружающей среде тепло: (3) • D A Затраченная работа расходуется на увеличение внутренней энергии (4)
• С D Работа, затраченная на сжатие, переходит в отдаваемое окружающей среде тепло: (3) • D A Затраченная работа расходуется на увеличение внутренней энергии (4)
 (5) Для адиабаты ВС Для адиабаты DA (6) (7)
(5) Для адиабаты ВС Для адиабаты DA (6) (7)
 Разделив уравнение (6) на (7), получим: или Уравнение (5) представим так: (8) Разделим уравнение (8) на уравнение (1): (9)
Разделив уравнение (6) на (7), получим: или Уравнение (5) представим так: (8) Разделим уравнение (8) на уравнение (1): (9)
 Уравнение (9) можно представить в ином виде: Коэффициент полезного действия цикла Карно ( ) всегда больше коэффициента полезного действия любого кругового цикла ( ’), состоящего из необратимых процессов.
Уравнение (9) можно представить в ином виде: Коэффициент полезного действия цикла Карно ( ) всегда больше коэффициента полезного действия любого кругового цикла ( ’), состоящего из необратимых процессов.
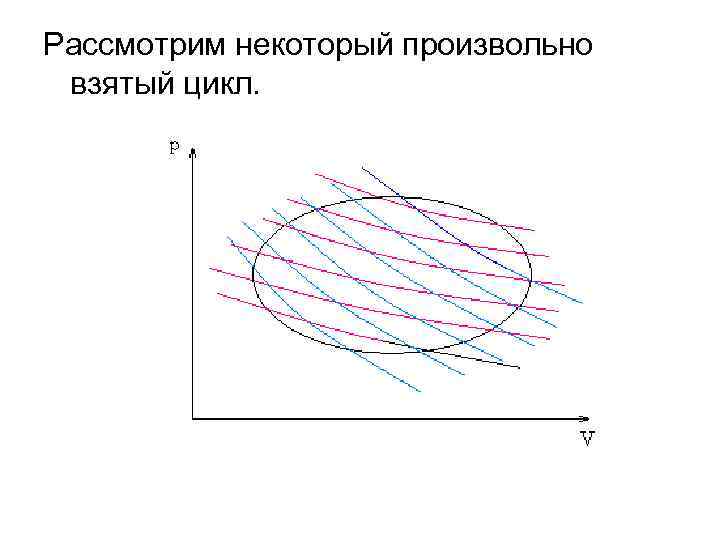 Рассмотрим некоторый произвольно взятый цикл.
Рассмотрим некоторый произвольно взятый цикл.
 Для каждого из бесконечно малых циклов справедливы равенства: и т. д. Суммируем эти равенства:
Для каждого из бесконечно малых циклов справедливы равенства: и т. д. Суммируем эти равенства:
 В пределе алгебраическая сумма переходит в интеграл по замкнутому контуру
В пределе алгебраическая сумма переходит в интеграл по замкнутому контуру
 • Энтропия – S • - для обратимых процессов • Для необратимых процессов
• Энтропия – S • - для обратимых процессов • Для необратимых процессов
 • Математическая формулировка второго начала термодинамики: или Знак > - для необратимого процесса Знак = - для обратимого процесса
• Математическая формулировка второго начала термодинамики: или Знак > - для необратимого процесса Знак = - для обратимого процесса
 • Энтропия является функцией состояния. • Энтропия является аддитивным свойством. Это означает, что энтропия системы равна сумме энтропий составных частей. • Энтропия является мерой разупорядоченности вещества. • Размерность энтропии – единицы энергии деленные на градус (Дж/моль. К) • Энтропия характеризует количество энергии отнесенное к 1 данной температуры.
• Энтропия является функцией состояния. • Энтропия является аддитивным свойством. Это означает, что энтропия системы равна сумме энтропий составных частей. • Энтропия является мерой разупорядоченности вещества. • Размерность энтропии – единицы энергии деленные на градус (Дж/моль. К) • Энтропия характеризует количество энергии отнесенное к 1 данной температуры.
 Вычисление изменения энтропии при различных процессах. • Изобарический процесс (p=const)
Вычисление изменения энтропии при различных процессах. • Изобарический процесс (p=const)
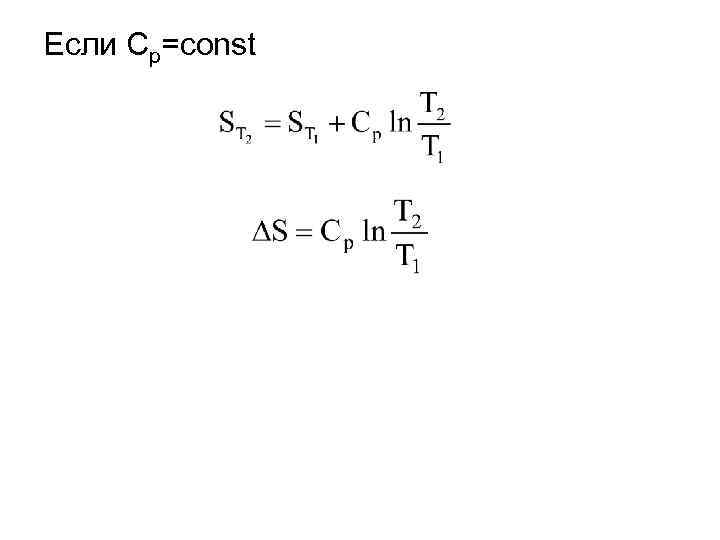 Если Ср=const
Если Ср=const
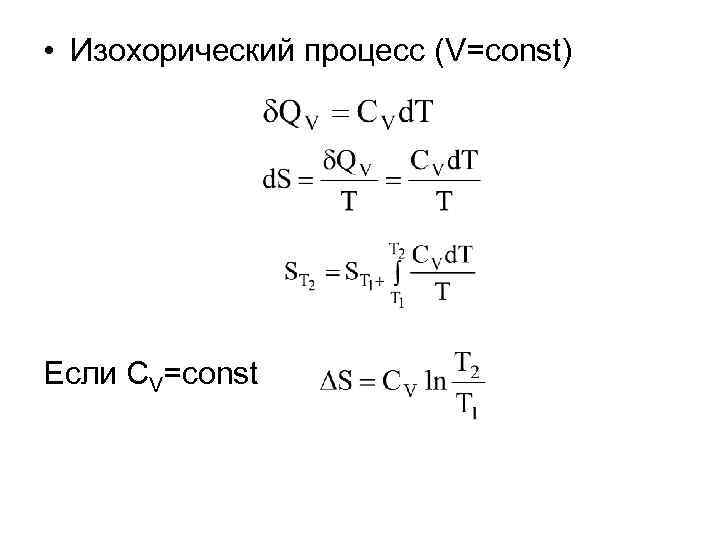 • Изохорический процесс (V=const) Если CV=const
• Изохорический процесс (V=const) Если CV=const
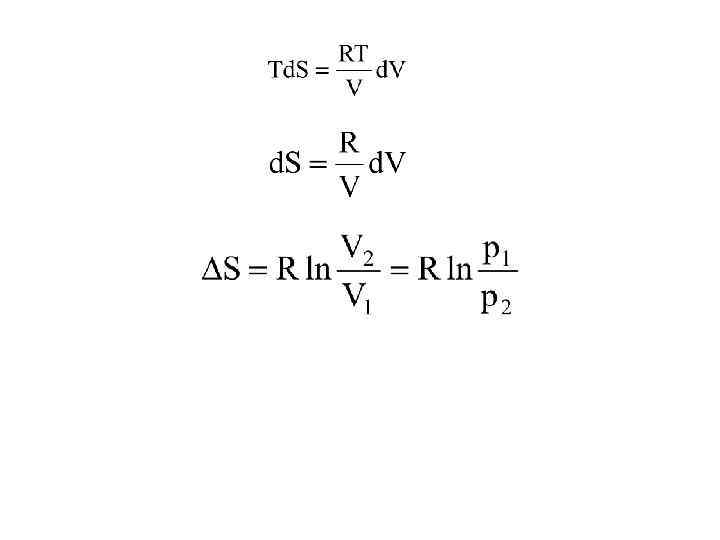
 • Изотермический процесс (T=const) d. U=0
• Изотермический процесс (T=const) d. U=0
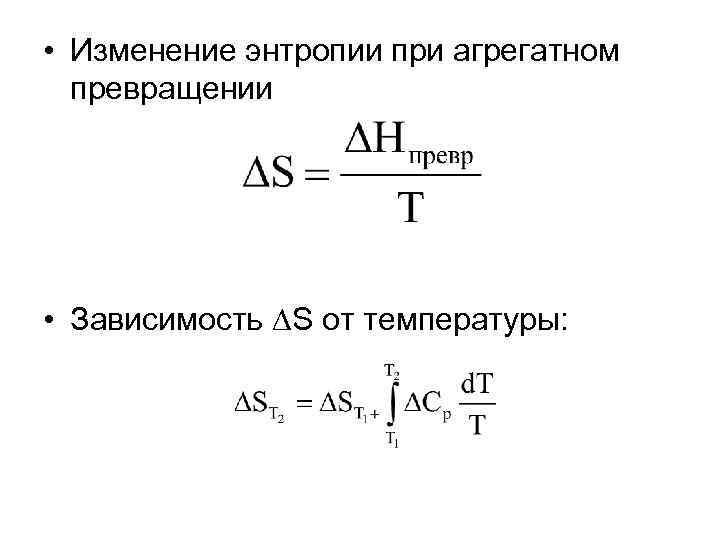 • Изменение энтропии при агрегатном превращении • Зависимость S от температуры:
• Изменение энтропии при агрегатном превращении • Зависимость S от температуры:
 • Рассчитайте изменение энтропии при реакции 2 H 2(газ)+СО(газ)=СН 3 ОН(газ) при температуре 500 К с помощью таблиц стандартных термодинамических величин.
• Рассчитайте изменение энтропии при реакции 2 H 2(газ)+СО(газ)=СН 3 ОН(газ) при температуре 500 К с помощью таблиц стандартных термодинамических величин.
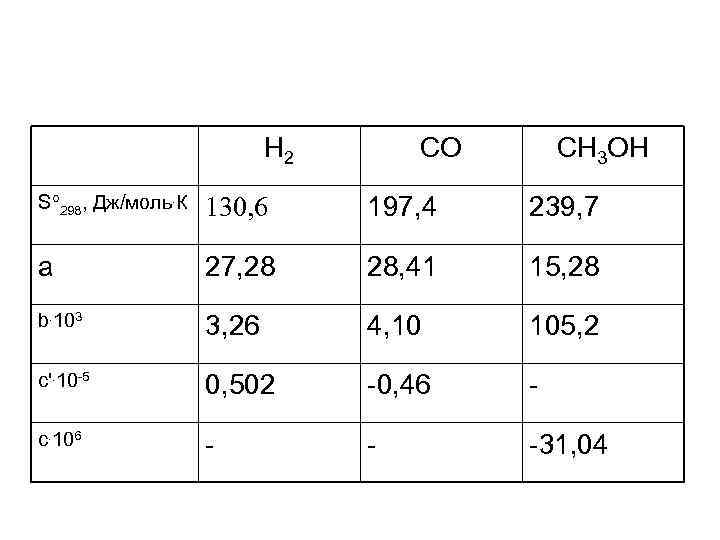 Н 2 СО СН 3 ОН S 298, Дж/моль. К 130, 6 197, 4 239, 7 а 27, 28 28, 41 15, 28 b. 103 3, 26 4, 10 105, 2 c'. 10 -5 0, 502 -0, 46 - c. 106 - - -31, 04
Н 2 СО СН 3 ОН S 298, Дж/моль. К 130, 6 197, 4 239, 7 а 27, 28 28, 41 15, 28 b. 103 3, 26 4, 10 105, 2 c'. 10 -5 0, 502 -0, 46 - c. 106 - - -31, 04
 а = 15, 28 -28, 41 -2. 27, 28 = - 67, 69 b = 105, 2 -4, 10 -2. 3, 26 = 94, 58 с’=0, 46 -2. 0, 502 = -0, 544 с = -31, 04 Сp= -67, 69+94, 58. 10 -3. Т-0, 544. 105 Т-2 -31, 04. 10 -6 Т 2
а = 15, 28 -28, 41 -2. 27, 28 = - 67, 69 b = 105, 2 -4, 10 -2. 3, 26 = 94, 58 с’=0, 46 -2. 0, 502 = -0, 544 с = -31, 04 Сp= -67, 69+94, 58. 10 -3. Т-0, 544. 105 Т-2 -31, 04. 10 -6 Т 2