lecture_2_1.pptx
- Количество слайдов: 31
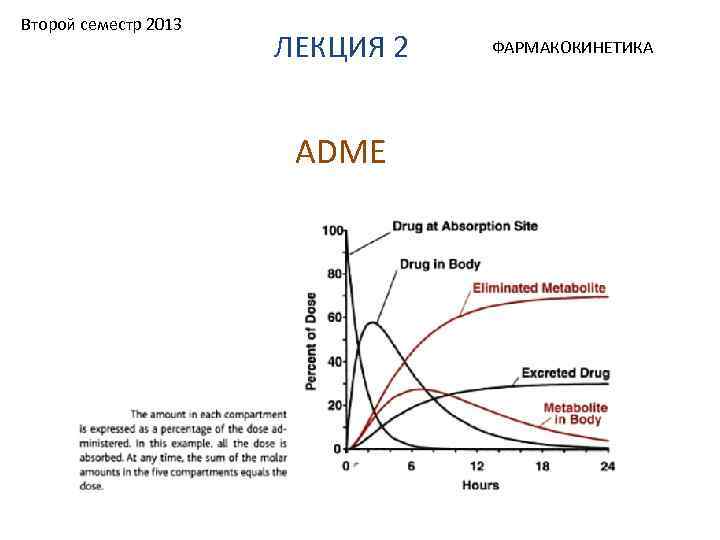 Второй семестр 2013 ЛЕКЦИЯ 2 ADME ФАРМАКОКИНЕТИКА
Второй семестр 2013 ЛЕКЦИЯ 2 ADME ФАРМАКОКИНЕТИКА
 ADME 1. 2. 3. 4. 5. распределения вещества в организме (Vd) время полужизни в плазме крови (T 1/2) степень устойчивости лекарственного соединения по отношению к P гликопротеинам (P gp) степень связывания ЛС с белками крови (PPB) клиренс ( Cl, элиминирование) ►Следуя общепринятой методологии разработки новых ЛС, фармакокинетические параметры и токсичность (не суррогатная фармакокинетика) оцениваются на более поздних стадиях биологических исследований; ►Существует целый ряд примеров тому, как перспективные агенты, показавшие высокие значения активности и селективности на этапе in vitro и на начальной стадии in vivo биологического тестирования, снимались с дальнейших испытаний по причине неудовлетворительных ADME характеристик; ►На сегодняшний день существует несколько подходов к оценке фармакокинетических параметров, включая наиболее тривиальные общие структурные фильтры, такие как правила Липински (Lipinski's rule of five) для пероральных лекарственных форм. Во многих случаях применение такого рода простых критериев не гарантирует должной точности прогнозирования и детализации, т. к. они являются общими и несут значение границ подобия лекарственным соединениям (Drug Likeness). Not more than 5 hydrogen bond donors (nitrogen or oxygen atoms with one or more hydrogen atoms) Not more than 10 hydrogen bond acceptors (nitrogen or oxygen atoms) A molecular mass less than 500 daltons Molar refractivity from 40 to 130 An octanol water partition coefficient log P not greater than 5 Number of atoms from 20 to 70 Polar surface area no greater than 140 Ǻ 2
ADME 1. 2. 3. 4. 5. распределения вещества в организме (Vd) время полужизни в плазме крови (T 1/2) степень устойчивости лекарственного соединения по отношению к P гликопротеинам (P gp) степень связывания ЛС с белками крови (PPB) клиренс ( Cl, элиминирование) ►Следуя общепринятой методологии разработки новых ЛС, фармакокинетические параметры и токсичность (не суррогатная фармакокинетика) оцениваются на более поздних стадиях биологических исследований; ►Существует целый ряд примеров тому, как перспективные агенты, показавшие высокие значения активности и селективности на этапе in vitro и на начальной стадии in vivo биологического тестирования, снимались с дальнейших испытаний по причине неудовлетворительных ADME характеристик; ►На сегодняшний день существует несколько подходов к оценке фармакокинетических параметров, включая наиболее тривиальные общие структурные фильтры, такие как правила Липински (Lipinski's rule of five) для пероральных лекарственных форм. Во многих случаях применение такого рода простых критериев не гарантирует должной точности прогнозирования и детализации, т. к. они являются общими и несут значение границ подобия лекарственным соединениям (Drug Likeness). Not more than 5 hydrogen bond donors (nitrogen or oxygen atoms with one or more hydrogen atoms) Not more than 10 hydrogen bond acceptors (nitrogen or oxygen atoms) A molecular mass less than 500 daltons Molar refractivity from 40 to 130 An octanol water partition coefficient log P not greater than 5 Number of atoms from 20 to 70 Polar surface area no greater than 140 Ǻ 2
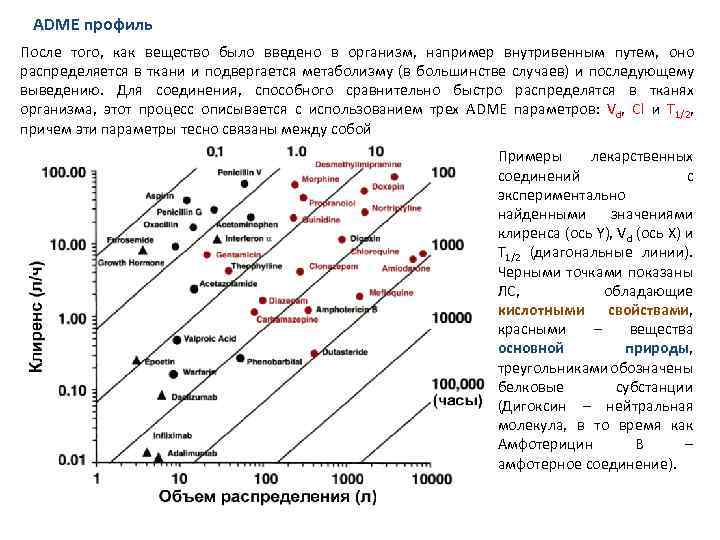 ADME профиль После того, как вещество было введено в организм, например внутривенным путем, оно распределяется в ткани и подвергается метаболизму (в большинстве случаев) и последующему выведению. Для соединения, способного сравнительно быстро распределятся в тканях организма, этот процесс описывается с использованием трех ADME параметров: Vd, Cl и T 1/2, причем эти параметры тесно связаны между собой Примеры лекарственных соединений с экспериментально найденными значениями клиренса (ось Y), Vd (ось Х) и T 1/2 (диагональные линии). Черными точками показаны ЛС, обладающие кислотными свойствами, красными – вещества основной природы, треугольниками обозначены белковые субстанции (Дигоксин – нейтральная молекула, в то время как Амфотерицин B – амфотерное соединение).
ADME профиль После того, как вещество было введено в организм, например внутривенным путем, оно распределяется в ткани и подвергается метаболизму (в большинстве случаев) и последующему выведению. Для соединения, способного сравнительно быстро распределятся в тканях организма, этот процесс описывается с использованием трех ADME параметров: Vd, Cl и T 1/2, причем эти параметры тесно связаны между собой Примеры лекарственных соединений с экспериментально найденными значениями клиренса (ось Y), Vd (ось Х) и T 1/2 (диагональные линии). Черными точками показаны ЛС, обладающие кислотными свойствами, красными – вещества основной природы, треугольниками обозначены белковые субстанции (Дигоксин – нейтральная молекула, в то время как Амфотерицин B – амфотерное соединение).
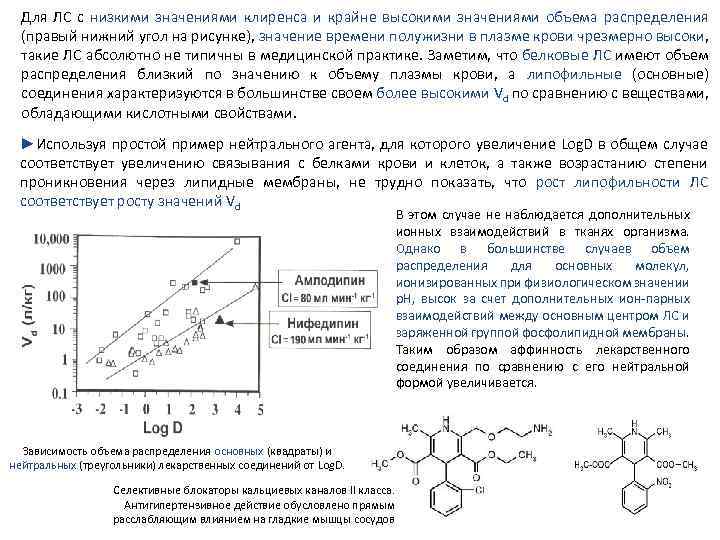 Для ЛС с низкими значениями клиренса и крайне высокими значениями объема распределения (правый нижний угол на рисунке), значение времени полужизни в плазме крови чрезмерно высоки, такие ЛС абсолютно не типичны в медицинской практике. Заметим, что белковые ЛС имеют объем распределения близкий по значению к объему плазмы крови, а липофильные (основные) соединения характеризуются в большинстве своем более высокими Vd по сравнению с веществами, обладающими кислотными свойствами. ►Используя простой пример нейтрального агента, для которого увеличение Log. D в общем случае соответствует увеличению связывания с белками крови и клеток, а также возрастанию степени проникновения через липидные мембраны, не трудно показать, что рост липофильности ЛС соответствует росту значений Vd В этом случае не наблюдается дополнительных ионных взаимодействий в тканях организма. Однако в большинстве случаев объем распределения для основных молекул, ионизированных при физиологическом значении p. H, высок за счет дополнительных ион парных взаимодействий между основным центром ЛС и заряженной группой фосфолипидной мембраны. Таким образом аффинность лекарственного соединения по сравнению с его нейтральной формой увеличивается. Зависимость объема распределения основных (квадраты) и нейтральных (треугольники) лекарственных соединений от Log. D. Селективные блокаторы кальциевых каналов II класса. Антигипертензивное действие обусловлено прямым расслабляющим влиянием на гладкие мышцы сосудов
Для ЛС с низкими значениями клиренса и крайне высокими значениями объема распределения (правый нижний угол на рисунке), значение времени полужизни в плазме крови чрезмерно высоки, такие ЛС абсолютно не типичны в медицинской практике. Заметим, что белковые ЛС имеют объем распределения близкий по значению к объему плазмы крови, а липофильные (основные) соединения характеризуются в большинстве своем более высокими Vd по сравнению с веществами, обладающими кислотными свойствами. ►Используя простой пример нейтрального агента, для которого увеличение Log. D в общем случае соответствует увеличению связывания с белками крови и клеток, а также возрастанию степени проникновения через липидные мембраны, не трудно показать, что рост липофильности ЛС соответствует росту значений Vd В этом случае не наблюдается дополнительных ионных взаимодействий в тканях организма. Однако в большинстве случаев объем распределения для основных молекул, ионизированных при физиологическом значении p. H, высок за счет дополнительных ион парных взаимодействий между основным центром ЛС и заряженной группой фосфолипидной мембраны. Таким образом аффинность лекарственного соединения по сравнению с его нейтральной формой увеличивается. Зависимость объема распределения основных (квадраты) и нейтральных (треугольники) лекарственных соединений от Log. D. Селективные блокаторы кальциевых каналов II класса. Антигипертензивное действие обусловлено прямым расслабляющим влиянием на гладкие мышцы сосудов
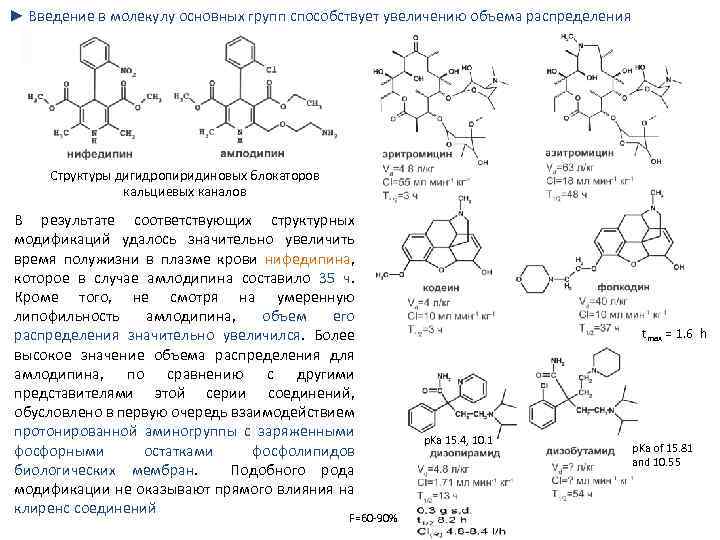 ► Введение в молекулу основных групп способствует увеличению объема распределения Структуры дигидропиридиновых блокаторов кальциевых каналов В результате соответствующих структурных модификаций удалось значительно увеличить время полужизни в плазме крови нифедипина, которое в случае амлодипина составило 35 ч. Кроме того, не смотря на умеренную липофильность амлодипина, объем его распределения значительно увеличился. Более высокое значение объема распределения для амлодипина, по сравнению с другими представителями этой серии соединений, обусловлено в первую очередь взаимодействием протонированной аминогруппы с заряженными фосфорными остатками фосфолипидов биологических мембран. Подобного рода модификации не оказывают прямого влияния на клиренс соединений F=60 90% tmax = 1. 6 h p. Ka 15. 4, 10. 1 p. Ka of 15. 81 and 10. 55
► Введение в молекулу основных групп способствует увеличению объема распределения Структуры дигидропиридиновых блокаторов кальциевых каналов В результате соответствующих структурных модификаций удалось значительно увеличить время полужизни в плазме крови нифедипина, которое в случае амлодипина составило 35 ч. Кроме того, не смотря на умеренную липофильность амлодипина, объем его распределения значительно увеличился. Более высокое значение объема распределения для амлодипина, по сравнению с другими представителями этой серии соединений, обусловлено в первую очередь взаимодействием протонированной аминогруппы с заряженными фосфорными остатками фосфолипидов биологических мембран. Подобного рода модификации не оказывают прямого влияния на клиренс соединений F=60 90% tmax = 1. 6 h p. Ka 15. 4, 10. 1 p. Ka of 15. 81 and 10. 55
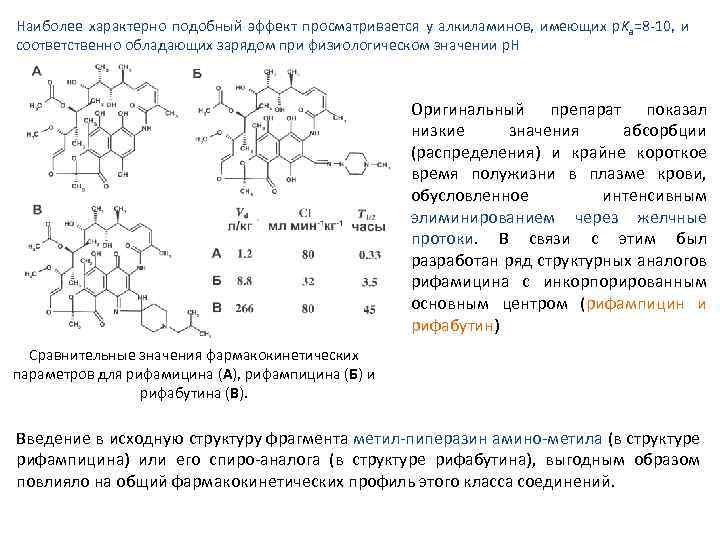 Наиболее характерно подобный эффект просматривается у алкиламинов, имеющих p. Ka=8 10, и соответственно обладающих зарядом при физиологическом значении р. Н Оригинальный препарат показал низкие значения абсорбции (распределения) и крайне короткое время полужизни в плазме крови, обусловленное интенсивным элиминированием через желчные протоки. В связи с этим был разработан ряд структурных аналогов рифамицина с инкорпорированным основным центром (рифампицин и рифабутин) Сравнительные значения фармакокинетических параметров для рифамицина (А), рифампицина (Б) и рифабутина (В). Введение в исходную структуру фрагмента метил пиперазин амино метила (в структуре рифампицина) или его спиро аналога (в структуре рифабутина), выгодным образом повлияло на общий фармакокинетических профиль этого класса соединений.
Наиболее характерно подобный эффект просматривается у алкиламинов, имеющих p. Ka=8 10, и соответственно обладающих зарядом при физиологическом значении р. Н Оригинальный препарат показал низкие значения абсорбции (распределения) и крайне короткое время полужизни в плазме крови, обусловленное интенсивным элиминированием через желчные протоки. В связи с этим был разработан ряд структурных аналогов рифамицина с инкорпорированным основным центром (рифампицин и рифабутин) Сравнительные значения фармакокинетических параметров для рифамицина (А), рифампицина (Б) и рифабутина (В). Введение в исходную структуру фрагмента метил пиперазин амино метила (в структуре рифампицина) или его спиро аналога (в структуре рифабутина), выгодным образом повлияло на общий фармакокинетических профиль этого класса соединений.
 ►Перед рассмотрением практически каждого из ADME параметров необходимо учитывать тесные взаимосвязи между ними, что в определенной степени нивелирует значение исключительно одного свойства молекулы, например липофильности, при оценке факторов, влияющих на отдельно взятое фармакокинетическое свойство. Объем распределения вещества в организме (Vd) соответствует объему жидкости организма или же массе ткани, необходимому для равномерного распределения всего количества введенного вещества в концентрации, равной его концентрации в плазме крови. Иными словами, объем распределения характеризует аффинность соединения по отношению к тканям. Такая аффинность может относится как к различным органам и тканям, так и к одному единственному или же наиболее выраженному участку, к которому вещество испытывает наибольшее сродство в силу специфических взаимодействий. ► Vd в большинстве случаев является исключительно теоретическим показателем Количество свободной жидкости в организме взрослого человека насчитывает в среднем около 60% от общей массы тела. Она включает в себя 35% внутриклеточной жидкости и 25% внеклеточной жидкости, которая в свою очередь состоит из 4% крови и 21% интерстициальной жидкости, окружающей все клетки вне сосудистой системы. Кровь же состоит из жидкой плазмы и распределенных в ней форменных элементов крови (лейкоциты, эритроциты, тромбоциты). Плазма включает в себя жидкую фракцию крови с растворенным в ней белком фибриногеном, после отделения которого получают серозную жидкость (serum)
►Перед рассмотрением практически каждого из ADME параметров необходимо учитывать тесные взаимосвязи между ними, что в определенной степени нивелирует значение исключительно одного свойства молекулы, например липофильности, при оценке факторов, влияющих на отдельно взятое фармакокинетическое свойство. Объем распределения вещества в организме (Vd) соответствует объему жидкости организма или же массе ткани, необходимому для равномерного распределения всего количества введенного вещества в концентрации, равной его концентрации в плазме крови. Иными словами, объем распределения характеризует аффинность соединения по отношению к тканям. Такая аффинность может относится как к различным органам и тканям, так и к одному единственному или же наиболее выраженному участку, к которому вещество испытывает наибольшее сродство в силу специфических взаимодействий. ► Vd в большинстве случаев является исключительно теоретическим показателем Количество свободной жидкости в организме взрослого человека насчитывает в среднем около 60% от общей массы тела. Она включает в себя 35% внутриклеточной жидкости и 25% внеклеточной жидкости, которая в свою очередь состоит из 4% крови и 21% интерстициальной жидкости, окружающей все клетки вне сосудистой системы. Кровь же состоит из жидкой плазмы и распределенных в ней форменных элементов крови (лейкоциты, эритроциты, тромбоциты). Плазма включает в себя жидкую фракцию крови с растворенным в ней белком фибриногеном, после отделения которого получают серозную жидкость (serum)
 ►Средний объем крови у взрослого человека составляет 80 мл/кг (объем плазмы порядка 3 л), в то время как средний объем воды – 800 мл/кг (в среднем около 45 л. Значение параметра Vd зависит от ряда условий и допущений. За счет дифференцировки крови по составу концентрация вещества именно в плазме крови может быть намного меньше, чем в ее общем объеме, за счет, например, сильного связывания соединения с форменными элементами. ►В большинстве случаев концентрация вещества в серозной жидкости является наиболее значимой характеристикой, поскольку биологическая активность ЛС обусловлена в первую очередь его свободной концентрацией. Однако для некоторых веществ, например антималярийных препаратов, которые обладают высоким сродством к эритроцитам, следует использовать общую концентрацию вещества во всем объеме крови. ►Исходя из средних объемов крови и воды в организме человека, Vd имеет физиологический смысл исключительно в интервале 80 -800 мл/кг, что в первом случае соответствует распределению всего вещества только в плазме крови (Vd=0, 08 л/кг), а во втором случае – в общем объеме воды (0, 8 л/кг). За пределами этих величин объем распределения имеет теоретическое/математическое значение; в этом случае его часто называют гипотетическим или кажущимся объемом распределения
►Средний объем крови у взрослого человека составляет 80 мл/кг (объем плазмы порядка 3 л), в то время как средний объем воды – 800 мл/кг (в среднем около 45 л. Значение параметра Vd зависит от ряда условий и допущений. За счет дифференцировки крови по составу концентрация вещества именно в плазме крови может быть намного меньше, чем в ее общем объеме, за счет, например, сильного связывания соединения с форменными элементами. ►В большинстве случаев концентрация вещества в серозной жидкости является наиболее значимой характеристикой, поскольку биологическая активность ЛС обусловлена в первую очередь его свободной концентрацией. Однако для некоторых веществ, например антималярийных препаратов, которые обладают высоким сродством к эритроцитам, следует использовать общую концентрацию вещества во всем объеме крови. ►Исходя из средних объемов крови и воды в организме человека, Vd имеет физиологический смысл исключительно в интервале 80 -800 мл/кг, что в первом случае соответствует распределению всего вещества только в плазме крови (Vd=0, 08 л/кг), а во втором случае – в общем объеме воды (0, 8 л/кг). За пределами этих величин объем распределения имеет теоретическое/математическое значение; в этом случае его часто называют гипотетическим или кажущимся объемом распределения
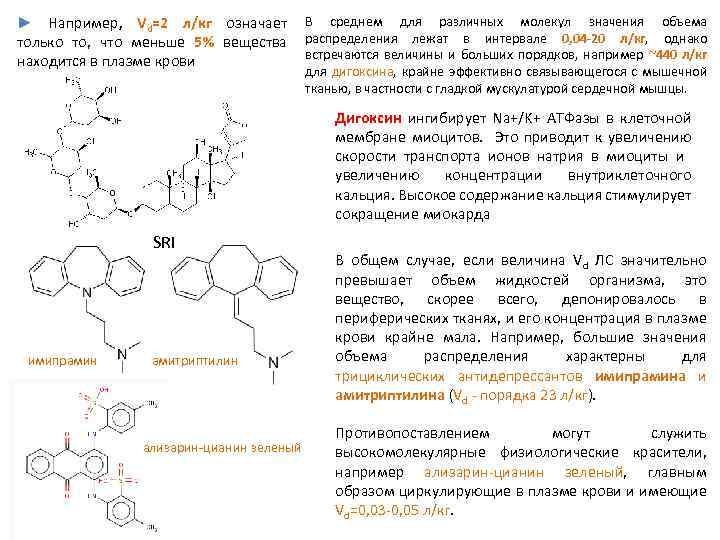 ► Например, Vd=2 л/кг означает только то, что меньше 5% вещества находится в плазме крови В среднем для различных молекул значения объема распределения лежат в интервале 0, 04 -20 л/кг, однако встречаются величины и больших порядков, например ~440 л/кг для дигоксина, крайне эффективно связывающегося с мышечной тканью, в частности с гладкой мускулатурой сердечной мышцы. Дигоксин ингибирует Na+/K+ АТФазы в клеточной мембране миоцитов. Это приводит к увеличению скорости транспорта ионов натрия в миоциты и увеличению концентрации внутриклеточного кальция. Высокое содержание кальция стимулирует сокращение миокарда SRI имипрамин амитриптилин ализарин цианин зеленый В общем случае, если величина Vd ЛС значительно превышает объем жидкостей организма, это вещество, скорее всего, депонировалось в периферических тканях, и его концентрация в плазме крови крайне мала. Например, большие значения объема распределения характерны для трициклических антидепрессантов имипрамина и амитриптилина (Vd порядка 23 л/кг). Противопоставлением могут служить высокомолекулярные физиологические красители, например ализарин цианин зеленый, главным образом циркулирующие в плазме крови и имеющие Vd=0, 03 0, 05 л/кг.
► Например, Vd=2 л/кг означает только то, что меньше 5% вещества находится в плазме крови В среднем для различных молекул значения объема распределения лежат в интервале 0, 04 -20 л/кг, однако встречаются величины и больших порядков, например ~440 л/кг для дигоксина, крайне эффективно связывающегося с мышечной тканью, в частности с гладкой мускулатурой сердечной мышцы. Дигоксин ингибирует Na+/K+ АТФазы в клеточной мембране миоцитов. Это приводит к увеличению скорости транспорта ионов натрия в миоциты и увеличению концентрации внутриклеточного кальция. Высокое содержание кальция стимулирует сокращение миокарда SRI имипрамин амитриптилин ализарин цианин зеленый В общем случае, если величина Vd ЛС значительно превышает объем жидкостей организма, это вещество, скорее всего, депонировалось в периферических тканях, и его концентрация в плазме крови крайне мала. Например, большие значения объема распределения характерны для трициклических антидепрессантов имипрамина и амитриптилина (Vd порядка 23 л/кг). Противопоставлением могут служить высокомолекулярные физиологические красители, например ализарин цианин зеленый, главным образом циркулирующие в плазме крови и имеющие Vd=0, 03 0, 05 л/кг.
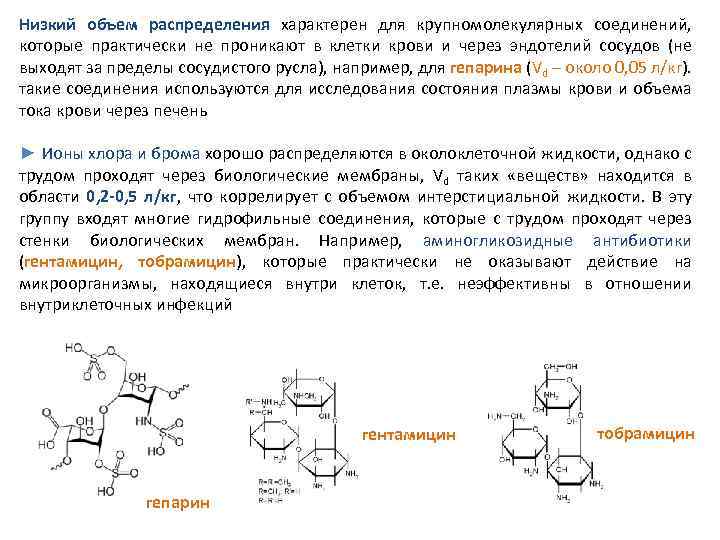 Низкий объем распределения характерен для крупномолекулярных соединений, которые практически не проникают в клетки крови и через эндотелий сосудов (не выходят за пределы сосудистого русла), например, для гепарина (Vd – около 0, 05 л/кг). такие соединения используются для исследования состояния плазмы крови и объема тока крови через печень ► Ионы хлора и брома хорошо распределяются в околоклеточной жидкости, однако с трудом проходят через биологические мембраны, Vd таких «веществ» находится в области 0, 2 -0, 5 л/кг, что коррелирует с объемом интерстициальной жидкости. В эту группу входят многие гидрофильные соединения, которые с трудом проходят через стенки биологических мембран. Например, аминогликозидные антибиотики (гентамицин, тобрамицин), которые практически не оказывают действие на микроорганизмы, находящиеся внутри клеток, т. е. неэффективны в отношении внутриклеточных инфекций гентамицин гепарин тобрамицин
Низкий объем распределения характерен для крупномолекулярных соединений, которые практически не проникают в клетки крови и через эндотелий сосудов (не выходят за пределы сосудистого русла), например, для гепарина (Vd – около 0, 05 л/кг). такие соединения используются для исследования состояния плазмы крови и объема тока крови через печень ► Ионы хлора и брома хорошо распределяются в околоклеточной жидкости, однако с трудом проходят через биологические мембраны, Vd таких «веществ» находится в области 0, 2 -0, 5 л/кг, что коррелирует с объемом интерстициальной жидкости. В эту группу входят многие гидрофильные соединения, которые с трудом проходят через стенки биологических мембран. Например, аминогликозидные антибиотики (гентамицин, тобрамицин), которые практически не оказывают действие на микроорганизмы, находящиеся внутри клеток, т. е. неэффективны в отношении внутриклеточных инфекций гентамицин гепарин тобрамицин
 Липофильные малые молекулы способны проходить через стенки биологических мембран, заполняя при этом оба объема – внутриклеточную жидкость и околоклеточную – равновесным образом. Например, антипирин (анальгетик) с Vd=0, 7 л/кг часто используется в качестве маркера общего объема воды в организме ► Значение гипотетического объема распределения для основных ЛС, обладающих высоким сродством к тканям организма, лежит в интервале 15 -22 л/кг. Таким образом, кажущийся объем распределения позволяет судить о том, в каком соотношении распределяется вещество между жидкостями организма (плазмой крови, интерстициальной, внутриклеточной жидкостями). COX 1 ингибитор Объем распределения зависит от физико химических свойств ЛС (молекулярная масса, уровень ионизации и полярность молекулы, растворимость в воде и липидах), которые влияют на его прохождение через мембраны, возраста, пола больного, общего количества жиров в организме. Например, у пожилых людей и новорожденных объем распределения снижен. Кроме того, Vd изменяется при некоторых патологических состояниях, особенно при заболеваниях печени, почек, сердечно сосудистой системы и т. д.
Липофильные малые молекулы способны проходить через стенки биологических мембран, заполняя при этом оба объема – внутриклеточную жидкость и околоклеточную – равновесным образом. Например, антипирин (анальгетик) с Vd=0, 7 л/кг часто используется в качестве маркера общего объема воды в организме ► Значение гипотетического объема распределения для основных ЛС, обладающих высоким сродством к тканям организма, лежит в интервале 15 -22 л/кг. Таким образом, кажущийся объем распределения позволяет судить о том, в каком соотношении распределяется вещество между жидкостями организма (плазмой крови, интерстициальной, внутриклеточной жидкостями). COX 1 ингибитор Объем распределения зависит от физико химических свойств ЛС (молекулярная масса, уровень ионизации и полярность молекулы, растворимость в воде и липидах), которые влияют на его прохождение через мембраны, возраста, пола больного, общего количества жиров в организме. Например, у пожилых людей и новорожденных объем распределения снижен. Кроме того, Vd изменяется при некоторых патологических состояниях, особенно при заболеваниях печени, почек, сердечно сосудистой системы и т. д.
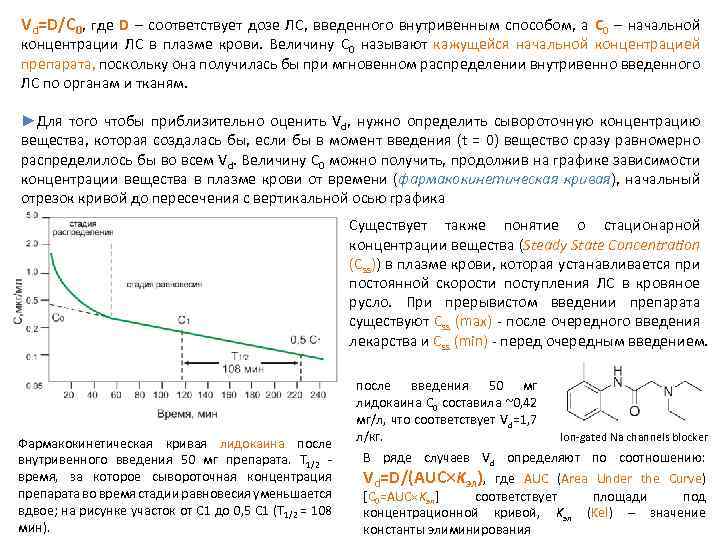 Vd=D/C 0, где D – соответствует дозе ЛС, введенного внутривенным способом, а C 0 – начальной концентрации ЛС в плазме крови. Величину С 0 называют кажущейся начальной концентрацией препарата, поскольку она получилась бы при мгновенном распределении внутривенно введенного ЛС по органам и тканям. ►Для того чтобы приблизительно оценить Vd, нужно определить сывороточную концентрацию вещества, которая создалась бы, если бы в момент введения (t = 0) вещество сразу равномерно распределилось бы во всем Vd. Величину С 0 можно получить, продолжив на графике зависимости концентрации вещества в плазме крови от времени (фармакокинетическая кривая), начальный отрезок кривой до пересечения с вертикальной осью графика Существует также понятие о стационарной концентрации вещества (Steady State Concentration (Css)) в плазме крови, которая устанавливается при постоянной скорости поступления ЛС в кровяное русло. При прерывистом введении препарата существуют Css (max) после очередного введения лекарства и Сss (min) перед очередным введением. Фармакокинетическая кривая лидокаина после внутривенного введения 50 мг препарата. Т 1/2 время, за которое сывороточная концентрация препарата во время стадии равновесия уменьшается вдвое; на рисунке участок от С 1 до 0, 5 С 1 (Т 1/2 = 108 мин). после введения 50 мг лидокаина С 0 составила ~0, 42 мг/л, что соответствует Vd=1, 7 л/кг. Ion gated Na channels blocker В ряде случаев Vd определяют по соотношению: Vd=D/(AUC Kэл), где AUC (Area Under the Curve) [C 0=AUC Kэл] соответствует площади под концентрационной кривой, Kэл (Kel) – значение константы элиминирования
Vd=D/C 0, где D – соответствует дозе ЛС, введенного внутривенным способом, а C 0 – начальной концентрации ЛС в плазме крови. Величину С 0 называют кажущейся начальной концентрацией препарата, поскольку она получилась бы при мгновенном распределении внутривенно введенного ЛС по органам и тканям. ►Для того чтобы приблизительно оценить Vd, нужно определить сывороточную концентрацию вещества, которая создалась бы, если бы в момент введения (t = 0) вещество сразу равномерно распределилось бы во всем Vd. Величину С 0 можно получить, продолжив на графике зависимости концентрации вещества в плазме крови от времени (фармакокинетическая кривая), начальный отрезок кривой до пересечения с вертикальной осью графика Существует также понятие о стационарной концентрации вещества (Steady State Concentration (Css)) в плазме крови, которая устанавливается при постоянной скорости поступления ЛС в кровяное русло. При прерывистом введении препарата существуют Css (max) после очередного введения лекарства и Сss (min) перед очередным введением. Фармакокинетическая кривая лидокаина после внутривенного введения 50 мг препарата. Т 1/2 время, за которое сывороточная концентрация препарата во время стадии равновесия уменьшается вдвое; на рисунке участок от С 1 до 0, 5 С 1 (Т 1/2 = 108 мин). после введения 50 мг лидокаина С 0 составила ~0, 42 мг/л, что соответствует Vd=1, 7 л/кг. Ion gated Na channels blocker В ряде случаев Vd определяют по соотношению: Vd=D/(AUC Kэл), где AUC (Area Under the Curve) [C 0=AUC Kэл] соответствует площади под концентрационной кривой, Kэл (Kel) – значение константы элиминирования
 ►С целью более точного определения объема распределения, без допущения мгновенной равновесной концентрации и с учетом элиминирования, используют соотношение: Vd=1, 44 Cl(л/ч) T 1/2(ч), которое нетрудно вывести из определений клиренса и времени полужизни вещества в плазме крови. Для диазепама Cl=1, 5 л/кг, а Т 1/2=22 ч, откуда Vd=48 л или Vd=0, 68 л/кг для средней массы тела в 70 кг. Равновесная концентрация в межклеточной жидкости будет определяться несвязанной формой ЛС. Чем больше уровень связывания препарата с белками плазмы крови, тем меньше лекарства может выйти за пределы сосудов, и тем меньше будет объем его распределения. Например, исследование отношения между объемом распределения Пропранолола и концентрацией свободной фракции показывает, что Vd повышается с увеличением несвязанной формы. GABAR Agonist b adrenoceptor blocker (non selective) Объем распределения может служить показателем как распределения, так и связывания ЛС с белками крови. Обычно при расчетах Vd пользуются общей концентрацией препарата в плазме. Однако, учитывая допущение, что только свободная фракция ЛС способна проникать в ткани, использование величины общей концентрации может дать ошибочные результаты, поскольку связанная форма в распределении не участвует. Для ЛС, которые хорошо связываются с белками крови, значение объема распределения наиболее принципиально.
►С целью более точного определения объема распределения, без допущения мгновенной равновесной концентрации и с учетом элиминирования, используют соотношение: Vd=1, 44 Cl(л/ч) T 1/2(ч), которое нетрудно вывести из определений клиренса и времени полужизни вещества в плазме крови. Для диазепама Cl=1, 5 л/кг, а Т 1/2=22 ч, откуда Vd=48 л или Vd=0, 68 л/кг для средней массы тела в 70 кг. Равновесная концентрация в межклеточной жидкости будет определяться несвязанной формой ЛС. Чем больше уровень связывания препарата с белками плазмы крови, тем меньше лекарства может выйти за пределы сосудов, и тем меньше будет объем его распределения. Например, исследование отношения между объемом распределения Пропранолола и концентрацией свободной фракции показывает, что Vd повышается с увеличением несвязанной формы. GABAR Agonist b adrenoceptor blocker (non selective) Объем распределения может служить показателем как распределения, так и связывания ЛС с белками крови. Обычно при расчетах Vd пользуются общей концентрацией препарата в плазме. Однако, учитывая допущение, что только свободная фракция ЛС способна проникать в ткани, использование величины общей концентрации может дать ошибочные результаты, поскольку связанная форма в распределении не участвует. Для ЛС, которые хорошо связываются с белками крови, значение объема распределения наиболее принципиально.
 ► Предложено много моделей (in vivo и ex vivo) определения объема распределения, каждая из которых имеет свои допущения и условия: Daccept = Vп Сп+Vт Ст, где V – обозначает свободную фракцию вещества, а C – общую концентрацию ЛС в плазме крови и в ткани (соответственно индексы «п» и «т» ), а объем распределения выражается отношением V=Da/C, откуда Da=V C, то в условиях равновесия исходное выражение преобразуется к виду: Vd(ss)=Vп+Vт Kп, где Kп=Ст/Сп (константа, отражающая сродство вещества к конкретной ткани). ► Ст/Сп=1 в случае вещества, которое равной мере связывается как плазмой, так и тканями, откуда Vd(ss)=Vп+Vт, что соответствует объему воды всего тела. Объем распределения вещества в организме зависит как от его связывания с белками крови, так и от взаимодействия с белками тканей, например рецепторами. Объем распределения и время полужизни в плазме крови определяют в первую очередь дозу ЛС, необходимую для достижения необходимой концентрации, вызывающей целевой физиологический ответ. ►Для расчета объема распределения были предложены различные модели, использующие в качестве вводных параметров экспериментальные значения связывания вещества с белками крови, Log. P и константу ионизации. Однако, если Log. P и p. Ka можно рассчитать с использованием специальных математических моделей, связывание вещества с белками крови определяют в большинстве случаев экспериментальным путем.
► Предложено много моделей (in vivo и ex vivo) определения объема распределения, каждая из которых имеет свои допущения и условия: Daccept = Vп Сп+Vт Ст, где V – обозначает свободную фракцию вещества, а C – общую концентрацию ЛС в плазме крови и в ткани (соответственно индексы «п» и «т» ), а объем распределения выражается отношением V=Da/C, откуда Da=V C, то в условиях равновесия исходное выражение преобразуется к виду: Vd(ss)=Vп+Vт Kп, где Kп=Ст/Сп (константа, отражающая сродство вещества к конкретной ткани). ► Ст/Сп=1 в случае вещества, которое равной мере связывается как плазмой, так и тканями, откуда Vd(ss)=Vп+Vт, что соответствует объему воды всего тела. Объем распределения вещества в организме зависит как от его связывания с белками крови, так и от взаимодействия с белками тканей, например рецепторами. Объем распределения и время полужизни в плазме крови определяют в первую очередь дозу ЛС, необходимую для достижения необходимой концентрации, вызывающей целевой физиологический ответ. ►Для расчета объема распределения были предложены различные модели, использующие в качестве вводных параметров экспериментальные значения связывания вещества с белками крови, Log. P и константу ионизации. Однако, если Log. P и p. Ka можно рассчитать с использованием специальных математических моделей, связывание вещества с белками крови определяют в большинстве случаев экспериментальным путем.
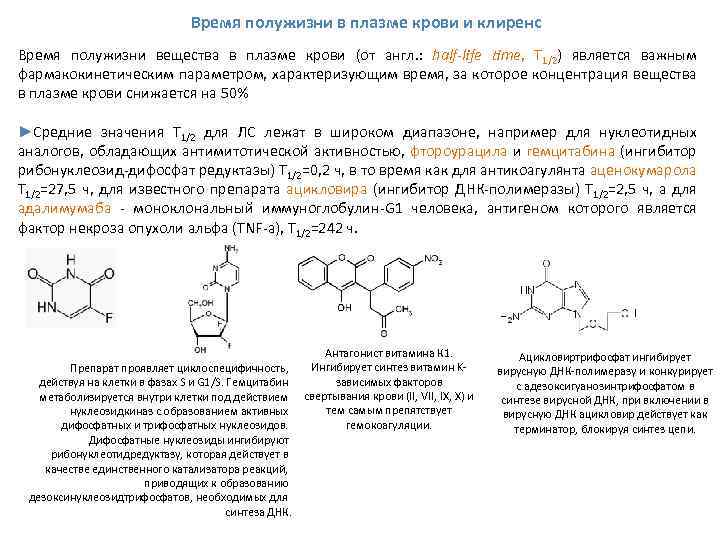 Время полужизни в плазме крови и клиренс Время полужизни вещества в плазме крови (от англ. : half-life time, T 1/2) является важным фармакокинетическим параметром, характеризующим время, за которое концентрация вещества в плазме крови снижается на 50% ►Средние значения T 1/2 для ЛС лежат в широком диапазоне, например для нуклеотидных аналогов, обладающих антимитотической активностью, фтороурацила и гемцитабина (ингибитор рибонуклеозид дифосфат редуктазы) T 1/2=0, 2 ч, в то время как для антикоагулянта аценокумарола T 1/2=27, 5 ч, для известного препарата ацикловира (ингибитор ДНК полимеразы) T 1/2=2, 5 ч, а для адалимумаба моноклональный иммуноглобулин G 1 человека, антигеном которого является фактор некроза опухоли альфа (TNF a), T 1/2=242 ч. Препарат проявляет циклоспецифичность, действуя на клетки в фазах S и G 1/S. Гемцитабин метаболизируется внутри клетки под действием нуклеозидкиназ с образованием активных дифосфатных и трифосфатных нуклеозидов. Дифосфатные нуклеозиды ингибируют рибонуклеотидредуктазу, которая действует в качестве единственного катализатора реакций, приводящих к образованию дезоксинуклеозидтрифосфатов, необходимых для синтеза ДНК. Антагонист витамина К 1. Ингибирует синтез витамин K зависимых факторов свертывания крови (II, VII, IX, X) и тем самым препятствует гемокоагуляции. Ацикловиртрифосфат ингибирует вирусную ДНК полимеразу и конкурирует с адезоксигуанозинтрифосфатом в синтезе вирусной ДНК, при включении в вирусную ДНК ацикловир действует как терминатор, блокируя синтез цепи.
Время полужизни в плазме крови и клиренс Время полужизни вещества в плазме крови (от англ. : half-life time, T 1/2) является важным фармакокинетическим параметром, характеризующим время, за которое концентрация вещества в плазме крови снижается на 50% ►Средние значения T 1/2 для ЛС лежат в широком диапазоне, например для нуклеотидных аналогов, обладающих антимитотической активностью, фтороурацила и гемцитабина (ингибитор рибонуклеозид дифосфат редуктазы) T 1/2=0, 2 ч, в то время как для антикоагулянта аценокумарола T 1/2=27, 5 ч, для известного препарата ацикловира (ингибитор ДНК полимеразы) T 1/2=2, 5 ч, а для адалимумаба моноклональный иммуноглобулин G 1 человека, антигеном которого является фактор некроза опухоли альфа (TNF a), T 1/2=242 ч. Препарат проявляет циклоспецифичность, действуя на клетки в фазах S и G 1/S. Гемцитабин метаболизируется внутри клетки под действием нуклеозидкиназ с образованием активных дифосфатных и трифосфатных нуклеозидов. Дифосфатные нуклеозиды ингибируют рибонуклеотидредуктазу, которая действует в качестве единственного катализатора реакций, приводящих к образованию дезоксинуклеозидтрифосфатов, необходимых для синтеза ДНК. Антагонист витамина К 1. Ингибирует синтез витамин K зависимых факторов свертывания крови (II, VII, IX, X) и тем самым препятствует гемокоагуляции. Ацикловиртрифосфат ингибирует вирусную ДНК полимеразу и конкурирует с адезоксигуанозинтрифосфатом в синтезе вирусной ДНК, при включении в вирусную ДНК ацикловир действует как терминатор, блокируя синтез цепи.
 T 1/2 для одного и того же вещества может варироваться в некоторых пределах в зависимости от этнической принадлежности и индивидуальных физиологических особенностей отдельно взятого человека. Однако, оперируя средними значениями, для большинства ЛС оно остается постоянным. ►T 1/2 зависит от Vd и Cl. Изменения связывания ЛС с белками крови могут различным образом влиять как на Vd, так и от Cl. Точная оценка влияния связывания вещества с белками крови на время его полужизни является непростой задачей. Например, снижение связывания тиопентала с белками плазмы у больных с хронической почечной недостаточностью в результате вышеописанных причин не приводит к изменению времени его полужизни. Замедляет время закрытия ГАМК зависимых каналов на постсинаптической мембране нейронов головного мозга Для математического определения T 1/2 необходимо дать общее определение клиренса. Так, при условии мгновенного распределения вещества в объеме крови, его начальная концентрация C 0 постепенно уменьшается в основном за счет двух процессов биотрансформации и экскреции. клиренс – это мера удаления вещества из организма или точнее – из плазмы крови при условии его равновесной концентрации. клиренс не показывает количество вещества, выведенного из организма, его соотносят исключительно с объемом плазмы или крови, из которого элиминируется вещество за единицу времени. Таким образом, концентрация ЛС в плазме крови определяется скоростью его администрирования, объемом распределения и клиренсом.
T 1/2 для одного и того же вещества может варироваться в некоторых пределах в зависимости от этнической принадлежности и индивидуальных физиологических особенностей отдельно взятого человека. Однако, оперируя средними значениями, для большинства ЛС оно остается постоянным. ►T 1/2 зависит от Vd и Cl. Изменения связывания ЛС с белками крови могут различным образом влиять как на Vd, так и от Cl. Точная оценка влияния связывания вещества с белками крови на время его полужизни является непростой задачей. Например, снижение связывания тиопентала с белками плазмы у больных с хронической почечной недостаточностью в результате вышеописанных причин не приводит к изменению времени его полужизни. Замедляет время закрытия ГАМК зависимых каналов на постсинаптической мембране нейронов головного мозга Для математического определения T 1/2 необходимо дать общее определение клиренса. Так, при условии мгновенного распределения вещества в объеме крови, его начальная концентрация C 0 постепенно уменьшается в основном за счет двух процессов биотрансформации и экскреции. клиренс – это мера удаления вещества из организма или точнее – из плазмы крови при условии его равновесной концентрации. клиренс не показывает количество вещества, выведенного из организма, его соотносят исключительно с объемом плазмы или крови, из которого элиминируется вещество за единицу времени. Таким образом, концентрация ЛС в плазме крови определяется скоростью его администрирования, объемом распределения и клиренсом.
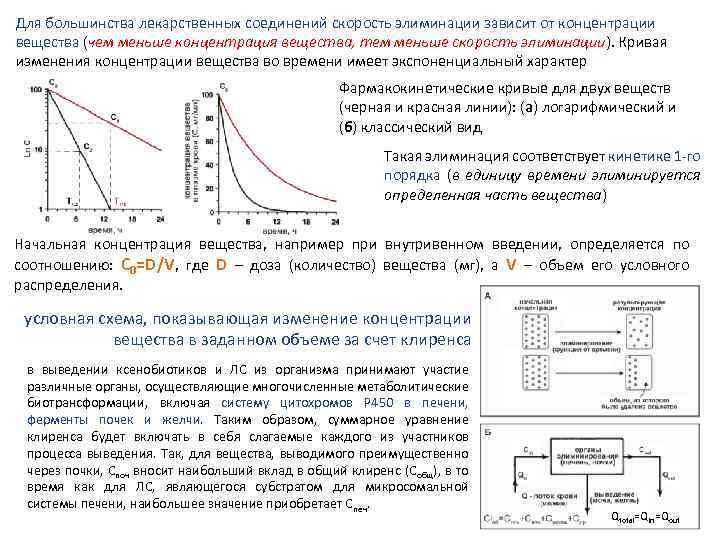 Для большинства лекарственных соединений скорость элиминации зависит от концентрации вещества (чем меньше концентрация вещества, тем меньше скорость элиминации). Кривая изменения концентрации вещества во времени имеет экспоненциальный характер Фармакокинетические кривые для двух веществ (черная и красная линии): (а) логарифмический и (б) классический вид Такая элиминация соответствует кинетике 1 го порядка (в единицу времени элиминируется определенная часть вещества) Начальная концентрация вещества, например при внутривенном введении, определяется по соотношению: С 0=D/V, где D – доза (количество) вещества (мг), а V – объем его условного распределения. условная схема, показывающая изменение концентрации вещества в заданном объеме за счет клиренса в выведении ксенобиотиков и ЛС из организма принимают участие различные органы, осуществляющие многочисленные метаболитические биотрансформации, включая систему цитохромов P 450 в печени, ферменты почек и желчи. Таким образом, суммарное уравнение клиренса будет включать в себя слагаемые каждого из участников процесса выведения. Так, для вещества, выводимого преимущественно через почки, Споч вносит наибольший вклад в общий клиренс (Собщ), в то время как для ЛС, являющегося субстратом для микросомальной системы печени, наибольшее значение приобретает Спеч. Qtotal=Qin=Qout
Для большинства лекарственных соединений скорость элиминации зависит от концентрации вещества (чем меньше концентрация вещества, тем меньше скорость элиминации). Кривая изменения концентрации вещества во времени имеет экспоненциальный характер Фармакокинетические кривые для двух веществ (черная и красная линии): (а) логарифмический и (б) классический вид Такая элиминация соответствует кинетике 1 го порядка (в единицу времени элиминируется определенная часть вещества) Начальная концентрация вещества, например при внутривенном введении, определяется по соотношению: С 0=D/V, где D – доза (количество) вещества (мг), а V – объем его условного распределения. условная схема, показывающая изменение концентрации вещества в заданном объеме за счет клиренса в выведении ксенобиотиков и ЛС из организма принимают участие различные органы, осуществляющие многочисленные метаболитические биотрансформации, включая систему цитохромов P 450 в печени, ферменты почек и желчи. Таким образом, суммарное уравнение клиренса будет включать в себя слагаемые каждого из участников процесса выведения. Так, для вещества, выводимого преимущественно через почки, Споч вносит наибольший вклад в общий клиренс (Собщ), в то время как для ЛС, являющегося субстратом для микросомальной системы печени, наибольшее значение приобретает Спеч. Qtotal=Qin=Qout
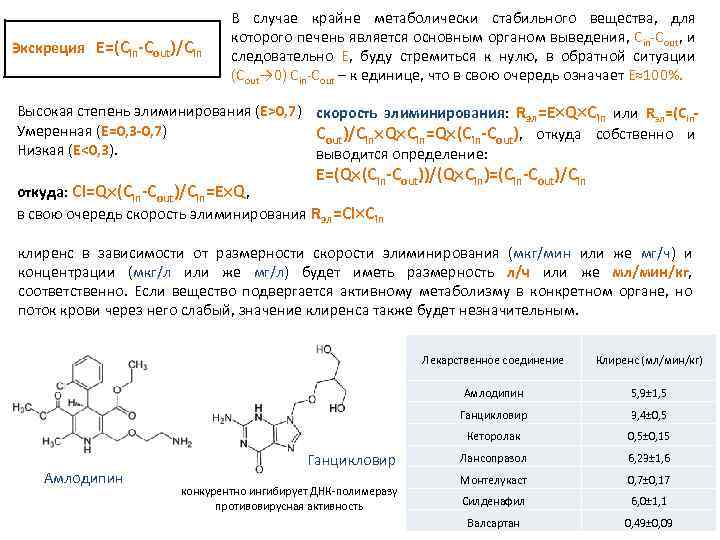 Экскреция E=(Сin-Cout)/Cin В случае крайне метаболически стабильного вещества, для которого печень является основным органом выведения, Сin Cout, и следовательно Е, буду стремиться к нулю, в обратной ситуации (Cout→ 0) Сin Cout – к единице, что в свою очередь означает E≈100%. Высокая степень элиминирования (E>0, 7) скорость элиминирования: Rэл=E Q Cin или Rэл=(Сin. Умеренная (E=0, 3 -0, 7) Cout)/Cin Q Cin=Q (Сin-Cout), откуда собственно и Низкая (E<0, 3). выводится определение: E=(Q (Сin-Cout))/(Q Cin)=(Сin-Cout)/Cin откуда: Сl=Q (Сin-Cout)/Cin=E Q, в свою очередь скорость элиминирования Rэл=Cl Cin клиренс в зависимости от размерности скорости элиминирования (мкг/мин или же мг/ч) и концентрации (мкг/л или же мг/л) будет иметь размерность л/ч или же мл/мин/кг, соответственно. Если вещество подвергается активному метаболизму в конкретном органе, но поток крови через него слабый, значение клиренса также будет незначительным. Лекарственное соединение Амлодипин конкурентно ингибирует ДНК полимеразу противовирусная активность 3, 4± 0, 5 Кеторолак Амлодипин 5, 9± 1, 5 Ганцикловир Клиренс (мл/мин/кг) 0, 5± 0, 15 Лансопразол 6, 23± 1, 6 Монтелукаст 0, 7± 0, 17 Силденафил 6, 0± 1, 1 Валсартан 0, 49± 0, 09
Экскреция E=(Сin-Cout)/Cin В случае крайне метаболически стабильного вещества, для которого печень является основным органом выведения, Сin Cout, и следовательно Е, буду стремиться к нулю, в обратной ситуации (Cout→ 0) Сin Cout – к единице, что в свою очередь означает E≈100%. Высокая степень элиминирования (E>0, 7) скорость элиминирования: Rэл=E Q Cin или Rэл=(Сin. Умеренная (E=0, 3 -0, 7) Cout)/Cin Q Cin=Q (Сin-Cout), откуда собственно и Низкая (E<0, 3). выводится определение: E=(Q (Сin-Cout))/(Q Cin)=(Сin-Cout)/Cin откуда: Сl=Q (Сin-Cout)/Cin=E Q, в свою очередь скорость элиминирования Rэл=Cl Cin клиренс в зависимости от размерности скорости элиминирования (мкг/мин или же мг/ч) и концентрации (мкг/л или же мг/л) будет иметь размерность л/ч или же мл/мин/кг, соответственно. Если вещество подвергается активному метаболизму в конкретном органе, но поток крови через него слабый, значение клиренса также будет незначительным. Лекарственное соединение Амлодипин конкурентно ингибирует ДНК полимеразу противовирусная активность 3, 4± 0, 5 Кеторолак Амлодипин 5, 9± 1, 5 Ганцикловир Клиренс (мл/мин/кг) 0, 5± 0, 15 Лансопразол 6, 23± 1, 6 Монтелукаст 0, 7± 0, 17 Силденафил 6, 0± 1, 1 Валсартан 0, 49± 0, 09
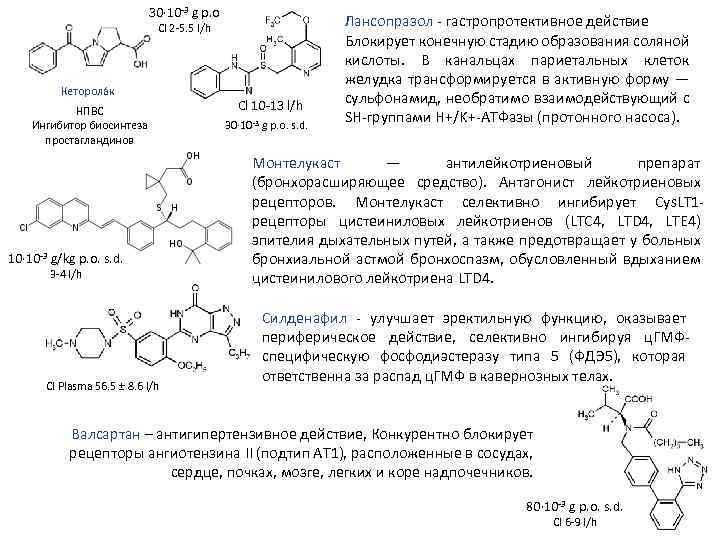 30· 10 3 g p. o Сl 2 5. 5 l/h Кеторола к НПВС Ингибитор биосинтеза простагландинов 10· 10 3 g/kg p. o. s. d. 3 4 l/h Cl Plasma 56. 5 ± 8. 6 l/h Cl 10 13 l/h 30· 10 3 g p. o. s. d. Лансопразол гастропротективное действие Блокирует конечную стадию образования соляной кислоты. В канальцах париетальных клеток желудка трансформируется в активную форму — сульфонамид, необратимо взаимодействующий с SH группами H+/K+ АТФазы (протонного насоса). Монтелукаст — антилейкотриеновый препарат (бронхорасширяющее средство). Антагонист лейкотриеновых рецепторов. Монтелукаст селективно ингибирует Cys. LT 1 рецепторы цистеиниловых лейкотриенов (LTC 4, LTD 4, LTE 4) эпителия дыхательных путей, а также предотвращает у больных бронхиальной астмой бронхоспазм, обусловленный вдыханием цистеинилового лейкотриена LTD 4. Силденафил улучшает эректильную функцию, оказывает периферическое действие, селективно ингибируя ц. ГМФ специфическую фосфодиэстеразу типа 5 (ФДЭ 5), которая ответственна за распад ц. ГМФ в кавернозных телах. Валсартан – антигипертензивное действие, Конкурентно блокирует рецепторы ангиотензина II (подтип АТ 1), расположенные в сосудах, сердце, почках, мозге, легких и коре надпочечников. 80· 10 3 g p. o. s. d. Cl 6 9 l/h
30· 10 3 g p. o Сl 2 5. 5 l/h Кеторола к НПВС Ингибитор биосинтеза простагландинов 10· 10 3 g/kg p. o. s. d. 3 4 l/h Cl Plasma 56. 5 ± 8. 6 l/h Cl 10 13 l/h 30· 10 3 g p. o. s. d. Лансопразол гастропротективное действие Блокирует конечную стадию образования соляной кислоты. В канальцах париетальных клеток желудка трансформируется в активную форму — сульфонамид, необратимо взаимодействующий с SH группами H+/K+ АТФазы (протонного насоса). Монтелукаст — антилейкотриеновый препарат (бронхорасширяющее средство). Антагонист лейкотриеновых рецепторов. Монтелукаст селективно ингибирует Cys. LT 1 рецепторы цистеиниловых лейкотриенов (LTC 4, LTD 4, LTE 4) эпителия дыхательных путей, а также предотвращает у больных бронхиальной астмой бронхоспазм, обусловленный вдыханием цистеинилового лейкотриена LTD 4. Силденафил улучшает эректильную функцию, оказывает периферическое действие, селективно ингибируя ц. ГМФ специфическую фосфодиэстеразу типа 5 (ФДЭ 5), которая ответственна за распад ц. ГМФ в кавернозных телах. Валсартан – антигипертензивное действие, Конкурентно блокирует рецепторы ангиотензина II (подтип АТ 1), расположенные в сосудах, сердце, почках, мозге, легких и коре надпочечников. 80· 10 3 g p. o. s. d. Cl 6 9 l/h
 Одним из принципиальных параметров, характеризующих процесс выведения вещества, является константа скорости элиминирования (Kel), которая определяется по тангенсу угла наклона прямой на логарифмическом графике классической фармакокинетической экспоненциальной функции первый порядок Таким образом, константа скорости элиминации 1 го порядка показывает, какая часть вещества выводится из организма в единицу времени (размерность мин 1, ч 1). Например, если Kel какого либо вещества, которое ввели внутривенно в дозе 100 мг, составляет 0, 1 ч 1, то через 1 ч количество вещества в крови будет равно 90 мг, через 2 ч 81 мг и т. д. Существует ряд веществ, таких как этанол и фенитоин, которые элиминируются в соответствии с кинетикой нулевого порядка. Скорость такой элиминации не зависит от концентрации вещества и является постоянной величиной, т. е. в единицу времени элиминируется определенное количество вещества (например, за 1 ч элиминируется 10 г чистого этанола), что связано с ограниченной насыщением скоростью ферментативных реакций метаболизма. Исходя из общего определения времени полужизни вещества в плазме крови и зная, что С 1=C 0 e^( Kel t), не трудно показать, что 0, 5 C 0=C 0 e^( Kel T 1/2), откуда e^( Kel T 1/2)=0, 5, следовательно: T 1/2=Ln 2/Kel, что соответствует T 1/2=0, 693/Kel=0, 693 V/Cl.
Одним из принципиальных параметров, характеризующих процесс выведения вещества, является константа скорости элиминирования (Kel), которая определяется по тангенсу угла наклона прямой на логарифмическом графике классической фармакокинетической экспоненциальной функции первый порядок Таким образом, константа скорости элиминации 1 го порядка показывает, какая часть вещества выводится из организма в единицу времени (размерность мин 1, ч 1). Например, если Kel какого либо вещества, которое ввели внутривенно в дозе 100 мг, составляет 0, 1 ч 1, то через 1 ч количество вещества в крови будет равно 90 мг, через 2 ч 81 мг и т. д. Существует ряд веществ, таких как этанол и фенитоин, которые элиминируются в соответствии с кинетикой нулевого порядка. Скорость такой элиминации не зависит от концентрации вещества и является постоянной величиной, т. е. в единицу времени элиминируется определенное количество вещества (например, за 1 ч элиминируется 10 г чистого этанола), что связано с ограниченной насыщением скоростью ферментативных реакций метаболизма. Исходя из общего определения времени полужизни вещества в плазме крови и зная, что С 1=C 0 e^( Kel t), не трудно показать, что 0, 5 C 0=C 0 e^( Kel T 1/2), откуда e^( Kel T 1/2)=0, 5, следовательно: T 1/2=Ln 2/Kel, что соответствует T 1/2=0, 693/Kel=0, 693 V/Cl.
 Для большинства ЛС, элиминация которых подчиняется кинетике 1 го порядка, период полужизни в плазме крови является величиной постоянной в определенных пределах и не зависит от вводимой дозы. Следовательно, если за первый период полужизни из плазмы крови удаляется 50% внутривенно введенного ЛС, то за 2 периода это количество составит 75%, соответственно за 3, 3 периода 90%. Этот фармакокинетический параметр часто используют для подбора интервалов между периодами введения ЛС, с целью поддержания его постоянной терапевтически значимой концентрации в крови. На основании T 1/2 делается предположение о необходимой терапевтической дозе ЛС и о периодах его введения, также оценивается его относительная метаболическая стабильность в потоке крови. Степень связывания с белками плазмы крови Многие белки крови участвуют в переносе специфических лигандов из одного органа к другому. Часто в комплексе с белками переносятся молекулы, плохо растворимые в воде. Так, гемоглобин эритроцитов участвует в переносе O 2 от лёгких к тканям. Стероидные гормоны транспортируются в крови специфическими транспортными белками, которые также участвуют в переносе гидрофильных веществ через гидрофобные мембраны. . В плазме крови множество как эндогенных, так и экзогенных липофильных веществ транс портируютсяальбумином и рядом других белков. - ►Альбумин (от лат. : albus, белый) основной белок плазмы крови, связывающий различные гидрофобные вещес тва, его часто называют сывороточным альбумином (Human Serum Albumin, HSA). Сывороточный альбумин наиболее известный вид альбумина. Помимо плазмы, он также может встречаться и в других жидкостях, например в спинно мозговой жидкости.
Для большинства ЛС, элиминация которых подчиняется кинетике 1 го порядка, период полужизни в плазме крови является величиной постоянной в определенных пределах и не зависит от вводимой дозы. Следовательно, если за первый период полужизни из плазмы крови удаляется 50% внутривенно введенного ЛС, то за 2 периода это количество составит 75%, соответственно за 3, 3 периода 90%. Этот фармакокинетический параметр часто используют для подбора интервалов между периодами введения ЛС, с целью поддержания его постоянной терапевтически значимой концентрации в крови. На основании T 1/2 делается предположение о необходимой терапевтической дозе ЛС и о периодах его введения, также оценивается его относительная метаболическая стабильность в потоке крови. Степень связывания с белками плазмы крови Многие белки крови участвуют в переносе специфических лигандов из одного органа к другому. Часто в комплексе с белками переносятся молекулы, плохо растворимые в воде. Так, гемоглобин эритроцитов участвует в переносе O 2 от лёгких к тканям. Стероидные гормоны транспортируются в крови специфическими транспортными белками, которые также участвуют в переносе гидрофильных веществ через гидрофобные мембраны. . В плазме крови множество как эндогенных, так и экзогенных липофильных веществ транс портируютсяальбумином и рядом других белков. - ►Альбумин (от лат. : albus, белый) основной белок плазмы крови, связывающий различные гидрофобные вещес тва, его часто называют сывороточным альбумином (Human Serum Albumin, HSA). Сывороточный альбумин наиболее известный вид альбумина. Помимо плазмы, он также может встречаться и в других жидкостях, например в спинно мозговой жидкости.
 ►Альбумин составляет 60% от белков сыворотки (40 50 г/л). В кровеносном русле находится 40% всего альбумина организма, в то время как остальные 60% в интерстициальном пространстве, главным образом в мышцах и коже. Однако его концентрация в плазме выше, чем в межклеточной жидкости. ►В малых количествах альбумин также обнаруживается в физиологических жидкостях, таких как пот, слёзы, желудочный сок, желчь. Скорость синтеза альбумина в печени составляет 150 250 мг/кг/день и зависит от доступа аминокислот и, следовательно, она может снижаться в период белковой недостаточности. У нормальных индивидуумов весом 70 кг в день продуцируется 10 18 г альбумина. В клетках печени альбумин синтезируется изначально на рибосомах шероховатого ЭПР в виде белка предшественника – пре про альбумина, который в своей структуре содержит N терминальный вспомогательный протеин. ►После ферментативного отщепления этого фрагмента молекулы про альбумина поступают в аппарат Гольджии, где превращаются в нативный альбумин, который запасается в секреторных пузырьках. Время полужизни в плазме крови составляет примерно 20 дней. Альбумин состоит из 585 аминокислотных остатков, имеет 17 дисульфидных мостиков и обладает молекулярной массой 69 к. Д. Ген альбумина локализован в четвертой хромосоме, мутации в которой могут привести к аномальному альбумину, не способному выполнять свои нативные функции. ►Альбумин не диффундирует через неповреждённую эндотелиальную выстилку. Таким образом, это главный белок, обеспечивающий коллоидное осмотическое и онкотическое давление, которое регулирует диффузию воды и растворимых веществ через капилляры. Тем самым он участвует в обмене воды между кровью и межтканевым пространством.
►Альбумин составляет 60% от белков сыворотки (40 50 г/л). В кровеносном русле находится 40% всего альбумина организма, в то время как остальные 60% в интерстициальном пространстве, главным образом в мышцах и коже. Однако его концентрация в плазме выше, чем в межклеточной жидкости. ►В малых количествах альбумин также обнаруживается в физиологических жидкостях, таких как пот, слёзы, желудочный сок, желчь. Скорость синтеза альбумина в печени составляет 150 250 мг/кг/день и зависит от доступа аминокислот и, следовательно, она может снижаться в период белковой недостаточности. У нормальных индивидуумов весом 70 кг в день продуцируется 10 18 г альбумина. В клетках печени альбумин синтезируется изначально на рибосомах шероховатого ЭПР в виде белка предшественника – пре про альбумина, который в своей структуре содержит N терминальный вспомогательный протеин. ►После ферментативного отщепления этого фрагмента молекулы про альбумина поступают в аппарат Гольджии, где превращаются в нативный альбумин, который запасается в секреторных пузырьках. Время полужизни в плазме крови составляет примерно 20 дней. Альбумин состоит из 585 аминокислотных остатков, имеет 17 дисульфидных мостиков и обладает молекулярной массой 69 к. Д. Ген альбумина локализован в четвертой хромосоме, мутации в которой могут привести к аномальному альбумину, не способному выполнять свои нативные функции. ►Альбумин не диффундирует через неповреждённую эндотелиальную выстилку. Таким образом, это главный белок, обеспечивающий коллоидное осмотическое и онкотическое давление, которое регулирует диффузию воды и растворимых веществ через капилляры. Тем самым он участвует в обмене воды между кровью и межтканевым пространством.
 Вещества, содержащие в своей структуре кислые группы, связываются с альбумином, в то время как основные ЛС в большинстве случаев с кислым a 1 гликопротеином, нейтральные соединения тяготеют к транспортным липопротеинам. Особенность транспортных гликопротеинов состоит в том, что они являются индуцируемыми белками, участвующим в ответной реакции орга низмана изменения, происходящие в состоянии стресса, например, при инфаркте миокарда, вос палительных процессах; его количество в плазме увеличивается наряду с другими протеинами. Связывая ксенобиотики, кислый a гликопротеин инактивирует их и переносит в печень, где комплекс с белком распадается, и чужеродные вещества обезвреживаются и выводятся из ор ганизма. ►Некоторые гормоны селективно связываются со специфическими протеинами, например кортизол взаимодействует с транскортином, тироксин – с тироид связывающим глобулином, тестостерон – с одним из ГСПГ (глобулин, связывающий половые гормоны). ►Общая площадь поверхности множества мелких молекул сывороточного альбумина очень велика, поэтому они особенно хорошо подходят для выполнения функции переносчиков многих транспортируемых кровью и плохо растворимых в воде веществ, включая билирубин (продукт распада гема), уробилин, триптофан, тироксин и трийодтиронин, различные ксенобиотики, жирные кислоты, а также их соли, ионы металлов, гормоны и многие лекарственные соединения, такие как варфарин, фенобутазон, хлофибрат, аспирин, дикумарол, сульфаниламиды, фенитоин и т. д. , поступающие в организм извне. ►Молекула альбумина содержит много дикарбоновых аминокислот, поэтому может удерживать в крови различные одновалентные и двухвалентные катионы, включая К+, Са 2+, Cu 2+ и Zn 2+. Каждая молекула транспортного альбумина содержит в своей структуре не менее одиннадцати различных сайтов связывания
Вещества, содержащие в своей структуре кислые группы, связываются с альбумином, в то время как основные ЛС в большинстве случаев с кислым a 1 гликопротеином, нейтральные соединения тяготеют к транспортным липопротеинам. Особенность транспортных гликопротеинов состоит в том, что они являются индуцируемыми белками, участвующим в ответной реакции орга низмана изменения, происходящие в состоянии стресса, например, при инфаркте миокарда, вос палительных процессах; его количество в плазме увеличивается наряду с другими протеинами. Связывая ксенобиотики, кислый a гликопротеин инактивирует их и переносит в печень, где комплекс с белком распадается, и чужеродные вещества обезвреживаются и выводятся из ор ганизма. ►Некоторые гормоны селективно связываются со специфическими протеинами, например кортизол взаимодействует с транскортином, тироксин – с тироид связывающим глобулином, тестостерон – с одним из ГСПГ (глобулин, связывающий половые гормоны). ►Общая площадь поверхности множества мелких молекул сывороточного альбумина очень велика, поэтому они особенно хорошо подходят для выполнения функции переносчиков многих транспортируемых кровью и плохо растворимых в воде веществ, включая билирубин (продукт распада гема), уробилин, триптофан, тироксин и трийодтиронин, различные ксенобиотики, жирные кислоты, а также их соли, ионы металлов, гормоны и многие лекарственные соединения, такие как варфарин, фенобутазон, хлофибрат, аспирин, дикумарол, сульфаниламиды, фенитоин и т. д. , поступающие в организм извне. ►Молекула альбумина содержит много дикарбоновых аминокислот, поэтому может удерживать в крови различные одновалентные и двухвалентные катионы, включая К+, Са 2+, Cu 2+ и Zn 2+. Каждая молекула транспортного альбумина содержит в своей структуре не менее одиннадцати различных сайтов связывания
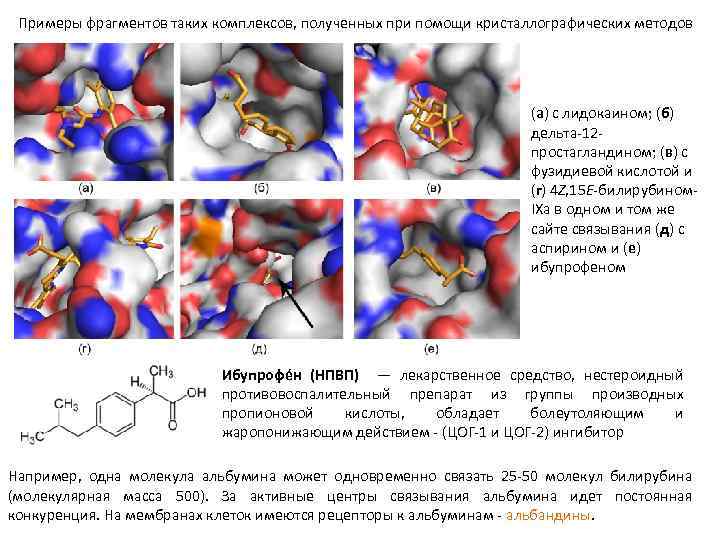 Примеры фрагментов таких комплексов, полученных при помощи кристаллографических методов (а) с лидокаином; (б) дельта 12 простагландином; (в) с фузидиевой кислотой и (г) 4 Z, 15 E билирубином IXa в одном и том же сайте связывания (д) с аспирином и (е) ибупрофеном Ибупрофе н (НПВП) — лекарственное средство, нестероидный противовоспалительный препарат из группы производных пропионовой кислоты, обладает болеутоляющим и жаропонижающим действием (ЦОГ 1 и ЦОГ 2) ингибитор Например, одна молекула альбумина может одновременно связать 25 50 молекул билирубина (молекулярная масса 500). За активные центры связывания альбумина идет постоянная конкуренция. На мембранах клеток имеются рецепторы к альбуминам альбандины.
Примеры фрагментов таких комплексов, полученных при помощи кристаллографических методов (а) с лидокаином; (б) дельта 12 простагландином; (в) с фузидиевой кислотой и (г) 4 Z, 15 E билирубином IXa в одном и том же сайте связывания (д) с аспирином и (е) ибупрофеном Ибупрофе н (НПВП) — лекарственное средство, нестероидный противовоспалительный препарат из группы производных пропионовой кислоты, обладает болеутоляющим и жаропонижающим действием (ЦОГ 1 и ЦОГ 2) ингибитор Например, одна молекула альбумина может одновременно связать 25 50 молекул билирубина (молекулярная масса 500). За активные центры связывания альбумина идет постоянная конкуренция. На мембранах клеток имеются рецепторы к альбуминам альбандины.
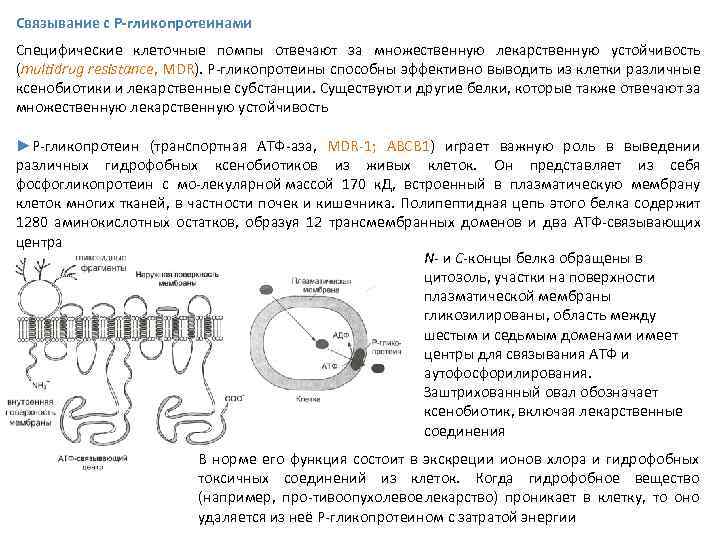 Связывание с P-гликопротеинами Специфические клеточные помпы отвечают за множественную лекарственную устойчивость (multidrug resistance, MDR). P гликопротеины способны эффективно выводить из клетки различные ксенобиотики и лекарственные субстанции. Существуют и другие белки, которые также отвечают за множественную лекарственную устойчивость ►Р гликопротеин (транспортная АТФ аза, MDR 1; ABCB 1) играет важную роль в выведении различных гидрофобных ксенобиотиков из живых клеток. Он представляет из себя фосфогликопротеин с мо лекулярной массой 170 к. Д, встроенный в плазматическую мембрану клеток многих тканей, в частности почек и кишечника. Полипептидная цепь этого белка содержит 1280 аминокислотных остатков, образуя 12 трансмембранных доменов и два АТФ связывающих центра N и C концы белка обращены в цитозоль, участки на поверхности плазматической мембраны гликозилированы, область между шестым и седьмым доменами имеет центры для связывания АТФ и аутофосфорилирования. Заштрихованный овал обозначает ксенобиотик, включая лекарственные соединения В норме его функция состоит в экскреции ионов хлора и гидрофобных токсичных соединений из клеток. Когда гидрофобное вещество (например, про тивоопухолевое лекарство) проникает в клетку, то оно удаляется из неё Р гликопротеином с затратой энергии
Связывание с P-гликопротеинами Специфические клеточные помпы отвечают за множественную лекарственную устойчивость (multidrug resistance, MDR). P гликопротеины способны эффективно выводить из клетки различные ксенобиотики и лекарственные субстанции. Существуют и другие белки, которые также отвечают за множественную лекарственную устойчивость ►Р гликопротеин (транспортная АТФ аза, MDR 1; ABCB 1) играет важную роль в выведении различных гидрофобных ксенобиотиков из живых клеток. Он представляет из себя фосфогликопротеин с мо лекулярной массой 170 к. Д, встроенный в плазматическую мембрану клеток многих тканей, в частности почек и кишечника. Полипептидная цепь этого белка содержит 1280 аминокислотных остатков, образуя 12 трансмембранных доменов и два АТФ связывающих центра N и C концы белка обращены в цитозоль, участки на поверхности плазматической мембраны гликозилированы, область между шестым и седьмым доменами имеет центры для связывания АТФ и аутофосфорилирования. Заштрихованный овал обозначает ксенобиотик, включая лекарственные соединения В норме его функция состоит в экскреции ионов хлора и гидрофобных токсичных соединений из клеток. Когда гидрофобное вещество (например, про тивоопухолевое лекарство) проникает в клетку, то оно удаляется из неё Р гликопротеином с затратой энергии
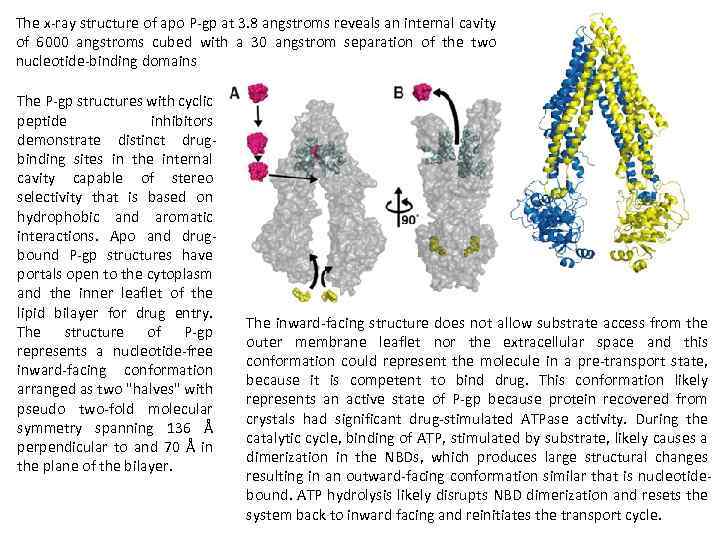 The x ray structure of apo P gp at 3. 8 angstroms reveals an internal cavity of 6000 angstroms cubed with a 30 angstrom separation of the two nucleotide binding domains The P gp structures with cyclic peptide inhibitors demonstrate distinct drug binding sites in the internal cavity capable of stereo selectivity that is based on hydrophobic and aromatic interactions. Apo and drug bound P gp structures have portals open to the cytoplasm and the inner leaflet of the lipid bilayer for drug entry. The structure of P gp represents a nucleotide free inward facing conformation arranged as two "halves" with pseudo two fold molecular symmetry spanning 136 Å perpendicular to and 70 Å in the plane of the bilayer. The inward facing structure does not allow substrate access from the outer membrane leaflet nor the extracellular space and this conformation could represent the molecule in a pre transport state, because it is competent to bind drug. This conformation likely represents an active state of P gp because protein recovered from crystals had significant drug stimulated ATPase activity. During the catalytic cycle, binding of ATP, stimulated by substrate, likely causes a dimerization in the NBDs, which produces large structural changes resulting in an outward facing conformation similar that is nucleotide bound. ATP hydrolysis likely disrupts NBD dimerization and resets the system back to inward facing and reinitiates the transport cycle.
The x ray structure of apo P gp at 3. 8 angstroms reveals an internal cavity of 6000 angstroms cubed with a 30 angstrom separation of the two nucleotide binding domains The P gp structures with cyclic peptide inhibitors demonstrate distinct drug binding sites in the internal cavity capable of stereo selectivity that is based on hydrophobic and aromatic interactions. Apo and drug bound P gp structures have portals open to the cytoplasm and the inner leaflet of the lipid bilayer for drug entry. The structure of P gp represents a nucleotide free inward facing conformation arranged as two "halves" with pseudo two fold molecular symmetry spanning 136 Å perpendicular to and 70 Å in the plane of the bilayer. The inward facing structure does not allow substrate access from the outer membrane leaflet nor the extracellular space and this conformation could represent the molecule in a pre transport state, because it is competent to bind drug. This conformation likely represents an active state of P gp because protein recovered from crystals had significant drug stimulated ATPase activity. During the catalytic cycle, binding of ATP, stimulated by substrate, likely causes a dimerization in the NBDs, which produces large structural changes resulting in an outward facing conformation similar that is nucleotide bound. ATP hydrolysis likely disrupts NBD dimerization and resets the system back to inward facing and reinitiates the transport cycle.
 ►Уменьшение количества лекарства в клетке снижает эффек тивность его применения при химиотерапии онкологических заболеваний. В общем случае, если введенное вещество является субстратом P гликопротеина, его молекулы могут неоднократно поступать в энтероциты кишечника и выводиться из него, в результате чего вероятность метаболизма нулевой фазы на цитохромах P 450 (в большей степени это касается неселективной изоформы CYP 3 A 4) лекарственного соединения в энтероцитах существенно возрастает. ►P гликопротеины в большом количестве экспрессированы в нормальных клетках, выстилающих кишечник, проксимальные канальцы почек, капилляры гематоэнцефалического барьера, и в клетках печени ►Транспортеры типа P гликопротеина являются членами надсемейства самого большого и наиболее древнего семейства транспортеров, представленного в организмах от прокариотов до человека. ►По приблизительным оценкам при непосредственном участии этого транспортера из опухолевых клеток выводится более 35 известных противоопухолевых ЛС, включая актиномицин D, доксорубицин, этопозид, митомицин C, таксол и винкристин, что не удивительно в силу его низкой субстратной специфичности, сравнимой со специфичностью системы цитохромов P 450.
►Уменьшение количества лекарства в клетке снижает эффек тивность его применения при химиотерапии онкологических заболеваний. В общем случае, если введенное вещество является субстратом P гликопротеина, его молекулы могут неоднократно поступать в энтероциты кишечника и выводиться из него, в результате чего вероятность метаболизма нулевой фазы на цитохромах P 450 (в большей степени это касается неселективной изоформы CYP 3 A 4) лекарственного соединения в энтероцитах существенно возрастает. ►P гликопротеины в большом количестве экспрессированы в нормальных клетках, выстилающих кишечник, проксимальные канальцы почек, капилляры гематоэнцефалического барьера, и в клетках печени ►Транспортеры типа P гликопротеина являются членами надсемейства самого большого и наиболее древнего семейства транспортеров, представленного в организмах от прокариотов до человека. ►По приблизительным оценкам при непосредственном участии этого транспортера из опухолевых клеток выводится более 35 известных противоопухолевых ЛС, включая актиномицин D, доксорубицин, этопозид, митомицин C, таксол и винкристин, что не удивительно в силу его низкой субстратной специфичности, сравнимой со специфичностью системы цитохромов P 450.
 ►Синергический эффект, который оказывают эти две системы на лекарственные субстанции, являются серьезным препятствием на пути создания новых ЛС. Учитывая это обстоятельство, разработке низкомолекулярных селективных ингибиторов активности P гликопротеинов и цитохромов P 450 уделяется значительное внимание. ►На сегодняшний день уже обнаружен целый ряд известных лекарственных субстанций, включая блокаторы кальциевых каналов, верапамил и нифедипин, противоаритмические агенты, хинидин и амиодарон, способных обратимо блокировать активные центры P гликопротеинов Многие фармацевтические компании ведут активные исследования в области создания селективных и менее фармакологически лабильных P gp ингибиторов. Блокирует быстрые натриевые каналы, снижает скорость проведения импульсов, возбудимость миокарда. Блокирует ионные каналы (главным образом калиевые, в меньшей степени — кальциевые и натриевые) мембран кардиомиоцитов, тормозит возбуждение альфа и бета адренорецепторов.
►Синергический эффект, который оказывают эти две системы на лекарственные субстанции, являются серьезным препятствием на пути создания новых ЛС. Учитывая это обстоятельство, разработке низкомолекулярных селективных ингибиторов активности P гликопротеинов и цитохромов P 450 уделяется значительное внимание. ►На сегодняшний день уже обнаружен целый ряд известных лекарственных субстанций, включая блокаторы кальциевых каналов, верапамил и нифедипин, противоаритмические агенты, хинидин и амиодарон, способных обратимо блокировать активные центры P гликопротеинов Многие фармацевтические компании ведут активные исследования в области создания селективных и менее фармакологически лабильных P gp ингибиторов. Блокирует быстрые натриевые каналы, снижает скорость проведения импульсов, возбудимость миокарда. Блокирует ионные каналы (главным образом калиевые, в меньшей степени — кальциевые и натриевые) мембран кардиомиоцитов, тормозит возбуждение альфа и бета адренорецепторов.
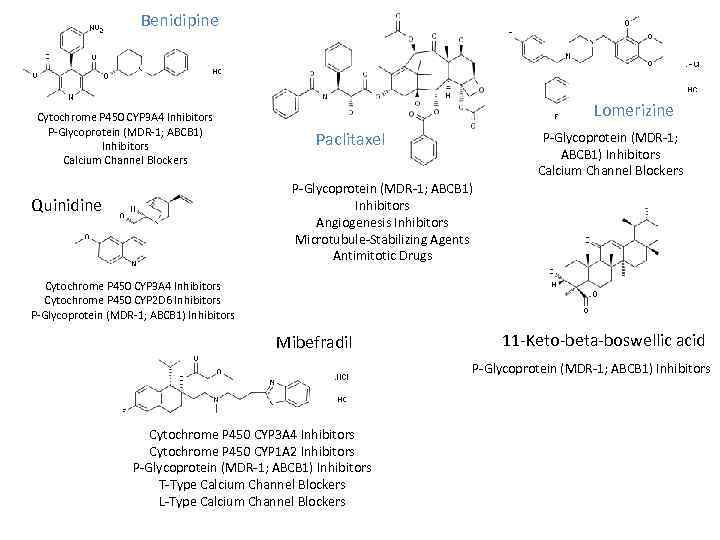 Benidipine Cytochrome P 450 CYP 3 A 4 Inhibitors P Glycoprotein (MDR 1; ABCB 1) Inhibitors Calcium Channel Blockers Lomerizine Paclitaxel P Glycoprotein (MDR 1; ABCB 1) Inhibitors Calcium Channel Blockers P Glycoprotein (MDR 1; ABCB 1) Inhibitors Angiogenesis Inhibitors Microtubule Stabilizing Agents Antimitotic Drugs Quinidine Cytochrome P 450 CYP 3 A 4 Inhibitors Cytochrome P 450 CYP 2 D 6 Inhibitors P Glycoprotein (MDR 1; ABCB 1) Inhibitors Mibefradil 11 Keto beta boswellic acid P Glycoprotein (MDR 1; ABCB 1) Inhibitors Cytochrome P 450 CYP 3 A 4 Inhibitors Cytochrome P 450 CYP 1 A 2 Inhibitors P Glycoprotein (MDR 1; ABCB 1) Inhibitors T Type Calcium Channel Blockers L Type Calcium Channel Blockers
Benidipine Cytochrome P 450 CYP 3 A 4 Inhibitors P Glycoprotein (MDR 1; ABCB 1) Inhibitors Calcium Channel Blockers Lomerizine Paclitaxel P Glycoprotein (MDR 1; ABCB 1) Inhibitors Calcium Channel Blockers P Glycoprotein (MDR 1; ABCB 1) Inhibitors Angiogenesis Inhibitors Microtubule Stabilizing Agents Antimitotic Drugs Quinidine Cytochrome P 450 CYP 3 A 4 Inhibitors Cytochrome P 450 CYP 2 D 6 Inhibitors P Glycoprotein (MDR 1; ABCB 1) Inhibitors Mibefradil 11 Keto beta boswellic acid P Glycoprotein (MDR 1; ABCB 1) Inhibitors Cytochrome P 450 CYP 3 A 4 Inhibitors Cytochrome P 450 CYP 1 A 2 Inhibitors P Glycoprotein (MDR 1; ABCB 1) Inhibitors T Type Calcium Channel Blockers L Type Calcium Channel Blockers
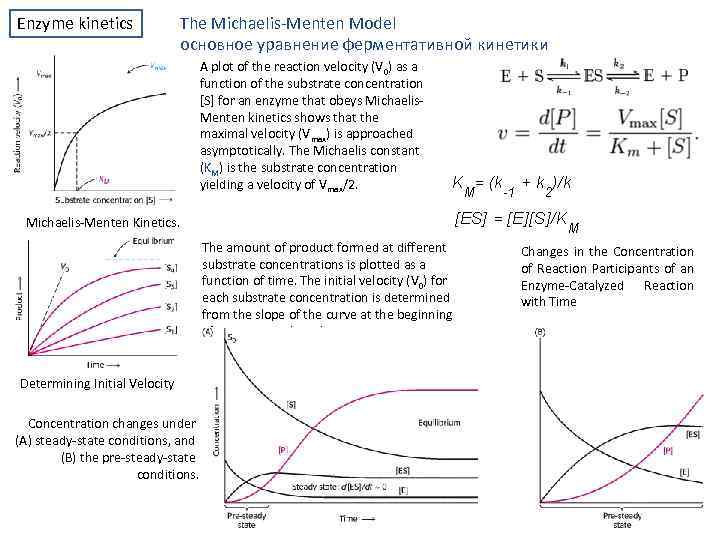 Enzyme kinetics The Michaelis Menten Model основное уравнение ферментативной кинетики A plot of the reaction velocity (V 0) as a function of the substrate concentration [S] for an enzyme that obeys Michaelis Menten kinetics shows that the maximal velocity (Vmax) is approached asymptotically. The Michaelis constant (KM) is the substrate concentration yielding a velocity of Vmax/2. Michaelis Menten Kinetics. The amount of product formed at different substrate concentrations is plotted as a function of time. The initial velocity (V 0) for each substrate concentration is determined from the slope of the curve at the beginning of a reaction, when the reverse reaction is insignificant. Determining Initial Velocity Concentration changes under (A) steady state conditions, and (B) the pre steady state conditions. Changes in the Concentration of Reaction Participants of an Enzyme Catalyzed Reaction with Time
Enzyme kinetics The Michaelis Menten Model основное уравнение ферментативной кинетики A plot of the reaction velocity (V 0) as a function of the substrate concentration [S] for an enzyme that obeys Michaelis Menten kinetics shows that the maximal velocity (Vmax) is approached asymptotically. The Michaelis constant (KM) is the substrate concentration yielding a velocity of Vmax/2. Michaelis Menten Kinetics. The amount of product formed at different substrate concentrations is plotted as a function of time. The initial velocity (V 0) for each substrate concentration is determined from the slope of the curve at the beginning of a reaction, when the reverse reaction is insignificant. Determining Initial Velocity Concentration changes under (A) steady state conditions, and (B) the pre steady state conditions. Changes in the Concentration of Reaction Participants of an Enzyme Catalyzed Reaction with Time
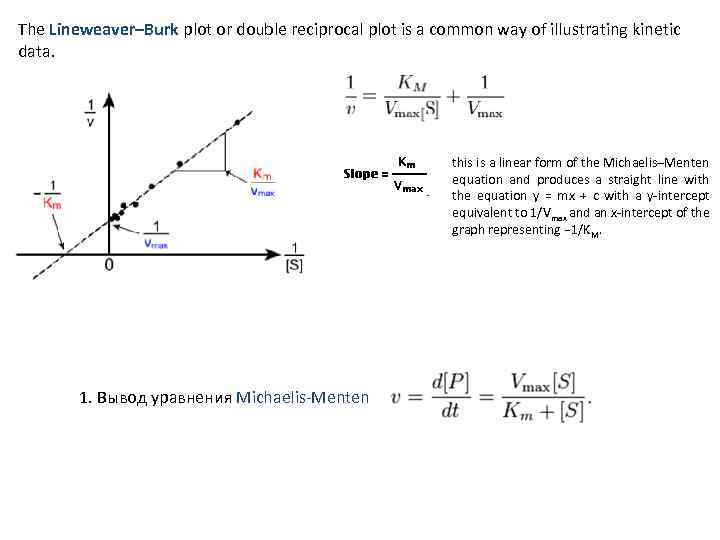 The Lineweaver–Burk plot or double reciprocal plot is a common way of illustrating kinetic data. this is a linear form of the Michaelis–Menten equation and produces a straight line with the equation y = mx + c with a y intercept equivalent to 1/Vmax and an x intercept of the graph representing − 1/KM. 1. Вывод уравнения Michaelis Menten
The Lineweaver–Burk plot or double reciprocal plot is a common way of illustrating kinetic data. this is a linear form of the Michaelis–Menten equation and produces a straight line with the equation y = mx + c with a y intercept equivalent to 1/Vmax and an x intercept of the graph representing − 1/KM. 1. Вывод уравнения Michaelis Menten


