Строение_атома_теория_Бора.ppt
- Количество слайдов: 25

 «Все тела состоят из мельчайших частиц – атомов» Левкипп Демокрит
«Все тела состоят из мельчайших частиц – атомов» Левкипп Демокрит

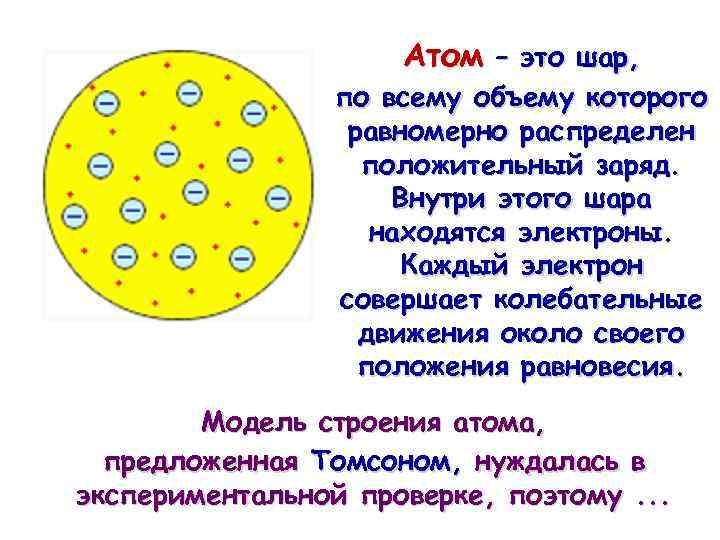 Атом – это шар, по всему объему которого равномерно распределен положительный заряд. Внутри этого шара находятся электроны. Каждый электрон совершает колебательные движения около своего положения равновесия. Модель строения атома, предложенная Томсоном, нуждалась в экспериментальной проверке, поэтому. . .
Атом – это шар, по всему объему которого равномерно распределен положительный заряд. Внутри этого шара находятся электроны. Каждый электрон совершает колебательные движения около своего положения равновесия. Модель строения атома, предложенная Томсоном, нуждалась в экспериментальной проверке, поэтому. . .


 Радиоактивный источник Золотая Люминесцирую Микроскоп фольга щий экран
Радиоактивный источник Золотая Люминесцирую Микроскоп фольга щий экран

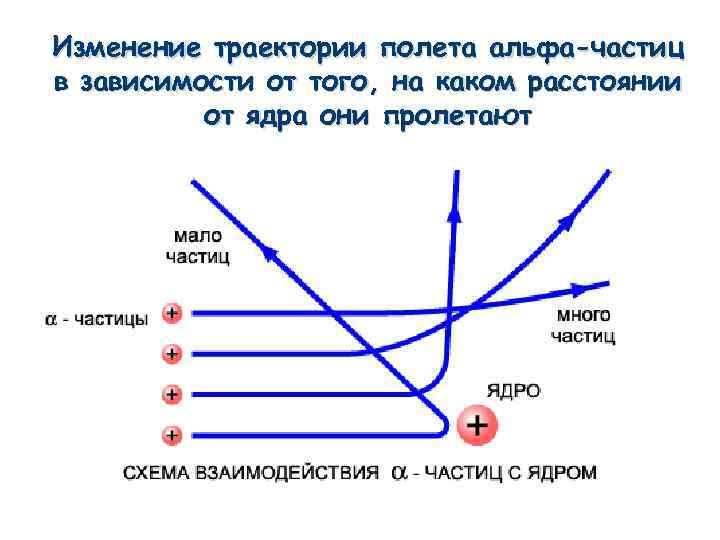 Изменение траектории полета альфа-частиц в зависимости от того, на каком расстоянии от ядра они пролетают
Изменение траектории полета альфа-частиц в зависимости от того, на каком расстоянии от ядра они пролетают
 Э. Резерфорд открыл планетарную модель атома Практически вся масса атома сосредоточена в ядре, а размеры ядра на четыре порядка меньше размеров атома
Э. Резерфорд открыл планетарную модель атома Практически вся масса атома сосредоточена в ядре, а размеры ядра на четыре порядка меньше размеров атома
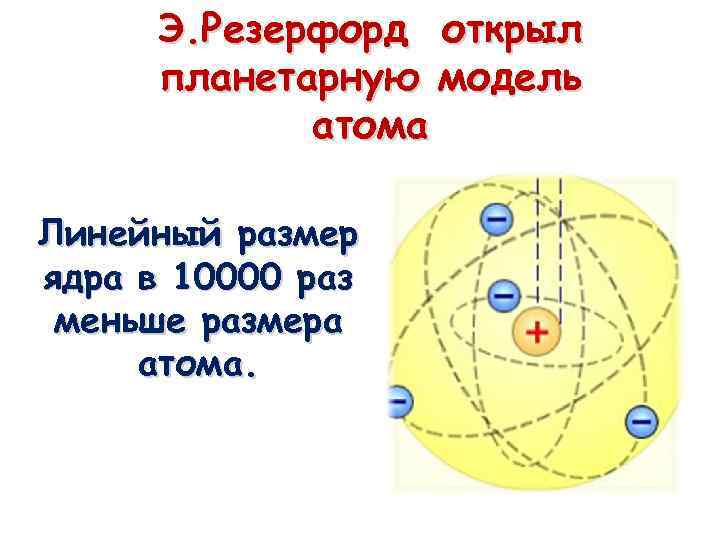 Э. Резерфорд открыл планетарную модель атома Линейный размер ядра в 10000 раз меньше размера атома.
Э. Резерфорд открыл планетарную модель атома Линейный размер ядра в 10000 раз меньше размера атома.
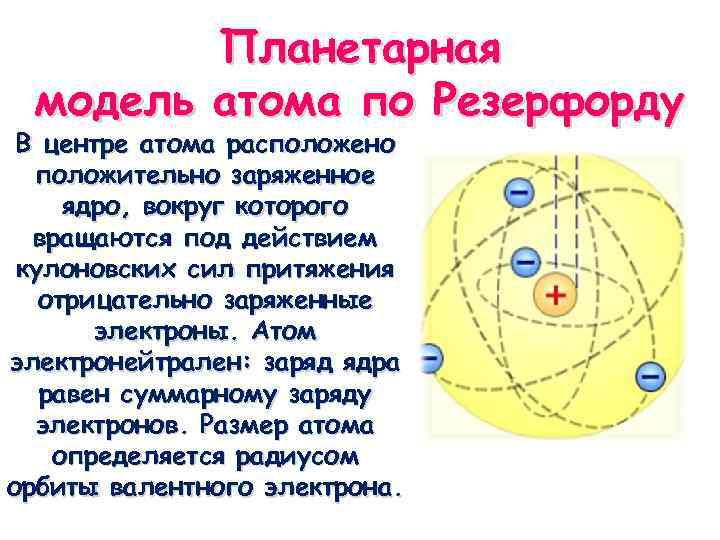 Планетарная модель атома по Резерфорду В центре атома расположено положительно заряженное ядро, вокруг которого вращаются под действием кулоновских сил притяжения отрицательно заряженные электроны. Атом электронейтрален: заряд ядра равен суммарному заряду электронов. Размер атома определяется радиусом орбиты валентного электрона.
Планетарная модель атома по Резерфорду В центре атома расположено положительно заряженное ядро, вокруг которого вращаются под действием кулоновских сил притяжения отрицательно заряженные электроны. Атом электронейтрален: заряд ядра равен суммарному заряду электронов. Размер атома определяется радиусом орбиты валентного электрона.
 Планетарная модель атома по Резерфорду Модель проста, но не позволяет объяснить устойчивость атомов!!! Электроны, вращающиеся вокруг ядра обладают центростремительным ускорением, а ускоренно движущийся заряд излучает э-м волны. Теряя энергию на излучение, электроны должны упасть на ядро, и атом должен прекратить свое существование, а частота излучаемого света должна увеличиваться. В действительности атомы устойчивы и в состоянии с минимальной энергией могут существовать неограниченно долго!!!
Планетарная модель атома по Резерфорду Модель проста, но не позволяет объяснить устойчивость атомов!!! Электроны, вращающиеся вокруг ядра обладают центростремительным ускорением, а ускоренно движущийся заряд излучает э-м волны. Теряя энергию на излучение, электроны должны упасть на ядро, и атом должен прекратить свое существование, а частота излучаемого света должна увеличиваться. В действительности атомы устойчивы и в состоянии с минимальной энергией могут существовать неограниченно долго!!!
 Модель атома водорода по Бору
Модель атома водорода по Бору
 Первый постулат Бора В устойчивом атоме электрон может двигаться лишь по особым, стационарным орбитам, не излучая при этом электромагнитной энергии
Первый постулат Бора В устойчивом атоме электрон может двигаться лишь по особым, стационарным орбитам, не излучая при этом электромагнитной энергии
 Правило квантования орбит Бора
Правило квантования орбит Бора
 Энергетический уровень Энергия, которой обладает электрон в определенном стационарном состоянии Основное состояние атома – состояние с минимальной энергией Для атома водорода, который имеет определенный спектр энергий состояние атома с n=1 называют основным (в основном состоянии электрон ближе всего к ядру)
Энергетический уровень Энергия, которой обладает электрон в определенном стационарном состоянии Основное состояние атома – состояние с минимальной энергией Для атома водорода, который имеет определенный спектр энергий состояние атома с n=1 называют основным (в основном состоянии электрон ближе всего к ядру)
 Возбужденные состояния атомов – состояния с n>1 Чем больше квантовое число, тем дальше от ядра находится электрон, тем выше его энергетический уровень. Свободные состояния электрона – энергетические состояния с положительной энергией электрона Связанные состояния электрона – энергетические состояния с отрицательной энергией электрона
Возбужденные состояния атомов – состояния с n>1 Чем больше квантовое число, тем дальше от ядра находится электрон, тем выше его энергетический уровень. Свободные состояния электрона – энергетические состояния с положительной энергией электрона Связанные состояния электрона – энергетические состояния с отрицательной энергией электрона
 Второй постулат Бора Энергия ионизации– минимальная энергия, которую нужно затратить для перевода электрона из основного состояния атома в свободное состояние Излучение света атомом происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En
Второй постулат Бора Энергия ионизации– минимальная энергия, которую нужно затратить для перевода электрона из основного состояния атома в свободное состояние Излучение света атомом происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En
 Второй постулат Бора Излучение света атомом происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En Энергия излученного фотона равна разности энергий стационарных состояний
Второй постулат Бора Излучение света атомом происходит при переходе атома из стационарного состояния с большей энергией Ek в стационарное состояние с меньшей энергией En Энергия излученного фотона равна разности энергий стационарных состояний
 Второй постулат Бора n=1, 2, 3, …; k>n Все возможные частоты дают спектр излучения атома водорода, согласующийся с экспериментом. Спектр составляют ряд серий излучения, которые образуются при переходах атома в одно из фиксированных нижних энергетических состояний n из всех возможных верхних энергетических состояний k
Второй постулат Бора n=1, 2, 3, …; k>n Все возможные частоты дают спектр излучения атома водорода, согласующийся с экспериментом. Спектр составляют ряд серий излучения, которые образуются при переходах атома в одно из фиксированных нижних энергетических состояний n из всех возможных верхних энергетических состояний k

 Серия Бальмера Переходы в первое возбужденное состояние (на второй энергетический уровень) с верхних уровней (швейцарский учитель Бальмер 1885 г. )
Серия Бальмера Переходы в первое возбужденное состояние (на второй энергетический уровень) с верхних уровней (швейцарский учитель Бальмер 1885 г. )
 Серия Бальмера Переходы в первое возбужденное состояние (на второй энергетический уровень) с верхних уровней (швейцарский учитель Бальмер 1885 г. )
Серия Бальмера Переходы в первое возбужденное состояние (на второй энергетический уровень) с верхних уровней (швейцарский учитель Бальмер 1885 г. )
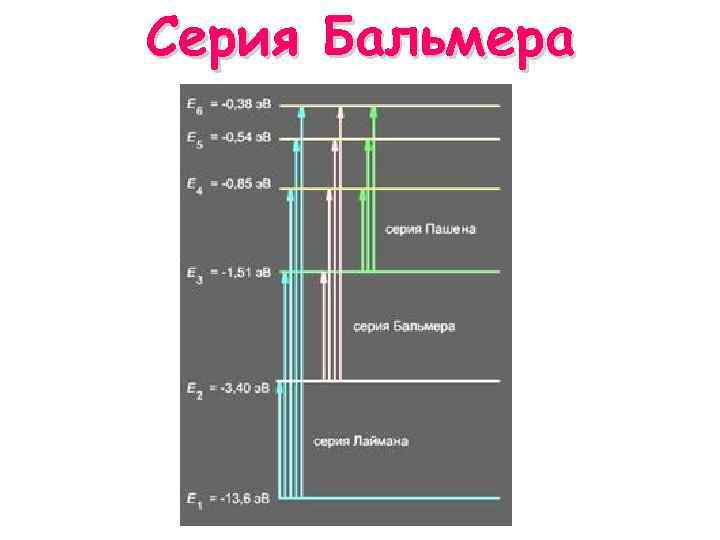 Серия Бальмера
Серия Бальмера


