2013_Врождённый иммунитет.ppt
- Количество слайдов: 89

ВРОЖДЁННЫЙ (=ЕСТЕСТВЕННЫЙ) ИММУНИТЕТ ШАБАН Ж. Г.

Иммунитет (лат. immunitas – освобождение от чего-либо, избавление) - совокупность защитных и приспособительных реакций организма, направленных на: - поддержание гомеостаза внутренней среды, - защиту от инфекций и генетических чужеродных агентов

Иммунитет – реакция: Ø древняя (возникла вместе с инфекцией) Ø уникальная (только у живых организмов) Ø универсальная (у всех особей без исключения) Ø многокомпонентная Ø многообразная в проявлениях
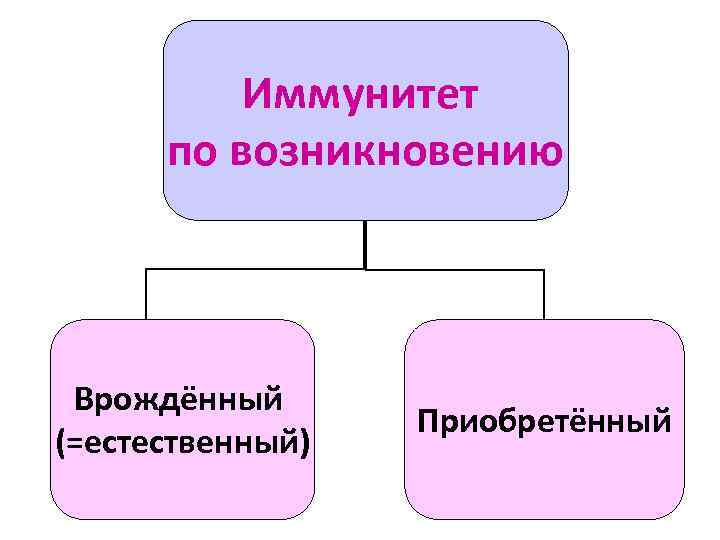
Иммунитет по возникновению Врождённый (=естественный) Приобретённый

Врождённый иммунитет - форма видовой невосприимчивости - осуществляется совокупностью биологических особенностей организма - не связана с развитием специфического ИО
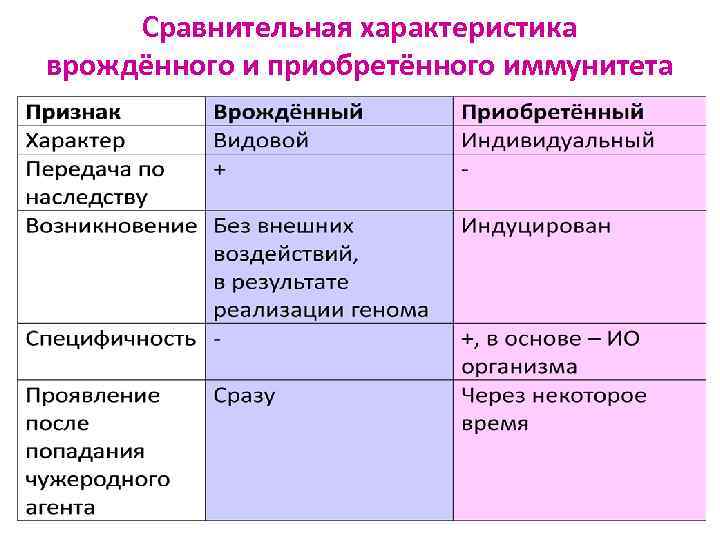
Сравнительная характеристика врождённого и приобретённого иммунитета
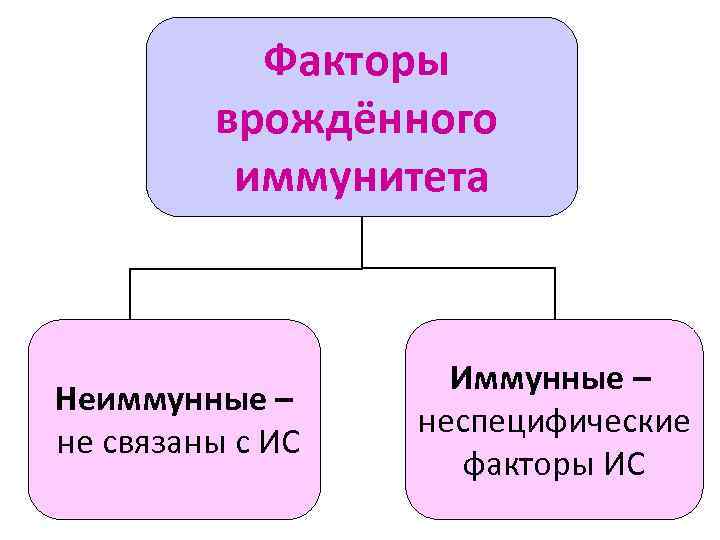
Факторы врождённого иммунитета Неиммунные – не связаны с ИС Иммунные – неспецифические факторы ИС
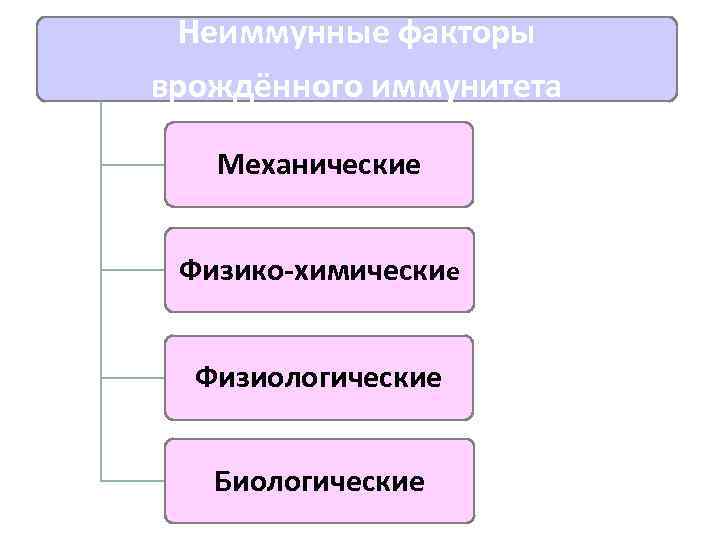
Неиммунные факторы врождённого иммунитета Механические Физико-химические Физиологические Биологические

Механические неиммунные факторы Ø Барьерные свойства кожи и слизистых Ø Гистогематические барьеры (мозг, глаза, внутреннее ухо, тимус, половые железы, плод) Ø Реснитчатый эпителий дыхательных путей Ø Механические выделительные реакции (кашель, чихание, рвота, диарея)

Физико-химические неиммунные факторы Ø Бактерицидные секреты потовых и сальных желёз (антимикробные свойства кожи) Ø HCl желудочного сока Ø Рибонуклеаза – иммунитет к вирусам

Физиологические неиммунные факторы Ø Ареактивность клеток и тканей (отсутствие мишеней для микроорганизма в тканях) Ø Клеточная гетерохрония (неодновременность развития клеток в составе ткани) Ø Мутации (серповидно-клеточная анемия – иммунитет к малярии) Ø Температурная реакция Ø Изменение обмена веществ Ø Состояние НС и ЭС Ø Воспалительная реакция Ø Состав пищи

Биологические неиммунные факторы Ø Конкурентная роль нормальной микрофлоры (микробный антагонизм): - бифидумбактерии препятствуют развитию патогенных МИО в толстом кишечнике - пробиотики используются для коррекции дисбиозов - патогенная флора влагалища уничтожается палочками Дедерлейна (МКБ)
Иммунные факторы врождённого иммунитета Гуморальные Клеточные
Гуморальные иммунные факторы ВИ Система комплемента Лизоцим β-лизины Интерфероны Белки острой фазы воспаления Транспортные белки (лактоферрин, трансферрин, церулоплазмин)

Система комплемента (англ. сотрlеmеnt - дополнение) - система белков сыворотки крови и тканевой жидкости (постоянно присутствуют, 10% всех белков сыворотки) - синтезируются гепатоцитами, Мф, нейтрофилами - циркулируют в неактивном состоянии (неактивные проферменты) - неспецифически распознают активаторы (МИО, иммунные комплексы АГ-АТ) - каскадно активируются путем протеолиза - обладают бактерицидным действием

Состав системы комплемента (> 30 белков и белковых комплексов): Ø Компоненты - набор протеаз (всего 11 белков), обозначаются С и номером: С 1 (3 субъединицы: q, r, s), С 2, С 3, С 4, С 5, С 6, С 7, С 8, С 9 Продукты протеолиза обозначаются дополнительно строчными буквами – a, b. Центральную роль в работе системы комплемента играет С 3 (его концентрация в сыворотке крови 1 г/л) Ø Факторы B, D, H, P Ø Регуляторные белки: С 1 -ингибитор, С 3 в-инактиватор и др. Ø Рецепторы белков комплемента на клетках: CR 1 -CR 4

Активация комплемента Ø Место активации комплемента - мембрана клетки Ø Процесс расщепления белка на 2 фрагмента (a и b) либо изменение его конформации белок приобретает способность активировать последующий белок системы Ø Протекает каскадно, каждый активированный фермент действует как усилитель: расщепляет много молекул следующего профермента и приводит к образованию множества литических комплексов Ø В результате активации образуются регуляторные и эффекторные биомолекулы
Пути активации комплемента Альтернативный Классический Лектиновый

Альтернативный путь (АП) Ø Ранний: протекает в неиммунном организме (без участия комплекса АГ-АТ) Ø Активатор - ЛПС МИО; АП развивается при связывании С 3 b с поверхностью МИО Ø Не участвуют ранние белки (С 1, С 4, С 2) Ø Участвуют: ионы Са+, Мg+, факторы B, D, P (пропердин), поздние белки (С 3, С 5 -С 9) Ø Малая скорость реакций

Этапы альтернативного пути (АП) 1. В сыворотке циркулирует небольшое количество С 3 b. При взаимодействии с С 3 b, фактор D катализирует расщепление фактора В на Ва и Вb. С 3 b вместе с Вb образует комплекс С 3 b. Вb - С 3 конвертазу АП. 2. Связывание с пропердином Р стабилизирует С 3 конвертазу АП. 3. Стабилизированный комплекс катализирует продолжение протеолиза С 3 (амплификация (усиление) за счёт вновь образующихся активированных фрагментов C 3 b). 4. Комплекс C 3 b. Bb связывает новые фрагменты C 3 b образуется (С 3 b)n. Bb – C 5 конвертаза АП.

Классический путь (КП) Ø Был открыт первым, но эволюционно является новым Ø Поздний: протекает в иммунном организме Ø Активатор – иммунный комплекс (АГ-АТ), Ig. M и Ig. G обладают высоким сродством к субкомпоненту С 1 q Ø Участвуют все 9 компонентов с С 1 по С 9 Ø Высокая скорость реакций

Этапы классического пути (КП) 1. Связывание С 1 q конформационные изменения в С 1, активация субкомпонентов С 1 r и С 1 s протеолиз С 4 с образованием фрагментов С 4 а и С 4 b. 2. Более крупный фрагмент С 4 b связывается с С 2, который затем под действием С 1 s распадается на С 2 а и С 2 b. Фрагмент С 2 а остается связанным с С 4 b, образуя С 4 b. С 2 а - С 3 -конвертазу КП. 3. С 3 -конвертаза КП катализирует протеолиз С 3 с образованием С 3 а и активного фрагмента С 3 b, который участвует в формировании С 4 b. С 2 а. С 3 b - С 5 -конвертазы КП.
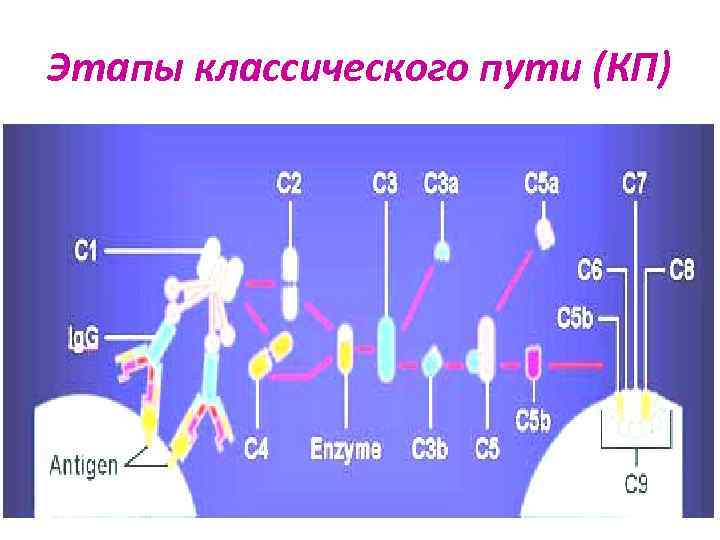
Этапы классического пути (КП)

Лектиновый путь (ЛП) Ø Активатор - полисахариды поверхности МИО Ø Играет важную роль в системе врождённого иммунитета у пациентов с дефицитом С 1 Ø Роль С 1 q выполняет маннозо-связывающий лектин Ø Роль С 1 r и C 1 s выполняет ассоциированная протеиназа, активирующая компоненты С 4 и С 2

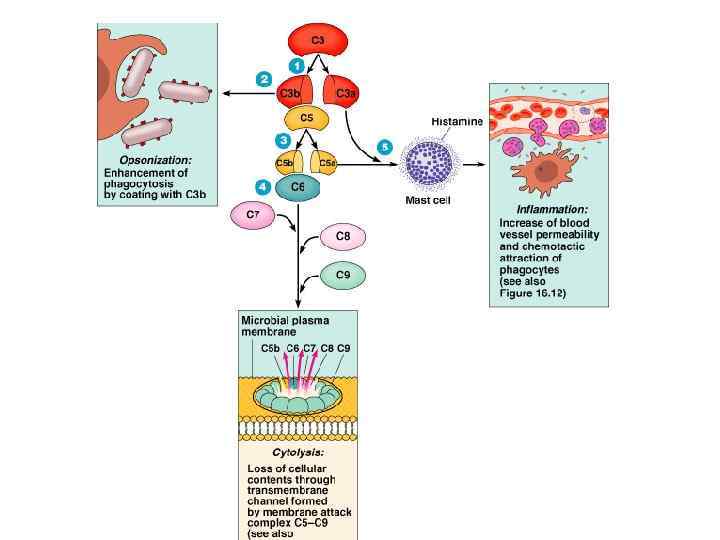
ЗАКЛЮЧИТЕЛЬНЫЕ СТАДИИ ЛИЗИСА Конвертазы (С 3 b)n. Bb и С 4 b. С 2 а. С 3 b – конечные продукты КП, АП и ЛП активации комплемента. С 3 b - участок связывания белка С 5, который в результате протеолиза распадается на С 5 а и С 5 b. Фрагмент С 5 b начинает формирование МАК, связывает белки С 6 и С 7, образуется комплекс С 5 b. С 6 С 7. С комплексом С 5 b. С 6 С 7 связываются С 8 и С 9, образуя С 5 b. С 6 С 7 С 8 С 9 =литический мембраноатакующий комплекс (МАК), где С 9 – белок-перфорин, образует пору в мембране клетки. Клетка подвергается осмотическому лизису.
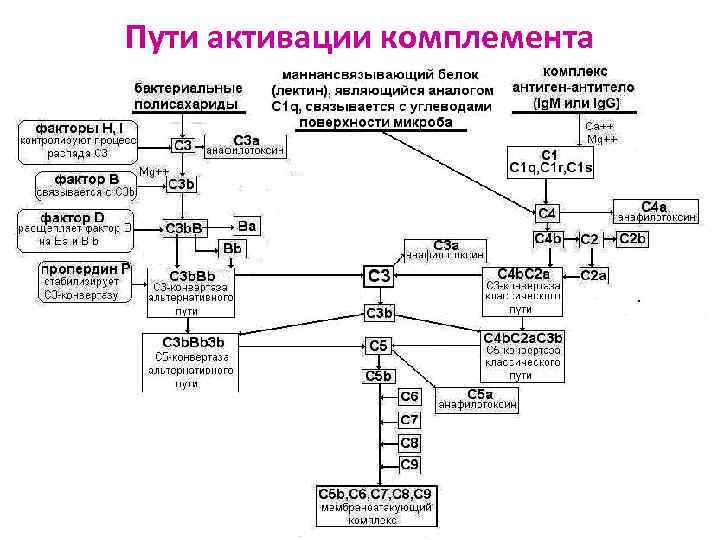
Пути активации комплемента

Функции системы комплемента 1. Усиление фагоцитоза: - С 5 а, С 3 а, С 6, С 7 (хемотаксины), способствуют накоплению фагоцитов в очаге воспаления - С 3 b, C 4 b, C 5 b (опсонины) активируют иммунный фагоцитоз, обеспечиваемый Мф
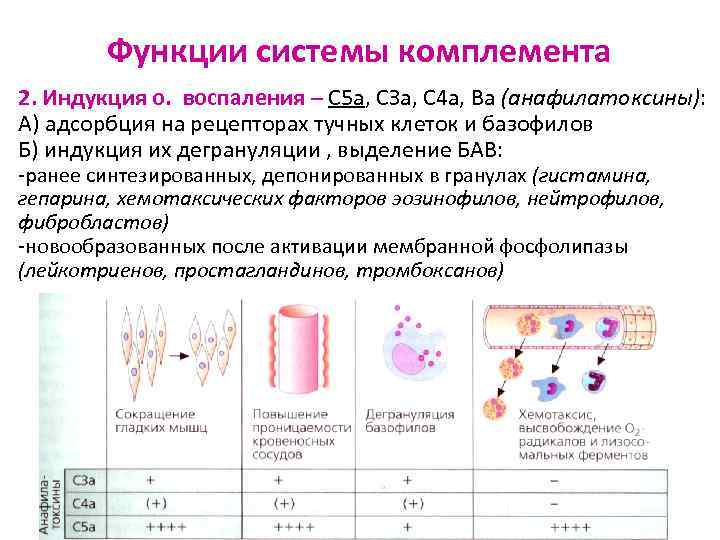
Функции системы комплемента 2. Индукция о. воспаления – С 5 а, СЗа, С 4 а, Ва (анафилатоксины): А) адсорбция на рецепторах тучных клеток и базофилов Б) индукция их дегрануляции , выделение БАВ: -ранее синтезированных, депонированных в гранулах (гистамина, гепарина, хемотаксических факторов эозинофилов, нейтрофилов, фибробластов) -новообразованных после активации мембранной фосфолипазы (лейкотриенов, простагландинов, тромбоксанов)

БАВ – индукторы острого воспаления - расширение сосудов – rubor (покраснение) - местное температуры – сalor (жар) - проницаемости сосудов белки и фагоциты проиникают в ткани – tumor (припухлость) - давления в тканях, раздражающее действие на чувствительные нервные окончания – dolor (боль) - functio laeza (нарушение функции)

Функции системы комплемента 3. Участие в аллергических реакциях: воздействие БАВ - сокращение гладких мышц и проницаемости сосудов - хемотаксис и активация фагоцитов, выброс лизосомальных ферментов 4. Цитолитическое действие за счёт С 9 (перфорина): - лизис мембран бактерий (бактериолиз) - цитолиз (лизис соматических клеток) цитотоксические и аутоиммунные реакции 5. Удаление из организма иммунных комплексов 6. Регуляция иммунного ответа: - С 3 а – супрессия ИО (ингибиция взаимодействия Лф с рецепторами) - С 5 а – стимуляция ИО (активация взаимодействия Лф с рецепторами)
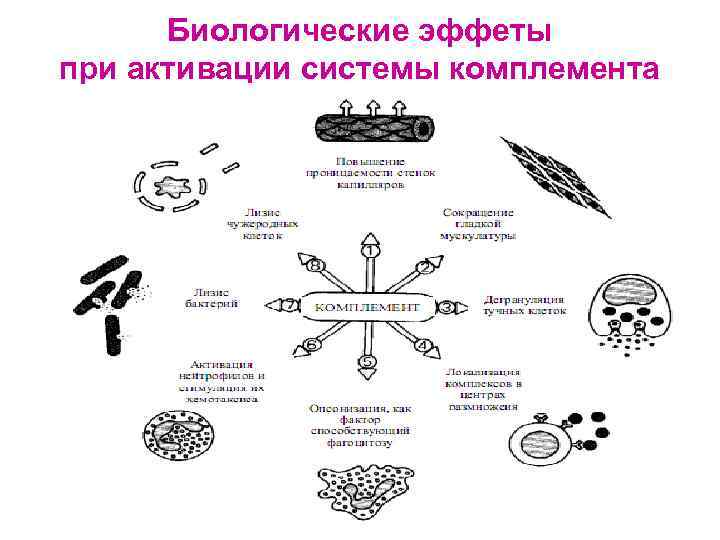
Биологические эффеты при активации системы комплемента

Регуляторные механизмы системы комплемента А. Ферменты плазмы крови - расщепляют и инактивируют компоненты комплемента (фактор I, инактиватор анафилатоксинов) Б. Белки плазмы крови - связывают и активность компонентов комплемента (С 1 -ингибитор, фактор H, C 4 bр, S-белок (=витронектин)) В. Регуляторные белки клеточных мембран препятствуют активации комплемента на поверхности собственных клеток организма (DAF, MCP, С 8 -связывающий белок)

Регуляция начальных этапов активации Ø С 1 -ингибитор (α-глобулин плазмы) - : а) контролирует КП: связывает и инактивирует C 1 r и C 1 s субъединицы, не допуская образования избыточных количеств активированного С 1 б) выключает ЛП, удаляя ферменты MASP из MBP-комплекса в) ингибирует плазмин, калликреин, активированный фактор Хагемана Ø C 4 bр (С 4 -связывающий белок): а) препятствует образованию избыточных количеств С 3 -конвертазы КП: - конкурирует с С 1 за присоединение С 4 - вытесняет С 2 а из комплексов C 4 b. C 2 a б) кофактор для фактора I – связывается с С 4 b и делает его доступным атаке фактора I

Регуляция начальных этапов активации ØФактор I (сериновая протеаза): а) инативатор С 3 -конвертаз: расщепляет С 4 b (только в присутствии C 4 bp и фактора Н) б) инактиватор С 5 -конвертаз: расщепляет С 3 b (в растворе и на поверхности клетки) расщеплённый С 3 b не может функционировать в составе С 5 -конвертаз; образуются биоактивные продукты расщепления: С 3 с и С 3 е Ø Фактор H: а) кофактора I б) ингибирует активность C 3 b. Bb: связывает и инактивирует С 3 b образуется неактивный i. C 3 b Ø Инактиватор анафилатоксинов (сывороточная карбоксипептидаза N): разрушает С 3 а, С 5 а, С 4 а

Начальные механизмы защиты клеточных мембран Ø DAF (= ФУД, фактор, ускоряющий диссоциацию, CD 55) препятствует образованию С 3 -конвертаз КП и АП: - ускоряет диссоциацию С 4 b. С 2 a (препятствует связыванию С 2 с C 4 b, вытесняет С 2 а из комплексов C 4 b. C 2 a) - ускоряет диссоциацию C 3 b. Bb Ø MCP (= МКБ, интегральный мембранный кофакторный белок, CD 46) - способствует инактивации С 3 b и C 4 b фактором I Ø CR 1 - рецептор комплемента первого типа (он же CD 35) расположен на поверхности эритороцитов: - препятствует образованию С 3 -конвертаз КП и АП, аналогично DAF - способствует инактивации С 3 b и C 4 b фактором I аналогично MCP

Механизмы защиты клеточных мембран от уже начавших формироваться МАК СЫВОРОТОЧНЫЕ РЕГУЛЯТОРЫ: - S-белок (витронектин) - его присоединение связывает неустойчивый комплекс С 5 b 67 и защищает клетки-мишени от лизиса МЕМБРАННЫЕ РЕГУЛЯТОРЫ ЭРИТРОЦИТОВ (синтезируются до контакта МАК): - молекула CD 59 - присоединяется к белку С 8 в составе формирующегося МАК и ингибирует полимеризацию С 9 во время образования МАК, не давая ему сформироваться; -HRF (= ФГР, фактор гомологичной рестрикции (=ограничения), С 8 -связывающий белок) : -препятствует ассоциации С 8 с комплексом С 5 b 67 -ограничивает внедрение в мембрану С 9 - менее эффективен, чем CD 59 МЕМБРАННЫЕ РЕГУЛЯТОРЫ ЯДРОСОДЕРЖАЩИХ КЛЕТОК: -эндоцитоз или экзоцитоз участков мембраны, на поверхности которых формируются комплексы C 5 b. С 6 C 7 С 8

Дефекты (болезни)системы комплемента 1. СВЯЗАНЫ С ДЕФЕКТАМИ КОМПОНЕНТОВ: Ø С 1, С 4, С 2 нарушение элиминации ИК, аутоиммунные заболевания Ø С 3 рецидивирующие гнойные инфекции Ø С 5, 6, 7 тяжёлое течение и генерализация бактериальных инфекций, вызванных Neisseria (гонорея и менингит) 2. СВЯЗАНЫ С ДЕФЕКТАМИ ИНГИБИТОРОВ КОМПОНЕНТОВ Ø Дефицит DAF пароксизмальная ночная гемоглобинурия – чувствительности эритроцитов к комплемент-опосредованному лизису Ø Дефект С 1 -ингибитора врождённый ангионевротический отёк
Дефицит С 1 -ингибитора – врождённый ангионевротический отёк, вызываемый избыточными количествами С 4 а и С 3 а. При этом не происходит истощения сыворотки по основным белкам комплемента, поскольку срабатывает регуляция на следующих этапах.

Лизоцим (=фермент муромидаза) Ø расщепляет пептидогликан (муреин) клеточных стенок Г+ бактерий Ø содержится: - в секретах слизистых - в лизосомах фагоцитов - в сыворотке (<)

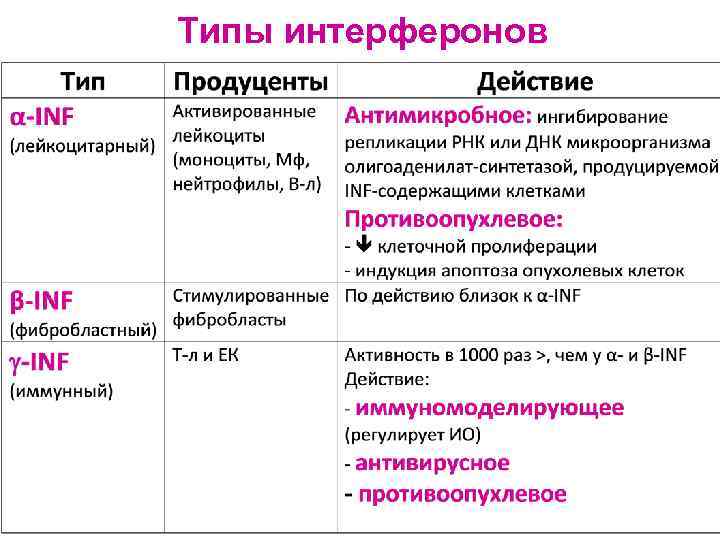
Интерфероны (α, β, ) Ø Группа низкомолекулярных белков Ø Синтезируются эукариотическими клетками (лейкоцитами, фибробластами) в ответ на внедрение биологических агентов Ø Явление интерференции – противовирусный иммунитет: при инфицировании одним вирусом вырабатывается интерферон, он не обладает вирусспецифическим действием и защищает клетки от инфицирования другими вирусами
Типы интерферонов
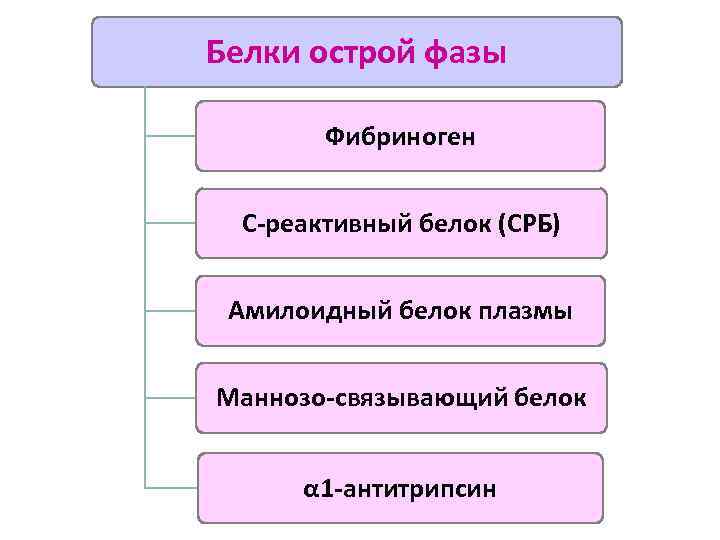
Белки острой фазы Фибриноген С-реактивный белок (СРБ) Амилоидный белок плазмы Маннозо-связывающий белок α 1 -антитрипсин

Белки острой фазы Ø Синтезируются клетками РЭС и гепатоцитами Ø Постоянно присутствуют в норме в плазме крови Ø Их синтез на несколько порядков: - при системном воспалении - под воздействием ИЛ 6 , ИЛ 1, ФНОα Ø Определение некоторых белков острой фазы (СРБ) применяется в клинике для оценки интенсивности воспаления

С-реактивный белок (СРБ) Амилоидный белок плазмы Ø Относятся к семейству пентраксинов (состоят из 5 субъединиц) Ø По химическому строению и свойствам - лектины С-типа (связываются с углеводными молекулами на поверхности МИО) Ø При связывании активируют комплемент Ø Связанный СРБ - хемоаттрактант и опсонин для нейтрофилов Ø При деградации пентраксинов высвобождаются фрагменты, активирующие Мф и стимулирующие синтез провоспалительных цитокинов

Маннозо-связывающий белок (МСБ) Ø Относится к семейству коллектинов (по структуре напоминает С 1 q). Каждая цепь содержит коллагеноподобный участок и С-лектиновый участок, специфичный к сахарам МИО (маннозе, фукозе, глюкозамину) Ø При связывании сахаров на фрагментах клеточной стенки МИО МСБ изменяет конформацию и превращается в сериновую протеазу, которая: - активирует протеазы, ассоциированные с МСБ запуск ЛП активации комплемента - расщепляет факторы С 2 и С 4 запуск КП активации комплемента

Транспортные белки (лактоферрин, трансферрин, церулоплазмин) ØКонкурируют с МИО за Fe и Cu – факторы роста для МИО ØОбладают бактериостатическим действием
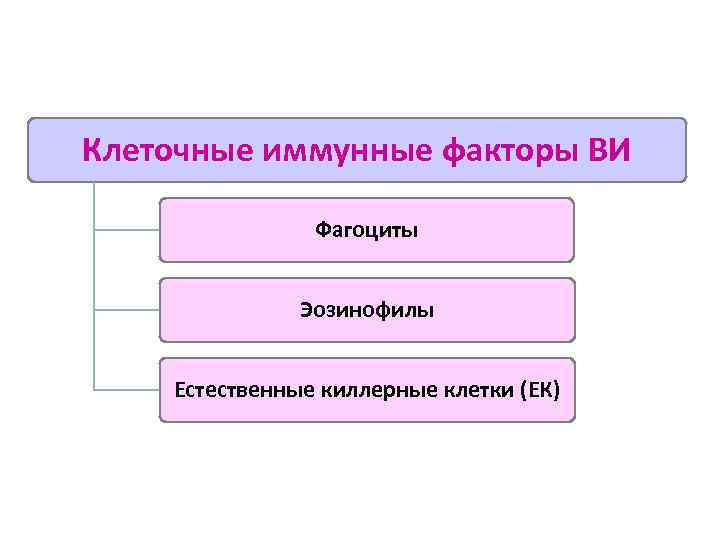
Клеточные иммунные факторы ВИ Фагоциты Эозинофилы Естественные киллерные клетки (ЕК)

Происхождение клеток системы врождённого иммунитета 1. Миелоидной природы – фагоциты: - ПЯЛ (гранулоциты) – нейтрофилы, эозинофилы, базофилы - тучные клетки – тканевые базофилы - мононуклеарные лейкоциты: - моноциты крови - тканевые Мф (купферовские клетки печени, перитонеальные Мф, плевральные Мф, альвеолярные Мф, глиальные Мф, мезангиальные клетки почек, остеокласты) - дендритные клетки (ДК) (клетки Лангерганса (кожа), ДК слизистых, интердигитальные клетки (л/у), ДК тимуса) 2. Лимфоидной природы: - естественные киллеры (ЕК) - Лф с двойственной функцией (γδ Tл , Bл 1 типа)
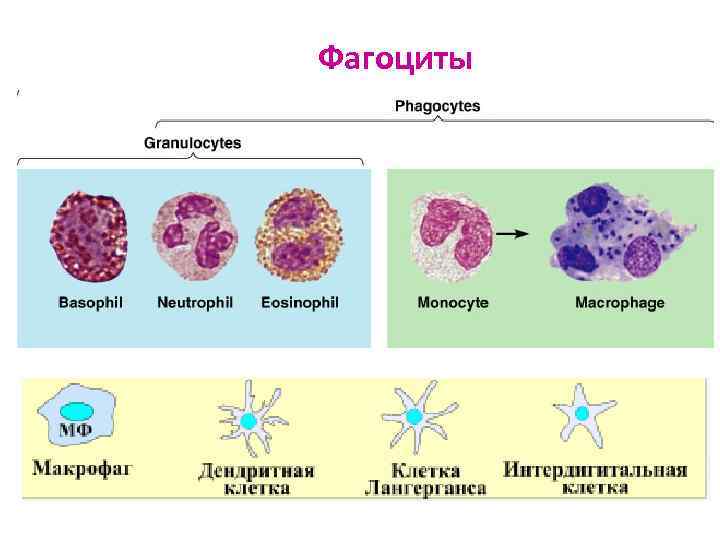
Фагоциты

Фагоцитоз (греч. phagen - есть) процесс узнавания, поглощения и биодеградации чужеродных частиц (в т. ч. МИО) и макромолекул специализированными клетками ИС – фагоцитами
Электронограмма лейкоцита и фагоцитируемой им бактерии, полученная при сканирующей электронной микроскопии

Стадии фагоцитоза Хемотаксис/Опсонизация Адгезия фагоцита к объекту фагоцитоза Активация фагоцита Поглощение объекта и образование фагосомы Слияние фагосомы с лизосомой образование фаголизосомы Киллинг живого объекта Переваривание Исход

Хемотаксис Ø Направленное движение фагоцитов по градиенту хемоаттрактантов: - продуктов деградации бактерий (пептидов, липопротеидов) - цитокинов (ИЛ-8) - продуктов активации комплемента (С 3 а, С 5 а) - протеолитических фрагментов факторов свертывания крови - фибринолизина Ø Хемоаттрактанты обеспечивают поступление Мф в очаг воспаления Ø Задерживают Мф в очаге воспаления ингибиторы хемотаксиса (интерферон, гиалуроновая кислота)

Опсонизация (opsonin – усиливающий) – фагоцитоза за счёт связывания опсонинов с поверхностью объекта и взаимодействия с рецепторами фагоцитов Ø Опсонины: - активированный С 3 b (связывается с рецептором к С 3 b на фагоците) - Ig. G (связывается с рецептором к Fc-фрагменту Ig. G на фагоците) - фибронектин – гликопротеин, который связывается с МИО фагоците) (затем связывается с рецептором к фибронектину на
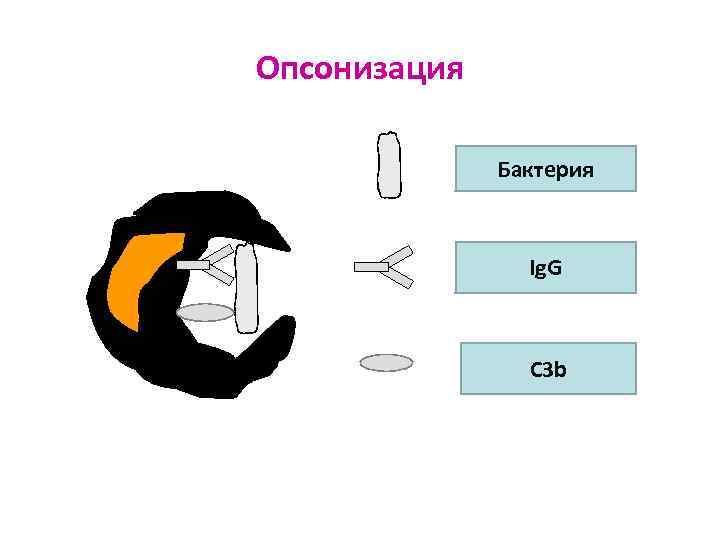
Опсонизация Бактерия Ig. G C 3 b

Активаторы фагоцитов Ø Все лиганды ТПР (ЛПС) Ø Цитокины (INF- ) Ø Адгезины (интегрины, хемокины) Ø Активированные факторы комплемента Ø Стимуляторы перечисленных факторов

Проявления активации фагоцитов Ø Усиление фагоцитоза, кислородный взрыв Ø экспрессии адгезинов, молекул костимуляции и ГКГС Ø Синтез цитокинов Ø цитотоксичности Ø Отмена апоптоза
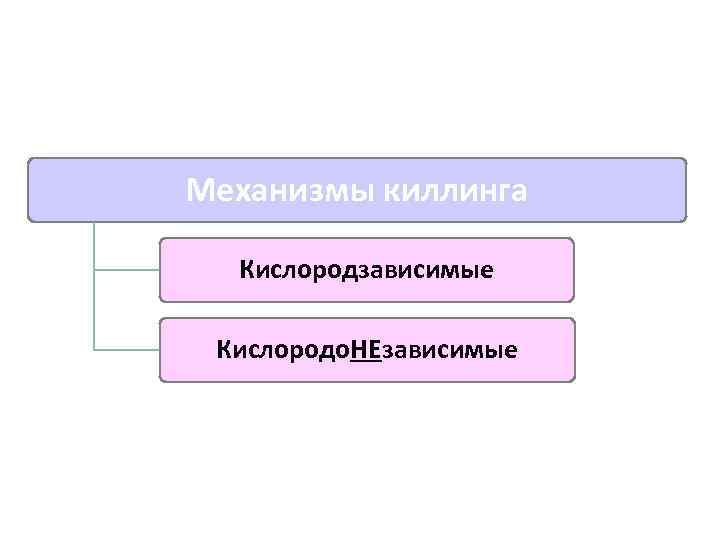
Механизмы киллинга Кислородзависимые Кислородо. НЕзависимые
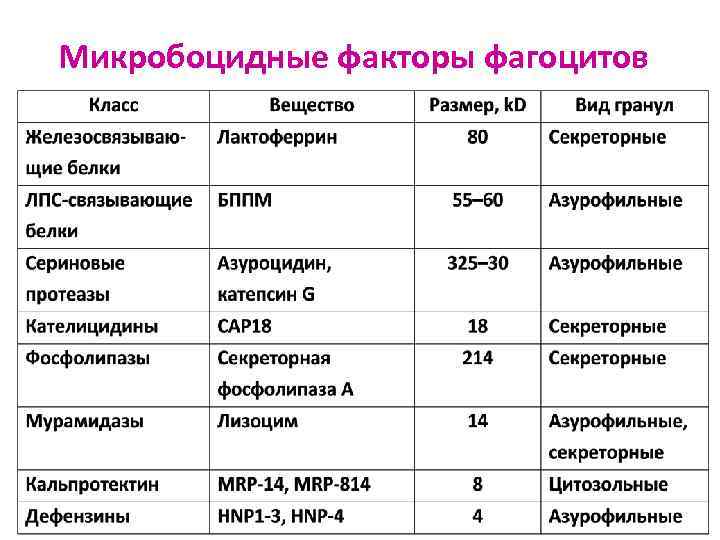
Микробоцидные факторы фагоцитов
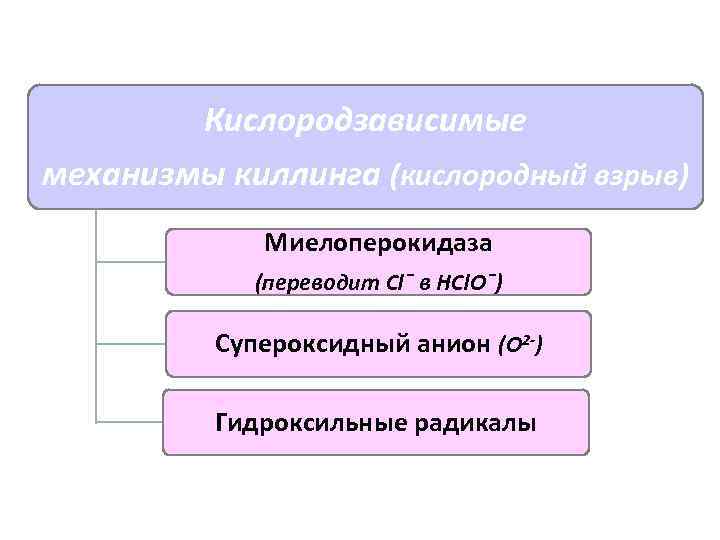
Кислородзависимые механизмы киллинга (кислородный взрыв) Миелоперокидаза (переводит Сl¯ в НСl. О¯) Супероксидный анион (О 2 -) Гидроксильные радикалы

Кислородозависимые механизмы внутриклеточной бактерицидности
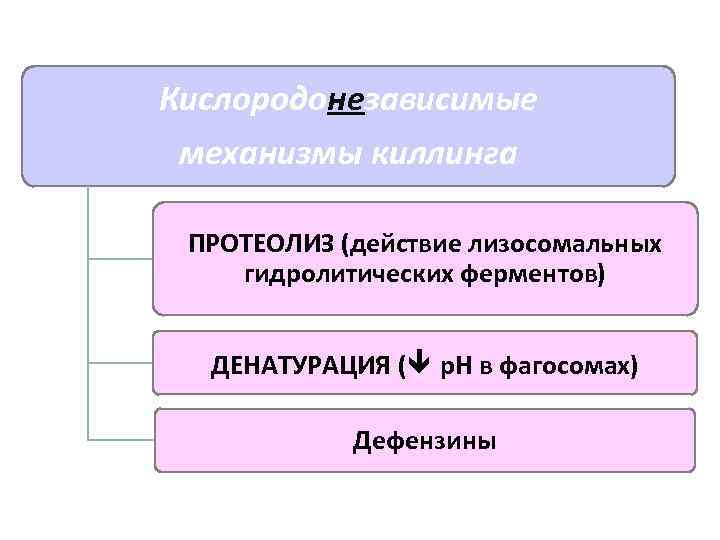
Кислородонезависимые механизмы киллинга ПРОТЕОЛИЗ (действие лизосомальных гидролитических ферментов) ДЕНАТУРАЦИЯ ( р. Н в фагосомах) Дефензины
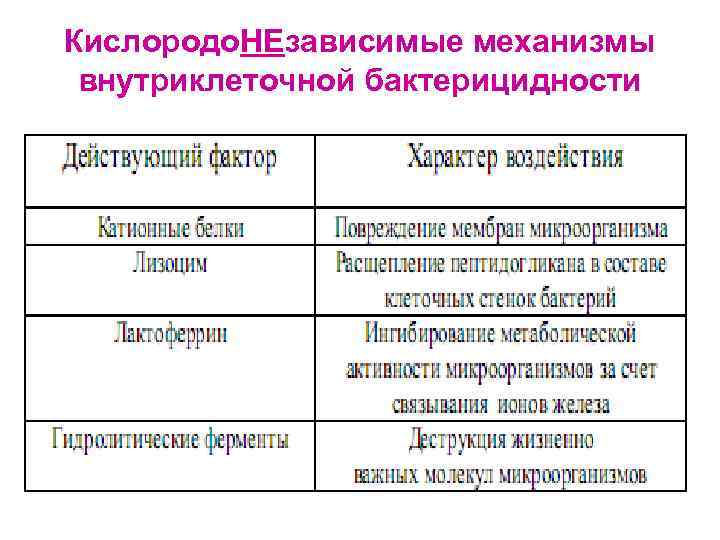
Кислородо. НЕзависимые механизмы внутриклеточной бактерицидности

Кислородный взрыв Активация пентозо-фосфатного шунта, накопление НАДФ Генерация активного супероксид-аниона кислорода с участием НАДФ и цитохрома b 245 (НАДФ-оксидаза) Спонтанные реакции с водой и протонами с образованием перекисных соединений и синглетного кислорода Образование активных соединений хлора и синглетного хлора при участии миелопероксидазы

Оксид азота (NO) Ø Образуется из аргинина с помощью NO-синтетазы, НАДФ и лейкотриена В 4 Ø NO-синтетаза: - конститутивная - индуцибельная (в 1000 раз активнее) Ø активируется INF- , ФНОα, ИЛ-1 Ø угнетается ИЛ-10, 4, 13 Ø механизм действия: - нерепарируемые повреждения - инактивация ферментов - быстрое связывание железа
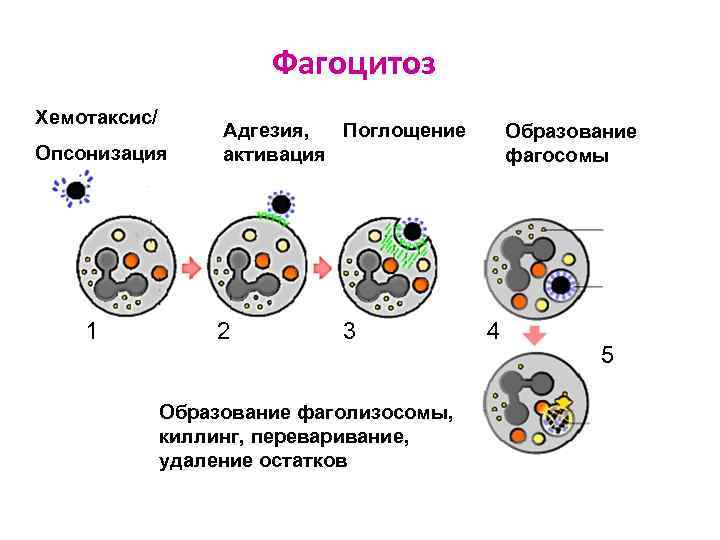
Фагоцитоз Хемотаксис/ Опсонизация 1 Адгезия, Поглощение активация 2 3 Образование фаголизосомы, киллинг, переваривание, удаление остатков Образование фагосомы 4 5

Исходы фагоцитоза Ø Завершенный Ø Незавершенный: - гибель фагоцита - персистенция МИО в фагоците

Механизмы персистенции МИО в фагоцитах Ø Блокада слияния фагосомы и лизосомы Ø Резистентность к действию лизосомальных ферментов Ø Способность патогенных МИО покидать фагосому до слияния ее с лизосомой
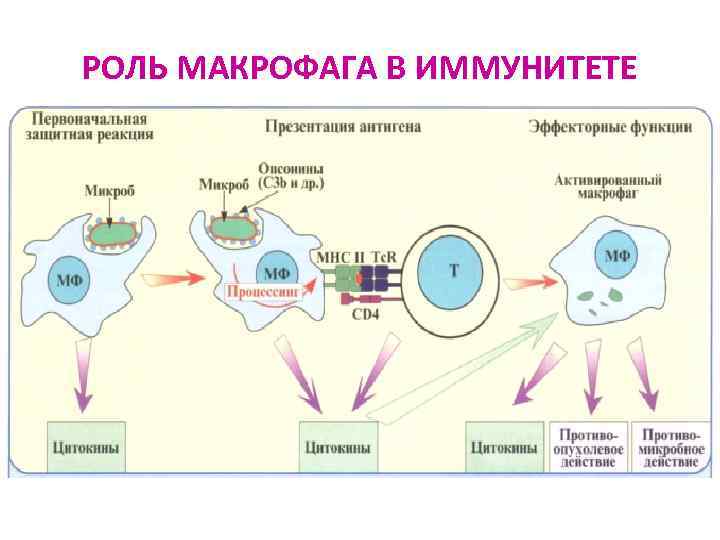
РОЛЬ МАКРОФАГА В ИММУНИТЕТЕ

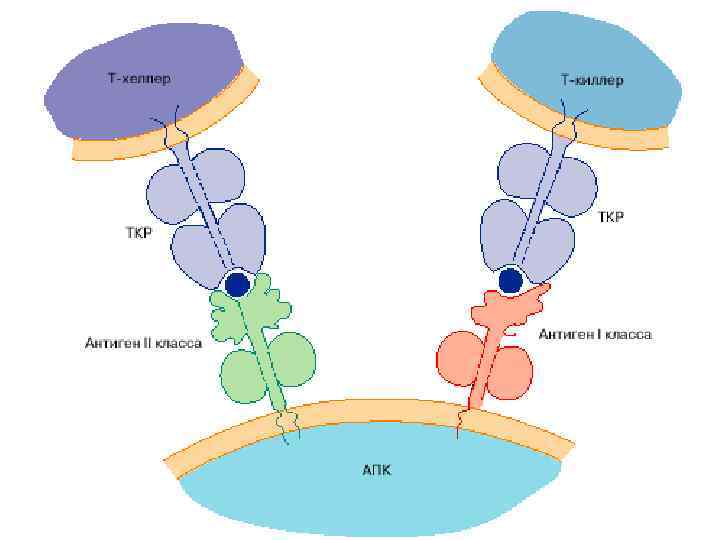
Распознавание АГ лимфоцитами возможно только после предварительного процессинга и представления АГ АГ-презентирующей клеткой Презентация антигена - представление процессированного АГ в комплексе с молекулами ГКГС антигенспецифическим клонам регуляторных и эффекторных Т-лимфоцитов Этапы АГ- презентации: Ø Ø поглощение АГ антиген-презентирующей клеткой расщепление АГ в цитоплазме АПК ферментами (процессинг АГ) связывание образующихся антигенных пептидов с молекулами ГКГС I или II класса транспортировка и выход образовавшегося комплекса на поверхность мембраны клетки, где АГ (пептид) распознается рецепторами лимфоцитов
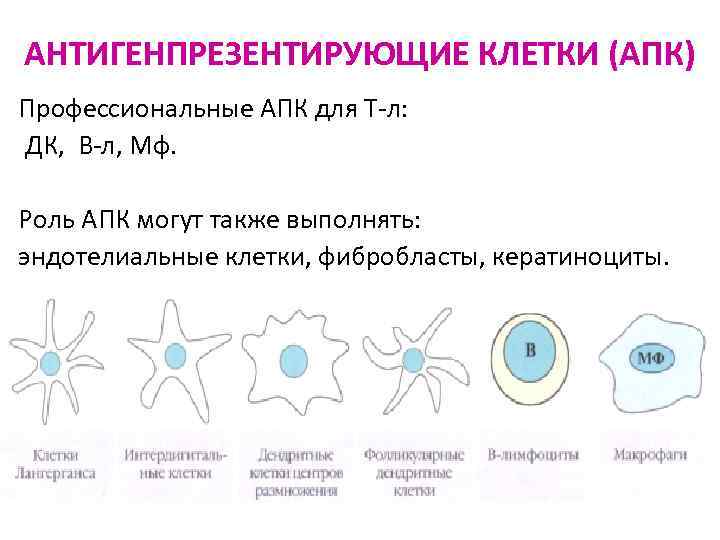
АНТИГЕНПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ (АПК) Профессиональные АПК для Т-л: ДК, В-л, Мф. Роль АПК могут также выполнять: эндотелиальные клетки, фибробласты, кератиноциты.
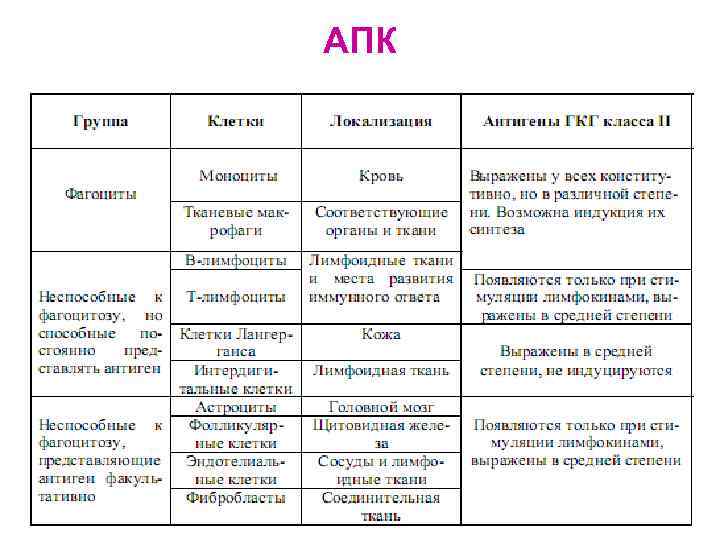
АПК

Роль молекул ГКГС в АГ-презентации АГ ГКГС I класса: Ø Ø есть на всех ядросодержащих клетках состоят из трансмембранной α-цепи и β 2 -микроглобулина гены расположены в локусах А, В и С участвуют в процессах распознавания АГ лимфоцитами: представляют CD 8+-лимфоцитам «процессированный» АГ АГ ГКГС II класса: Ø Ø есть только на некоторых иммунных клетках состоят из 2 трансмембранных цепей (α и β) гены расположены в локусах DP, DQ, DR участвуют в процессах распознавания АГ лимфоцитами: представляют CD 4+- лимфоцитам «процессированный» АГ
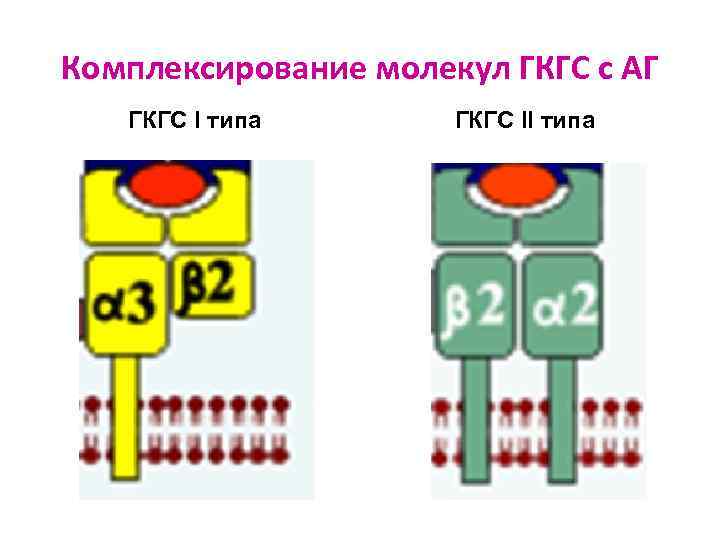
Комплексирование молекул ГКГС с АГ ГКГС I типа ГКГС II типа
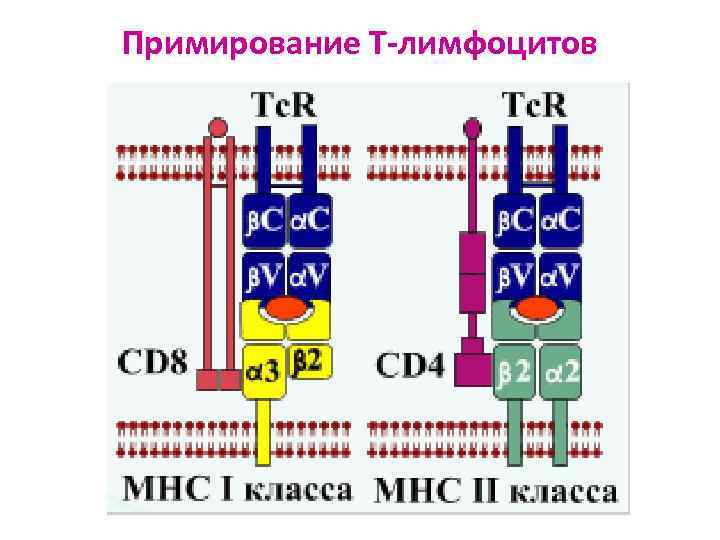
Примирование Т-лимфоцитов
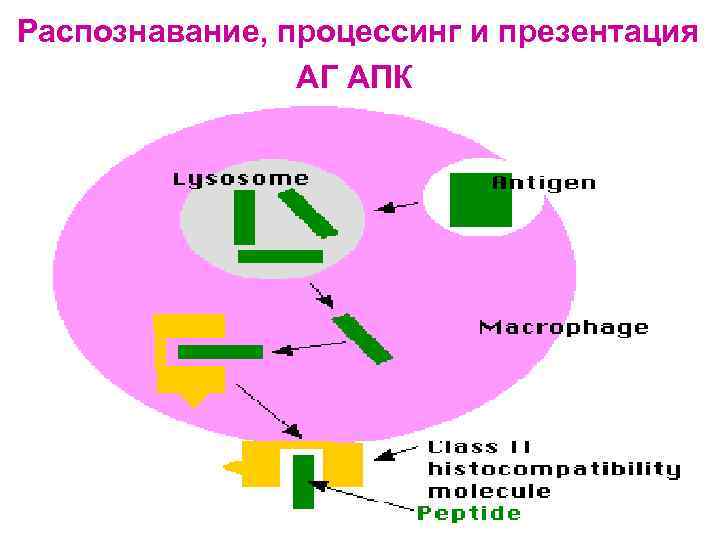
Распознавание, процессинг и презентация АГ АПК
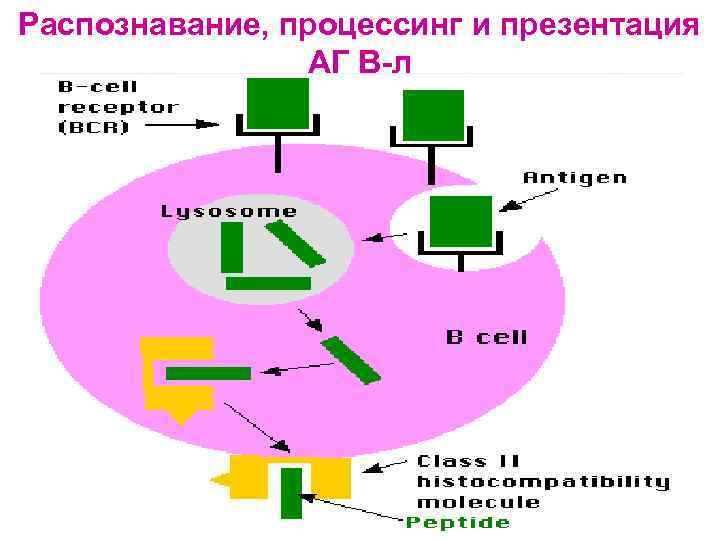
Распознавание, процессинг и презентация АГ В-л
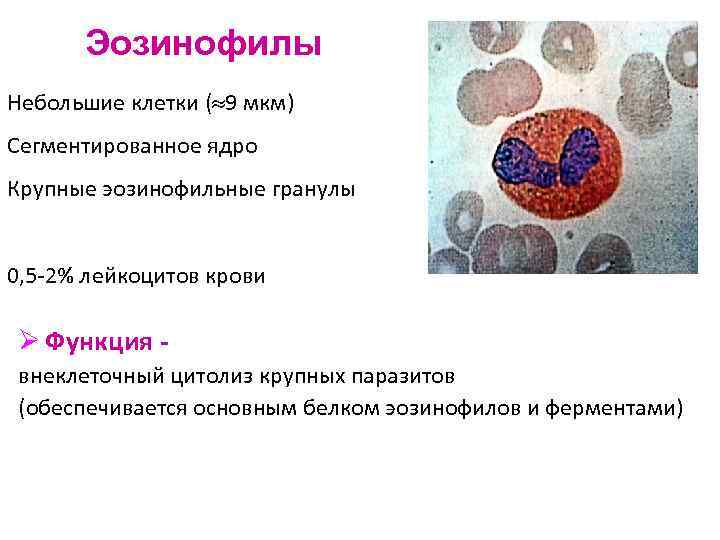
Эозинофилы Небольшие клетки ( 9 мкм) Сегментированное ядро Крупные эозинофильные гранулы 0, 5 -2% лейкоцитов крови Ø Функция внеклеточный цитолиз крупных паразитов (обеспечивается основным белком эозинофилов и ферментами)
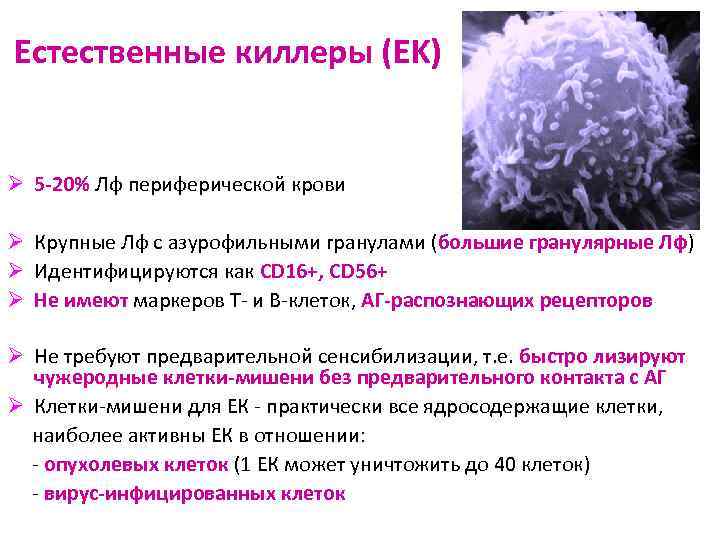
Естественные киллеры (ЕK) Ø 5 -20% Лф периферической крови Ø Крупные Лф с азурофильными гранулами (большие гранулярные Лф) Ø Идентифицируются как CD 16+, CD 56+ Ø Не имеют маркеров Т- и В-клеток, АГ-распознающих рецепторов Ø Не требуют предварительной сенсибилизации, т. е. быстро лизируют чужеродные клетки-мишени без предварительного контакта с АГ Ø Клетки-мишени для ЕК - практически все ядросодержащие клетки, наиболее активны ЕК в отношении: - опухолевых клеток (1 ЕК может уничтожить до 40 клеток) - вирус-инфицированных клеток

Механизмы цитотоксичности ЕК 1. Прямая цитотоксичность: - ЕК распознают лектины на мембранах чужеродных клеток-мишеней - ЕК выделяют гранулы, содержащие перфорин (белок, проделывает поры в мембране) - ЕК выделяют гранзимы (протеиназы, запускают апоптоз в клетках) 2. АЗКЦ (антитело-зависимая клеточная цитотоксичность): - ЕК имеет рецептор к Fc-фрагменту Ig. G - ч/з Fc-рецептор ЕК связывается с чужеродной клеткой, опсонизированной Ig. G - лизис чужеродной клетки

Распознавание в системе врождённого иммунитета (СВИ) 1. Возможности для распознавания ограничены: - геномом (МИО гетерогенны и вариабельны) - высокой скоростью ответа 2. Объекты для распознавания должны быть: - универсальны - высоко консервативны - отсутствовать на собственных тканях 3. Необходимо исключить повреждение собственных клеток и молекул: - отсутствие мишени для распознавания - присутствие нейтрализующих факторов - одновременное распознавание своего и запрещение атаки

Для распознавания АГ фагоциты имеют специфические рецепторы к молекулам патогенов Ø Toll- подобные рецепторы (TLR, ТР, нем. toll - замечательный) участвуют в процессах связывания определённых структур МИО и цитокинов Ø Известно 11 типов ТР Ø В распознавании структур ТР помогает молекула CD 14
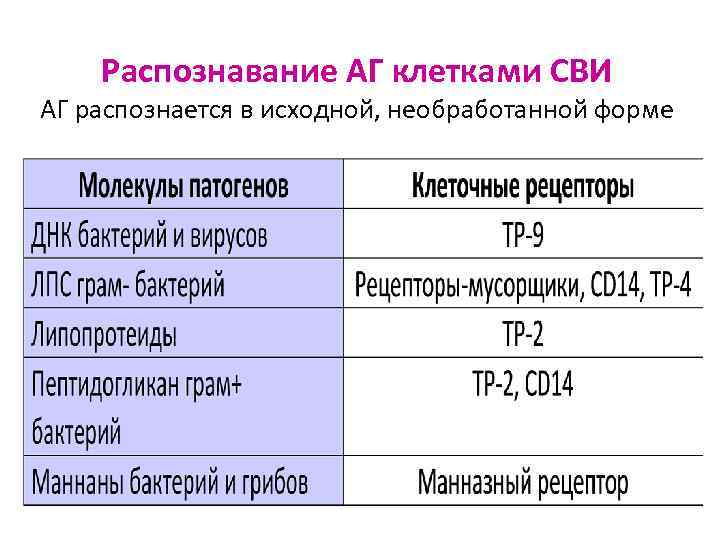
Распознавание АГ клетками СВИ АГ распознается в исходной, необработанной форме
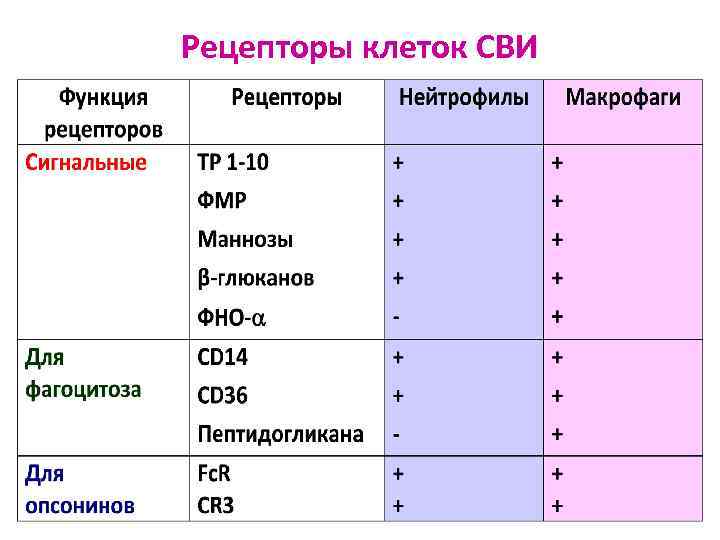
Рецепторы клеток СВИ

Рецепторы клеток СВИ Ø Рецепторы для распознавания МИО: - результат эволюции - закреплены наследственно Ø Широко специфичны Ø Экспрессированы на эпителиоцитах и всех клетках СВИ Ø Относятся к различным семействам биомолекул Ø При активации эти рецепторы немедленно вызывают эффекторный ответ: - киллинг, лизис, фагоцитоз - организацию воспаления - организацию специфического ИО
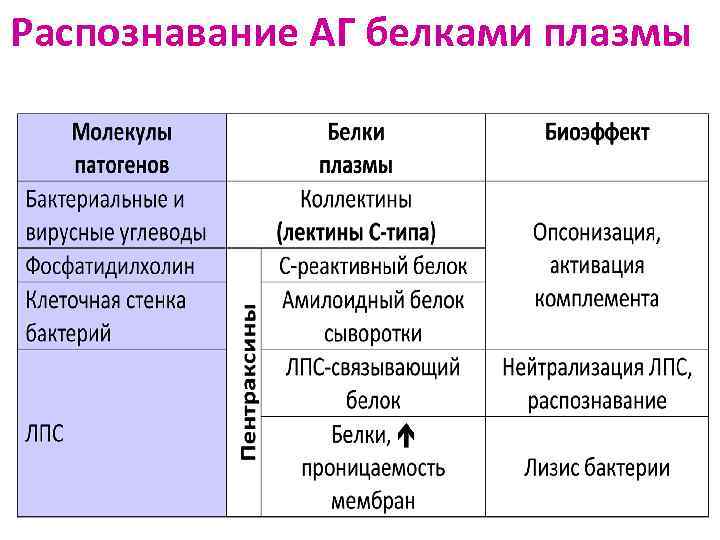
Распознавание АГ белками плазмы

СПАСИБО ЗА ВНИМАНИЕ!
2013_Врождённый иммунитет.ppt