Врожден.имм_2012.ppt
- Количество слайдов: 48

ВРОЖДЕННЫЙ ИММУНИТЕТ

«Иммунитет - это способ защиты организма от тел и веществ, несущих признаки генетически чужеродной информации. » классическое определение Петрова Р. В. – первого директора Института Иммунологии, академика РАН, РАМН, РАСХН. Иммунитет – комплекс биологических механизмов и реакций, направленных на поддержание целостности организма

Абсолютный врожденный иммунитет проявляется как полная невосприимчивость к чужеродному агенту. Например, домашние животные не восприимчивы к заболеваниям человека (гриппу, дифтерии и т. д. ), т. е. они ни при каких условиях не могут заразиться. Однако, есть случаи, когда птицы в результате ослабления организма могут болеть сибирской язвой. Это относительный видовой иммунитет. Приобретенный иммунитет – иммунитет, возникновение которого связано с перенесенным инфекционным заболеванием, иммунизацией или передачей антител от матери. Естественный активный иммунитет – иммунитет после перенесенной болезни. Естественный пассивный иммунитет – иммунитет, полученный от матери.
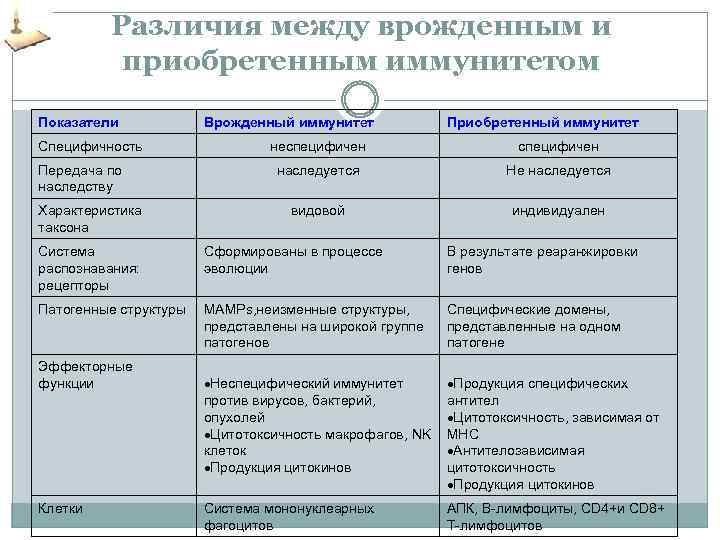
Различия между врожденным и приобретенным иммунитетом Показатели Специфичность Передача по наследству Характеристика таксона Врожденный иммунитет Приобретенный иммунитет неспецифичен наследуется Не наследуется видовой индивидуален Система распознавания: рецепторы Сформированы в процессе эволюции В результате реаранжировки генов Патогенные структуры МAMPs, неизменные структуры, представлены на широкой группе патогенов Специфические домены, представленные на одном патогене Неспецифический иммунитет против вирусов, бактерий, опухолей Цитотоксичность макрофагов, NK клеток Продукция цитокинов Продукция специфических антител Цитотоксичность, зависимая от МНС Антителозависимая цитотоксичность Продукция цитокинов Система мононуклеарных фагоцитов АПК, В-лимфоциты, CD 4+и СD 8+ Т-лимфоцитов Эффекторные функции Клетки

Факторы врожденного иммунитета Условно факторы неспецифической защиты можно разбить на четыре типа: -Естественные барьеры: кожа и слизистые оболочки; индигенная микрофлора; -Физиологические факторы организма, такие как повышение температуры тела, роль выделительной системы в элиминации возбудителей и их токсинов, гуморальные факторы сыворотки и других биологических жидкостей -Клеточные факторы защиты – фагоцитирующие клетки, включая нейтрофила и моноциты/макрофаги, и нормальные киллеры (NK клетки); Воспалительная реакция на инфекционный агент (осуществляется совместно гуморальными и клеточными факторами);

Естественные барьеры Кожа человека выполняет в первую очередь механическую, барьерную функцию. Кожа подавляет колонизацию и размножение бактерий, благодаря сниженныму р. Н за счет присутствия в потовых выделениях молочной и жирных кислот. Слизистые, выстилающие желудочно кишечный тракт, дыхательные пути, урогенитальный тракт, также выполняют барьерную функцию. Инфекционный процесс развивается лишь тогда, когда патоген способен колонизировать эпителий или когда нарушается целостность эпителиальных покровов в результате механических повреждений (раны, ожоги) или укусов насекомых. Механическим препятствием к колонизации являются также секреты слезных и слюнных желез. Нормальная микрофлора отвечает за колонизационную резистентность (конкурирует за сайты адгезии; формирует вокруг себя среду, негативно действующую на чужие микробы; поддерживает и регулирует иммунные реакции в слизистой оболочке)

Физиологические факторы Кислый р. Н желудочного сока Кашлевой рефлекс Повышение температуры тела (оптимальная температура для фагоцитоза 38 40°C) Гуморальные факторы сыворотки и других биологических жидкостей: Лизоцим , бета лизины Белки острой фазы Система комплемента Нормальные антитела Дефенсины Молочная и жирные кислоты Цитокины Лактоферрин и трансферрин

Гуморальные факторы Лизоцим – это фермент мурамидаза, расщепляющий бета 1, 4 гликозидные связи между аминосахарами пептидогликана (муреина), – в результате разрушения клеточной стенки бактерии погибают; – активен в отношении грамположительных бактерий; – содержится в слизи всех слизистых оболочек (конъюнктивы глаза, ротовой полости, полости носа, носоглотки, влагалища), в грудном молоке, сыворотке крови, тканевых жидкостях (кроме ликвора, мочи, пота); Бета-лизины –термостабильная фракция сыворотки; – сывороточные белки, обладающие бактерицидной активностью к аэробным спорообразующим бактериям, особенно В. subtilis и В. anthracis.

Система комплемента Комплемент – сложный белковый комплекс сыворотки крови. Система комплемента состоит из более чем 30 белков глобулиновой природы(компонентов, или фракций) протеаз. Фракции системы комплемента обозначаются по разному. 1. Девять – открытых первыми – белков системы комплемента обозначаются буквой С (от английского слова complement) с соответствующей цифрой. 2. Остальные фракции системы комплемента: фактор В, фактор D, пропердин и ряд регуляторных белков Белки комплемента синтезируются в основном в печени и составляют приблизительно 5 % от всей глобулиновой фракции плазмы крови.

Система комплемента В сыворотке находится в неактивном состоянии полностью инактивируется при 56°C) Активируется система комплемента за счет каскадного процесса: продукт предыдущей реакции исполняет роль катализатора последующей реакции. При активации у первых пяти компонентов происходит расщепление: Большинство этих ранних компонентов — проферменты, последовательно активируемые путем протеолиза. Когда какой либо из этих проферментов специфическим образом расщепляется, он становится активным протеолитическим ферментом и расщепляет следующий профермент, и т. д. Продукты этого расщепления и обозначаются как активные фракции системы комплемента. 1. Больший из фрагментов (обозначаемый буквой b), образовавшихся при расщеплении неактивной фракции, остается на поверхности клетки – активация комплемента всегда происходит на поверхности микробной клетки, но не собственных эукариотических клеток. Этот фрагмент приобретает свойства фермента и способность воздействовать на последующий компонент, активируя его. 2. Меньший фрагмент (обозначается буквой a) является растворимым и «уходит» в жидкую фазу, т. е. в сыворотку крови.
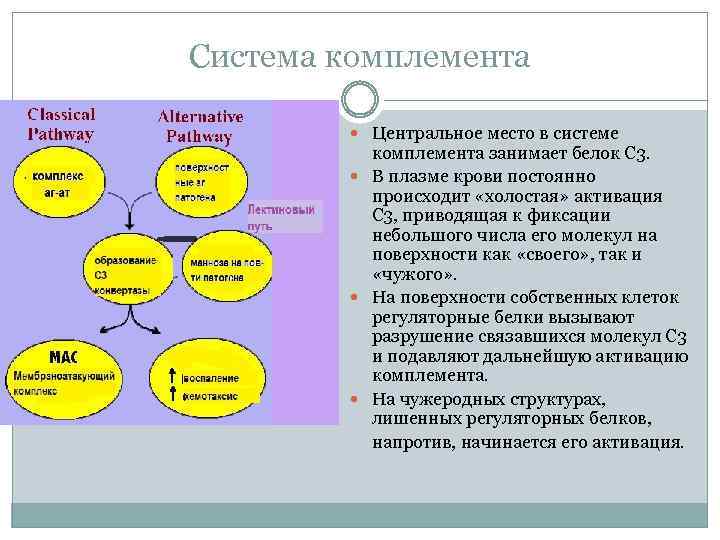
Система комплемента Центральное место в системе комплемента занимает белок С 3. В плазме крови постоянно происходит «холостая» активация С 3, приводящая к фиксации небольшого числа его молекул на поверхности как «своего» , так и «чужого» . На поверхности собственных клеток регуляторные белки вызывают разрушение связавшихся молекул С 3 и подавляют дальнейшую активацию комплемента. На чужеродных структурах, лишенных регуляторных белков, напротив, начинается его активация.
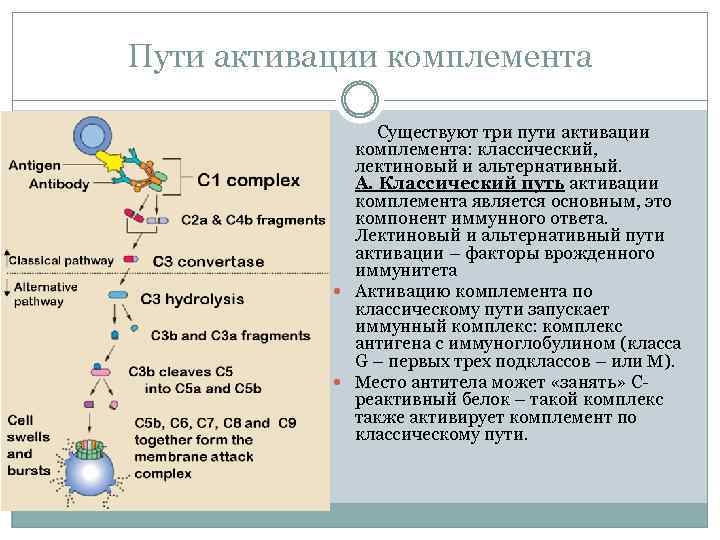
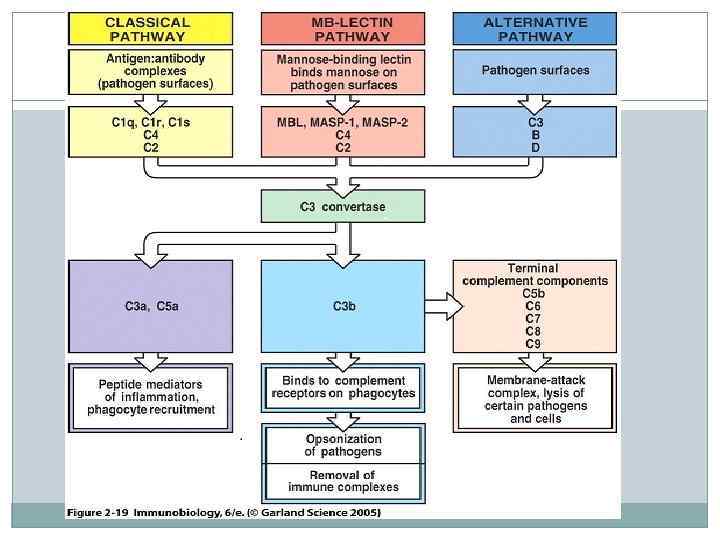
Пути активации комплемента Существуют три пути активации комплемента: классический, лектиновый и альтернативный. А. Классический путь активации комплемента является основным, это компонент иммунного ответа. Лектиновый и альтернативный пути активации – факторы врожденного иммунитета Активацию комплемента по классическому пути запускает иммунный комплекс: комплекс антигена с иммуноглобулином (класса G – первых трех подклассов – или М). Место антитела может «занять» С реактивный белок – такой комплекс также активирует комплемент по классическому пути.

Пути активации комплемента (альтернативный путь) Б. Альтернативный путь активации комплемента • запускается гидролизом C 3 прямо на поверхности патогена. • в альтернативном пути участвуют факторы В и D. С их помощью происходит образование фермента СЗb. Вb. • Стабилизирует его и обеспечивает его длительное функционирование белок P (пропердин). • Далее РС 3 b. Вb активирует С 3, в результате образуется С 5 конвертаза и запускается образование мембраноатакующего комплекса. • Дальнейшая активация терминальных компонентов комплемента происходит так же, как и по классическому пути активации комплемента.

Пути активации комплемента (альтернативный путь) • С филогенетической точки зрения этот путь является более древним • Для активации системы комплемента не требуется образования иммунных комплексов, поэтому не уходит время на продукцию иммуноглобулинов; • Альтернативный путь не требует участия первых компонентов комплемента — С 1, С 4 и С 2; • Альтернативный путь срабатывает сразу же после внедрения антигенов и активаторами его могут выступать бактериальные полисахариды, липополисахариды, вирусные частицы на поверхности клеточных мембран, опухолевые клетки, паразиты, зимозан (компонент клеточных стенок некоторых грибов), агрегированные Ig. A, Ig. G, Ig. E и Ig. M, а также фактор яда кобры.

Пути активации комплемента (лектиновый путь) Маннан (маннан — полимер маннозы) связанный лектиновый путь гомологичен классическому пути активации системы комплемента. Этот путь использует маннан связывающий лектин (MBL) белок, подобный C 1 q классического пути активации, который связывается с маннозными остатками и другими сахарами на мембране, что позволяет распознавать разнообразные болезнетворные микроорганизмы. MBL — белок, принадлежащий к коллектиновой группе белков, которая производится печенью и может активировать каскад комплемента, связываясь с поверхностью патогена. Лектиновый путь активации комплемента запускается комплексом нормального белка сыворотки крови – маннансвязывающего лектина (МСЛ) – с углеводами поверхностных структур микробных клеток (с остатками маннозы). Активизирующаяся в результате этого процесса МСЛ ассоциированная сериновая протеаза действует аналогично С 1 эстеразе классического пути, по которому, собственно, и развиваются дальнейшие события, заканчивающиеся формированием МАК
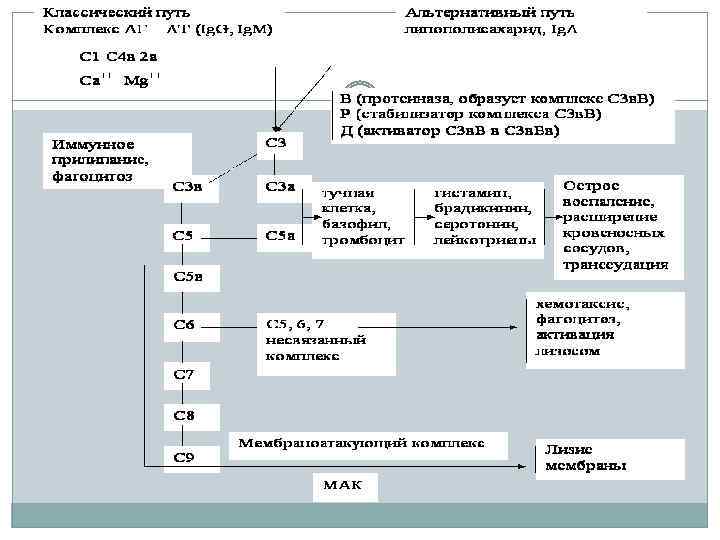

Биологические эффекты активации системы комплемента • Необратимое повреждение мембраны животных и бактериальных клеток (цитолиз, или комплементарный киллинг). В конечной стадии активации системы комплемента образуется мембраноатакующий комплекс (МАК) из поздних компонентов комплемента, который атакует мембрану бактериальной или любой другой клетки и разрушает ее. Активные фракции системы комплемента принимают участие в формировании воспалительной реакции: q Активация и хемотаксическое привлечение лейкоцитов в очаг воспаления q Индукция синтеза медиаторов анафилаксинов тучными клетками и участие в воспалении Участие в развитии адаптивного иммунитета
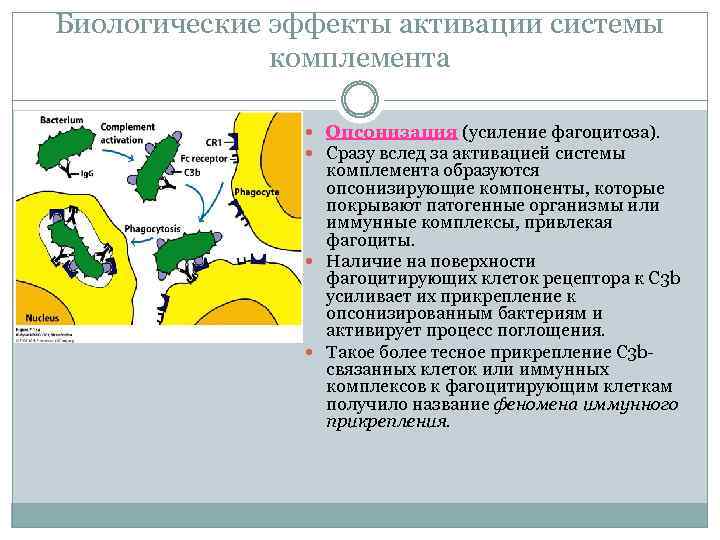
Биологические эффекты активации системы комплемента Опсонизация (усиление фагоцитоза). Сразу вслед за активацией системы комплемента образуются опсонизирующие компоненты, которые покрывают патогенные организмы или иммунные комплексы, привлекая фагоциты. Наличие на поверхности фагоцитирующих клеток рецептора к С 3 b усиливает их прикрепление к опсонизированным бактериям и активирует процесс поглощения. Такое более тесное прикрепление С 3 b связанных клеток или иммунных комплексов к фагоцитирующим клеткам получило название феномена иммунного прикрепления.
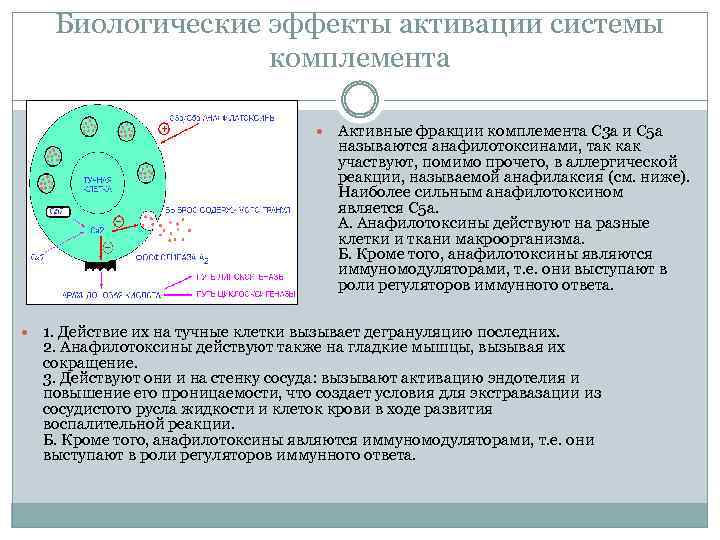
Биологические эффекты активации системы комплемента Активные фракции комплемента С 3 а и С 5 а называются анафилотоксинами, так как участвуют, помимо прочего, в аллергической реакции, называемой анафилаксия (см. ниже). Наиболее сильным анафилотоксином является С 5 а. А. Анафилотоксины действуют на разные клетки и ткани макроорганизма. Б. Кроме того, анафилотоксины являются иммуномодуляторами, т. е. они выступают в роли регуляторов иммунного ответа. 1. Действие их на тучные клетки вызывает дегрануляцию последних. 2. Анафилотоксины действуют также на гладкие мышцы, вызывая их сокращение. 3. Действуют они и на стенку сосуда: вызывают активацию эндотелия и повышение его проницаемости, что создает условия для экстравазации из сосудистого русла жидкости и клеток крови в ходе развития воспалительной реакции. Б. Кроме того, анафилотоксины являются иммуномодуляторами, т. е. они выступают в роли регуляторов иммунного ответа.
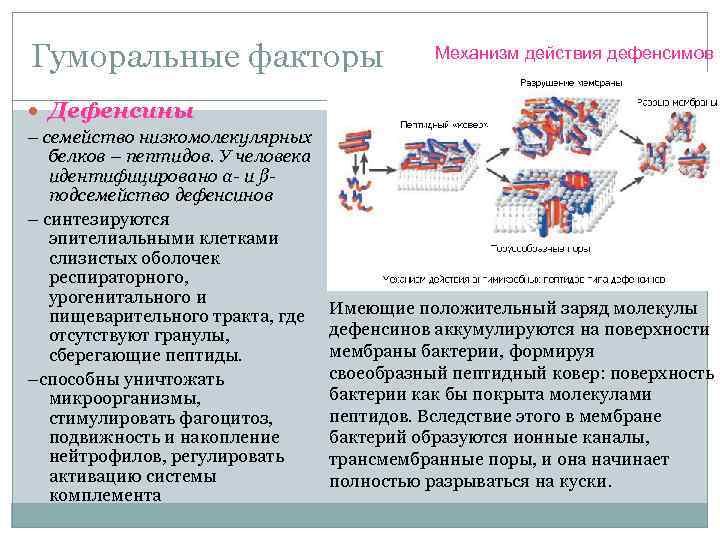
Гуморальные факторы Механизм действия дефенсимов Дефенсины – семейство низкомолекулярных белков – пептидов. У человека идентифицировано α- и ßподсемейство дефенсинов – синтезируются эпителиальными клетками слизистых оболочек респираторного, урогенитального и пищеварительного тракта, где отсутствуют гранулы, сберегающие пептиды. –способны уничтожать микроорганизмы, стимулировать фагоцитоз, подвижность и накопление нейтрофилов, регулировать активацию системы комплемента Имеющие положительный заряд молекулы дефенсинов аккумулируются на поверхности мембраны бактерии, формируя своеобразный пептидный ковер: поверхность бактерии как бы покрыта молекулами пептидов. Вследствие этого в мембране бактерий образуются ионные каналы, трансмембранные поры, и она начинает полностью разрываться на куски.

Механизм распознавания «чужого» Чтобы защититься от вторжения инфекции, кожа или слизистые должны распознавать присутствие микроорганизмов. Существуют рецепторы врожденной иммунной системы, называемые паттерн распознающи рецепторы — PRR (TLR, е NOD, CLR, RLR) Эти рецепторы распознают структуры, обнаруживаемые на микробных патогенах, которые называются MAMP (молекулярные паттерны, ассоциированные с микроорганизмами): ЛПС, липопротеины, пептидогликан, липотейхоевые кислоты, флагелин и др. МAMPs синтезируются только микроорганизмами и не образуются в клетках макроорганизма. МAMPs характерны не только для патогенов, но и для представителей нормальной микрофлоры. Тем не менее, как правило, распознавание патоген ассоциированной структуры каким либо из паттерн распознающих рецепторов является сигналом о том, что в организме хозяина присутствует инфекция.

Механизм распознавания «чужого» Паттерн-распознающие рецепторы – PRRs: белковые молекулы в зависимости от функций разделяются на несколько групп. Toll подобных рецепторах (Toll like receptors TLRs) семейство v v v сигнальных белков, локализующихся на различных клетках, в том числе и на иммунокомпетентных клетках. TLRs способны распознавать патоген ассоциированные структуры и функционируют как рецепторы врожденной иммунной системы Toll подобные рецепторы, связываясь с МAMPs: идентифицируют "образ" как чужеродный для организма хозяина и запускают каскад реакций, обеспечивающих передачу сигнала к ядру иммунокомпетентной клетки, следствием чего является активация синтеза определенных противомикробных пептидов.
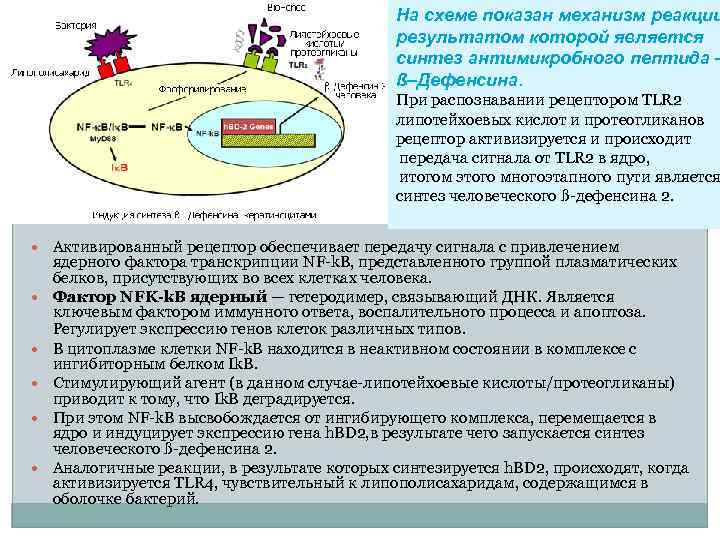
На схеме показан механизм реакции результатом которой является синтез антимикробного пептида – ß–Дефенсина. При распознавании рецептором TLR 2 липотейхоевых кислот и протеогликанов рецептор активизируется и происходит передача сигнала от TLR 2 в ядро, итогом этого многоэтапного пути является синтез человеческого ß дефенсина 2. Активированный рецептор обеспечивает передачу сигнала с привлечением ядерного фактора транскрипции NF k. B, представленного группой плазматических белков, присутствующих во всех клетках человека. Фактор NFK-k. B ядерный — гетеродимер, связывающий ДНК. Является ключевым фактором иммунного ответа, воспалительного процесса и апоптоза. Регулирует экспрессию генов клеток различных типов. В цитоплазме клетки NF k. B находится в неактивном состоянии в комплексе с ингибиторным белком Ik. B. Стимулирующий агент (в данном случае липотейхоевые кислоты/протеогликаны) приводит к тому, что Ik. B деградируется. При этом NF k. B высвобождается от ингибирующего комплекса, перемещается в ядро и индуцирует экспрессию гена h. BD 2, в результате чего запускается синтез человеческого ß дефенсина 2. Аналогичные реакции, в результате которых синтезируется h. BD 2, происходят, когда активизируется TLR 4, чувствительный к липополисахаридам, содержащимся в оболочке бактерий.

Гуморальные факторы Цитокины это небольшие белки, действующие аутокринно(т. е. на клетку, которая их продуцирует) или паракринно (на клетки, расположенные вблизи); – образование и высвобождение этих высокоактивных молекул происходит кратковременно и жестко регулируется; – синтезируются и секретируются клетками иммунной системы и другими типами клеток; – управляют развитием и гомеостазом иммунной системы, осуществляют контроль за ростом и дифференцировкой клеток крови (системой гемопоэза) и некоторых других и принимают участие в неспецифических защитных реакциях организма – принимают участие в регуляции роста, дифференцировки и продолжительности жизни клеток, а также в управлении апоптозом – включают интерлейкины [ИЛ (IL)], лимфокины, монокины, хемокины, интерфероны [Иф (IFN)], колонийстимулирующие факторы [КСФ (CSF)]. –
Цитокины(продолжение) ИЛ 1 и ФНО альфа. Эти цитокины способствуют активации фагоцитов, их миграции в место воспаления, а также высвобождению медиаторов воспаления Хемокины (хемотаксические цитокины) важный класс провоспалительных цитокинов, необходимых для активации нейтрофилов и моноцитов и привлечения этих клеток в очаг воспаления; инициируют локальное воспаление в результате вовлечения инфламаторных (воспалительных) клеток в процесс хемотаксиса, а далее в процесс активации их функции.
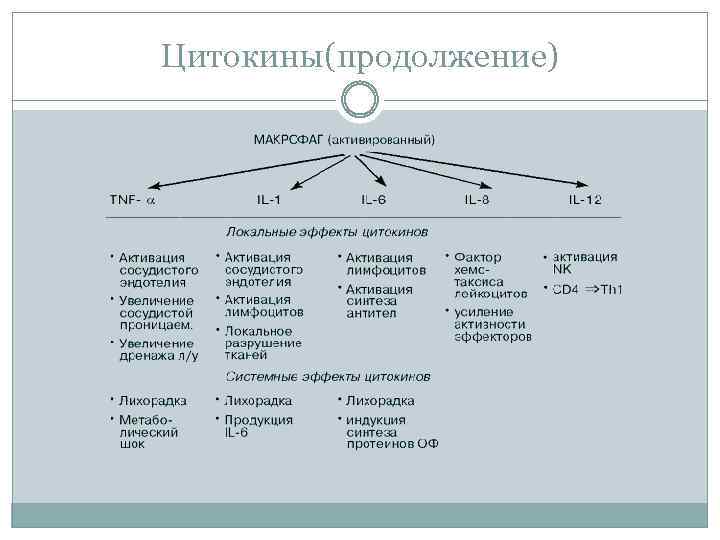
Цитокины(продолжение)

Цитокины: интерфероны Интерфероны – полипептиды, вырабатывающиеся и аккумулирующиеся во всех ядросодержащих клетках крови и эпителиальных клетках слизистых оболочек являются цитокинами с широким спектром биологических активностей: противовирусное действие, ингибирование гемопоэза; модуляция иммунного и воспалительного ответов, регуляция пролиферации и дифференцировки клеток и т. д. При вирусной инфекции клетки синтезируют интерферон и секретируют его в межклеточное пространство, где он связывается со специфическими рецепторами соседних незараженных клеток. – Связанный интерферон оказывает противовирусное действие. – Конечный результат состоит из образования барьера из устойчивых к вирусу неинфицированных клеток вокруг очага инфекции, чтобы ограничить ее распространение.
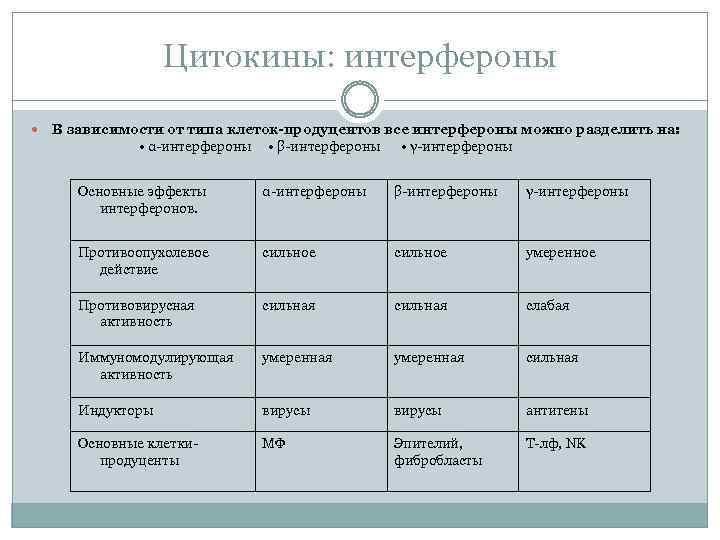
Цитокины: интерфероны В зависимости от типа клеток-продуцентов все интерфероны можно разделить на: • α интерфероны • β интерфероны • γ интерфероны Основные эффекты интерферонов. α интерфероны β интерфероны γ интерфероны Противоопухолевое действие сильное умеренное Противовирусная активность сильная слабая Иммуномодулирующая активность умеренная сильная Индукторы вирусы антигены Основные клетки продуценты МФ Эпителий, фибробласты Т лф, NK

Белки острой фазы В ответ на инфекцию или повреждение тканей резко увеличивается концентрация некоторых белков плазмы крови, имеющих общее название "белки острой фазы". q q q q К острофазным белкам относятся: С реактивный белок (СРБ) Сывороточный амилоидный А белок Фибриноген С 3 и С 4 компоненты комплемента Эндотоксин (ЛПС) связывающий белок Маннозосвязывающий белок Фактор В сыворотки крови Протромбин и другие Общей характеристикой белков данной группы является их выраженная опсонизирующая, антипротеолитическая и бактериостатическая активность, а также способность к связыванию свободных радикалов, усилению коагуляции крови и активации системы комплемента. ОФБ продуцируются, главным образом, активированными гепатоцитами (ИЛ 6), а также моноцитами/макрофагами, фибробластами и другими типами клеток

Белки острой фазы С-реактивный белок (СРБ). Является важным фактором регуляции воспалительных процессов и антимикробной защиты организма. СРБ способен связываться с большим числом микроорганизмов и макромолекул. Связывание СРБ с бактериями приводит к разбуханию их капсулы и агглютинации микробов, к фиксации и активации комплемента. Связывание СРБ с детритом клеток активирует фагоцитоз. Введение СРБ животным увеличивает их выживаемость при экспериментальном микробном заражении и повышает их противоопухолевую резистентность. Взаимодействие СРБ с иммунокомпетентными клетками способно приводить к изменению их метаболизма и функциональной активности.
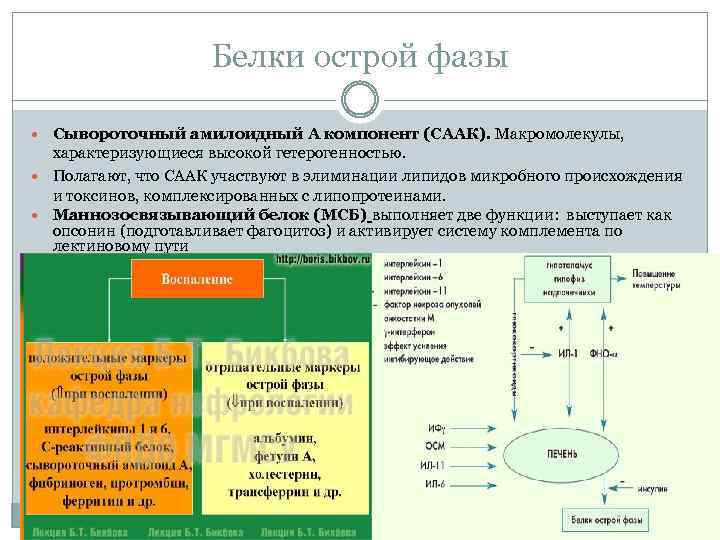
Белки острой фазы Сывороточный амилоидный А компонент (СААК). Макромолекулы, характеризующиеся высокой гетерогенностью. Полагают, что СААК участвуют в элиминации липидов микробного происхождения и токсинов, комплексированных с липопротеинами. Маннозосвязывающий белок (МСБ) выполняет две функции: выступает как опсонин (подготавливает фагоцитоз) и активирует систему комплемента по лектиновому пути

Нормальные антитела Антитела, появление которых не связано с иммунизацией или инфекцией называют v v нормальными. То есть, сыворотка крови может содержать иммуноглобулины даже по отношению к антигенам, о которых заведомо известно, что они никогда не поступали в данный организм. Происхождение: нормальные антитела появляются в результате так называемой неприметной иммунизации возбудителями или антигенами, поступающими с пищей, результат неспецифической активации антиген реактивных клеток цитокинами или другими стимуляторами, формируемыми в ходе иммунного ответа надругие антигены. результат генетически обусловленного механизма (клонально селекционная теория Бернета) Результат стимуляции иммунной системой микроорганизмами из состава нормальной микрофлоры • обычно определяются в низких титрах, однако их иммунологическая роль довольно выражена, особенно по отношению к инфекционным агентам. • Нормальные антитела способствуют индукции первичного иммунного ответа, участвуя в представлении антигена антигенреактивным клеткам, и усиливают фагоцитоз, направляя действие фагоцитов на микробные и другие клетки, к которым присоединились антитела (опсонизация).

Клеточные факторы К клеточным факторам относятся: фагоцитирующие клетки натуральные (естественные) клетки киллеры (NK клетки) вспомогательные клетки (тучные клетки, базофилы, эозинофилы, тромбоциты)
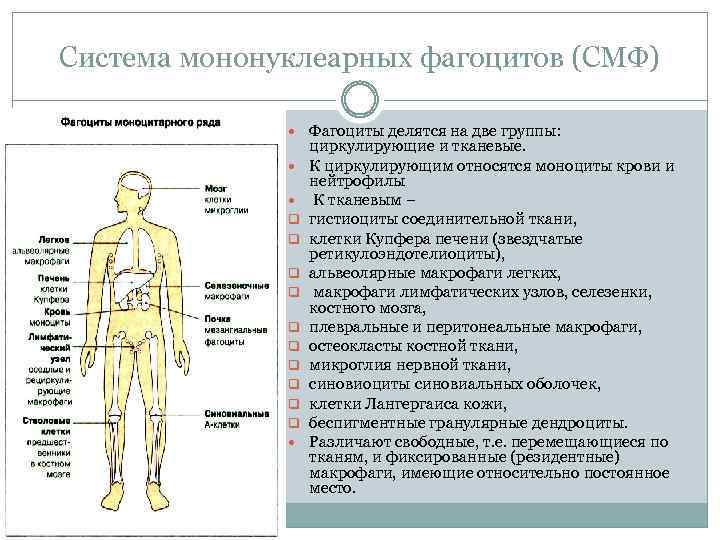
Система мононуклеарных фагоцитов (СМФ) Фагоциты делятся на две группы: q q q q q циркулирующие и тканевые. К циркулирующим относятся моноциты крови и нейтрофилы К тканевым – гистиоциты соединительной ткани, клетки Купфера печени (звездчатые ретикулоэндотелиоциты), альвеолярные макрофаги легких, макрофаги лимфатических узлов, селезенки, костного мозга, плевральные и перитонеальные макрофаги, остеокласты костной ткани, микроглия нервной ткани, синовиоциты синовиальных оболочек, клетки Лангергаиса кожи, беспигментные гранулярные дендроциты. Различают свободные, т. е. перемещающиеся по тканям, и фиксированные (резидентные) макрофаги, имеющие относительно постоянное место.
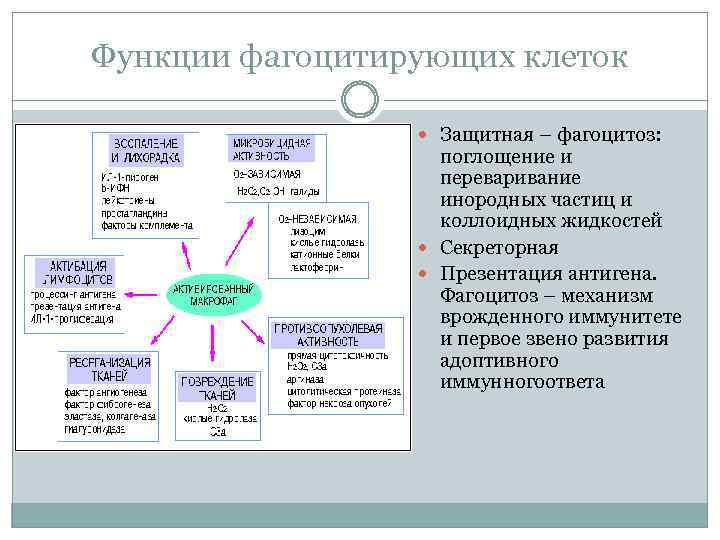
Функции фагоцитирующих клеток Защитная – фагоцитоз: поглощение и переваривание инородных частиц и коллоидных жидкостей Секреторная Презентация антигена. Фагоцитоз – механизм врожденного иммунитете и первое звено развития адоптивного иммунногоответа
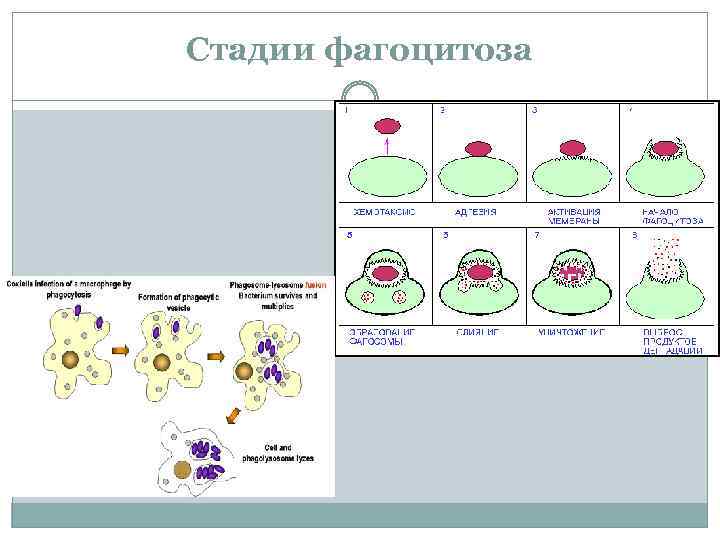
Стадии фагоцитоза
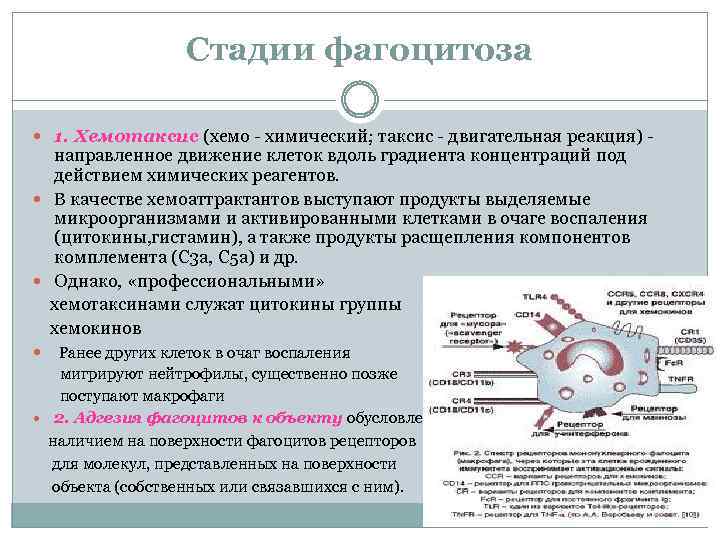
Стадии фагоцитоза 1. Хемотаксис (хемо химический; таксис двигательная реакция) направленное движение клеток вдоль градиента концентраций под действием химических реагентов. В качестве хемоаттрактантов выступают продукты выделяемые микроорганизмами и активированными клетками в очаге воспаления (цитокины, гистамин), а также продукты расщепления компонентов комплемента (С 3 а, С 5 а) и др. Однако, «профессиональными» хемотаксинами служат цитокины группы хемокинов Ранее других клеток в очаг воспаления мигрируют нейтрофилы, существенно позже поступают макрофаги 2. Адгезия фагоцитов к объекту обусловлена наличием на поверхности фагоцитов рецепторов для молекул, представленных на поверхности объекта (собственных или связавшихся с ним).

Стадии фагоцитоза 3. Эндоцитоз (поглощение) состоит из этапов: q Активация мембраны. На этой стадии осуществляется подготовка объекта q q q к погружению. Происходит активация протеинкиназы С, выход ионов кальция из внутриклеточных депо. Большое значение играют переходы золь гель в системе клеточных коллоидов и актино миозиновые перестройки. Погружение. Происходит обволакивание объекта. Образование фагосомы. Замыкание мембраны, погружение объекта с частью мембраны фагоцита внутрь клетки. 4. Внутриклеточное переваривание. Образование фаголизосомы. Слияние фагосомы с лизосомами, в результате чего образуются оптимальные условия для бактериолиза и расщепления убитой клетки. Киллинг и расщепление. Велика роль клеточной стенки перевариваемой клетки. Основные вещества участвующие в бактериолизе: перекись водорода, продукты азотного метаболизма, лизоцим и др. Процесс разрушения бактериальных клеток завершается благодаря активности протеаз, нуклеаз, липаз и других ферментов, активность которых оптимальна при низких значениях p. H. Выброс продуктов деградации.

Механизмы уничтожения чужеродных агентов Внутриклеточный кислородзависимый Поглощение фагоцитом чужеродного материала сопровождается увеличением потребления кислорода – респираторный взрыв, сопровождающийся образованием активных форм кислорода. Соединения кислорода токсичны как для патогена, так и для самой клетки, поэтому они хранятся в ячейках внутри самой клетки. Кислород зависимое внутриклеточное уничтожение, который делится на 2 типа: Первый тип —образование супероксиданионного радикала, обладающего бактерицидным эффектом. Супероксид под действием фермента супероксиддисмутазы превращается в синглетный кислород и пероксид водорода, который далее образует гидроксил радикал. Второй тип связан с активностью фермента миелопероксидазы из нейтрофильных гранул. Этот фермент использует пероксид водорода и хлор для образования гипохлорита, также токсичного для бактерий. Внутриклеточный кислород-независимый Различают 4 основных типа: При первом типе используются электрически заряженные белки, которые повреждают мембрану бактерий. При втором типе используются лизозимы ферменты, разрушающие клеточную стенку бактерий. При третьем типе используются лактоферины гранул нейтрофилов, удаляющие необходимое для бактерий железо. При четвёртом типе используются кислые гидролазы лизосом для переваривания белков разрушенных бактерий
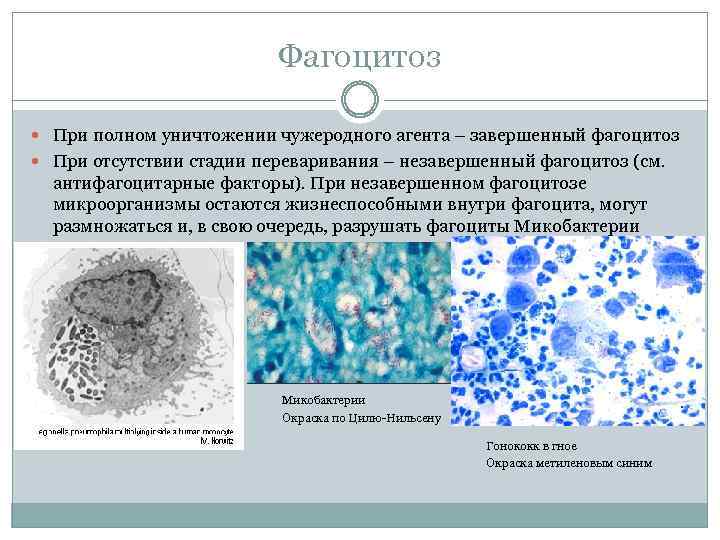
Фагоцитоз При полном уничтожении чужеродного агента – завершенный фагоцитоз При отсутствии стадии переваривания – незавершенный фагоцитоз (см. антифагоцитарные факторы). При незавершенном фагоцитозе микроорганизмы остаются жизнеспособными внутри фагоцита, могут размножаться и, в свою очередь, разрушать фагоциты Микобактерии Окраска по Цилю Нильсену Гонококк в гное Окраска метиленовым синим

Нормальные киллеры (NK-клетки) Нормальные киллеры или NK (от англ. natural killer) это большие зернистые лимфоциты У человека составляют примерно 5% лимфоцитов периферической крови. Лишены маркеров Т и В лимфоцитов. NK узнают определенные структуры высокомолекулярных гликопротеинов, которые экспрессируются на мембране инфицированных вирусом клеток. Узнавание клетки мишени и сближение с ней происходит за счет рецепторов NK. В результате NK активируются, и содержимое гранул выбрасывается во внеклеточное пространство. Главная роль здесь принадлежит перфорину (цитолизину), имеющему некоторое структурное сходство с компонентом комплемента C 9 (антитела к перфорину подавляют внеклеточное уничтожение). Перфорин встраивается в мембрану клетки мишени и образует трансмембранные поры, что приводит к гибели клетки Кроме того, гранулы NK содержат две сериновые протеинкиназы, которые могут функционировать как цитотоксические факторы, но не вполне ясна их роль в NK зависимом лизисе
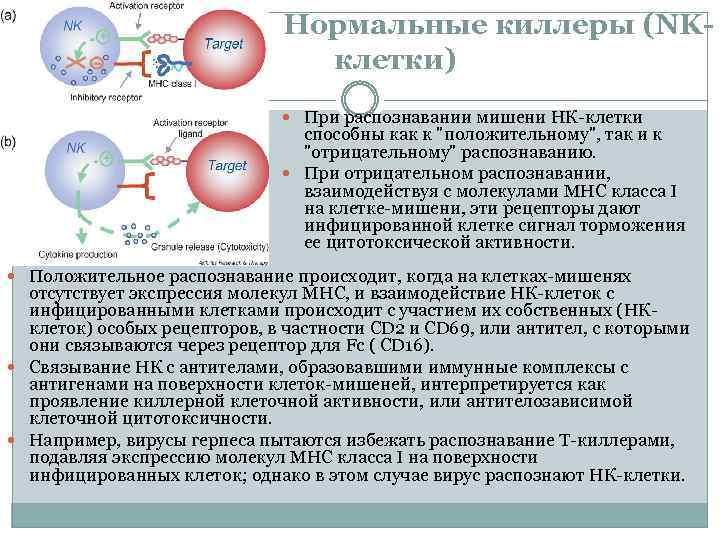
Нормальные киллеры (NKклетки) При распознавании мишени НК клетки способны как к "положительному", так и к "отрицательному" распознаванию. При отрицательном распознавании, взаимодействуя с молекулами MHC класса I на клетке мишени, эти рецепторы дают инфицированной клетке сигнал торможения ее цитотоксической активности. Положительное распознавание происходит, когда на клетках мишенях отсутствует экспрессия молекул MHC, и взаимодействие НК клеток с инфицированными клетками происходит с участием их собственных (НК клеток) особых рецепторов, в частности CD 2 и CD 69, или антител, с которыми они связываются через рецептор для Fc ( CD 16). Связывание НК с антителами, образовавшими иммунные комплексы с антигенами на поверхности клеток мишеней, интерпретируется как проявление киллерной клеточной активности, или антителозависимой клеточной цитотоксичности. Например, вирусы герпеса пытаются избежать распознавание T киллерами, подавляя экспрессию молекул MHC класса I на поверхности инфицированных клеток; однако в этом случае вирус распознают НК клетки.

Воспаление (inflammatio, от лат. Любое воспаление включает 3 основных компонента: • альтерацию повреждение клеток и тканей; • расстройство микроциркуляции с экссудацией и эмиграцией; • пролиферацию размножение клеток и восстановление целостности ткани. in-flammare воспламенять) сформировавшаяся в процессе эволюции реакция организма на местное повреждение, характеризующаяся явлениями альтерации, расстройств микроциркуляции (с экссудацией и эмиграцией) и пролиферации, направленными на локализацию, уничтожение и удаление повреждающего агента, а также на восстановление (или замещение) поврежденных им тканей
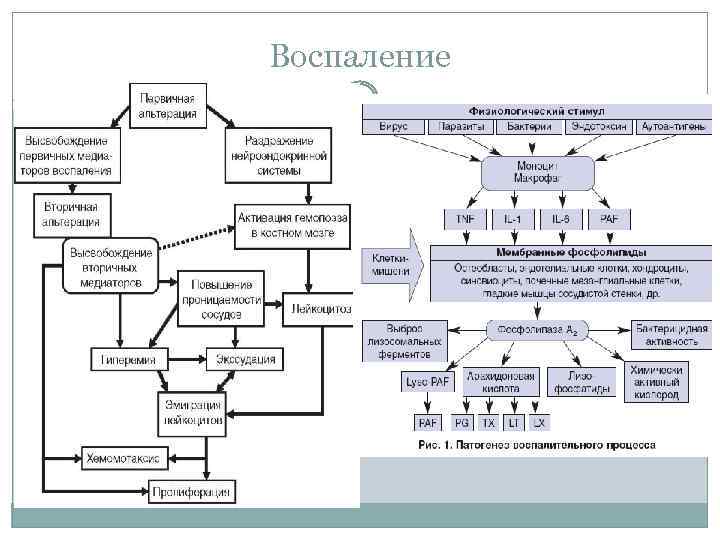
Воспаление
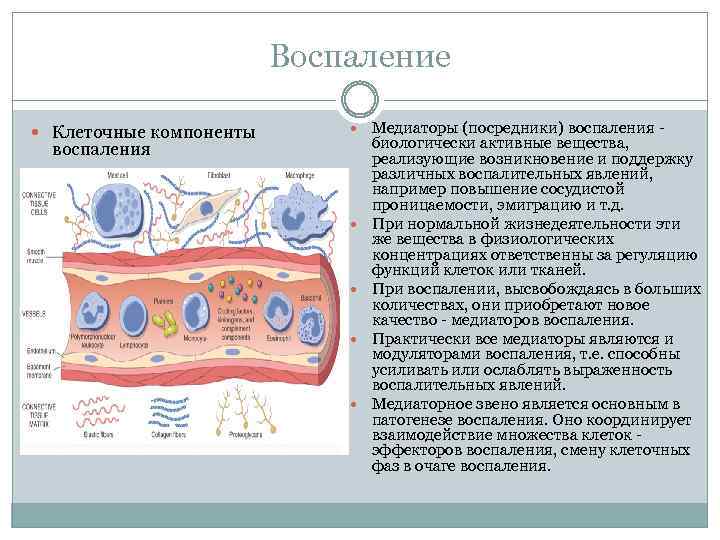
Воспаление Клеточные компоненты Медиаторы (посредники) воспаления биологически активные вещества, реализующие возникновение и поддержку различных воспалительных явлений, например повышение сосудистой проницаемости, эмиграцию и т. д. При нормальной жизнедеятельности эти же вещества в физиологических концентрациях ответственны за регуляцию функций клеток или тканей. При воспалении, высвобождаясь в больших количествах, они приобретают новое качество медиаторов воспаления. Практически все медиаторы являются и модуляторами воспаления, т. е. способны усиливать или ослаблять выраженность воспалительных явлений. Медиаторное звено является основным в патогенезе воспаления. Оно координирует взаимодействие множества клеток эффекторов воспаления, смену клеточных фаз в очаге воспаления.
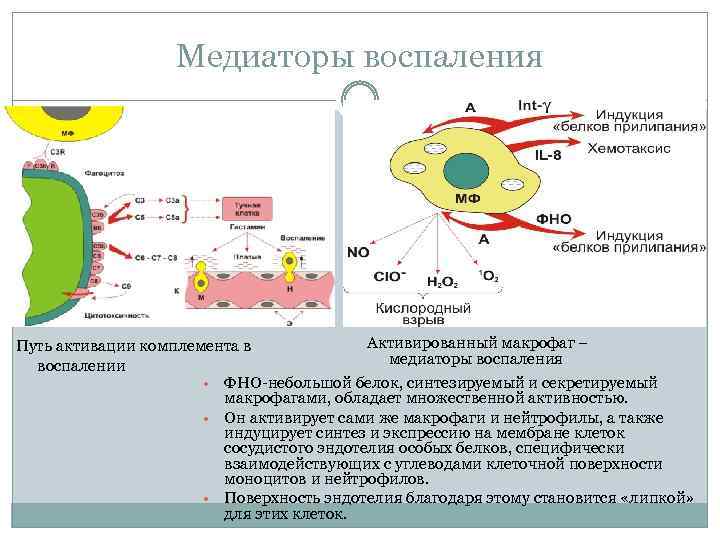
Медиаторы воспаления Активированный макрофаг – Путь активации комплемента в медиаторы воспаления воспалении • ФНО небольшой белок, синтезируемый и секретируемый макрофагами, обладает множественной активностью. • Он активирует сами же макрофаги и нейтрофилы, а также индуцирует синтез и экспрессию на мембране клеток сосудистого эндотелия особых белков, специфически взаимодействующих с углеводами клеточной поверхности моноцитов и нейтрофилов. • Поверхность эндотелия благодаря этому становится «липкой» для этих клеток.
Врожден.имм_2012.ppt