Обзорная лекция по ВПС.ppt
- Количество слайдов: 139
 ВПС: Этиология, эпидемиология. Факторы риска развития ВПС. Развитие сердца. Фетальное кровообращение. Номенклатура пороков сердца, классификация. Предоперационная диагностика. Обзор наиболее часто встречающихся ВПС. Центр детской кардиохирургии и хирургии новорожденных детей ФГУ ННИИПК имени академика Е. Н. Мешалкина МЗ РФ
ВПС: Этиология, эпидемиология. Факторы риска развития ВПС. Развитие сердца. Фетальное кровообращение. Номенклатура пороков сердца, классификация. Предоперационная диагностика. Обзор наиболее часто встречающихся ВПС. Центр детской кардиохирургии и хирургии новорожденных детей ФГУ ННИИПК имени академика Е. Н. Мешалкина МЗ РФ
 Врожденные аномалии сердечно-сосудистой системы, занимая одно из ведущих мест в структуре врожденной патологии, занимает третье место среди причин детской смертности после патологии ЦНС и опорнодвигательного аппарата. WHO 1999; Alan L. D. et al. 2000.
Врожденные аномалии сердечно-сосудистой системы, занимая одно из ведущих мест в структуре врожденной патологии, занимает третье место среди причин детской смертности после патологии ЦНС и опорнодвигательного аппарата. WHO 1999; Alan L. D. et al. 2000.
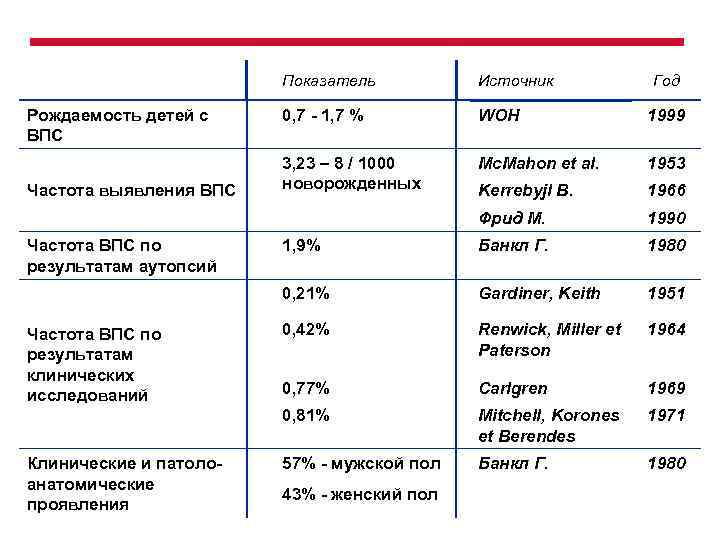 Показатель Частота ВПС по результатам клинических исследований Клинические и патолоанатомические проявления 1999 3, 23 – 8 / 1000 новорожденных Mc. Mаhon et al. 1953 Kerrebyjl B. 1966 1990 1, 9% Банкл Г. 1980 Gardiner, Keith 1951 0, 42% Renwick, Miller et Paterson 1964 0, 77% Carlgren 1969 0, 81% Частота ВПС по результатам аутопсий WOH 0, 21% Частота выявления ВПС 0, 7 - 1, 7 % Фрид М. Рождаемость детей с ВПС Источник Mitchell, Korones et Berendes 1971 57% - мужской пол Банкл Г. 1980 43% - женский пол Год
Показатель Частота ВПС по результатам клинических исследований Клинические и патолоанатомические проявления 1999 3, 23 – 8 / 1000 новорожденных Mc. Mаhon et al. 1953 Kerrebyjl B. 1966 1990 1, 9% Банкл Г. 1980 Gardiner, Keith 1951 0, 42% Renwick, Miller et Paterson 1964 0, 77% Carlgren 1969 0, 81% Частота ВПС по результатам аутопсий WOH 0, 21% Частота выявления ВПС 0, 7 - 1, 7 % Фрид М. Рождаемость детей с ВПС Источник Mitchell, Korones et Berendes 1971 57% - мужской пол Банкл Г. 1980 43% - женский пол Год
 По данным Мин. Здравоохранения России за 2003 год: ● Во всех возрастных группах в России впервые зарегистрировано 47289 случаев ВПС; ● Доля ВПС у детей до 14 лет – 76, 55%; ● Общее число ВПС, зафиксированных в ЛПУ страны – 290641 (на 5104 больше, чем в 2002 г. (+1, 8%)); ● На диспансерном учете состоит 134643 ребенка в возрасте до 14 лет (77, 6% зарегистрированных случаев, среди этого контингента).
По данным Мин. Здравоохранения России за 2003 год: ● Во всех возрастных группах в России впервые зарегистрировано 47289 случаев ВПС; ● Доля ВПС у детей до 14 лет – 76, 55%; ● Общее число ВПС, зафиксированных в ЛПУ страны – 290641 (на 5104 больше, чем в 2002 г. (+1, 8%)); ● На диспансерном учете состоит 134643 ребенка в возрасте до 14 лет (77, 6% зарегистрированных случаев, среди этого контингента).
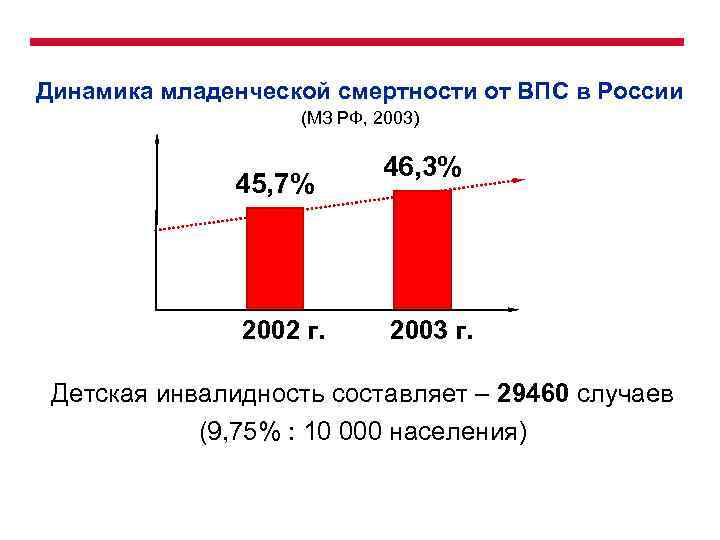 Динамика младенческой смертности от ВПС в России (МЗ РФ, 2003) 45, 7% 2002 г. 46, 3% 2003 г. Детская инвалидность составляет – 29460 случаев (9, 75% : 10 000 населения)
Динамика младенческой смертности от ВПС в России (МЗ РФ, 2003) 45, 7% 2002 г. 46, 3% 2003 г. Детская инвалидность составляет – 29460 случаев (9, 75% : 10 000 населения)
 Если говорить вообще о частоте развития ВПС, то она в ~ 5 раз выше у умерших пренатально, чем у живорожденных (Hoffman, 1995). По определению Дж. Брауна и Г. Диксона в природе существует «Акт милосердия» , когда имеющаяся патология является причиной самопроизвольных выкидышей (в 50%). Пики гибели и элиминации зародышей приходятся на 3 -4 -ю и 6 -8 -ю недели гестации (Boue J. , Boue А. , 1973).
Если говорить вообще о частоте развития ВПС, то она в ~ 5 раз выше у умерших пренатально, чем у живорожденных (Hoffman, 1995). По определению Дж. Брауна и Г. Диксона в природе существует «Акт милосердия» , когда имеющаяся патология является причиной самопроизвольных выкидышей (в 50%). Пики гибели и элиминации зародышей приходятся на 3 -4 -ю и 6 -8 -ю недели гестации (Boue J. , Boue А. , 1973).
 ВПС сочетаются с экстракардиальной патологией в 57% и в 53% ВПС связан с грубой патологией хромосом (Медведев М. В. , 2000). Наиболее часто им сопутствуют аномалии: желудочно-кишечного тракта, мочеполовой и костной систем (Menache V. et al. , 1967; Moller J. , Neal W. , 1981; Медведев М. В. , 2000). Наиболее высокая частота экстракардиальных пороков развития отмечается у больных с комбинированными септальными дефектами (74 %), ОАП (59 %), ДМЖП (58 %), наиболее низкая – при фиброэластозе и ТМС (Landtman B. , 1971).
ВПС сочетаются с экстракардиальной патологией в 57% и в 53% ВПС связан с грубой патологией хромосом (Медведев М. В. , 2000). Наиболее часто им сопутствуют аномалии: желудочно-кишечного тракта, мочеполовой и костной систем (Menache V. et al. , 1967; Moller J. , Neal W. , 1981; Медведев М. В. , 2000). Наиболее высокая частота экстракардиальных пороков развития отмечается у больных с комбинированными септальными дефектами (74 %), ОАП (59 %), ДМЖП (58 %), наиболее низкая – при фиброэластозе и ТМС (Landtman B. , 1971).
 ЭТИОЛОГИЯ ВПС
ЭТИОЛОГИЯ ВПС
 Факторы влияющие на возникновения ВПС Хромосомные нарушения Мутации одного гена а) алкоголизм; Факторы внешней б) инфекция; в) лекарственные препараты; среды: г) рентгеновское и ионизирующее облучение Полигенно-мультифакторное наследование Метаболические нарушения
Факторы влияющие на возникновения ВПС Хромосомные нарушения Мутации одного гена а) алкоголизм; Факторы внешней б) инфекция; в) лекарственные препараты; среды: г) рентгеновское и ионизирующее облучение Полигенно-мультифакторное наследование Метаболические нарушения
 Хромосомные аномалии Частота ~ 5% (Friedman W. , 1984; Затикян Е. , 1996). Возможно возникновение количественных и структурных мутации хромосом. ВПС, ассоциированные с хромосомными абберациями, всегда являются частью синдрома полисистемных пороков развития, а не изолированными дефектами.
Хромосомные аномалии Частота ~ 5% (Friedman W. , 1984; Затикян Е. , 1996). Возможно возникновение количественных и структурных мутации хромосом. ВПС, ассоциированные с хромосомными абберациями, всегда являются частью синдрома полисистемных пороков развития, а не изолированными дефектами.
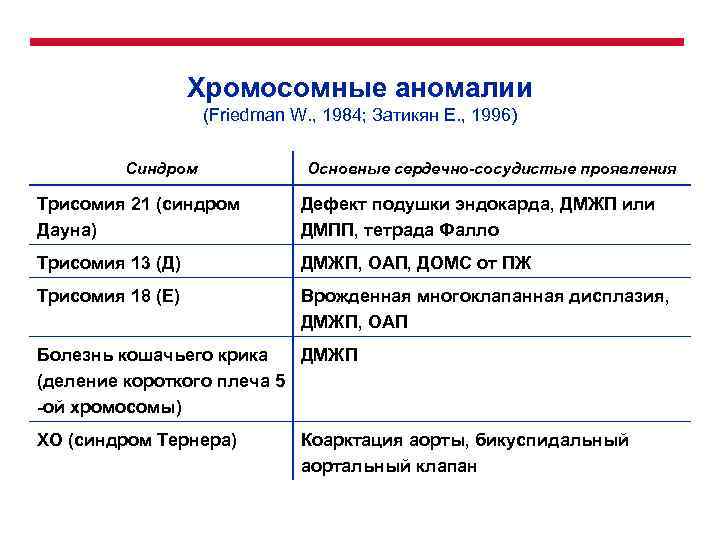 Хромосомные аномалии (Friedman W. , 1984; Затикян Е. , 1996) Синдром Основные сердечно-сосудистые проявления Трисомия 21 (синдром Дауна) Дефект подушки эндокарда, ДМЖП или ДМПП, тетрада Фалло Трисомия 13 (Д) ДМЖП, ОАП, ДОМС от ПЖ Трисомия 18 (Е) Врожденная многоклапанная дисплазия, ДМЖП, ОАП Болезнь кошачьего крика ДМЖП (деление короткого плеча 5 -ой хромосомы) ХО (синдром Тернера) Коарктация аорты, бикуспидальный аортальный клапан
Хромосомные аномалии (Friedman W. , 1984; Затикян Е. , 1996) Синдром Основные сердечно-сосудистые проявления Трисомия 21 (синдром Дауна) Дефект подушки эндокарда, ДМЖП или ДМПП, тетрада Фалло Трисомия 13 (Д) ДМЖП, ОАП, ДОМС от ПЖ Трисомия 18 (Е) Врожденная многоклапанная дисплазия, ДМЖП, ОАП Болезнь кошачьего крика ДМЖП (деление короткого плеча 5 -ой хромосомы) ХО (синдром Тернера) Коарктация аорты, бикуспидальный аортальный клапан
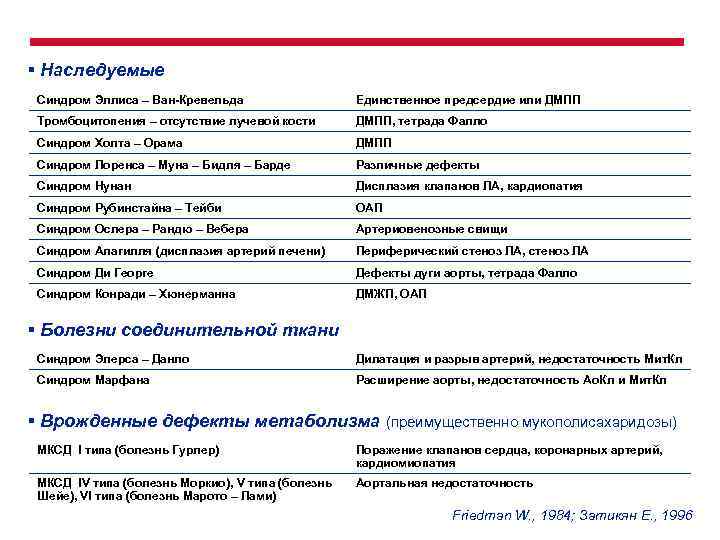 § Наследуемые Синдром Эллиса – Ван-Кревельда Единственное предсердие или ДМПП Тромбоцитопения – отсутствие лучевой кости ДМПП, тетрада Фалло Синдром Холта – Орама ДМПП Синдром Лоренса – Муна – Бидля – Барде Различные дефекты Синдром Нунан Дисплазия клапанов ЛА, кардиопатия Синдром Рубинстайна – Тейби ОАП Синдром Ослера – Рандю – Вебера Артериовенозные свищи Синдром Алагилля (дисплазия артерий печени) Периферический стеноз ЛА, стеноз ЛА Синдром Ди Георге Дефекты дуги аорты, тетрада Фалло Синдром Конради – Хюнерманна ДМЖП, ОАП § Болезни соединительной ткани Синдром Элерса – Данло Дилатация и разрыв артерий, недостаточность Мит. Кл Синдром Марфана Расширение аорты, недостаточность Ао. Кл и Мит. Кл § Врожденные дефекты метаболизма (преимущественно мукополисахаридозы) МКСД I типа (болезнь Гурлер) Поражение клапанов сердца, коронарных артерий, кардиомиопатия МКСД IV типа (болезнь Моркио), V типа (болезнь Шейе), VI типа (болезнь Марото – Лами) Аортальная недостаточность Friedman W. , 1984; Затикян Е. , 1996
§ Наследуемые Синдром Эллиса – Ван-Кревельда Единственное предсердие или ДМПП Тромбоцитопения – отсутствие лучевой кости ДМПП, тетрада Фалло Синдром Холта – Орама ДМПП Синдром Лоренса – Муна – Бидля – Барде Различные дефекты Синдром Нунан Дисплазия клапанов ЛА, кардиопатия Синдром Рубинстайна – Тейби ОАП Синдром Ослера – Рандю – Вебера Артериовенозные свищи Синдром Алагилля (дисплазия артерий печени) Периферический стеноз ЛА, стеноз ЛА Синдром Ди Георге Дефекты дуги аорты, тетрада Фалло Синдром Конради – Хюнерманна ДМЖП, ОАП § Болезни соединительной ткани Синдром Элерса – Данло Дилатация и разрыв артерий, недостаточность Мит. Кл Синдром Марфана Расширение аорты, недостаточность Ао. Кл и Мит. Кл § Врожденные дефекты метаболизма (преимущественно мукополисахаридозы) МКСД I типа (болезнь Гурлер) Поражение клапанов сердца, коронарных артерий, кардиомиопатия МКСД IV типа (болезнь Моркио), V типа (болезнь Шейе), VI типа (болезнь Марото – Лами) Аортальная недостаточность Friedman W. , 1984; Затикян Е. , 1996
 Мутация одного гена (Friedman W. , 1984; Затикян Е. , 1996) Частота ~ 2 – 5 %. Часто сочетается с аномалиями развития других органов. Пороки развития сердечно-сосудистой системы являются, как правило, частью синдрома. Большинству синдромов свойственна вариабельная экспрессивность: изменения в сердце могут варьировать от легкой степени поражения до тяжелой. Это наиболее выражено при межсемейственной мутации гена (Nora J. , 1986).
Мутация одного гена (Friedman W. , 1984; Затикян Е. , 1996) Частота ~ 2 – 5 %. Часто сочетается с аномалиями развития других органов. Пороки развития сердечно-сосудистой системы являются, как правило, частью синдрома. Большинству синдромов свойственна вариабельная экспрессивность: изменения в сердце могут варьировать от легкой степени поражения до тяжелой. Это наиболее выражено при межсемейственной мутации гена (Nora J. , 1986).
 Признаки полигенно-мультифакторной модели типа наследования ВПС (Бочков Н. П. , 1989) 1. Риск повторного поражения возрастает с увеличением больных среди родственников 1 степени. 2. В случае, когда в общей популяции имеются различия в заболевании патологией определенного пола, среди родственников оказываются пораженными особи противоположного пола. 3. Чем тяжелее порок сердца, тем выше риск его повторения. 4. Риск повторения у родственников 1 степени больного индивидуума равен приблизительно корню квадратному из частоты патологии среди общей популяции.
Признаки полигенно-мультифакторной модели типа наследования ВПС (Бочков Н. П. , 1989) 1. Риск повторного поражения возрастает с увеличением больных среди родственников 1 степени. 2. В случае, когда в общей популяции имеются различия в заболевании патологией определенного пола, среди родственников оказываются пораженными особи противоположного пола. 3. Чем тяжелее порок сердца, тем выше риск его повторения. 4. Риск повторения у родственников 1 степени больного индивидуума равен приблизительно корню квадратному из частоты патологии среди общей популяции.
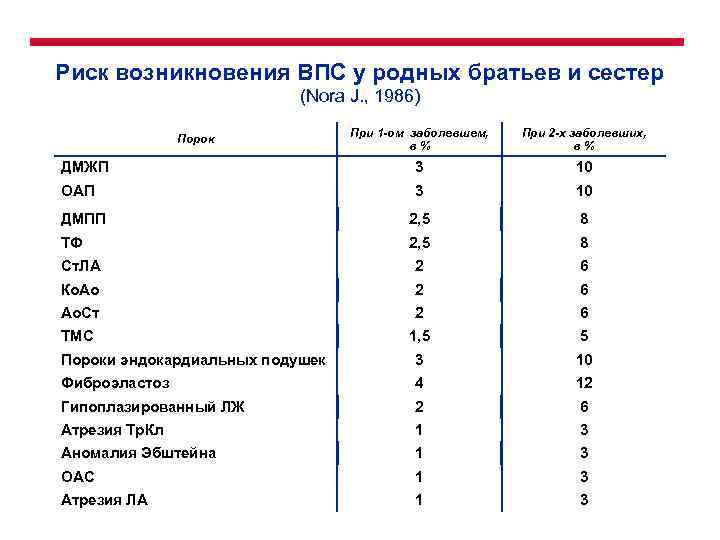 Риск возникновения ВПС у родных братьев и сестер (Nora J. , 1986) При 1 -ом заболевшем, в% При 2 -х заболевших, в% ДМЖП 3 10 ОАП 3 10 ДМПП 2, 5 8 ТФ 2, 5 8 Ст. ЛА 2 6 Ко. Ао 2 6 Ао. Ст 2 6 ТМС 1, 5 5 Пороки эндокардиальных подушек 3 10 Фиброэластоз 4 12 Гипоплазированный ЛЖ 2 6 Атрезия Тр. Кл 1 3 Аномалия Эбштейна 1 3 ОАС 1 3 Атрезия ЛА 1 3 Порок
Риск возникновения ВПС у родных братьев и сестер (Nora J. , 1986) При 1 -ом заболевшем, в% При 2 -х заболевших, в% ДМЖП 3 10 ОАП 3 10 ДМПП 2, 5 8 ТФ 2, 5 8 Ст. ЛА 2 6 Ко. Ао 2 6 Ао. Ст 2 6 ТМС 1, 5 5 Пороки эндокардиальных подушек 3 10 Фиброэластоз 4 12 Гипоплазированный ЛЖ 2 6 Атрезия Тр. Кл 1 3 Аномалия Эбштейна 1 3 ОАС 1 3 Атрезия ЛА 1 3 Порок
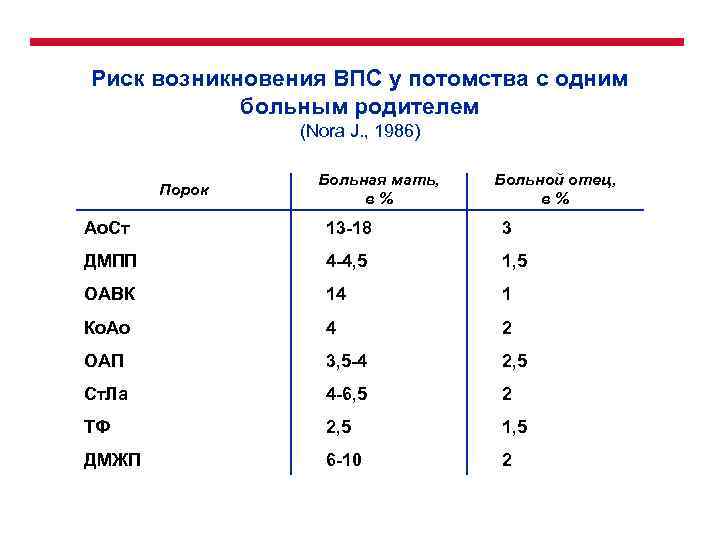 Риск возникновения ВПС у потомства с одним больным родителем (Nora J. , 1986) Порок Больная мать, в% Больной отец, в% Ао. Ст 13 -18 3 ДМПП 4 -4, 5 1, 5 ОАВК 14 1 Ко. Ао 4 2 ОАП 3, 5 -4 2, 5 Ст. Ла 4 -6, 5 2 ТФ 2, 5 1, 5 ДМЖП 6 -10 2
Риск возникновения ВПС у потомства с одним больным родителем (Nora J. , 1986) Порок Больная мать, в% Больной отец, в% Ао. Ст 13 -18 3 ДМПП 4 -4, 5 1, 5 ОАВК 14 1 Ко. Ао 4 2 ОАП 3, 5 -4 2, 5 Ст. Ла 4 -6, 5 2 ТФ 2, 5 1, 5 ДМЖП 6 -10 2
 Повреждающие факторы внешней среды - Инфекция Частота ~ 1 -2%. Причины: высокий уровень метаболизма в клетках эмбриона и большое количество нуклеиновых кислот способствуют внедрению и благоприятному существованию вирусов. l Вирус краснухи (1, 3 -2, 4%, Kramer H. et al. , 1987) l Цитомегаловирус l Ветряная оспа Основные l Простой герпес ВОЗБУДИТЕЛИ, l Вирус Коксаки l Сывороточный гепатит l Микоплазмоз l Токсоплазмоз ГОНДУ l Листерия l Туберкулез l Сифилис l Аденовирусная инфекция (Potter, 1971) вызывающие эмбриопатии:
Повреждающие факторы внешней среды - Инфекция Частота ~ 1 -2%. Причины: высокий уровень метаболизма в клетках эмбриона и большое количество нуклеиновых кислот способствуют внедрению и благоприятному существованию вирусов. l Вирус краснухи (1, 3 -2, 4%, Kramer H. et al. , 1987) l Цитомегаловирус l Ветряная оспа Основные l Простой герпес ВОЗБУДИТЕЛИ, l Вирус Коксаки l Сывороточный гепатит l Микоплазмоз l Токсоплазмоз ГОНДУ l Листерия l Туберкулез l Сифилис l Аденовирусная инфекция (Potter, 1971) вызывающие эмбриопатии:
 Повреждающие факторы внешней среды – Алкоголь, лекарственные средства Частота возникновения ВПС при алкоголизме матери ~ 1% (Kramer H. et al. , 1987). Употребление алкоголя, особенно при воздействии в первом триместре беременности, приводит к возникновению – ДМЖП, ОАП, ДМПП. Тератогенным эффектом обладают лекарственные препараты: 1. Противосудорожные l Гидантоин → СЛА, Ко. Ао, ОАП l Триметадоин → ТМС, ТФ, гипоплазия левого сердца l Препараты лития, обладают избирательным воздействием на трикуспидальный клапан → аномалии Эбштейна, атрезии Тр. Кл (Sipek A. , 1989) 2. Амфитамины 3. Прогестагены 4. Оральные контрацептивы 5. Противогипертензионные средства 6. Аспирин (? !) 7. Антибиотики (? !)
Повреждающие факторы внешней среды – Алкоголь, лекарственные средства Частота возникновения ВПС при алкоголизме матери ~ 1% (Kramer H. et al. , 1987). Употребление алкоголя, особенно при воздействии в первом триместре беременности, приводит к возникновению – ДМЖП, ОАП, ДМПП. Тератогенным эффектом обладают лекарственные препараты: 1. Противосудорожные l Гидантоин → СЛА, Ко. Ао, ОАП l Триметадоин → ТМС, ТФ, гипоплазия левого сердца l Препараты лития, обладают избирательным воздействием на трикуспидальный клапан → аномалии Эбштейна, атрезии Тр. Кл (Sipek A. , 1989) 2. Амфитамины 3. Прогестагены 4. Оральные контрацептивы 5. Противогипертензионные средства 6. Аспирин (? !) 7. Антибиотики (? !)
 Повреждающие факторы внешней среды: ● Рентгеновское излучение ● Ионизирующая радиация Метаболические нарушения ● Диабет (вызывает формирование ВПС в 3 -5%) ● Гипо- или гипертиреоз
Повреждающие факторы внешней среды: ● Рентгеновское излучение ● Ионизирующая радиация Метаболические нарушения ● Диабет (вызывает формирование ВПС в 3 -5%) ● Гипо- или гипертиреоз
 Решение о риске наследования должен принимать только консилиум врачей. Состав: ● Генетик ● Кардиолог ● Неонатолог
Решение о риске наследования должен принимать только консилиум врачей. Состав: ● Генетик ● Кардиолог ● Неонатолог
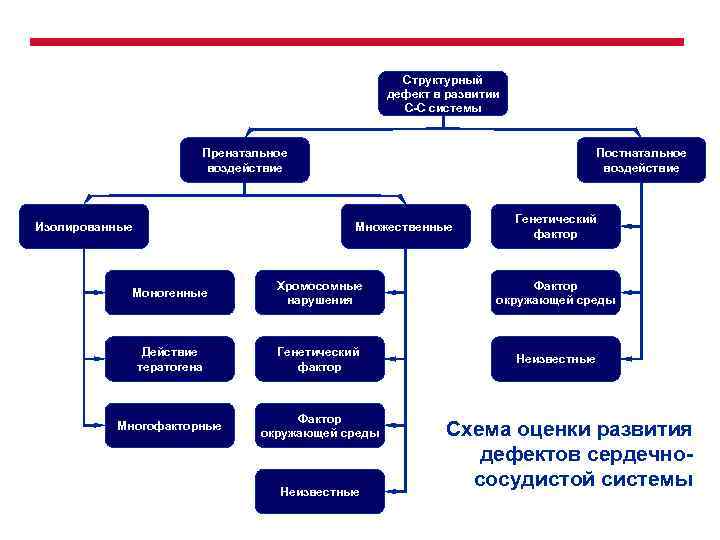 Структурный дефект в развитии С-С системы Пренатальное воздействие Постнатальное воздействие Множественные Изолированные Генетический фактор Моногенные Хромосомные нарушения Фактор окружающей среды Действие тератогена Генетический фактор Неизвестные Многофакторные Фактор окружающей среды Неизвестные Схема оценки развития дефектов сердечнососудистой системы
Структурный дефект в развитии С-С системы Пренатальное воздействие Постнатальное воздействие Множественные Изолированные Генетический фактор Моногенные Хромосомные нарушения Фактор окружающей среды Действие тератогена Генетический фактор Неизвестные Многофакторные Фактор окружающей среды Неизвестные Схема оценки развития дефектов сердечнососудистой системы
 ФАКТОРЫ РИСКА РАЗВИТИЯ ВПС
ФАКТОРЫ РИСКА РАЗВИТИЯ ВПС
 К группе риска рождения ребенка с ВПС относят женщин: ● в случаях беременности на грани детородного периода (старше 40 лет) ● с самопроизвольными абортами (выкидышами) и мертворождениями в анамнезе, а также рождении с другими аномалиями ● в семьях которых ВПС отмечается как наследственное заболевание (т. е. либо они сами, либо их родственники имеют ВПС) ● куривших и употреблявших алкоголь во время беременности; ● перенесших во время беременности инфекционные заболевания (особенно краснуху) ● употреблявших во время беременности некоторые лекарственные средства, например сульфаниламидные препараты, некоторые антибиотики, аспирин ● проживающих в экологически неблагоприятных районах
К группе риска рождения ребенка с ВПС относят женщин: ● в случаях беременности на грани детородного периода (старше 40 лет) ● с самопроизвольными абортами (выкидышами) и мертворождениями в анамнезе, а также рождении с другими аномалиями ● в семьях которых ВПС отмечается как наследственное заболевание (т. е. либо они сами, либо их родственники имеют ВПС) ● куривших и употреблявших алкоголь во время беременности; ● перенесших во время беременности инфекционные заболевания (особенно краснуху) ● употреблявших во время беременности некоторые лекарственные средства, например сульфаниламидные препараты, некоторые антибиотики, аспирин ● проживающих в экологически неблагоприятных районах
 Факторы риска развития ВПС со стороны родителей l Заболевания сердца у матери l Метаболические нарушения l Инфекция во время беременности l Синдром склерокистозных яичников l Заболевания сердца у отца l Факторы среды
Факторы риска развития ВПС со стороны родителей l Заболевания сердца у матери l Метаболические нарушения l Инфекция во время беременности l Синдром склерокистозных яичников l Заболевания сердца у отца l Факторы среды
 Факторы риска развития ВПС со стороны плода ● Экстракардиальные аномалии ● Хромосомные нарушения ● Нарушения ритма сердца ● Перикардит, асцит ● Гипотрофия плода ● Многоплодие
Факторы риска развития ВПС со стороны плода ● Экстракардиальные аномалии ● Хромосомные нарушения ● Нарушения ритма сердца ● Перикардит, асцит ● Гипотрофия плода ● Многоплодие
 Заболевания и патологические состояния матери, влияющие на сердечно-сосудистую систему плода Непосредственно повреждающие сердечно-сосудистую систему Опосредованное влияние через маточно -плацентарный кровоток l Инфекционные заболевания l Неинфекционные заболевания l Краснуха l Опухоли l Цитомегаловирус l Сахарный диабет l Энтеровирус l Пороки сердца l Токсоплазмоз l Анемии l Листериоз l Артериальная гипертензия l Сифилис l Почечная гипертензия l Неинфекционные заболевания l Астма l Феохромоцитома l Системные васкулиты l Гипертиреоидизм l Сахарный диабет l l Системные васкулиты l l l l (Ro-антитела) Лекарства и ксенобиотики Алкоголь Курение Противосудорожные средства Литий Антидепрессанты Наркотики l l l l (люпус-антикоагулянт) Инфекционные заболевания Цитомегаловирус Энтеровирус Стрептококк группы В Лекарства и ксенобиотики Курение Наркотики Нестероидные противовоспалительные средства Обзидан
Заболевания и патологические состояния матери, влияющие на сердечно-сосудистую систему плода Непосредственно повреждающие сердечно-сосудистую систему Опосредованное влияние через маточно -плацентарный кровоток l Инфекционные заболевания l Неинфекционные заболевания l Краснуха l Опухоли l Цитомегаловирус l Сахарный диабет l Энтеровирус l Пороки сердца l Токсоплазмоз l Анемии l Листериоз l Артериальная гипертензия l Сифилис l Почечная гипертензия l Неинфекционные заболевания l Астма l Феохромоцитома l Системные васкулиты l Гипертиреоидизм l Сахарный диабет l l Системные васкулиты l l l l (Ro-антитела) Лекарства и ксенобиотики Алкоголь Курение Противосудорожные средства Литий Антидепрессанты Наркотики l l l l (люпус-антикоагулянт) Инфекционные заболевания Цитомегаловирус Энтеровирус Стрептококк группы В Лекарства и ксенобиотики Курение Наркотики Нестероидные противовоспалительные средства Обзидан
 РАЗВИТИЕ СЕРДЦА
РАЗВИТИЕ СЕРДЦА
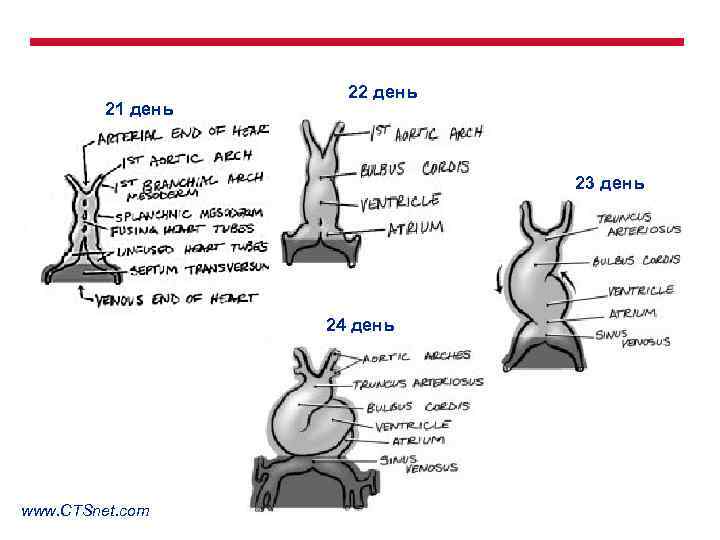
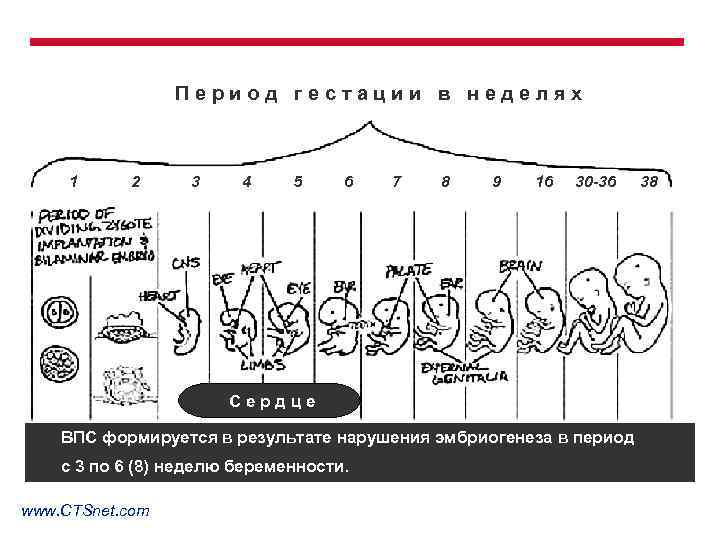 Период гестации в неделях 1 2 3 4 5 6 7 8 9 16 30 -36 Сердце ВПС формируется в результате нарушения эмбриогенеза в период с 3 по 6 (8) неделю беременности. www. CTSnet. com 38
Период гестации в неделях 1 2 3 4 5 6 7 8 9 16 30 -36 Сердце ВПС формируется в результате нарушения эмбриогенеза в период с 3 по 6 (8) неделю беременности. www. CTSnet. com 38
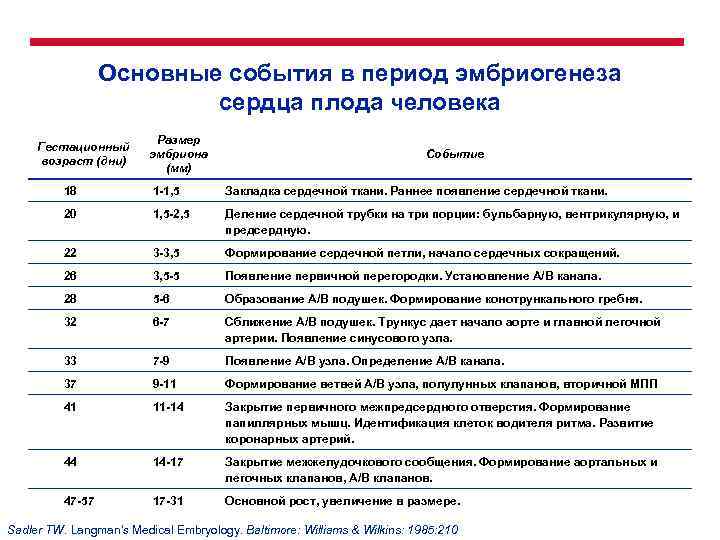 Основные события в период эмбриогенеза сердца плода человека Гестационный возраст (дни) Размер эмбриона (мм) Событие 18 1 -1, 5 Закладка сердечной ткани. Раннее появление сердечной ткани. 20 1, 5 -2, 5 Деление сердечной трубки на три порции: бульбарную, вентрикулярную, и предсердную. 22 3 -3, 5 Формирование сердечной петли, начало сердечных сокращений. 26 3, 5 -5 Появление первичной перегородки. Установление А/В канала. 28 5 -6 Образование А/В подушек. Формирование конотрункального гребня. 32 6 -7 Сближение А/В подушек. Трункус дает начало аорте и главной легочной артерии. Появление синусового узла. 33 7 -9 Появление А/В узла. Определение А/В канала. 37 9 -11 Формирование ветвей А/В узла, полулунных клапанов, вторичной МПП 41 11 -14 Закрытие первичного межпредсердного отверстия. Формирование папиллярных мышц. Идентификация клеток водителя ритма. Развитие коронарных артерий. 44 14 -17 Закрытие межжелудочкового сообщения. Формирование аортальных и легочных клапанов, А/В клапанов. 47 -57 17 -31 Основной рост, увеличение в размере. Sadler TW. Langman's Medical Embryology. Baltimore: Williams & Wilkins: 1985: 210
Основные события в период эмбриогенеза сердца плода человека Гестационный возраст (дни) Размер эмбриона (мм) Событие 18 1 -1, 5 Закладка сердечной ткани. Раннее появление сердечной ткани. 20 1, 5 -2, 5 Деление сердечной трубки на три порции: бульбарную, вентрикулярную, и предсердную. 22 3 -3, 5 Формирование сердечной петли, начало сердечных сокращений. 26 3, 5 -5 Появление первичной перегородки. Установление А/В канала. 28 5 -6 Образование А/В подушек. Формирование конотрункального гребня. 32 6 -7 Сближение А/В подушек. Трункус дает начало аорте и главной легочной артерии. Появление синусового узла. 33 7 -9 Появление А/В узла. Определение А/В канала. 37 9 -11 Формирование ветвей А/В узла, полулунных клапанов, вторичной МПП 41 11 -14 Закрытие первичного межпредсердного отверстия. Формирование папиллярных мышц. Идентификация клеток водителя ритма. Развитие коронарных артерий. 44 14 -17 Закрытие межжелудочкового сообщения. Формирование аортальных и легочных клапанов, А/В клапанов. 47 -57 17 -31 Основной рост, увеличение в размере. Sadler TW. Langman's Medical Embryology. Baltimore: Williams & Wilkins: 1985: 210
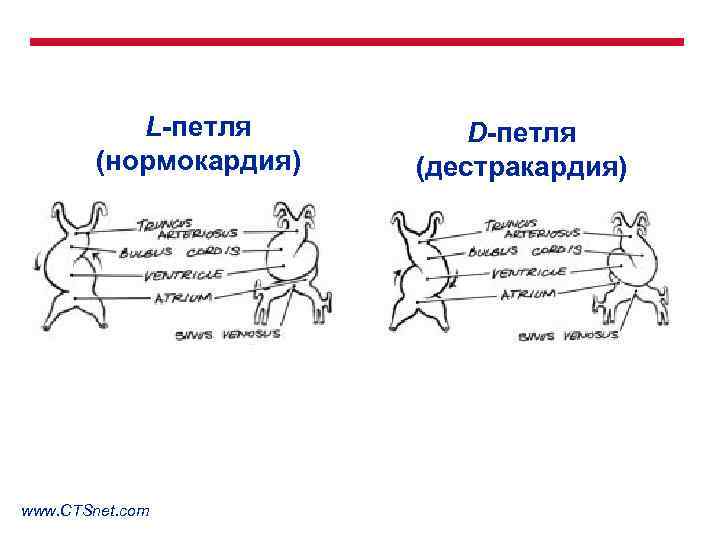
 Формирование ВПС возможно на одном из этапов эмбриогенеза: 1. Закладка сердца. 2. Формирование сердечной петли. 3. Формирование выводных трактов желудочков. 4. Септация предсердий. 5. Атриовентрикулярный канал и септация желудочков. 6. Конотрункальная септация.
Формирование ВПС возможно на одном из этапов эмбриогенеза: 1. Закладка сердца. 2. Формирование сердечной петли. 3. Формирование выводных трактов желудочков. 4. Септация предсердий. 5. Атриовентрикулярный канал и септация желудочков. 6. Конотрункальная септация.
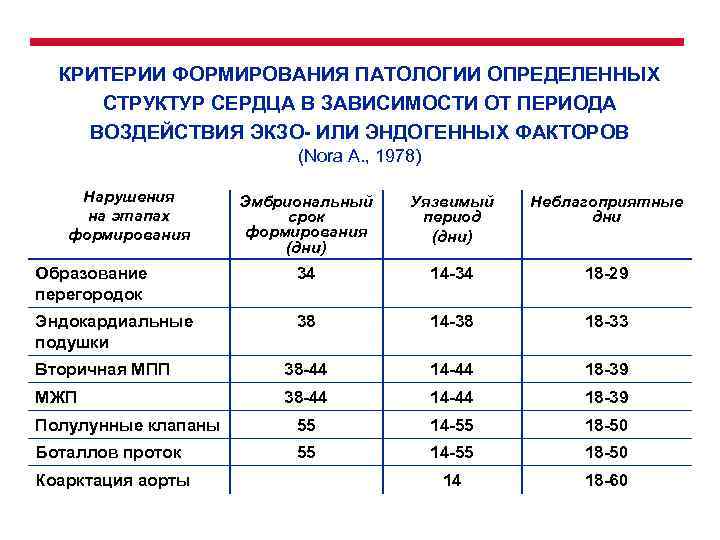 КРИТЕРИИ ФОРМИРОВАНИЯ ПАТОЛОГИИ ОПРЕДЕЛЕННЫХ СТРУКТУР СЕРДЦА В ЗАВИСИМОСТИ ОТ ПЕРИОДА ВОЗДЕЙСТВИЯ ЭКЗО- ИЛИ ЭНДОГЕННЫХ ФАКТОРОВ (Nora A. , 1978) Нарушения на этапах формирования Эмбриональный срок формирования (дни) Уязвимый период (дни) Неблагоприятные дни Образование перегородок 34 14 -34 18 -29 Эндокардиальные подушки 38 14 -38 18 -33 Вторичная МПП 38 -44 14 -44 18 -39 МЖП 38 -44 14 -44 18 -39 Полулунные клапаны 55 14 -55 18 -50 Боталлов проток 55 14 -55 18 -50 14 18 -60 Коарктация аорты
КРИТЕРИИ ФОРМИРОВАНИЯ ПАТОЛОГИИ ОПРЕДЕЛЕННЫХ СТРУКТУР СЕРДЦА В ЗАВИСИМОСТИ ОТ ПЕРИОДА ВОЗДЕЙСТВИЯ ЭКЗО- ИЛИ ЭНДОГЕННЫХ ФАКТОРОВ (Nora A. , 1978) Нарушения на этапах формирования Эмбриональный срок формирования (дни) Уязвимый период (дни) Неблагоприятные дни Образование перегородок 34 14 -34 18 -29 Эндокардиальные подушки 38 14 -38 18 -33 Вторичная МПП 38 -44 14 -44 18 -39 МЖП 38 -44 14 -44 18 -39 Полулунные клапаны 55 14 -55 18 -50 Боталлов проток 55 14 -55 18 -50 14 18 -60 Коарктация аорты
 21 день 22 день 23 день 24 день www. CTSnet. com
21 день 22 день 23 день 24 день www. CTSnet. com
 L-петля (нормокардия) www. CTSnet. com D-петля (дестракардия)
L-петля (нормокардия) www. CTSnet. com D-петля (дестракардия)
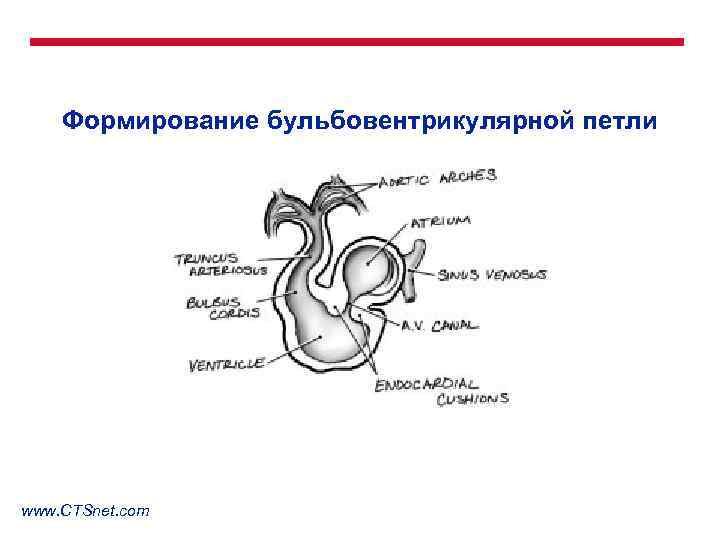 Формирование бульбовентрикулярной петли www. CTSnet. com
Формирование бульбовентрикулярной петли www. CTSnet. com
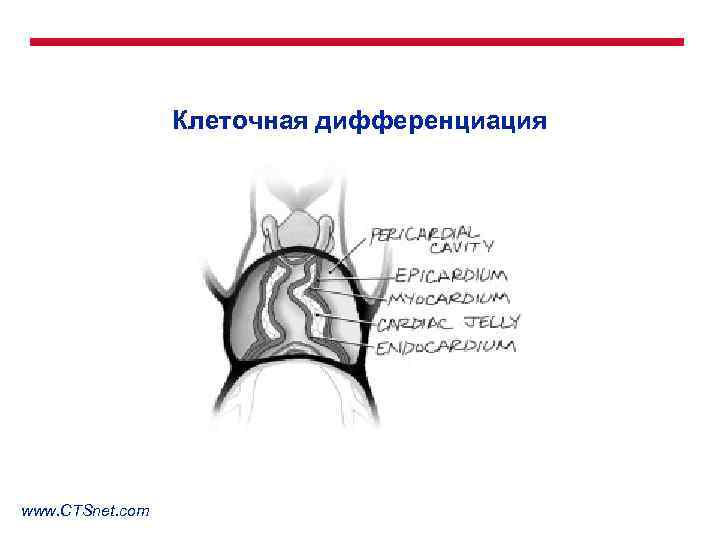 Клеточная дифференциация www. CTSnet. com
Клеточная дифференциация www. CTSnet. com
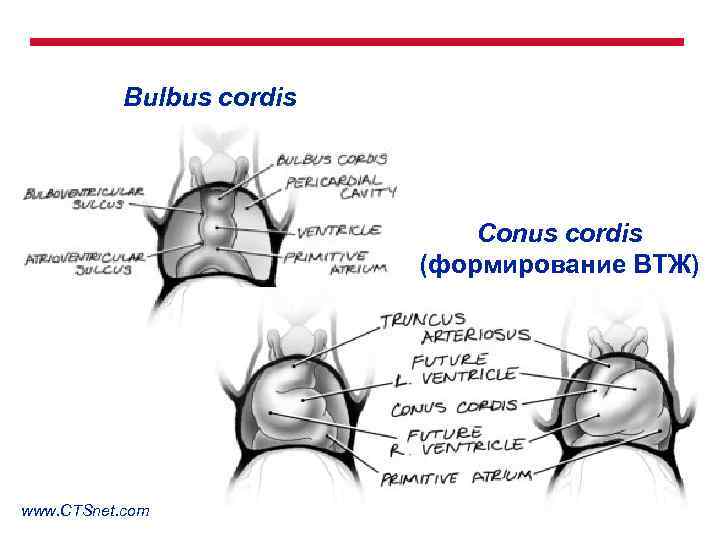 Bulbus cordis Conus cordis (формирование ВТЖ) www. CTSnet. com
Bulbus cordis Conus cordis (формирование ВТЖ) www. CTSnet. com
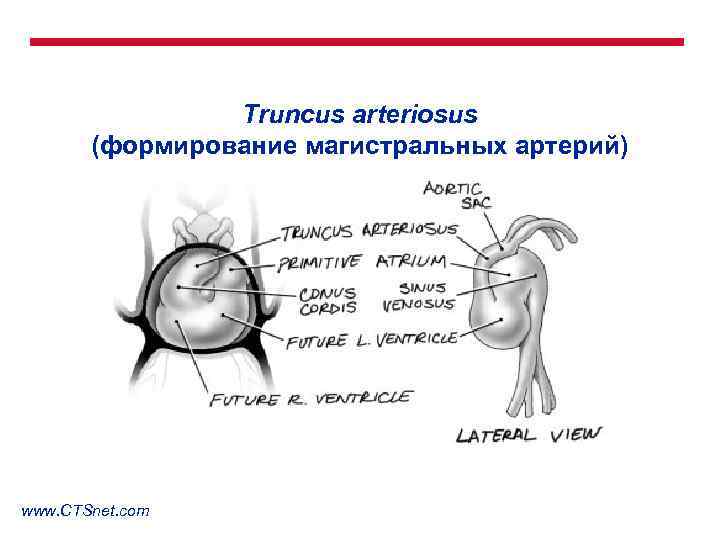 Truncus arteriosus (формирование магистральных артерий) www. CTSnet. com
Truncus arteriosus (формирование магистральных артерий) www. CTSnet. com
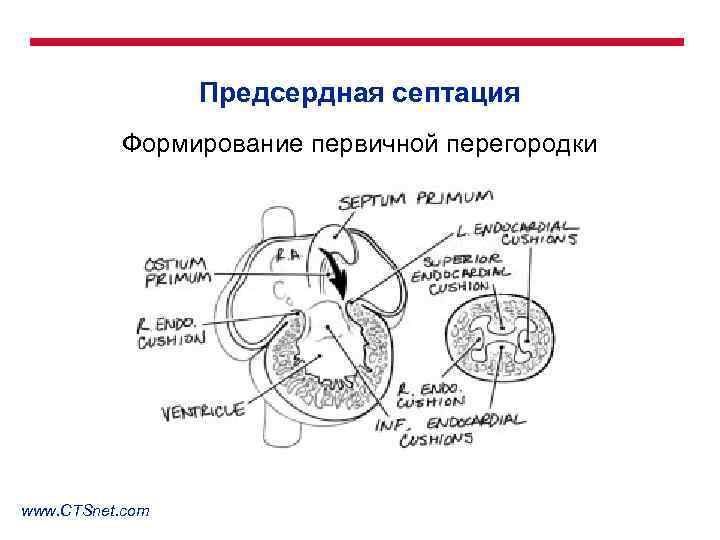 Предсердная септация Формирование первичной перегородки www. CTSnet. com
Предсердная септация Формирование первичной перегородки www. CTSnet. com
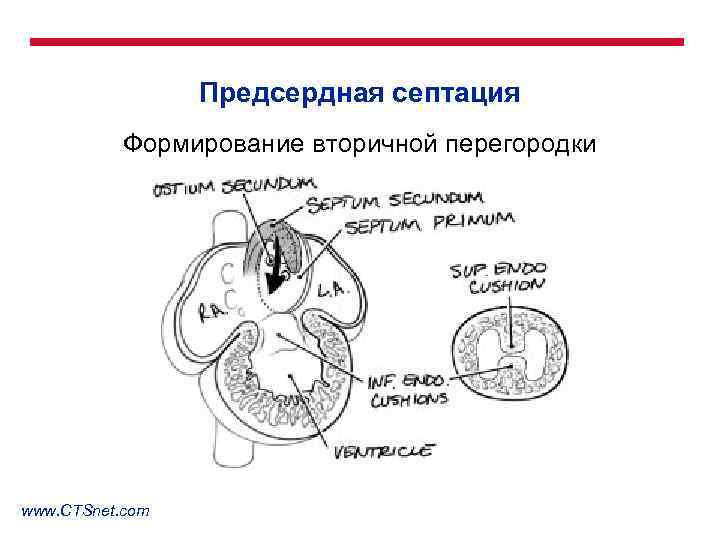 Предсердная септация Формирование вторичной перегородки www. CTSnet. com
Предсердная септация Формирование вторичной перегородки www. CTSnet. com
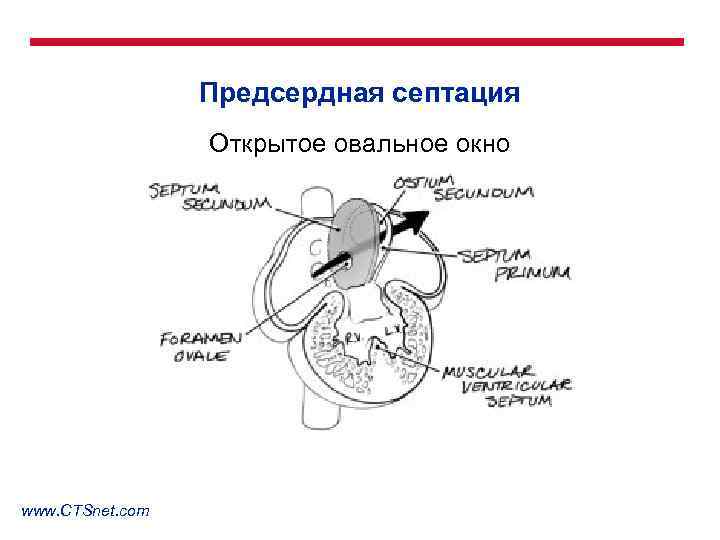 Предсердная септация Открытое овальное окно www. CTSnet. com
Предсердная септация Открытое овальное окно www. CTSnet. com
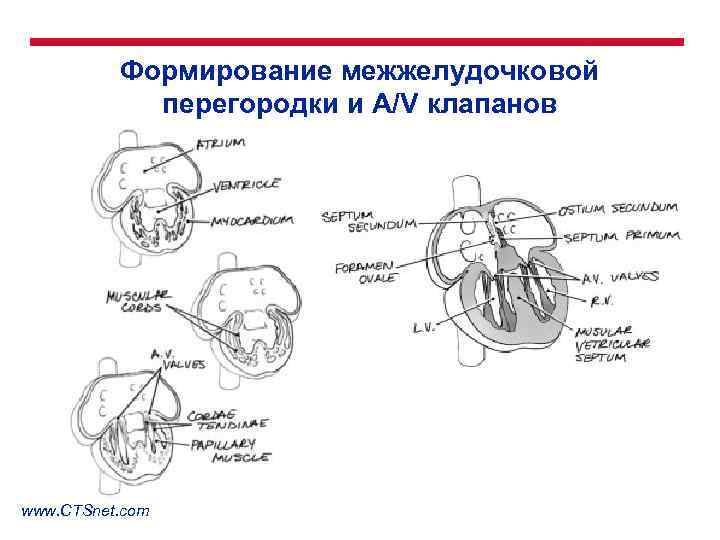 Формирование межжелудочковой перегородки и A/V клапанов www. CTSnet. com
Формирование межжелудочковой перегородки и A/V клапанов www. CTSnet. com
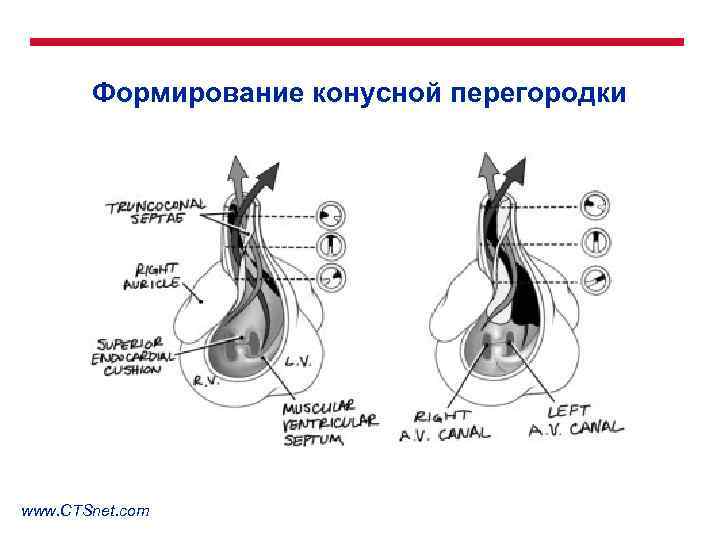 Формирование конусной перегородки www. CTSnet. com
Формирование конусной перегородки www. CTSnet. com
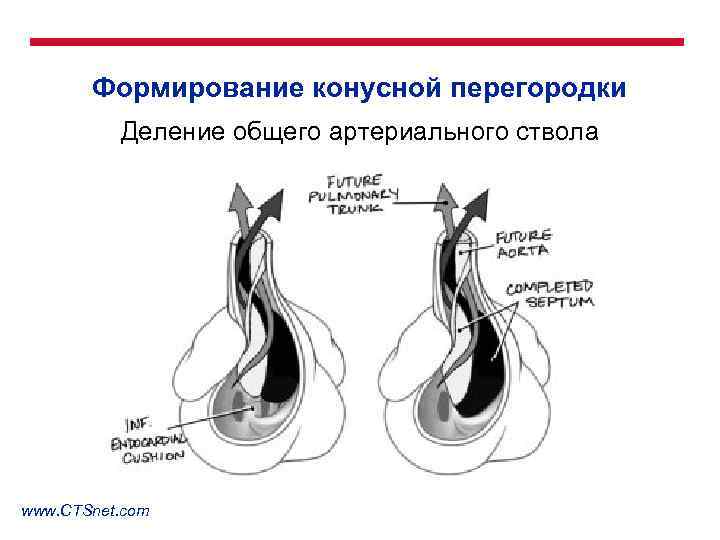 Формирование конусной перегородки Деление общего артериального ствола www. CTSnet. com
Формирование конусной перегородки Деление общего артериального ствола www. CTSnet. com
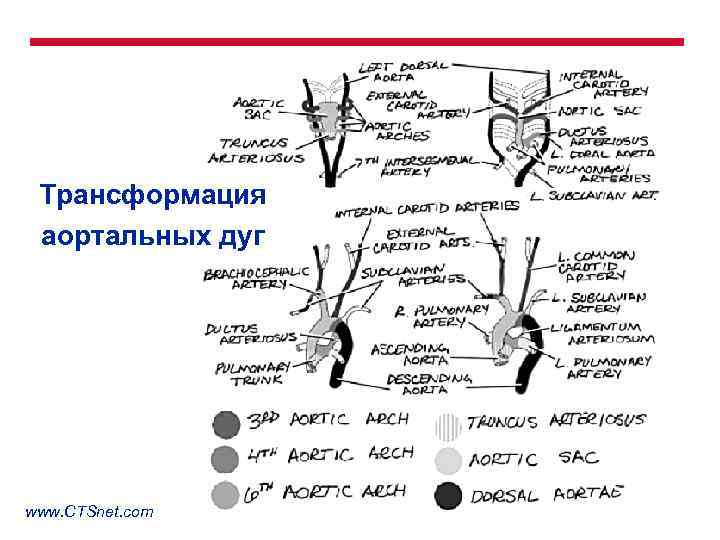 Трансформация аортальных дуг www. CTSnet. com
Трансформация аортальных дуг www. CTSnet. com
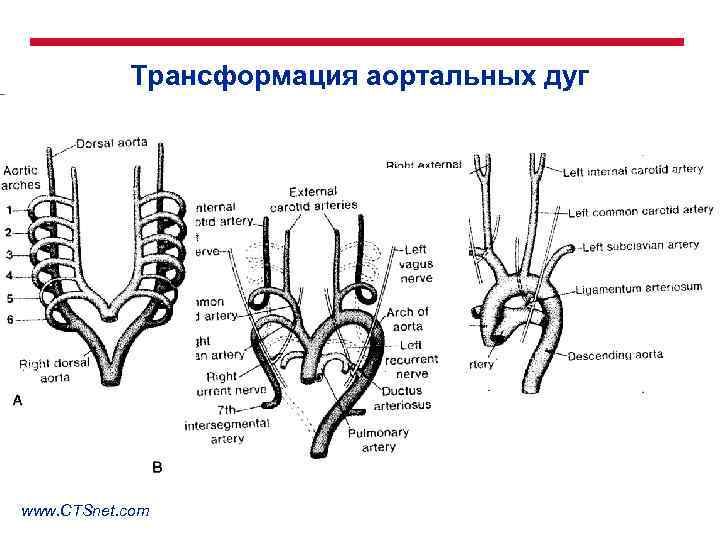 Трансформация аортальных дуг www. CTSnet. com
Трансформация аортальных дуг www. CTSnet. com
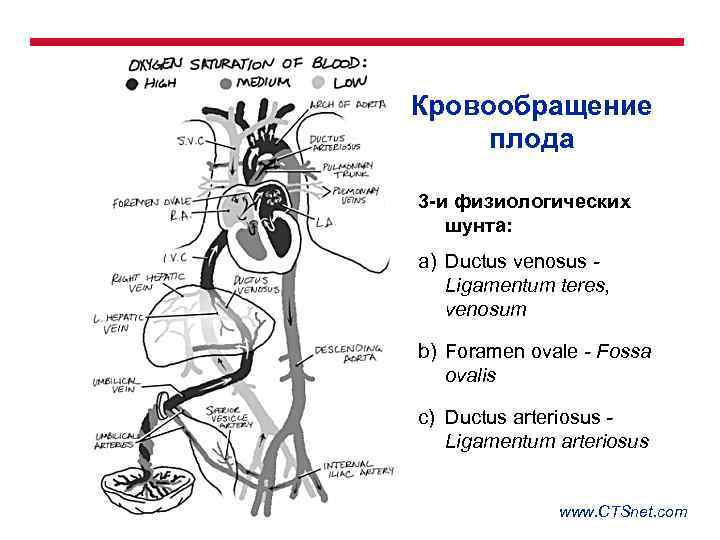 Кровообращение плода 3 -и физиологических шунта: a) Ductus venosus Ligamentum teres, venosum b) Foramen ovale - Fossa ovalis c) Ductus arteriosus Ligamentum arteriosus www. CTSnet. com
Кровообращение плода 3 -и физиологических шунта: a) Ductus venosus Ligamentum teres, venosum b) Foramen ovale - Fossa ovalis c) Ductus arteriosus Ligamentum arteriosus www. CTSnet. com
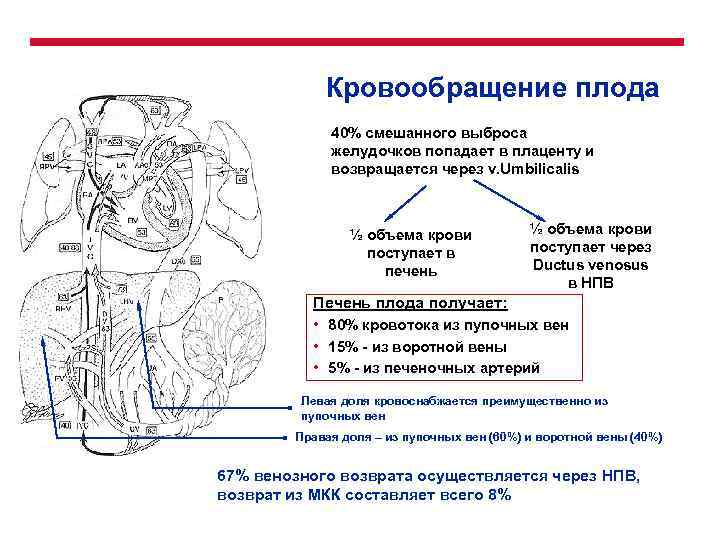 Кровообращение плода 40% смешанного выброса желудочков попадает в плаценту и возвращается через v. Umbilicalis ½ объема крови поступает в печень ½ объема крови поступает через Ductus venosus в НПВ Печень плода получает: • 80% кровотока из пупочных вен • 15% - из воротной вены • 5% - из печеночных артерий Левая доля кровоснабжается преимущественно из пупочных вен Правая доля – из пупочных вен (60%) и воротной вены (40%) 67% венозного возврата осуществляется через НПВ, возврат из МКК составляет всего 8%
Кровообращение плода 40% смешанного выброса желудочков попадает в плаценту и возвращается через v. Umbilicalis ½ объема крови поступает в печень ½ объема крови поступает через Ductus venosus в НПВ Печень плода получает: • 80% кровотока из пупочных вен • 15% - из воротной вены • 5% - из печеночных артерий Левая доля кровоснабжается преимущественно из пупочных вен Правая доля – из пупочных вен (60%) и воротной вены (40%) 67% венозного возврата осуществляется через НПВ, возврат из МКК составляет всего 8%
 Кровообращение плода 67% смешанного выброса желудочков сердца поступает в нижнюю половину тела и плаценту и ПП возвращается в сердце по НПВ 40% - поступает через овальное окно в ЛП (27% от общего выброса желудочков) Объем крови поступающий через Fossa Ovalis Венозный возврат из НПВ + коронарный синус (40% выброса желудочков) 60% - поступает через трикуспидальный клапан в ПЖ + Объем крови поступающий из легочных вен 35% от общего выброса обоих желудочков + Венозный возврат из ВПВ 65% от общего выброса обоих желудочков
Кровообращение плода 67% смешанного выброса желудочков сердца поступает в нижнюю половину тела и плаценту и ПП возвращается в сердце по НПВ 40% - поступает через овальное окно в ЛП (27% от общего выброса желудочков) Объем крови поступающий через Fossa Ovalis Венозный возврат из НПВ + коронарный синус (40% выброса желудочков) 60% - поступает через трикуспидальный клапан в ПЖ + Объем крови поступающий из легочных вен 35% от общего выброса обоих желудочков + Венозный возврат из ВПВ 65% от общего выброса обоих желудочков
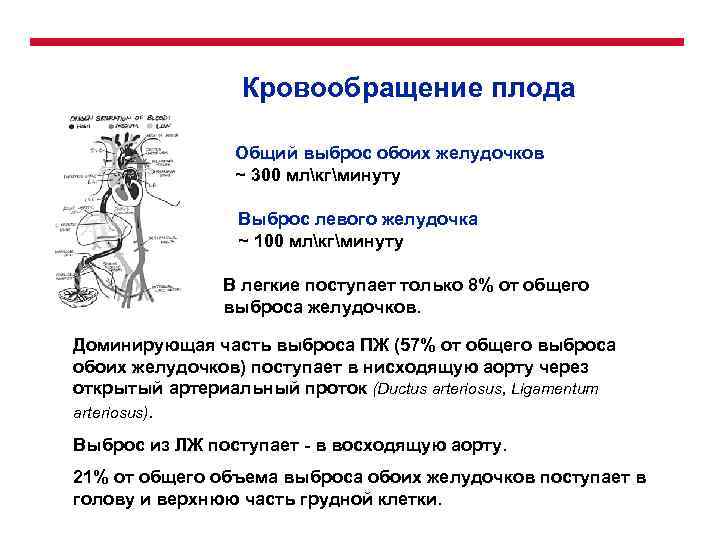 Кровообращение плода Общий выброс обоих желудочков ~ 300 млкгминуту ПП Выброс левого желудочка ~ 100 млкгминуту В легкие поступает только 8% от общего выброса желудочков. Доминирующая часть выброса ПЖ (57% от общего выброса обоих желудочков) поступает в нисходящую аорту через открытый артериальный проток (Ductus arteriosus, Ligamentum arteriosus). Выброс из ЛЖ поступает - в восходящую аорту. 21% от общего объема выброса обоих желудочков поступает в голову и верхнюю часть грудной клетки.
Кровообращение плода Общий выброс обоих желудочков ~ 300 млкгминуту ПП Выброс левого желудочка ~ 100 млкгминуту В легкие поступает только 8% от общего выброса желудочков. Доминирующая часть выброса ПЖ (57% от общего выброса обоих желудочков) поступает в нисходящую аорту через открытый артериальный проток (Ductus arteriosus, Ligamentum arteriosus). Выброс из ЛЖ поступает - в восходящую аорту. 21% от общего объема выброса обоих желудочков поступает в голову и верхнюю часть грудной клетки.
 Кровообращение плода Снабжение кислородом: Сатурация крови изгоняемой ЛЖ в Ао – 60%. ПП Сатурация крови из коронарного синуса – 20% Распределение кровотока в полостях сердца и магистральных сосудах плода:
Кровообращение плода Снабжение кислородом: Сатурация крови изгоняемой ЛЖ в Ао – 60%. ПП Сатурация крови из коронарного синуса – 20% Распределение кровотока в полостях сердца и магистральных сосудах плода:
 Легочный кровоток: Скорость легочного кровотока - 100 мл 100 гр. массы легочной ткани (8 -10% от общего выброса обоих желудочков). Физические факторы, регулирующие сопротивление сосудов ПП МКК и легочный кровоток: R=(Ppa-Ppv)Q где: R – сопротивление сосудов МКК, Q – легочного кровотока, Ppa – давление в легочных артериях, Ppv – давление в легочных венах; R=(Ppa-Ppv)Q=(8 )(lr 4)( ) где: R – сопротивление, l – длина системы сосудов, r – внутренний диаметр трубы, - вязкость. Вазоактивные вещества, регулирующие сопротивление сосудов МКК и легочный кровоток: Кислород, вазоактивные вещества (эйкозаноиды: простагландины, тромбоксан, лейкотриены), эндотелиальные факторы вазодилатации: оксид азота.
Легочный кровоток: Скорость легочного кровотока - 100 мл 100 гр. массы легочной ткани (8 -10% от общего выброса обоих желудочков). Физические факторы, регулирующие сопротивление сосудов ПП МКК и легочный кровоток: R=(Ppa-Ppv)Q где: R – сопротивление сосудов МКК, Q – легочного кровотока, Ppa – давление в легочных артериях, Ppv – давление в легочных венах; R=(Ppa-Ppv)Q=(8 )(lr 4)( ) где: R – сопротивление, l – длина системы сосудов, r – внутренний диаметр трубы, - вязкость. Вазоактивные вещества, регулирующие сопротивление сосудов МКК и легочный кровоток: Кислород, вазоактивные вещества (эйкозаноиды: простагландины, тромбоксан, лейкотриены), эндотелиальные факторы вазодилатации: оксид азота.
 Функция миокарда и сердечно-сосудистой системы плода и новорожденного Миокардиальный кровоток (у здорового плода) составляет 100 млминуту100 гр. ПП Потребление кислорода миокардом ЛЖ – 400 мк. Ммин100 гр. Управление функциями сердечно-сосудистой системы: Рефлекторные механизмы включают в себя механорефлексы, такие как барорефлексы, центральные и переферические хеморефлексы, работающие преимущественно посредством автономной нервной системы. Сосудосуживающие эффекты норадреналина или нервной стимуляции нарастают с увеличением срока беременности и снижаются с течением времени после рождения. Гормональная регуляция включает РААС систему, вазопрессин, предсердный натрийуретический фактор, местный сосудистый метаболизм арахидоновой кислоты и эндотелиальный синтез многих вазоактивных веществ.
Функция миокарда и сердечно-сосудистой системы плода и новорожденного Миокардиальный кровоток (у здорового плода) составляет 100 млминуту100 гр. ПП Потребление кислорода миокардом ЛЖ – 400 мк. Ммин100 гр. Управление функциями сердечно-сосудистой системы: Рефлекторные механизмы включают в себя механорефлексы, такие как барорефлексы, центральные и переферические хеморефлексы, работающие преимущественно посредством автономной нервной системы. Сосудосуживающие эффекты норадреналина или нервной стимуляции нарастают с увеличением срока беременности и снижаются с течением времени после рождения. Гормональная регуляция включает РААС систему, вазопрессин, предсердный натрийуретический фактор, местный сосудистый метаболизм арахидоновой кислоты и эндотелиальный синтез многих вазоактивных веществ.
 НОМЕНКЛАТУРА & КЛАССИФИКАЦИЯ ВПС
НОМЕНКЛАТУРА & КЛАССИФИКАЦИЯ ВПС
 Общее распределение ВПС по частоте встречаемости Порок ● ● ● ● ● Дефект межжелудочковой перегородки Дефект межпредсердной перегородки Открытый артериальный проток Коарктация аорты Врожденный аортальный стеноз Тетрада Фалло Легочный стеноз ТМС Легочная атрезия (с ДМЖП, без ДМЖП) Атриовентрикулярный септальный дефект Атрезия трикуспидального клапана Общий артериальный ствол Тотальный аномальный дренаж легочных вен Синдром гипоплазии левого сердца Перерыв дуги аорты Аномалия Эбштейна Митральный стеноз Аорто-легочное открытое окно Частота 20% 10% 10% 10% 5 -8% 5% 2 -5% 3% 3% 2% 2% 1% 0, 5% редко
Общее распределение ВПС по частоте встречаемости Порок ● ● ● ● ● Дефект межжелудочковой перегородки Дефект межпредсердной перегородки Открытый артериальный проток Коарктация аорты Врожденный аортальный стеноз Тетрада Фалло Легочный стеноз ТМС Легочная атрезия (с ДМЖП, без ДМЖП) Атриовентрикулярный септальный дефект Атрезия трикуспидального клапана Общий артериальный ствол Тотальный аномальный дренаж легочных вен Синдром гипоплазии левого сердца Перерыв дуги аорты Аномалия Эбштейна Митральный стеноз Аорто-легочное открытое окно Частота 20% 10% 10% 10% 5 -8% 5% 2 -5% 3% 3% 2% 2% 1% 0, 5% редко
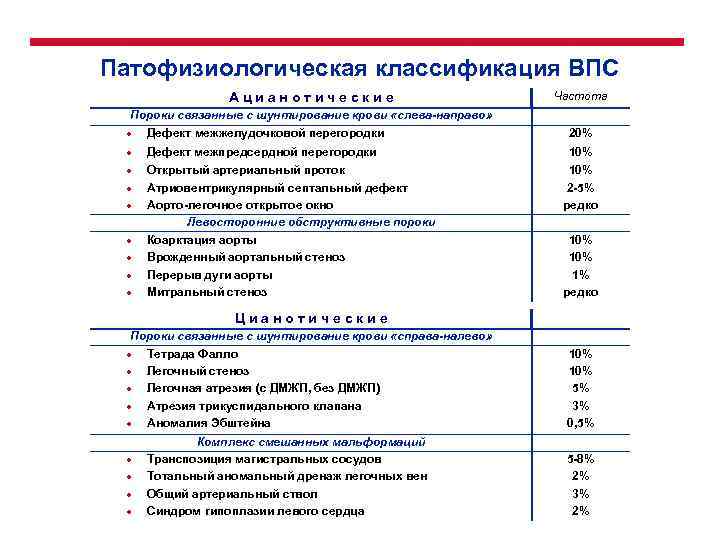 Патофизиологическая классификация ВПС Ацианотические Частота Пороки связанные с шунтирование крови «слева-направо» ● Дефект межжелудочковой перегородки 20% ● Дефект межпредсердной перегородки ● Открытый артериальный проток Атриовентрикулярный септальный дефект Аорто-легочное открытое окно Левосторонние обструктивные пороки Коарктация аорты Врожденный аортальный стеноз Перерыв дуги аорты Митральный стеноз ● ● ● 10% 2 -5% редко 10% 1% редко Цианотические Пороки связанные с шунтирование крови «справа-налево» ● Тетрада Фалло ● Легочный стеноз ● Легочная атрезия (с ДМЖП, без ДМЖП) ● Атрезия трикуспидального клапана ● Аномалия Эбштейна ● ● Комплекс смешанных мальформаций Транспозиция магистральных сосудов Тотальный аномальный дренаж легочных вен Общий артериальный ствол Синдром гипоплазии левого сердца 10% 5% 3% 0, 5% 5 -8% 2% 3% 2%
Патофизиологическая классификация ВПС Ацианотические Частота Пороки связанные с шунтирование крови «слева-направо» ● Дефект межжелудочковой перегородки 20% ● Дефект межпредсердной перегородки ● Открытый артериальный проток Атриовентрикулярный септальный дефект Аорто-легочное открытое окно Левосторонние обструктивные пороки Коарктация аорты Врожденный аортальный стеноз Перерыв дуги аорты Митральный стеноз ● ● ● 10% 2 -5% редко 10% 1% редко Цианотические Пороки связанные с шунтирование крови «справа-налево» ● Тетрада Фалло ● Легочный стеноз ● Легочная атрезия (с ДМЖП, без ДМЖП) ● Атрезия трикуспидального клапана ● Аномалия Эбштейна ● ● Комплекс смешанных мальформаций Транспозиция магистральных сосудов Тотальный аномальный дренаж легочных вен Общий артериальный ствол Синдром гипоплазии левого сердца 10% 5% 3% 0, 5% 5 -8% 2% 3% 2%
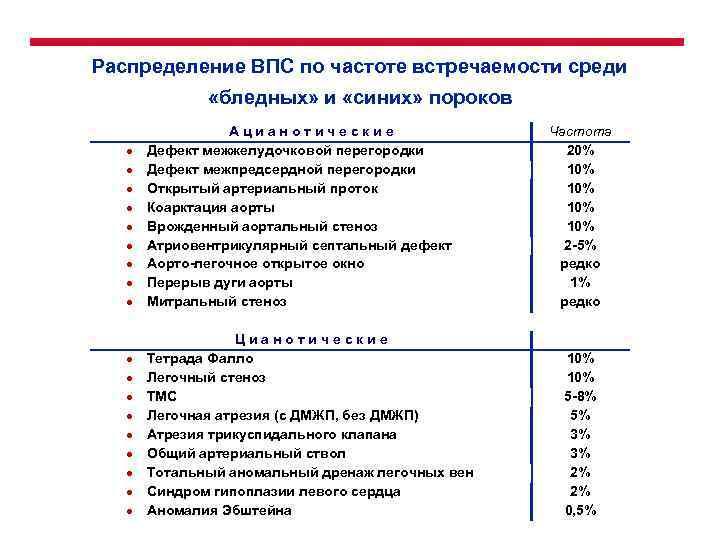 Распределение ВПС по частоте встречаемости среди «бледных» и «синих» пороков ● ● ● ● ● Ацианотические Дефект межжелудочковой перегородки Дефект межпредсердной перегородки Открытый артериальный проток Коарктация аорты Врожденный аортальный стеноз Атриовентрикулярный септальный дефект Аорто-легочное открытое окно Перерыв дуги аорты Митральный стеноз Цианотические Тетрада Фалло Легочный стеноз ТМС Легочная атрезия (с ДМЖП, без ДМЖП) Атрезия трикуспидального клапана Общий артериальный ствол Тотальный аномальный дренаж легочных вен Синдром гипоплазии левого сердца Аномалия Эбштейна Частота 20% 10% 10% 2 -5% редко 10% 10% 5 -8% 5% 3% 3% 2% 2% 0, 5%
Распределение ВПС по частоте встречаемости среди «бледных» и «синих» пороков ● ● ● ● ● Ацианотические Дефект межжелудочковой перегородки Дефект межпредсердной перегородки Открытый артериальный проток Коарктация аорты Врожденный аортальный стеноз Атриовентрикулярный септальный дефект Аорто-легочное открытое окно Перерыв дуги аорты Митральный стеноз Цианотические Тетрада Фалло Легочный стеноз ТМС Легочная атрезия (с ДМЖП, без ДМЖП) Атрезия трикуспидального клапана Общий артериальный ствол Тотальный аномальный дренаж легочных вен Синдром гипоплазии левого сердца Аномалия Эбштейна Частота 20% 10% 10% 2 -5% редко 10% 10% 5 -8% 5% 3% 3% 2% 2% 0, 5%
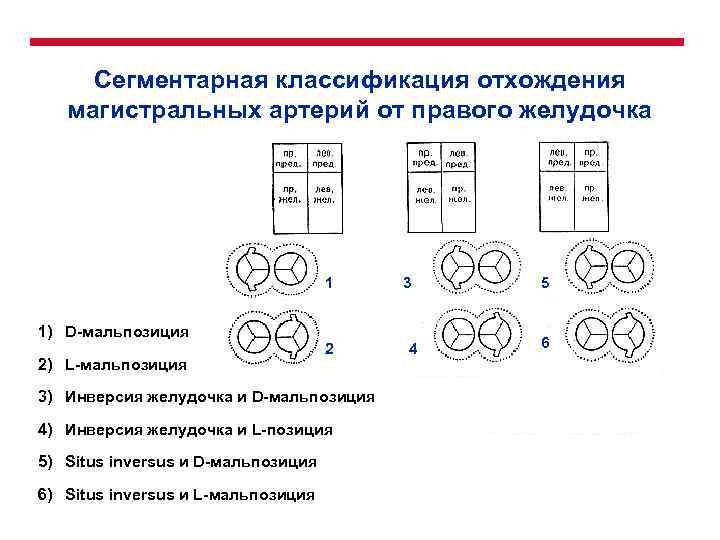 Сегментарная классификация отхождения магистральных артерий от правого желудочка 1 3 1) D-мальпозиция 2) L-мальпозиция 2 3) Инверсия желудочка и D-мальпозиция 4) Инверсия желудочка и L-позиция 5) Situs inversus и D-мальпозиция 6) Situs inversus и L-мальпозиция 4 5 6
Сегментарная классификация отхождения магистральных артерий от правого желудочка 1 3 1) D-мальпозиция 2) L-мальпозиция 2 3) Инверсия желудочка и D-мальпозиция 4) Инверсия желудочка и L-позиция 5) Situs inversus и D-мальпозиция 6) Situs inversus и L-мальпозиция 4 5 6
 ПРЕДОПЕРАЦИОННОЕ О БСЛЕДОВАНИЕ
ПРЕДОПЕРАЦИОННОЕ О БСЛЕДОВАНИЕ
 ПРЕДОПЕРАЦИОННОЕ ОБСЛЕДОВАНИЕ • • • Анамнез Общий осмотр Рентгенография Электрокардиография Эхокардиография Дополнительные методы: • Зондирование полостей сердца и ангиокардиография • Магнитно-резонансная томография и мультиспиральная компьютерная томография • Электрофизиологическое исследование
ПРЕДОПЕРАЦИОННОЕ ОБСЛЕДОВАНИЕ • • • Анамнез Общий осмотр Рентгенография Электрокардиография Эхокардиография Дополнительные методы: • Зондирование полостей сердца и ангиокардиография • Магнитно-резонансная томография и мультиспиральная компьютерная томография • Электрофизиологическое исследование
 Анамнез · Шум (с какого возраста выслушивается, динамика) · Одышка (с какого возраста, в покое/при нагрузке) · Нарушения аппетита · Повышенная потливость · Толерантность к физической нагрузке · Потери сознания (провоцирующие факторы) · Цианоз (с какого возраста, локализация, динамика, триггеры, ОЦП, infant angina) · Качество жизни (социальный коэффициент – SQ) · Течение беременности (принимаемые лекарства, инфекции, течение, осложнения, асфиксия по Апгар) · Семейная наследственность (ВПС в семье и др. ) · Принимаемые пациентом лекарства · Эффективность консервативной терапии
Анамнез · Шум (с какого возраста выслушивается, динамика) · Одышка (с какого возраста, в покое/при нагрузке) · Нарушения аппетита · Повышенная потливость · Толерантность к физической нагрузке · Потери сознания (провоцирующие факторы) · Цианоз (с какого возраста, локализация, динамика, триггеры, ОЦП, infant angina) · Качество жизни (социальный коэффициент – SQ) · Течение беременности (принимаемые лекарства, инфекции, течение, осложнения, асфиксия по Апгар) · Семейная наследственность (ВПС в семье и др. ) · Принимаемые пациентом лекарства · Эффективность консервативной терапии
 Общий осмотр · Измерение веса, длины тела, вычисление BSA (расчетные диаметры клапанов сердца по Кирклину и Ройлату) · Оценка физического развития (центильные шкалы, степень гипотрофии, тип дистрофии) · Выявление отеков и деформаций грудной клетки · Фенотипические признаки наследственных синдромов · Пальпация (характеристики пульса, прекардиальное дрожание, увеличение печени и селезенки и др. ) · Измерение артериального давления на руках и ногах · Перкуссия (относительная и абсолютная сердечная тупость, размеры печени, селезенки) · Выявление патогномоничных аускультативных признаков ВПС ( акцент II тона над легочной артерией при легочной гипертензии, нежный систолический шум при ДМПП, грубый пансистолический шум при ДМЖП, диастолический шум в точке Боткина-Эрба при аортальной недостаточности, систоло-диастолический шум при ОАП и БАЛК на спине и др. ).
Общий осмотр · Измерение веса, длины тела, вычисление BSA (расчетные диаметры клапанов сердца по Кирклину и Ройлату) · Оценка физического развития (центильные шкалы, степень гипотрофии, тип дистрофии) · Выявление отеков и деформаций грудной клетки · Фенотипические признаки наследственных синдромов · Пальпация (характеристики пульса, прекардиальное дрожание, увеличение печени и селезенки и др. ) · Измерение артериального давления на руках и ногах · Перкуссия (относительная и абсолютная сердечная тупость, размеры печени, селезенки) · Выявление патогномоничных аускультативных признаков ВПС ( акцент II тона над легочной артерией при легочной гипертензии, нежный систолический шум при ДМПП, грубый пансистолический шум при ДМЖП, диастолический шум в точке Боткина-Эрба при аортальной недостаточности, систоло-диастолический шум при ОАП и БАЛК на спине и др. ).
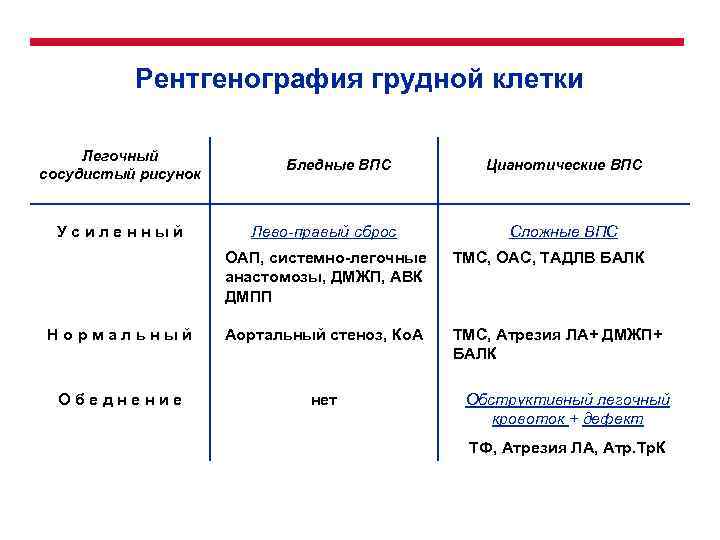 Рентгенография грудной клетки Легочный сосудистый рисунок Усиленный Бледные ВПС Лево-правый сброс Цианотические ВПС Сложные ВПС ОАП, системно-легочные анастомозы, ДМЖП, АВК ДМПП ТМС, ОАС, ТАДЛВ БАЛК Нормальный Аортальный стеноз, Ко. А ТМС, Атрезия ЛА+ ДМЖП+ БАЛК Обеднение нет Обструктивный легочный кровоток + дефект ТФ, Атрезия ЛА, Атр. Тр. К
Рентгенография грудной клетки Легочный сосудистый рисунок Усиленный Бледные ВПС Лево-правый сброс Цианотические ВПС Сложные ВПС ОАП, системно-легочные анастомозы, ДМЖП, АВК ДМПП ТМС, ОАС, ТАДЛВ БАЛК Нормальный Аортальный стеноз, Ко. А ТМС, Атрезия ЛА+ ДМЖП+ БАЛК Обеднение нет Обструктивный легочный кровоток + дефект ТФ, Атрезия ЛА, Атр. Тр. К
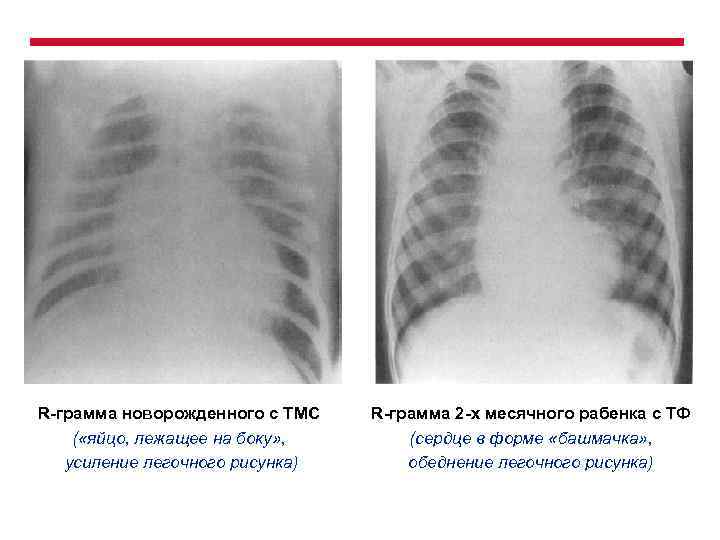 R-грамма новорожденного с ТМС ( «яйцо, лежащее на боку» , усиление легочного рисунка) R-грамма 2 -х месячного рабенка с ТФ (сердце в форме «башмачка» , обеднение легочного рисунка)
R-грамма новорожденного с ТМС ( «яйцо, лежащее на боку» , усиление легочного рисунка) R-грамма 2 -х месячного рабенка с ТФ (сердце в форме «башмачка» , обеднение легочного рисунка)
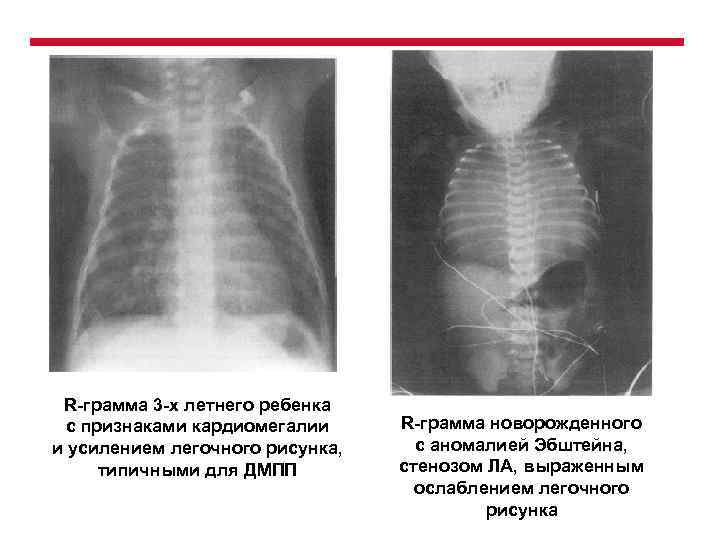 R-грамма 3 -х летнего ребенка с признаками кардиомегалии и усилением легочного рисунка, типичными для ДМПП R-грамма новорожденного с аномалией Эбштейна, стенозом ЛА, выраженным ослаблением легочного рисунка
R-грамма 3 -х летнего ребенка с признаками кардиомегалии и усилением легочного рисунка, типичными для ДМПП R-грамма новорожденного с аномалией Эбштейна, стенозом ЛА, выраженным ослаблением легочного рисунка
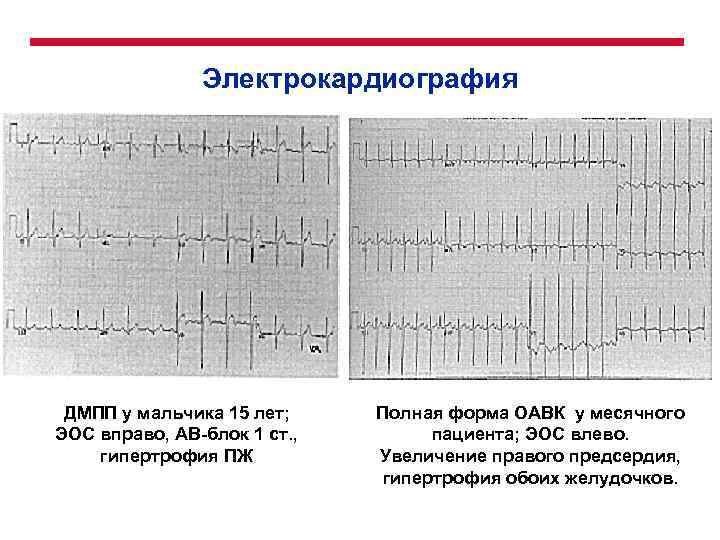 Электрокардиография ДМПП у мальчика 15 лет; ЭОС вправо, АВ-блок 1 ст. , гипертрофия ПЖ Полная форма ОАВК у месячного пациента; ЭОС влево. Увеличение правого предсердия, гипертрофия обоих желудочков.
Электрокардиография ДМПП у мальчика 15 лет; ЭОС вправо, АВ-блок 1 ст. , гипертрофия ПЖ Полная форма ОАВК у месячного пациента; ЭОС влево. Увеличение правого предсердия, гипертрофия обоих желудочков.
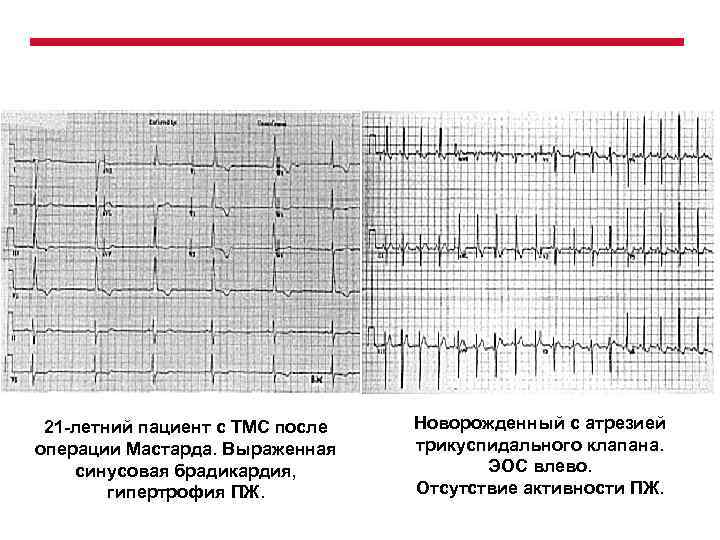 21 -летний пациент с ТМС после операции Мастарда. Выраженная синусовая брадикардия, гипертрофия ПЖ. Новорожденный с атрезией трикуспидального клапана. ЭОС влево. Отсутствие активности ПЖ.
21 -летний пациент с ТМС после операции Мастарда. Выраженная синусовая брадикардия, гипертрофия ПЖ. Новорожденный с атрезией трикуспидального клапана. ЭОС влево. Отсутствие активности ПЖ.
 Эхокардиография Применяют трансторакальную и чрезпищеводную Эхо КГ Режимы Эхо КГ: · двухмерный (изучение анатомии ВПС) · цветной допплеровский (изучение гемодинамических синдромов – сбросов и шлюзов) · М – режим (изучение функции сердца)
Эхокардиография Применяют трансторакальную и чрезпищеводную Эхо КГ Режимы Эхо КГ: · двухмерный (изучение анатомии ВПС) · цветной допплеровский (изучение гемодинамических синдромов – сбросов и шлюзов) · М – режим (изучение функции сердца)
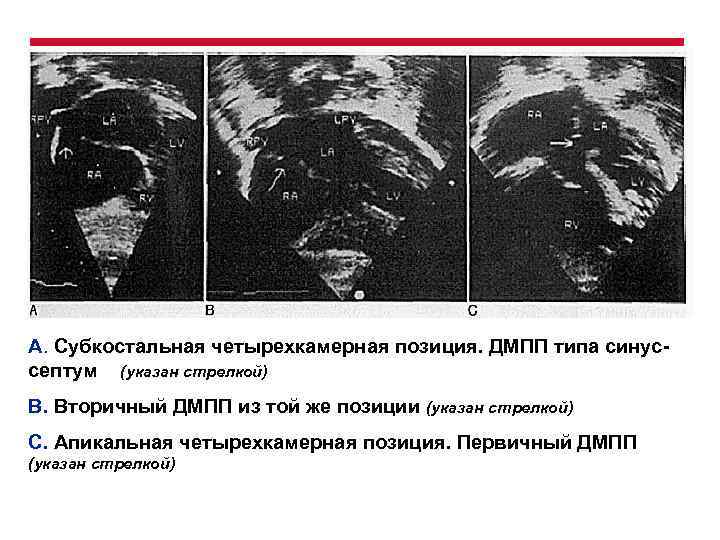 А. Субкостальная четырехкамерная позиция. ДМПП типа синуссептум (указан стрелкой) В. Вторичный ДМПП из той же позиции (указан стрелкой) С. Апикальная четырехкамерная позиция. Первичный ДМПП (указан стрелкой)
А. Субкостальная четырехкамерная позиция. ДМПП типа синуссептум (указан стрелкой) В. Вторичный ДМПП из той же позиции (указан стрелкой) С. Апикальная четырехкамерная позиция. Первичный ДМПП (указан стрелкой)
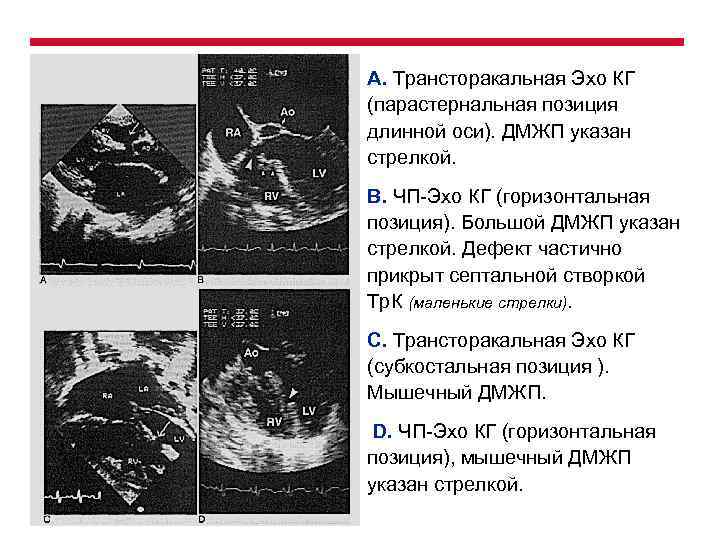 А. Трансторакальная Эхо КГ (парастернальная позиция длинной оси). ДМЖП указан стрелкой. В. ЧП-Эхо КГ (горизонтальная позиция). Большой ДМЖП указан стрелкой. Дефект частично прикрыт септальной створкой Тр. К (маленькие стрелки). С. Трансторакальная Эхо КГ (субкостальная позиция ). Мышечный ДМЖП. D. ЧП-Эхо КГ (горизонтальная позиция), мышечный ДМЖП указан стрелкой.
А. Трансторакальная Эхо КГ (парастернальная позиция длинной оси). ДМЖП указан стрелкой. В. ЧП-Эхо КГ (горизонтальная позиция). Большой ДМЖП указан стрелкой. Дефект частично прикрыт септальной створкой Тр. К (маленькие стрелки). С. Трансторакальная Эхо КГ (субкостальная позиция ). Мышечный ДМЖП. D. ЧП-Эхо КГ (горизонтальная позиция), мышечный ДМЖП указан стрелкой.
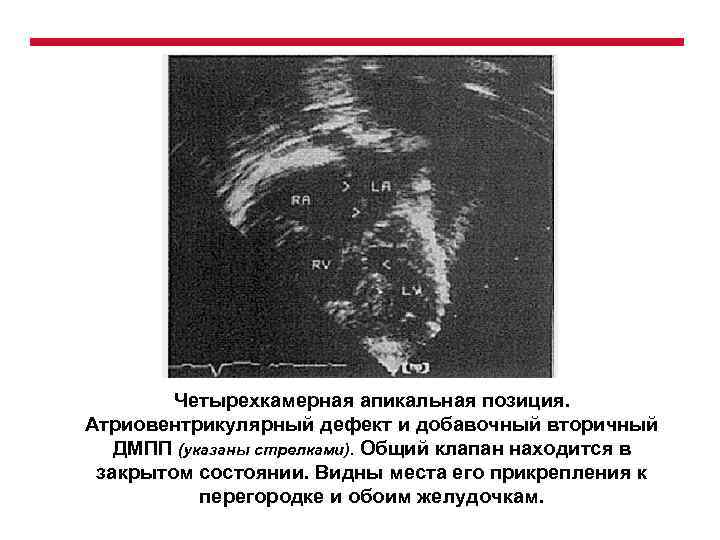 Четырехкамерная апикальная позиция. Атриовентрикулярный дефект и добавочный вторичный ДМПП (указаны стрелками). Общий клапан находится в закрытом состоянии. Видны места его прикрепления к перегородке и обоим желудочкам.
Четырехкамерная апикальная позиция. Атриовентрикулярный дефект и добавочный вторичный ДМПП (указаны стрелками). Общий клапан находится в закрытом состоянии. Видны места его прикрепления к перегородке и обоим желудочкам.
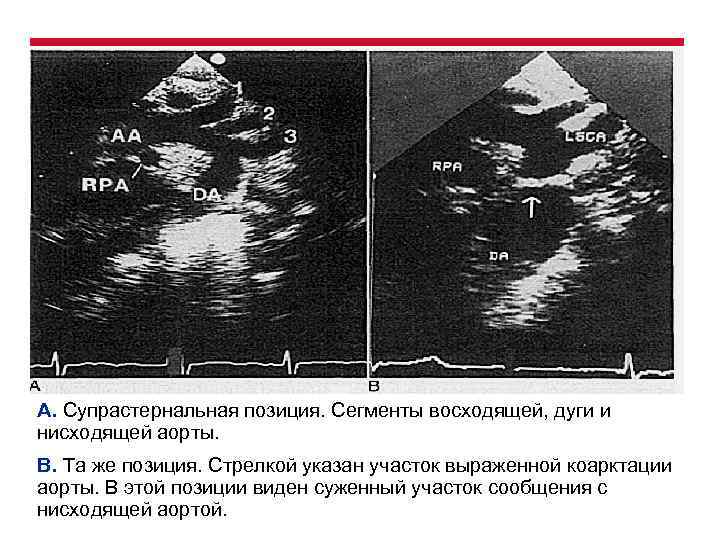 А. Супрастернальная позиция. Сегменты восходящей, дуги и нисходящей аорты. В. Та же позиция. Стрелкой указан участок выраженной коарктации аорты. В этой позиции виден суженный участок сообщения с нисходящей аортой.
А. Супрастернальная позиция. Сегменты восходящей, дуги и нисходящей аорты. В. Та же позиция. Стрелкой указан участок выраженной коарктации аорты. В этой позиции виден суженный участок сообщения с нисходящей аортой.
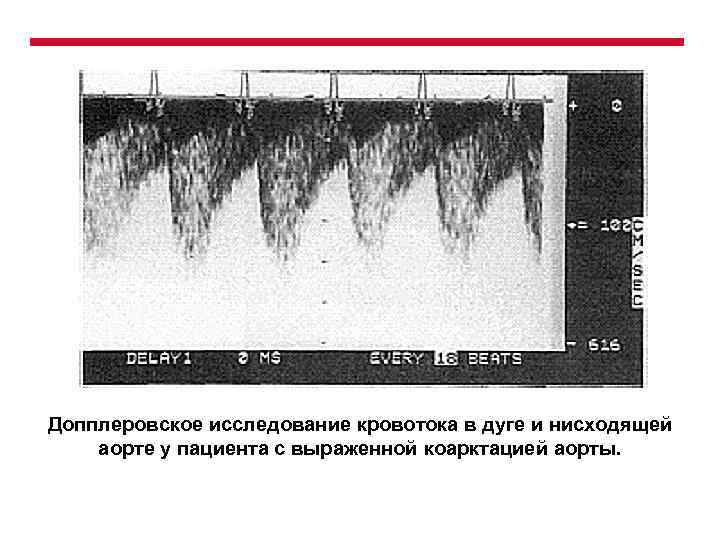 Допплеровское исследование кровотока в дуге и нисходящей аорте у пациента с выраженной коарктацией аорты.
Допплеровское исследование кровотока в дуге и нисходящей аорте у пациента с выраженной коарктацией аорты.
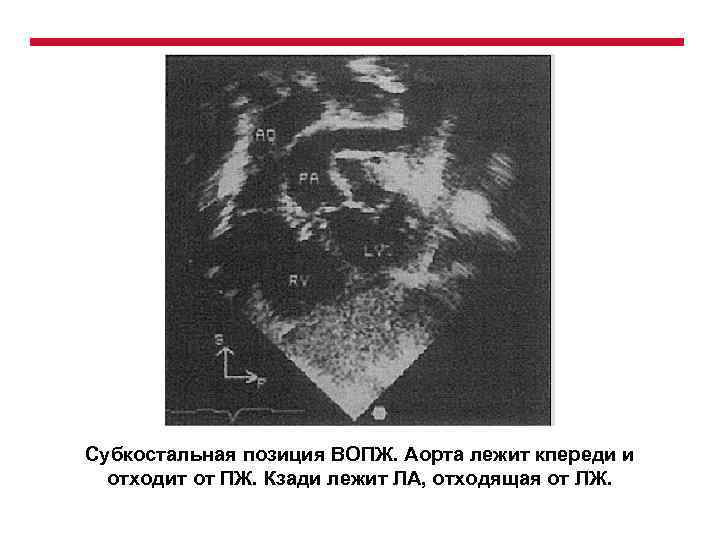 Субкостальная позиция ВОПЖ. Аорта лежит кпереди и отходит от ПЖ. Кзади лежит ЛА, отходящая от ЛЖ.
Субкостальная позиция ВОПЖ. Аорта лежит кпереди и отходит от ПЖ. Кзади лежит ЛА, отходящая от ЛЖ.
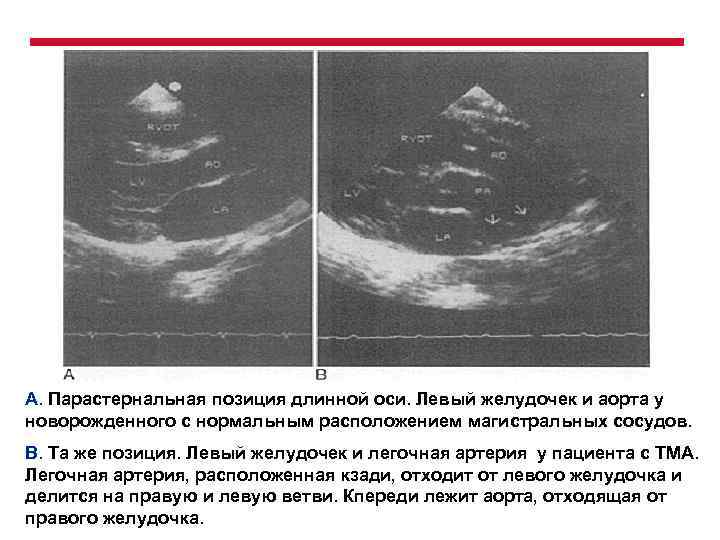 А. Парастернальная позиция длинной оси. Левый желудочек и аорта у новорожденного с нормальным расположением магистральных сосудов. В. Та же позиция. Левый желудочек и легочная артерия у пациента с ТМА. Легочная артерия, расположенная кзади, отходит от левого желудочка и делится на правую и левую ветви. Кпереди лежит аорта, отходящая от правого желудочка.
А. Парастернальная позиция длинной оси. Левый желудочек и аорта у новорожденного с нормальным расположением магистральных сосудов. В. Та же позиция. Левый желудочек и легочная артерия у пациента с ТМА. Легочная артерия, расположенная кзади, отходит от левого желудочка и делится на правую и левую ветви. Кпереди лежит аорта, отходящая от правого желудочка.
 ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА
ВРОЖДЕННЫЕ ПОРОКИ СЕРДЦА
 Открытый артериальный проток 1. 5 -10% от всех ВПС, 1/2000 новорожденных 2. Вдвое чаще у девочек 3. Факторы риска: Гипоксия, РДС, краснуха в первом триместре беременности, другой сопутствующий ВПС, наследственные факторы, проживание в высокогорных районах, малый гестационный возраст (30 нед ~ 30%, 28 -30 нед ~ 80%)
Открытый артериальный проток 1. 5 -10% от всех ВПС, 1/2000 новорожденных 2. Вдвое чаще у девочек 3. Факторы риска: Гипоксия, РДС, краснуха в первом триместре беременности, другой сопутствующий ВПС, наследственные факторы, проживание в высокогорных районах, малый гестационный возраст (30 нед ~ 30%, 28 -30 нед ~ 80%)
 Открытый артериальный проток l Естественное течение l l l Является производным 6 левой аортальной дуги Диаметр эквивалентен диаметру нисходящей аорты Анатомически является продолжением ствола ЛА и впадает в нисходящую аорту на несколько миллиметров ниже отхождения левой подкючичной артерии Стенка содержит гладкомышечные волокна, чувствительные к простагландинам (вазадилатация) и кислороду (вазаконстрикция) Вследствие высокого легочного сосудистого сопротивления большая часть выброса правого желудочка через АП направляется в нисходящую аорту Закрытие АП после рождения происходит вследствие: – увеличения напряжения кислорода с началом дыхания, что приводит к увеличению синтеза АТФ и сокращению гладкомышечных волокон в стенке АП – уменьшения уровня эндогенных и плацентарных простагландинов – изменение уровня гистамина, ацетилхолина, брадикинина, катехоламинов
Открытый артериальный проток l Естественное течение l l l Является производным 6 левой аортальной дуги Диаметр эквивалентен диаметру нисходящей аорты Анатомически является продолжением ствола ЛА и впадает в нисходящую аорту на несколько миллиметров ниже отхождения левой подкючичной артерии Стенка содержит гладкомышечные волокна, чувствительные к простагландинам (вазадилатация) и кислороду (вазаконстрикция) Вследствие высокого легочного сосудистого сопротивления большая часть выброса правого желудочка через АП направляется в нисходящую аорту Закрытие АП после рождения происходит вследствие: – увеличения напряжения кислорода с началом дыхания, что приводит к увеличению синтеза АТФ и сокращению гладкомышечных волокон в стенке АП – уменьшения уровня эндогенных и плацентарных простагландинов – изменение уровня гистамина, ацетилхолина, брадикинина, катехоламинов
 Открытый артериальный проток l Естественное течение l l l Спонтанное закрытие редко у доношенных детей и чаще у недоношенных Бактериальный эндокардит возникает главным образом у больных с ОАП небольшого размера Частые легочные инфекции Повреждение эндотелия легочных сосудов вследствие усиленного кровотока приводит к развитию легочной гипертензии, в течении 1 года возможно развитие синдрома Эйзенменгера Выраженная сердечная недостаточность является причиной смерти 30% больных с нелеченным ОАП. Сердечная недостаточность, вызванная наличием ОАП среднего размера является причиной смерти больных на 3 -4 декаде жизни
Открытый артериальный проток l Естественное течение l l l Спонтанное закрытие редко у доношенных детей и чаще у недоношенных Бактериальный эндокардит возникает главным образом у больных с ОАП небольшого размера Частые легочные инфекции Повреждение эндотелия легочных сосудов вследствие усиленного кровотока приводит к развитию легочной гипертензии, в течении 1 года возможно развитие синдрома Эйзенменгера Выраженная сердечная недостаточность является причиной смерти 30% больных с нелеченным ОАП. Сердечная недостаточность, вызванная наличием ОАП среднего размера является причиной смерти больных на 3 -4 декаде жизни
 Открытый артериальный проток l Клинические проявления l l Зависят от размера ОАП и легочного сосудистого сопротивления – ОАП небольшого размера могут выявляться случайно – Симптомы сердечной недостаточности, частые легочные инфекции, проявления бактериального эндокардита – Вследствие снижения легочного сосудистого сопротивления после рождения, ОАП большого размера могут приводить к отеку легких – Синдром фетальной циркуляции Диагностика l l Усиленный сердечный толчок, прекардиальное дрожание, быстрый, высокий пульс, переферические тоны, систолодиастолический шум 2 -3 м/р слева, гепатомегалия ЭКГ, рентгенография, ЭХО-кардиоскопия
Открытый артериальный проток l Клинические проявления l l Зависят от размера ОАП и легочного сосудистого сопротивления – ОАП небольшого размера могут выявляться случайно – Симптомы сердечной недостаточности, частые легочные инфекции, проявления бактериального эндокардита – Вследствие снижения легочного сосудистого сопротивления после рождения, ОАП большого размера могут приводить к отеку легких – Синдром фетальной циркуляции Диагностика l l Усиленный сердечный толчок, прекардиальное дрожание, быстрый, высокий пульс, переферические тоны, систолодиастолический шум 2 -3 м/р слева, гепатомегалия ЭКГ, рентгенография, ЭХО-кардиоскопия
 Открытый артериальный проток l Тактика ведения l l l Недоношенные дети: индометацин 0, 1 -0, 2 mg/kg каждые 12 -24 часа 1 -3 раза (противопоказания: нарушение функции почек, гипербилирубинемия, нарушения системы свертывания крови) Недоношенные дети с небольшим ОАП без клинических проявлений сердечной недостаточности могут вестись симптоматически Если есть противопоказания или индометацин не эффективен при наличии признаков выраженной сердечной недостаточности показано хирургическое закрытие (эндоваскулярная баталлоокклюзия, торакоскопия-окклюзия, открытая операция) 88% самостоятельное закрытие в течении 8 недель, дети старше 3 мес выборочно, при наличии признаков сердечной недостаточности или бактериального эндокардита – хирургическое закрытие Противопоказания: высокая легочная гипертензия с обратным сбросом Результаты l l Хирургическая летальность менее 1%, обусловленная высоким риском операции у взрослых больных с высокой ЛГ и хронической сердечной недостаточностью Реканализация ОАП при: – перевязке ОАП 4 -23% – пересечение ОАП 0% – торакоскопическое закрытие ОАП 0 -16% – зндоваскулярное закрытие 0 -20%
Открытый артериальный проток l Тактика ведения l l l Недоношенные дети: индометацин 0, 1 -0, 2 mg/kg каждые 12 -24 часа 1 -3 раза (противопоказания: нарушение функции почек, гипербилирубинемия, нарушения системы свертывания крови) Недоношенные дети с небольшим ОАП без клинических проявлений сердечной недостаточности могут вестись симптоматически Если есть противопоказания или индометацин не эффективен при наличии признаков выраженной сердечной недостаточности показано хирургическое закрытие (эндоваскулярная баталлоокклюзия, торакоскопия-окклюзия, открытая операция) 88% самостоятельное закрытие в течении 8 недель, дети старше 3 мес выборочно, при наличии признаков сердечной недостаточности или бактериального эндокардита – хирургическое закрытие Противопоказания: высокая легочная гипертензия с обратным сбросом Результаты l l Хирургическая летальность менее 1%, обусловленная высоким риском операции у взрослых больных с высокой ЛГ и хронической сердечной недостаточностью Реканализация ОАП при: – перевязке ОАП 4 -23% – пересечение ОАП 0% – торакоскопическое закрытие ОАП 0 -16% – зндоваскулярное закрытие 0 -20%
 Дефект межпредсердной перегородки l 10 -15% от всех ВПС, 1/1500 новорожденных l Вдвое чаще у девочек l Наиболее часто встречающийся ВПС у взрослых l Первый порок сердца успешно оперированный в условиях ИК
Дефект межпредсердной перегородки l 10 -15% от всех ВПС, 1/1500 новорожденных l Вдвое чаще у девочек l Наиболее часто встречающийся ВПС у взрослых l Первый порок сердца успешно оперированный в условиях ИК
 Дефект межпредсердной перегородки l Классификация l Общее предсердие l Дефект коронарного синуса l Открытое овальное окно (у 20% клинически здоровых людей) l Межпредсердный дефект первичного типа l Межпредсердный дефект вторичного типа l Дефект венозного синуса
Дефект межпредсердной перегородки l Классификация l Общее предсердие l Дефект коронарного синуса l Открытое овальное окно (у 20% клинически здоровых людей) l Межпредсердный дефект первичного типа l Межпредсердный дефект вторичного типа l Дефект венозного синуса
 Дефект межпредсердной перегородки l Патофизиология и естественное течение l l Направление и объем сброса зависят от размера дефекта и комплайнса желудочков сердца – У новорожденных комплайнс правого и левого желудочка примерно равен, что может приводить в переменному сбросу – В течение первых недель жизни комплайнс ПЖ увеличивается, приводя к преимущественно лево-правому сбросу – МПД больших размеров приводит к выравниванию давления в правом и левом предсердиях, что может сопровождаться переменным сбросом Увеличенный легочный кровоток приводит к развитию легочной гипертензии, объемная перегрузка ЛЖ к развитию СН – давление в ЛА 50 мм. рт. ст. имеют 5 -8% детей и 25 -50% взрослых при средних размерах дефекта – Увеличение частоты аритмий и патологии митрального клапана с возрастом у не оперированных больных – Длительное существование порока приводит к развитию обратного сброса – Средняя продолжительность жизни у не оперированных больных 50 лет, причина смерти прогрессирующая сердечная недостаточность
Дефект межпредсердной перегородки l Патофизиология и естественное течение l l Направление и объем сброса зависят от размера дефекта и комплайнса желудочков сердца – У новорожденных комплайнс правого и левого желудочка примерно равен, что может приводить в переменному сбросу – В течение первых недель жизни комплайнс ПЖ увеличивается, приводя к преимущественно лево-правому сбросу – МПД больших размеров приводит к выравниванию давления в правом и левом предсердиях, что может сопровождаться переменным сбросом Увеличенный легочный кровоток приводит к развитию легочной гипертензии, объемная перегрузка ЛЖ к развитию СН – давление в ЛА 50 мм. рт. ст. имеют 5 -8% детей и 25 -50% взрослых при средних размерах дефекта – Увеличение частоты аритмий и патологии митрального клапана с возрастом у не оперированных больных – Длительное существование порока приводит к развитию обратного сброса – Средняя продолжительность жизни у не оперированных больных 50 лет, причина смерти прогрессирующая сердечная недостаточность
 Дефект межпредсердной перегородки l Клинические проявления l l Может протекать бессимптомно Повышенная утомляемость Симптомы сердечной недостаточности Диагностика l l Систолический шум вдоль левого края грудины обусловленный относительным легочным стенозом Средне-диастолический шум в области верхушки сердца обусловленный увеличенным потоком через трикуспидальный клапан Удвоение второго тона ЭКГ, рентгенография, ЭХО-кардиоскопия
Дефект межпредсердной перегородки l Клинические проявления l l Может протекать бессимптомно Повышенная утомляемость Симптомы сердечной недостаточности Диагностика l l Систолический шум вдоль левого края грудины обусловленный относительным легочным стенозом Средне-диастолический шум в области верхушки сердца обусловленный увеличенным потоком через трикуспидальный клапан Удвоение второго тона ЭКГ, рентгенография, ЭХО-кардиоскопия
 Дефект межпредсердной перегородки l Тактика ведения l l l Показания к хирургическому лечению – Qp/Qs 2/1 – Возраст 2 -3 года – Новорожденные с признаками сердечной недостаточности, не купируемыми медикаментозно – Взрослые больные с Qp/Qs 2 -1. 5/1 Противопоказание: высокое легочное сосудистое сопротивление (1/2 -2/3 от системного) Результаты l l Хирургическая летальность менее 1% Осложнения: аэроэмболия, наджелудочковые нарушения ритма, проводимости
Дефект межпредсердной перегородки l Тактика ведения l l l Показания к хирургическому лечению – Qp/Qs 2/1 – Возраст 2 -3 года – Новорожденные с признаками сердечной недостаточности, не купируемыми медикаментозно – Взрослые больные с Qp/Qs 2 -1. 5/1 Противопоказание: высокое легочное сосудистое сопротивление (1/2 -2/3 от системного) Результаты l l Хирургическая летальность менее 1% Осложнения: аэроэмболия, наджелудочковые нарушения ритма, проводимости
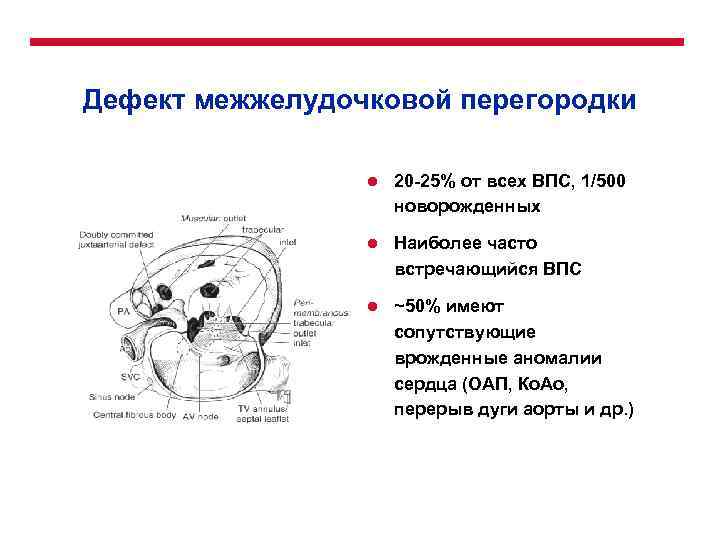 Дефект межжелудочковой перегородки l 20 -25% от всех ВПС, 1/500 новорожденных l Наиболее часто встречающийся ВПС l ~50% имеют сопутствующие врожденные аномалии сердца (ОАП, Ко. Ао, перерыв дуги аорты и др. )
Дефект межжелудочковой перегородки l 20 -25% от всех ВПС, 1/500 новорожденных l Наиболее часто встречающийся ВПС l ~50% имеют сопутствующие врожденные аномалии сердца (ОАП, Ко. Ао, перерыв дуги аорты и др. )
 Дефект межжелудочковой перегородки l Классификация (Robert Anderson) l Перимембранозный – Приточный – Отточный – Трабекулярный l Мышечный – Приточный – Отточный – Трабекулярный l Коммитированный, околоартериальный
Дефект межжелудочковой перегородки l Классификация (Robert Anderson) l Перимембранозный – Приточный – Отточный – Трабекулярный l Мышечный – Приточный – Отточный – Трабекулярный l Коммитированный, околоартериальный
 Дефект межжелудочковой перегородки l Патофизиология и естественное течение l l l l l Увеличенный легочный кровоток приводит к перегрузке левых отделов сердца, пролиферации интимы и гипертрофия медии легочных сосудов Изменения сосудов легких обратимы на ранних стадиях порока (зависит от обьема сброса) Прогрессирующее увеличение легочного сосудистого сопротивления сопровождается уменьшением симптомов сердечной недостаточности, дальнейшее увеличение сопротивления приводит к развитию синдрома Эйзенменгера (перемена сброса), обычно 1 -я декада жизни Развитие стеноза выходного тракта правого желудочка 5 -10%, что может предотвратить грубые изменения легочных сосудов Внесердечные осложнения естественного течения порока: кровохарканье, инфаркты головного мозга Развитие бактериального эндокардита более характерно для ДМЖП не большого размера Аортальная недостаточность 5% (субаортальная локализация дефекта) Летальность в течение 1 года жизни 9% Средняя продолжительность жизни у не оперированных больных 35 лет
Дефект межжелудочковой перегородки l Патофизиология и естественное течение l l l l l Увеличенный легочный кровоток приводит к перегрузке левых отделов сердца, пролиферации интимы и гипертрофия медии легочных сосудов Изменения сосудов легких обратимы на ранних стадиях порока (зависит от обьема сброса) Прогрессирующее увеличение легочного сосудистого сопротивления сопровождается уменьшением симптомов сердечной недостаточности, дальнейшее увеличение сопротивления приводит к развитию синдрома Эйзенменгера (перемена сброса), обычно 1 -я декада жизни Развитие стеноза выходного тракта правого желудочка 5 -10%, что может предотвратить грубые изменения легочных сосудов Внесердечные осложнения естественного течения порока: кровохарканье, инфаркты головного мозга Развитие бактериального эндокардита более характерно для ДМЖП не большого размера Аортальная недостаточность 5% (субаортальная локализация дефекта) Летальность в течение 1 года жизни 9% Средняя продолжительность жизни у не оперированных больных 35 лет
 Дефект межжелудочковой перегородки l Клинические проявления l Одышка, частые легочные инфекции l Симптомы прогрессирующей сердечной недостаточности l l У новорожденных с большим ДМЖП симптомы сердечной недостаточности прогрессируют с уменьшением легочного сосудистого сопротивления Диагностика l l Прекардиальное дрожжание, грубый систолический шум, диастолический шум на верхушке (усиленный поток через митральный клапан), усиленный 2 тон ЭКГ, рентгенография, ЭХО-кардиоскопия
Дефект межжелудочковой перегородки l Клинические проявления l Одышка, частые легочные инфекции l Симптомы прогрессирующей сердечной недостаточности l l У новорожденных с большим ДМЖП симптомы сердечной недостаточности прогрессируют с уменьшением легочного сосудистого сопротивления Диагностика l l Прекардиальное дрожжание, грубый систолический шум, диастолический шум на верхушке (усиленный поток через митральный клапан), усиленный 2 тон ЭКГ, рентгенография, ЭХО-кардиоскопия
 Дефект межжелудочковой перегородки l Тактика ведения l l l Маленькие дефекты перимембранозной и мышечной локализации, с бессимптомным течением или медикаментозно купированными проявлениями сердечной недостаточности, Qp/Qs не превышающим 2/1 и легочным сосудистым сопротивлением менее 4 ед/м 2 наблюдаются до 3 лет (возможность самопроизвольного закрытия) Новорожденные дети с большим ДМЖП и некупируемыми симптомами сердечной недостаточности оперируются до 3 мес. Медикаментозная терапия эффективна – хирургическое лечение откладывается до 6 мес и выполняется в этом возрасте, если легочное сосудистое сопротивление ≥ 4 ед/м 2. , или Qp/Qs превышает 2/1 Субаортальные дефекты закрываются всем больным в возрасте до 34 лет (опасность развития аортальной недостаточности) Наличие таких сопутствующих аномалий как: верхом-сидящй трикуспидальный клапан, множественные дефекты межжелудочковой перегородки типа «швейцарского сыра» должны оперироваться в раннем (до 6 мес) возрасте (суживание ЛА с последующей конверсией в одножелудочковый статус) Результаты l l l Хирургическая летальность при неосложненных формах менее 1% Множественные дефекты, сопутствующая патология 7% Осложнения: БПНПГ 34%, БПНПГ+БПВЛНПГ 8 -17%, резидуальный сброс 0, 7 -2%
Дефект межжелудочковой перегородки l Тактика ведения l l l Маленькие дефекты перимембранозной и мышечной локализации, с бессимптомным течением или медикаментозно купированными проявлениями сердечной недостаточности, Qp/Qs не превышающим 2/1 и легочным сосудистым сопротивлением менее 4 ед/м 2 наблюдаются до 3 лет (возможность самопроизвольного закрытия) Новорожденные дети с большим ДМЖП и некупируемыми симптомами сердечной недостаточности оперируются до 3 мес. Медикаментозная терапия эффективна – хирургическое лечение откладывается до 6 мес и выполняется в этом возрасте, если легочное сосудистое сопротивление ≥ 4 ед/м 2. , или Qp/Qs превышает 2/1 Субаортальные дефекты закрываются всем больным в возрасте до 34 лет (опасность развития аортальной недостаточности) Наличие таких сопутствующих аномалий как: верхом-сидящй трикуспидальный клапан, множественные дефекты межжелудочковой перегородки типа «швейцарского сыра» должны оперироваться в раннем (до 6 мес) возрасте (суживание ЛА с последующей конверсией в одножелудочковый статус) Результаты l l l Хирургическая летальность при неосложненных формах менее 1% Множественные дефекты, сопутствующая патология 7% Осложнения: БПНПГ 34%, БПНПГ+БПВЛНПГ 8 -17%, резидуальный сброс 0, 7 -2%
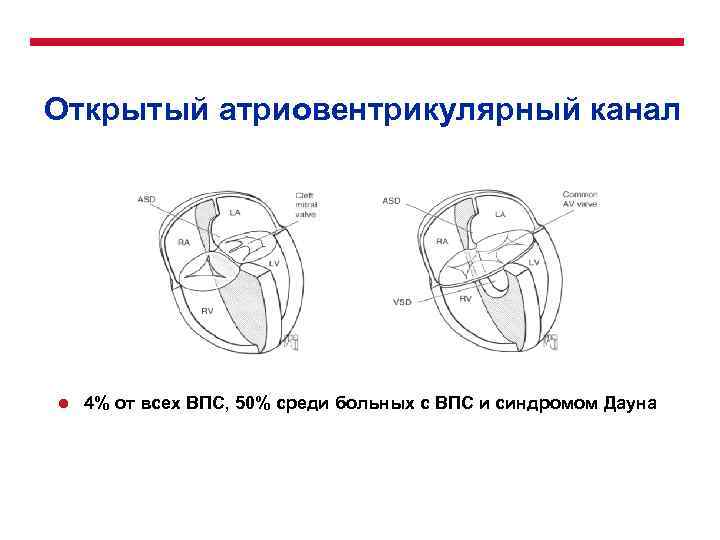 Открытый атриовентрикулярный канал l 4% от всех ВПС, 50% среди больных с ВПС и синдромом Дауна
Открытый атриовентрикулярный канал l 4% от всех ВПС, 50% среди больных с ВПС и синдромом Дауна
 Открытый атриовентрикулярный канал l Классификация l l Неполная форма Промежуточная форма Сопутствующие аномалии: l l l l Гипоплазия одного из желудочков сердца (несбалансированная форма) Тетрада Фалло Двойное отхождение магистральных сосудов Стеноз левого выводного тракта Множественные ДМЖП Двойное отверстие митрального клапана Единственная папиллярная мышца
Открытый атриовентрикулярный канал l Классификация l l Неполная форма Промежуточная форма Сопутствующие аномалии: l l l l Гипоплазия одного из желудочков сердца (несбалансированная форма) Тетрада Фалло Двойное отхождение магистральных сосудов Стеноз левого выводного тракта Множественные ДМЖП Двойное отверстие митрального клапана Единственная папиллярная мышца
 Открытый атриовентрикулярный канал l Патофизиология и естественное течение l l Увеличенный легочный кровоток При частичной форме гемодинамика аналогична большому МПД, в случае наличия значительной регургитации на левом a-v клапане увеличивается лево-правый сброс (кардиомегалия, прогрессирующая сердечная недостаточность) У больных с полной формой ОАВК большой объем сброса обуславливает развитие высокой легочной гипертензии с рождения Сочетание высокой легочной гипертензии, прогрессирующей сердечной недостаточности, которая усугубляется регургитацией на общем a-v клапане у больных с полной формой ОАВК, обуславливаю необходимость как можно более раннего хирургического лечения
Открытый атриовентрикулярный канал l Патофизиология и естественное течение l l Увеличенный легочный кровоток При частичной форме гемодинамика аналогична большому МПД, в случае наличия значительной регургитации на левом a-v клапане увеличивается лево-правый сброс (кардиомегалия, прогрессирующая сердечная недостаточность) У больных с полной формой ОАВК большой объем сброса обуславливает развитие высокой легочной гипертензии с рождения Сочетание высокой легочной гипертензии, прогрессирующей сердечной недостаточности, которая усугубляется регургитацией на общем a-v клапане у больных с полной формой ОАВК, обуславливаю необходимость как можно более раннего хирургического лечения
 Открытый атриовентрикулярный канал l Клинические проявления l l l Симптомы выраженной сердечной недостаточности, обычно наиболее выраженные с 2 -3 месяца жизни Систолический шум Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия – В т. ч. Исключение сопутствующих аномалий: несбалансированная форма ОАВК, единственная папиллярная мышца, множественные ДМЖП, двойное отверстие митрального клапана
Открытый атриовентрикулярный канал l Клинические проявления l l l Симптомы выраженной сердечной недостаточности, обычно наиболее выраженные с 2 -3 месяца жизни Систолический шум Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия – В т. ч. Исключение сопутствующих аномалий: несбалансированная форма ОАВК, единственная папиллярная мышца, множественные ДМЖП, двойное отверстие митрального клапана
 Открытый атриовентрикулярный канал l Тактика ведения l l Частичная форма – хирургическое лечение в 2 -4 года, при наличии выраженной митральной недостаточности или сопутствующим ВПС раньше Полная форма – 3 -6 мес. , старше 1 года – необратимые изменения сосудистого ложа легких Промежуточная форма – зависит от размера межжелудочкового сообщения Результаты l Хирургическая летальность 2 -5% l 5 -летняя выживаемость 94%, 40 -летняя 76%
Открытый атриовентрикулярный канал l Тактика ведения l l Частичная форма – хирургическое лечение в 2 -4 года, при наличии выраженной митральной недостаточности или сопутствующим ВПС раньше Полная форма – 3 -6 мес. , старше 1 года – необратимые изменения сосудистого ложа легких Промежуточная форма – зависит от размера межжелудочкового сообщения Результаты l Хирургическая летальность 2 -5% l 5 -летняя выживаемость 94%, 40 -летняя 76%
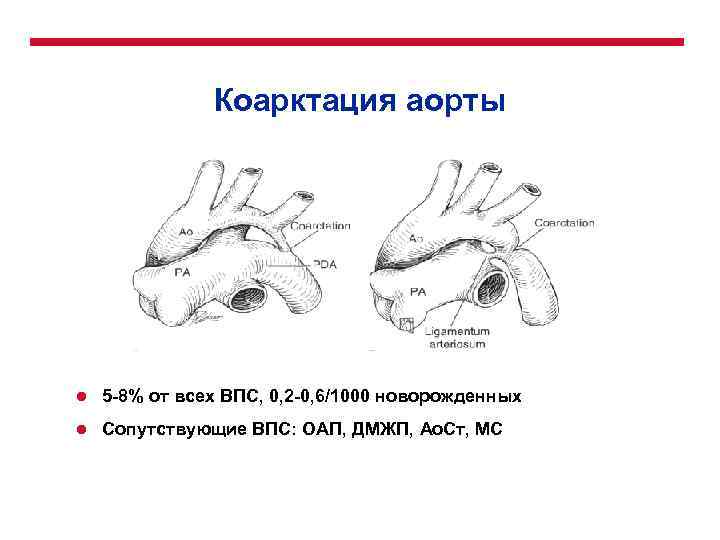 Коарктация аорты l 5 -8% от всех ВПС, 0, 2 -0, 6/1000 новорожденных l Сопутствующие ВПС: ОАП, ДМЖП, Ао. Ст, МС
Коарктация аорты l 5 -8% от всех ВПС, 0, 2 -0, 6/1000 новорожденных l Сопутствующие ВПС: ОАП, ДМЖП, Ао. Ст, МС
 Коарктация аорты l Классификация l l l Коарктация аорты, изолированная Коарктация аорты с дефектом межжелудочковой перегородки Коарктация аорты с другими внутрисердечными пороками l Инфантильный тип l Взрослый тип
Коарктация аорты l Классификация l l l Коарктация аорты, изолированная Коарктация аорты с дефектом межжелудочковой перегородки Коарктация аорты с другими внутрисердечными пороками l Инфантильный тип l Взрослый тип
 Коарктация аорты l Патофизиология и естественное течение l l Два типа естественного течения порока – 1 клинические симптомы появляются на первых неделях жизни у пациентов с дуктус-зависимым кровообращением нижней половины тела, если порок не был установлен до закрытия артериального протока – острая почечная недостаточность, ацидоз, вызванные острой ишемией органов, кровоснабжаемых из отделов аорты ниже коарктации – 2 бессимптомное течение порока в течении первых месяцев жизни, в дальнейшем артериальная гипертензия верхней половины тела и гипоперфузия нижней приводят к появлению жалоб на хромоту, носовые кровотечения, головные боли. Возможно развитие таких осложнений как аневризма Веллизиего круга, аневризма аорты, диссекция аорты, ускоренное развитие атеросклероза коронарных артерий с последующим ИМ Средняя продолжительность жизни 35 лет. Основные причины смерти: сердечная недостаточность 26%, бактериальный эндокардит 25%, разрыв аорты 21%, внутричерепное кровоизлияние 13%
Коарктация аорты l Патофизиология и естественное течение l l Два типа естественного течения порока – 1 клинические симптомы появляются на первых неделях жизни у пациентов с дуктус-зависимым кровообращением нижней половины тела, если порок не был установлен до закрытия артериального протока – острая почечная недостаточность, ацидоз, вызванные острой ишемией органов, кровоснабжаемых из отделов аорты ниже коарктации – 2 бессимптомное течение порока в течении первых месяцев жизни, в дальнейшем артериальная гипертензия верхней половины тела и гипоперфузия нижней приводят к появлению жалоб на хромоту, носовые кровотечения, головные боли. Возможно развитие таких осложнений как аневризма Веллизиего круга, аневризма аорты, диссекция аорты, ускоренное развитие атеросклероза коронарных артерий с последующим ИМ Средняя продолжительность жизни 35 лет. Основные причины смерти: сердечная недостаточность 26%, бактериальный эндокардит 25%, разрыв аорты 21%, внутричерепное кровоизлияние 13%
 Коарктация аорты l Клинические проявления l l l Новорожденные с критической коарктацией: клиника сердечно-сосудистого шока (тахипноэ, тахикардия, бледность), отсутствие пульса на нижних конечностях, анурия, ацидоз Артериальная гипертензия, ослабление/отсутствие пульса на нижних конечностях, головные боли, носовые кровотечения, хромота Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия, МРТ, КТ
Коарктация аорты l Клинические проявления l l l Новорожденные с критической коарктацией: клиника сердечно-сосудистого шока (тахипноэ, тахикардия, бледность), отсутствие пульса на нижних конечностях, анурия, ацидоз Артериальная гипертензия, ослабление/отсутствие пульса на нижних конечностях, головные боли, носовые кровотечения, хромота Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия, МРТ, КТ
 Коарктация аорты l Тактика ведения l l l Новорожденные с критической коарктацией аорты: внутривенное введение простагландина PGE 1, интубация, инотропные препараты, коррекция кислотно -основного состояния, после стабилизации состояния – хирургическая корреция Хирургическая коррекция в возрасте 3 -4 лет Результаты l l Осложнения: параплегия, кровотечение, парадоксальная гипертензия, аневризма аорты, рекаорктация Общая летальность 10 -15%
Коарктация аорты l Тактика ведения l l l Новорожденные с критической коарктацией аорты: внутривенное введение простагландина PGE 1, интубация, инотропные препараты, коррекция кислотно -основного состояния, после стабилизации состояния – хирургическая корреция Хирургическая коррекция в возрасте 3 -4 лет Результаты l l Осложнения: параплегия, кровотечение, парадоксальная гипертензия, аневризма аорты, рекаорктация Общая летальность 10 -15%
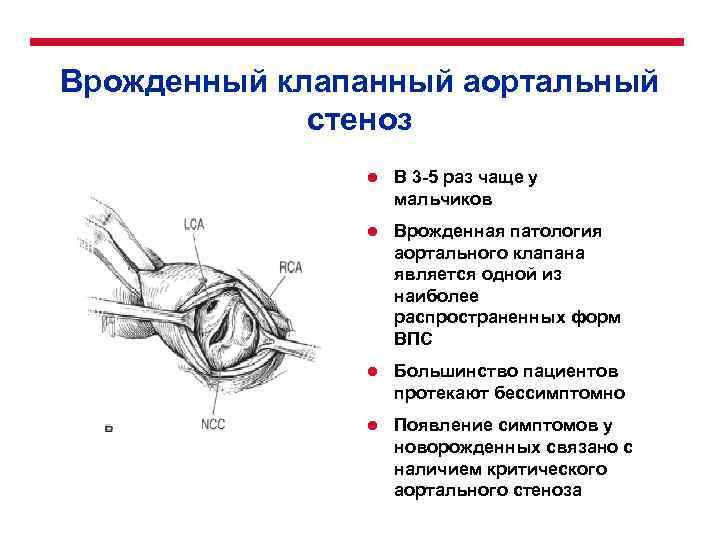 Врожденный клапанный аортальный стеноз l В 3 -5 раз чаще у мальчиков l Врожденная патология аортального клапана является одной из наиболее распространенных форм ВПС l Большинство пациентов протекают бессимптомно l Появление симптомов у новорожденных связано с наличием критического аортального стеноза
Врожденный клапанный аортальный стеноз l В 3 -5 раз чаще у мальчиков l Врожденная патология аортального клапана является одной из наиболее распространенных форм ВПС l Большинство пациентов протекают бессимптомно l Появление симптомов у новорожденных связано с наличием критического аортального стеноза
 Врожденный клапанный аортальный стеноз l Патофизиология и естественное течение l l Фетальный период – Увеличенная постнагрузка для ЛЖ приводит к развитию его гипертрофии, систолической и диастолической дисфункции, что сопровождается повышением давления в ЛП, увеличением лево-правого шунта через ООО – Системная перфузия поддерживается через АП – Гиперфункция ЛЖ, высокое внутриполостное давление, ишемия миокарда, вызванная редуцированным коронарным кровотоком предрасполагают к развитию эндокардиального фиброэластоза – Возможно развитие вторичного субаортального стеноза – Уменьшение кровотока через левые отделы сердца предрасполагает к недоразвитию (гипоплазии) структур, имеющих отношение к левым отделам сердца (левый желудочек, дуга аорты, митральный клапан) Постнатальный период – Зависит от выраженности стеноза, степени дисфункции или гипоплазии ЛЖ – Течение критического аортального стеноза зависит от объема шунтирования на уровне ООО и ОАП – Умеренный Аост – обычно достаточно развитый ЛЖ, способный поддерживать адекватный системный кровоток. (бессимптомное течение продолжительное время, систолический шум, прогрессирующая гипертрофия ЛЖ) – Выраженный Аост – выраженная гипертрофия и дисфункция желудочка, большой градиент на клапане вызывают несоответствие между перфузионным коронарным давлением и интрамиокардиальным давлением, что приводит к ишемии миокарда (ИМ, аритмии) – Критический аортальный стеноз (10%) – ЛЖ не в состоянии поддерживать системную циркуляцию в необходимом объеме в т. ч. вследствие его гипоплазии или дисфукции, системная и коронарная перфузия становятся зависимыми от функционирования ОАП. (цианоз различной степени, в зависимости от объема кровотока через нативный аортальный клапан). Закрытие ОАП после рождения сопровождается развитием клиники сердечнососудистого шока (гипотония, олигоурия, ацидоз)
Врожденный клапанный аортальный стеноз l Патофизиология и естественное течение l l Фетальный период – Увеличенная постнагрузка для ЛЖ приводит к развитию его гипертрофии, систолической и диастолической дисфункции, что сопровождается повышением давления в ЛП, увеличением лево-правого шунта через ООО – Системная перфузия поддерживается через АП – Гиперфункция ЛЖ, высокое внутриполостное давление, ишемия миокарда, вызванная редуцированным коронарным кровотоком предрасполагают к развитию эндокардиального фиброэластоза – Возможно развитие вторичного субаортального стеноза – Уменьшение кровотока через левые отделы сердца предрасполагает к недоразвитию (гипоплазии) структур, имеющих отношение к левым отделам сердца (левый желудочек, дуга аорты, митральный клапан) Постнатальный период – Зависит от выраженности стеноза, степени дисфункции или гипоплазии ЛЖ – Течение критического аортального стеноза зависит от объема шунтирования на уровне ООО и ОАП – Умеренный Аост – обычно достаточно развитый ЛЖ, способный поддерживать адекватный системный кровоток. (бессимптомное течение продолжительное время, систолический шум, прогрессирующая гипертрофия ЛЖ) – Выраженный Аост – выраженная гипертрофия и дисфункция желудочка, большой градиент на клапане вызывают несоответствие между перфузионным коронарным давлением и интрамиокардиальным давлением, что приводит к ишемии миокарда (ИМ, аритмии) – Критический аортальный стеноз (10%) – ЛЖ не в состоянии поддерживать системную циркуляцию в необходимом объеме в т. ч. вследствие его гипоплазии или дисфукции, системная и коронарная перфузия становятся зависимыми от функционирования ОАП. (цианоз различной степени, в зависимости от объема кровотока через нативный аортальный клапан). Закрытие ОАП после рождения сопровождается развитием клиники сердечнососудистого шока (гипотония, олигоурия, ацидоз)
 Врожденный клапанный аортальный стеноз l Клинические проявления l Ослабленная пульсация на периферических сосудах l Влажные, холодные кожные покровы l l Систолический шум 2 м/р справа от грудины, систолический щелчок Цианоз указывает на наличие ОАП, может быть изолированный цианоз нижней половины тела Гепатомегалия свидетельствует о присоединении правожелудочковой недостаточности (неблагоприятный прогноз) Диагностика l ЭКГ, рентгенография, ЭХО
Врожденный клапанный аортальный стеноз l Клинические проявления l Ослабленная пульсация на периферических сосудах l Влажные, холодные кожные покровы l l Систолический шум 2 м/р справа от грудины, систолический щелчок Цианоз указывает на наличие ОАП, может быть изолированный цианоз нижней половины тела Гепатомегалия свидетельствует о присоединении правожелудочковой недостаточности (неблагоприятный прогноз) Диагностика l ЭКГ, рентгенография, ЭХО
 Врожденный клапанный аортальный стеноз l Тактика ведения l l l Новорожденные – Диагностика сопутствующих ВПС для выяснения возможности ЛЖ осуществлять системную перфузию (гипоплазия ЛЖ, МК, восходящей и дуги аорты) – кандидаты для конверсии в одножелудочковый статус – Новорожденные с критическим аортальным стенозом и клиникой закрывающегося ОАП – простагландин, далее транслюминальная баллонная вальвулопластика Более старшие дети – Градиент давления более 50 мм. рт. ст. + гипертрофия ЛЖ + симптомы дисфункции ЛЖ – показания для хирургической коррекции – Градиент давления более 75 мм. рт. ст. – показание для хирургической коррекции даже при отсутствии клинических проявлений Результаты l l Средняя госпитальная летальность при открытой вальвотомии и баллонной вальвопластике 10 – 12. 5%, 5 – летняя выживаемость при двухжелудочковой коррекции 70%, Norwood 60% 35% больных требуют повторного вмешательства через 20 лет 10 – летняя выживаемость после повторного вмешательства 88%
Врожденный клапанный аортальный стеноз l Тактика ведения l l l Новорожденные – Диагностика сопутствующих ВПС для выяснения возможности ЛЖ осуществлять системную перфузию (гипоплазия ЛЖ, МК, восходящей и дуги аорты) – кандидаты для конверсии в одножелудочковый статус – Новорожденные с критическим аортальным стенозом и клиникой закрывающегося ОАП – простагландин, далее транслюминальная баллонная вальвулопластика Более старшие дети – Градиент давления более 50 мм. рт. ст. + гипертрофия ЛЖ + симптомы дисфункции ЛЖ – показания для хирургической коррекции – Градиент давления более 75 мм. рт. ст. – показание для хирургической коррекции даже при отсутствии клинических проявлений Результаты l l Средняя госпитальная летальность при открытой вальвотомии и баллонной вальвопластике 10 – 12. 5%, 5 – летняя выживаемость при двухжелудочковой коррекции 70%, Norwood 60% 35% больных требуют повторного вмешательства через 20 лет 10 – летняя выживаемость после повторного вмешательства 88%
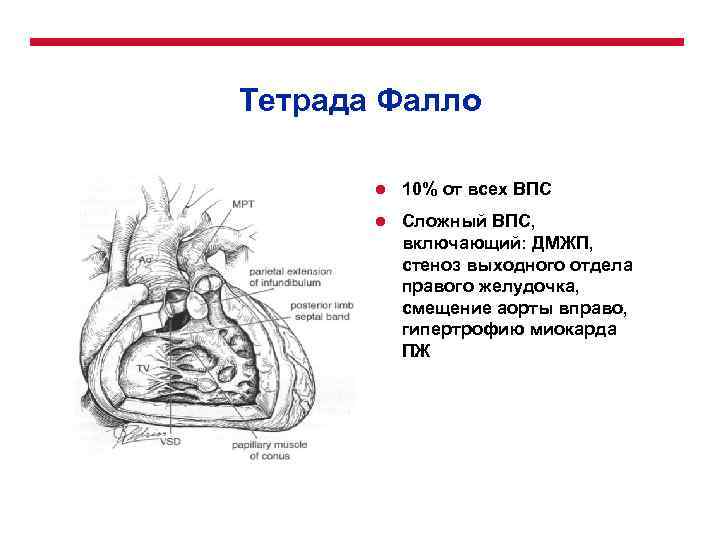 Тетрада Фалло l 10% от всех ВПС l Сложный ВПС, включающий: ДМЖП, стеноз выходного отдела правого желудочка, смещение аорты вправо, гипертрофию миокарда ПЖ
Тетрада Фалло l 10% от всех ВПС l Сложный ВПС, включающий: ДМЖП, стеноз выходного отдела правого желудочка, смещение аорты вправо, гипертрофию миокарда ПЖ
 Тетрада Фалло l Классификация l Тетрада Фалло со стенозом ЛА 86% l Тетрада Фалло с атрезией ЛА 7% l l Тетрада Фалло с открытым атриовентрикулярным каналом 2% Тетрада Фалло с отсутствующим клапаном легочной артерии 5%
Тетрада Фалло l Классификация l Тетрада Фалло со стенозом ЛА 86% l Тетрада Фалло с атрезией ЛА 7% l l Тетрада Фалло с открытым атриовентрикулярным каналом 2% Тетрада Фалло с отсутствующим клапаном легочной артерии 5%
 Тетрада Фалло l Патофизиология и естественное течение l l l ТФ со стенозом ЛА – Определяются отношением сосудистого сопротивления большого круга кровообращения и сопротивлением на уровне выходной отдела ПЖ – Наличие стеноза выходного отдела и нерестриктивного ДМЖП обуславливают направление сброса – право-левый, выраженность стеноза определяет степень системной гипоксемии и клинические проявления порока – Наиболее часто новорожденные имеют умеренно выраженный цианоз, прогрессирующий с нарастанием обструкции на уровне выходного отдела ПЖ (обычно гипоплазирован клапан/ствол ЛА) – В периоде новорожденности возможен лево-правый сброс, проявляющийся симптомами сердечной недостаточности у пациентов с умеренно выраженным стенозом ВОПЖ. Перемена сброса обычно происходит к 6 -8 мес жизни и проявляется купированием сердечной недостаточности и появлением цианоза (обычно клапан и ствол ЛА нормального размера) ТФ с атрезией ЛА – Выраженный цианоз с рождения – Легочная циркуляция поддерживается за счет внесердечных источников кровообращения – ОАП, БАЛК Летальность среди не оперированых больных в течении первого года 25%, основная причина смерти гипоксия
Тетрада Фалло l Патофизиология и естественное течение l l l ТФ со стенозом ЛА – Определяются отношением сосудистого сопротивления большого круга кровообращения и сопротивлением на уровне выходной отдела ПЖ – Наличие стеноза выходного отдела и нерестриктивного ДМЖП обуславливают направление сброса – право-левый, выраженность стеноза определяет степень системной гипоксемии и клинические проявления порока – Наиболее часто новорожденные имеют умеренно выраженный цианоз, прогрессирующий с нарастанием обструкции на уровне выходного отдела ПЖ (обычно гипоплазирован клапан/ствол ЛА) – В периоде новорожденности возможен лево-правый сброс, проявляющийся симптомами сердечной недостаточности у пациентов с умеренно выраженным стенозом ВОПЖ. Перемена сброса обычно происходит к 6 -8 мес жизни и проявляется купированием сердечной недостаточности и появлением цианоза (обычно клапан и ствол ЛА нормального размера) ТФ с атрезией ЛА – Выраженный цианоз с рождения – Легочная циркуляция поддерживается за счет внесердечных источников кровообращения – ОАП, БАЛК Летальность среди не оперированых больных в течении первого года 25%, основная причина смерти гипоксия
 Тетрада Фалло l Клинические проявления l l l Усиливающийся с возрастом цианоз, гипоксемические приступы Систолический шум Непрерывный шум, выслушиваемый на спине, над легочными полями характерен для больных с БАЛК Диастолический шум легочной регургитации характерен для больных с отсутствующим легочным клапаном Симптомы «барабанных палочек» и «часовых стекол» характерны для не оперированных пациентов старше 6 мес. Диагностика l l ЭКГ, рентгенография, ЭХО-кардиоскопия Катетеризация сердца, КТ, МРТ при подозрении на гипоплазию легочных артерий, БАЛК
Тетрада Фалло l Клинические проявления l l l Усиливающийся с возрастом цианоз, гипоксемические приступы Систолический шум Непрерывный шум, выслушиваемый на спине, над легочными полями характерен для больных с БАЛК Диастолический шум легочной регургитации характерен для больных с отсутствующим легочным клапаном Симптомы «барабанных палочек» и «часовых стекол» характерны для не оперированных пациентов старше 6 мес. Диагностика l l ЭКГ, рентгенография, ЭХО-кардиоскопия Катетеризация сердца, КТ, МРТ при подозрении на гипоплазию легочных артерий, БАЛК
 Тетрада фалло l Тактика ведения l l l Новорожденные и дети раннего возраста, не имеющие выраженной гипоксемии не нуждаются в хирургической коррекции Десатурация ниже 75%-80% является показанием к операции Наличие гипоксемических приступов является показанием к назначению пропранолола, при прекращении приступов и сатурации более 80% хирургическое вмешательство можно отложить Оптимальный срок радикальной коррекции 6 -24 мес Наличие таких факторов как: атрезия клапана легочной артерии, гипоплазия легочных артерий, гиполпазия ЛЖ являются показанием для паллиативного вмешательства в раннем возрасте Результаты l Операционная летальность 2 -5%, 5 -летняя выживаемость 90%
Тетрада фалло l Тактика ведения l l l Новорожденные и дети раннего возраста, не имеющие выраженной гипоксемии не нуждаются в хирургической коррекции Десатурация ниже 75%-80% является показанием к операции Наличие гипоксемических приступов является показанием к назначению пропранолола, при прекращении приступов и сатурации более 80% хирургическое вмешательство можно отложить Оптимальный срок радикальной коррекции 6 -24 мес Наличие таких факторов как: атрезия клапана легочной артерии, гипоплазия легочных артерий, гиполпазия ЛЖ являются показанием для паллиативного вмешательства в раннем возрасте Результаты l Операционная летальность 2 -5%, 5 -летняя выживаемость 90%
 Транспозиция магистральных сосудов l 9, 9% от всех ВПС l Наиболее часто диагностируемый ВПС у новорожденных
Транспозиция магистральных сосудов l 9, 9% от всех ВПС l Наиболее часто диагностируемый ВПС у новорожденных
 Транспозиция магистральных сосудов l Классификация l l Транспозиция магистральных сосудов с интактной межжелудочковой перегородкой (50%) Транспозиция магистральных сосудов с дефектом межжелудочковой перегородки (25%) Транспозиция магистральных сосудов с интактной межжелудочковой перегородкой, стенозом левого выводного тракта (редко) Транспозиция магистральных сосудов с дефектом межжелудочковой перегородки, стенозом левого выводного тракта (25%)
Транспозиция магистральных сосудов l Классификация l l Транспозиция магистральных сосудов с интактной межжелудочковой перегородкой (50%) Транспозиция магистральных сосудов с дефектом межжелудочковой перегородки (25%) Транспозиция магистральных сосудов с интактной межжелудочковой перегородкой, стенозом левого выводного тракта (редко) Транспозиция магистральных сосудов с дефектом межжелудочковой перегородки, стенозом левого выводного тракта (25%)
 Транспозиция магистральных сосудов l Патофизиология и естественное течение l l l Характеризуется параллельной, раздельной для малого и большого круга циркуляцией (системная гипоксемия) Жизнь после рождения возможна только при наличии смешивания крови двух кругов циркуляции ТМС + ИМП - смешивание крови происходит на уровне ОАП и ООО ТМС + ДМЖП – в т. ч. на уровне ДМЖП, при наличии большого ДМЖП возможно развитие легочной гипертензии Стеноз левого выводного тракта при интактной межжелудочковой перегородке развивается вследствие смещении межжелудочковой перегородки увеличенным правым желудочком Больные с ДМЖП и СЛВТ обычно имеют наиболее сбалансированную гемодинамику
Транспозиция магистральных сосудов l Патофизиология и естественное течение l l l Характеризуется параллельной, раздельной для малого и большого круга циркуляцией (системная гипоксемия) Жизнь после рождения возможна только при наличии смешивания крови двух кругов циркуляции ТМС + ИМП - смешивание крови происходит на уровне ОАП и ООО ТМС + ДМЖП – в т. ч. на уровне ДМЖП, при наличии большого ДМЖП возможно развитие легочной гипертензии Стеноз левого выводного тракта при интактной межжелудочковой перегородке развивается вследствие смещении межжелудочковой перегородки увеличенным правым желудочком Больные с ДМЖП и СЛВТ обычно имеют наиболее сбалансированную гемодинамику
 Транспозиция магистральных сосудов l Клинические симптомы l l Выраженность цианоза зависит от степени смешивания крови – ТМС + ИМП выраженный цианоз с первых часов после рождения – ТМС + ДМЖП менее выражен Мягкий, систолический шум, может отсутствовать При большом артерио-венозном сбросе симптомы сердечной недостаточности Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия
Транспозиция магистральных сосудов l Клинические симптомы l l Выраженность цианоза зависит от степени смешивания крови – ТМС + ИМП выраженный цианоз с первых часов после рождения – ТМС + ДМЖП менее выражен Мягкий, систолический шум, может отсутствовать При большом артерио-венозном сбросе симптомы сердечной недостаточности Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия
 Транспозиция магистральных сосудов l Тактика ведения l l ТМС + ИМП или маленький ДМЖП – PGE 1 + Коррекция кислотно-основного состояния – Процедура Рашкинда – Хирургическая коррекция (артериальное переключение) в возрасте 2 -3 недель ТМС + ДМЖП – Хирургическая коррекция (артериальное переключение) в возрасте 2 -3 мес ТМС + ДМЖП + СЛВТ – Хирургическая коррекция (операция Растелли) в возрасте 1 -2 лет Результаты l l артериальное переключение – Операционная летальность 2 -5% – 5 -летняя выживаемость 90% операция Растелли – Операционная летальность 5 -10% – Необходимость замены кондуита в будущем
Транспозиция магистральных сосудов l Тактика ведения l l ТМС + ИМП или маленький ДМЖП – PGE 1 + Коррекция кислотно-основного состояния – Процедура Рашкинда – Хирургическая коррекция (артериальное переключение) в возрасте 2 -3 недель ТМС + ДМЖП – Хирургическая коррекция (артериальное переключение) в возрасте 2 -3 мес ТМС + ДМЖП + СЛВТ – Хирургическая коррекция (операция Растелли) в возрасте 1 -2 лет Результаты l l артериальное переключение – Операционная летальность 2 -5% – 5 -летняя выживаемость 90% операция Растелли – Операционная летальность 5 -10% – Необходимость замены кондуита в будущем
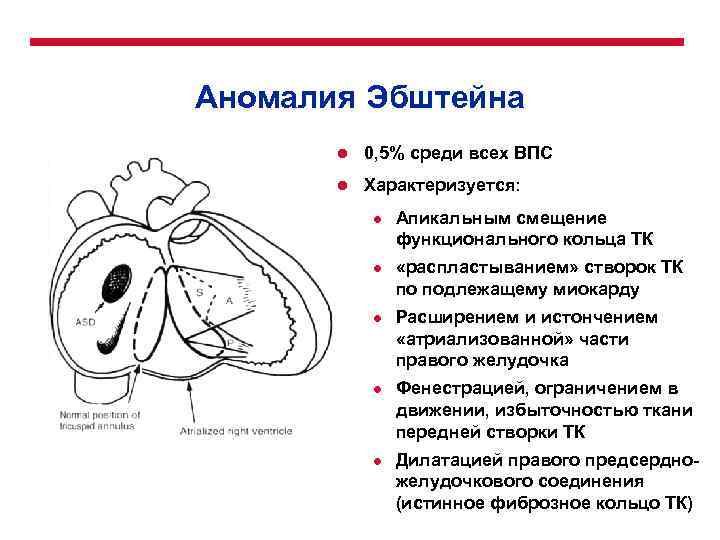 Аномалия Эбштейна l 0, 5% среди всех ВПС l Характеризуется: l l l Апикальным смещение функционального кольца ТК «распластыванием» створок ТК по подлежащему миокарду Расширением и истончением «атриализованной» части правого желудочка Фенестрацией, ограничением в движении, избыточностью ткани передней створки ТК Дилатацией правого предсердножелудочкового соединения (истинное фиброзное кольцо ТК)
Аномалия Эбштейна l 0, 5% среди всех ВПС l Характеризуется: l l l Апикальным смещение функционального кольца ТК «распластыванием» створок ТК по подлежащему миокарду Расширением и истончением «атриализованной» части правого желудочка Фенестрацией, ограничением в движении, избыточностью ткани передней створки ТК Дилатацией правого предсердножелудочкового соединения (истинное фиброзное кольцо ТК)
 Аномалия Эбштейна l Классификация (Carpentier) l Тип А – нормальный объем ПЖ l Тип В – атриализованная часть ПЖ больших размеров l Тип С – ограниченная подвижность передней створки ТК, может вызывать подлегочный стеноз l Тип D – субтотальная атриализация ПЖ (желудочковый мешок)
Аномалия Эбштейна l Классификация (Carpentier) l Тип А – нормальный объем ПЖ l Тип В – атриализованная часть ПЖ больших размеров l Тип С – ограниченная подвижность передней створки ТК, может вызывать подлегочный стеноз l Тип D – субтотальная атриализация ПЖ (желудочковый мешок)
 Аномалия Эбштейна l Патофизиология и естественное течение l l l Функциональная недостаточность ПЖ и регургитация на ТК, неодновременное сокращение правого предсердия и атриализованной части ПЖ препятствуют прохождению крови через правые отделы сердца, дилатацию ПП Право-левый сброс через межпредсердное сообщение В период новорожденности шлюз на уровне правых отделов сердца усугубляется повышенным легочным сопротивлением, что увеличивает право-левый сброс (выраженный цианоз), к 3 мес. цианоз уменьшается вследствии снижения легочного сосудистого сопротивления При появлении симптомов в периоде новорожденности – исход не благоприятный (2 -летняя выживаемость 50 -60%) Причины смерти: прогрессирующая сердечная недостаточность, внезапная смерть (аритмии), эмболии
Аномалия Эбштейна l Патофизиология и естественное течение l l l Функциональная недостаточность ПЖ и регургитация на ТК, неодновременное сокращение правого предсердия и атриализованной части ПЖ препятствуют прохождению крови через правые отделы сердца, дилатацию ПП Право-левый сброс через межпредсердное сообщение В период новорожденности шлюз на уровне правых отделов сердца усугубляется повышенным легочным сопротивлением, что увеличивает право-левый сброс (выраженный цианоз), к 3 мес. цианоз уменьшается вследствии снижения легочного сосудистого сопротивления При появлении симптомов в периоде новорожденности – исход не благоприятный (2 -летняя выживаемость 50 -60%) Причины смерти: прогрессирующая сердечная недостаточность, внезапная смерть (аритмии), эмболии
 Аномалия Эбштейна l Клинические проявления l Цианоз, одышка, периферические отеки, асцит l WPW синдром 15%, реентри-тахикардия 1 -2%, на конечной стадии сердечной недостаточности – большинство l Аускультативная картина разнообразна, м. б. систолический шум трикуспидальной недостаточности l Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия, электрофизиология
Аномалия Эбштейна l Клинические проявления l Цианоз, одышка, периферические отеки, асцит l WPW синдром 15%, реентри-тахикардия 1 -2%, на конечной стадии сердечной недостаточности – большинство l Аускультативная картина разнообразна, м. б. систолический шум трикуспидальной недостаточности l Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия, электрофизиология
 Аномалия Эбштейна l Тактика ведения l l Неонатальный период – ингаляция оксида азота или кислорода, цель – снижение легочного сосудистого сопротивления Показания к хирургической коррекции: – – – l Выраженная трикуспидальная недостаточность Нарастание цианоза Выраженная сердечная недостаточность Нарастающая кардиомегалия Нарушения ритма Результаты l Операционная летальность 5%, большинство пациентов NYHA 1 -2, необходимость повторных вмешательств 3 -5% (исключая больных с. Типом D)
Аномалия Эбштейна l Тактика ведения l l Неонатальный период – ингаляция оксида азота или кислорода, цель – снижение легочного сосудистого сопротивления Показания к хирургической коррекции: – – – l Выраженная трикуспидальная недостаточность Нарастание цианоза Выраженная сердечная недостаточность Нарастающая кардиомегалия Нарушения ритма Результаты l Операционная летальность 5%, большинство пациентов NYHA 1 -2, необходимость повторных вмешательств 3 -5% (исключая больных с. Типом D)
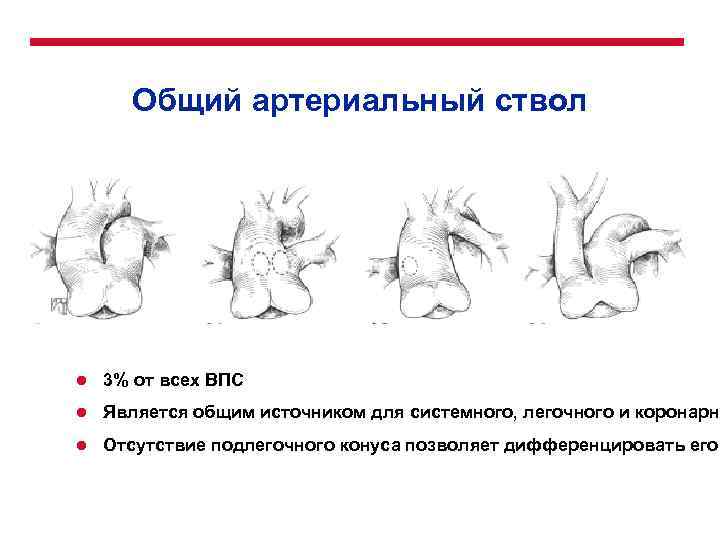 Общий артериальный ствол l 3% от всех ВПС l Является общим источником для системного, легочного и коронарно l Отсутствие подлегочного конуса позволяет дифференцировать его
Общий артериальный ствол l 3% от всех ВПС l Является общим источником для системного, легочного и коронарно l Отсутствие подлегочного конуса позволяет дифференцировать его
 Общий артериальный ствол l Классификация (Van Praagh) l А 1 – отхождение легочных артерий от общего ствола единым коллектором на уровне синусов клапана l А 2 – отхождение легочных артерий от общего ствола выше синусов клапана l А 3 – отхождение одной (чаще правой) легочной артерии от общего ствола, источником кровообращения для второго легкого являются ОАП или БАЛК l А 4 – сочетание общего артериального ствола с перерывом дуги аорты
Общий артериальный ствол l Классификация (Van Praagh) l А 1 – отхождение легочных артерий от общего ствола единым коллектором на уровне синусов клапана l А 2 – отхождение легочных артерий от общего ствола выше синусов клапана l А 3 – отхождение одной (чаще правой) легочной артерии от общего ствола, источником кровообращения для второго легкого являются ОАП или БАЛК l А 4 – сочетание общего артериального ствола с перерывом дуги аорты
 Общий артериальный ствол l Патофизиология и естественное течение l l Большой артериовенозный сброс, приводящий к объемной перегрузке желудочков сердца, быстрому развитию необратимых гипертензионных изменений в сосудах легких Увеличение сброса с уменьшением легочного сосудистого сопротивления у новорожденных 50% имеют недостаточность клапана общего ствола, приводящую к увеличению нагрузки на желудочки Летальность 65% в течении 6 мес. , 75% в течении 1 года жизни
Общий артериальный ствол l Патофизиология и естественное течение l l Большой артериовенозный сброс, приводящий к объемной перегрузке желудочков сердца, быстрому развитию необратимых гипертензионных изменений в сосудах легких Увеличение сброса с уменьшением легочного сосудистого сопротивления у новорожденных 50% имеют недостаточность клапана общего ствола, приводящую к увеличению нагрузки на желудочки Летальность 65% в течении 6 мес. , 75% в течении 1 года жизни
 Общий артериальный ствол l Клинические проявления l l l Симптомы прогрессирующей сердечной недостаточности Может быть цианоз Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия, катетеризация сердца
Общий артериальный ствол l Клинические проявления l l l Симптомы прогрессирующей сердечной недостаточности Может быть цианоз Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия, катетеризация сердца
 Общий артериальный ствол l Тактика ведения l l Ранняя хирургическая коррекция Результаты l Госпитальная летальность 10 -16% l 15 -летняя выживаемость 83% l Необходимость повторного вмешательства в связи с необходимостью замены кондуита, недостаточностью клапана общего ствола
Общий артериальный ствол l Тактика ведения l l Ранняя хирургическая коррекция Результаты l Госпитальная летальность 10 -16% l 15 -летняя выживаемость 83% l Необходимость повторного вмешательства в связи с необходимостью замены кондуита, недостаточностью клапана общего ствола
 Тотальный аномальный дренаж легочных вен l 2% среди всех ВПС l Левое предсердие уменьшено в обьеме l Левый желудочек имеет нормальную функцию и массу, может иметь уменьшенный объем l Всегда присутствует сообщение на уровне межпредсердной перегородки l При инфракардиальной форме в большинстве случаев обструкция легочных вен
Тотальный аномальный дренаж легочных вен l 2% среди всех ВПС l Левое предсердие уменьшено в обьеме l Левый желудочек имеет нормальную функцию и массу, может иметь уменьшенный объем l Всегда присутствует сообщение на уровне межпредсердной перегородки l При инфракардиальной форме в большинстве случаев обструкция легочных вен
 Тотальный аномальный дренаж легочных вен l Классификация l l Тип 1 – супракардиальная форма (50%) Тип 2 – кардиальная форма (25%) Тип 3 – инфракардиальная форма (20%) Тип 4 – смешанная (5%) форма
Тотальный аномальный дренаж легочных вен l Классификация l l Тип 1 – супракардиальная форма (50%) Тип 2 – кардиальная форма (25%) Тип 3 – инфракардиальная форма (20%) Тип 4 – смешанная (5%) форма
 Тотальный аномальный дренаж легочных вен l Патофизиология и естественное течение l l Весь венозный возврат малого круга кровообращения дренируется в правое предсердие Внутрисердечное смешивание венозного возврата малого и большого кругов кровообращения Наличие право-левого сброса (ООО, ДМПП) необходимо для жизни Увеличенный легочный кровоток приводит к развитию легочной гипертензии
Тотальный аномальный дренаж легочных вен l Патофизиология и естественное течение l l Весь венозный возврат малого круга кровообращения дренируется в правое предсердие Внутрисердечное смешивание венозного возврата малого и большого кругов кровообращения Наличие право-левого сброса (ООО, ДМПП) необходимо для жизни Увеличенный легочный кровоток приводит к развитию легочной гипертензии
 Тотальный аномальный дренаж легочных вен l Клинические проявления l Клиническая картина определяется наличием и степенью обструкции легочных вен l При выраженной обструкции состояние новорожденного критическое (одышка, гипоксемия, метаболический ацидоз) l Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия, катетеризация сердца
Тотальный аномальный дренаж легочных вен l Клинические проявления l Клиническая картина определяется наличием и степенью обструкции легочных вен l При выраженной обструкции состояние новорожденного критическое (одышка, гипоксемия, метаболический ацидоз) l Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия, катетеризация сердца
 Тотальный аномальный дренаж легочных вен l Тактика ведения l Время операции определяется наличием или отсутствием обструкции легочных вен – При наличии обструкции больные должны оперироваться непосредственно после установления диагноза – При отсутствии обструкции – до 6 мес. (до развития гипертензионных изменений в легких) l Результаты l l Госпитальная летальность 2 -20% 5 -10% требуют повторного вмешательства в связи с обструкцией легочных вен
Тотальный аномальный дренаж легочных вен l Тактика ведения l Время операции определяется наличием или отсутствием обструкции легочных вен – При наличии обструкции больные должны оперироваться непосредственно после установления диагноза – При отсутствии обструкции – до 6 мес. (до развития гипертензионных изменений в легких) l Результаты l l Госпитальная летальность 2 -20% 5 -10% требуют повторного вмешательства в связи с обструкцией легочных вен
 Единственный желудочек l Доминирование одного из желудочков l Обычно присутствие второго, гипоплазированного желудочка l Различные варианты атрио – вентрикуло – артериального соединения l Гиперволемия, гиповолемия малого круга кровообращения, сбалансированная перфузия большого и малого кругов кровообращения
Единственный желудочек l Доминирование одного из желудочков l Обычно присутствие второго, гипоплазированного желудочка l Различные варианты атрио – вентрикуло – артериального соединения l Гиперволемия, гиповолемия малого круга кровообращения, сбалансированная перфузия большого и малого кругов кровообращения
 Единственный желудочек l Классификация l ЕЖ, двуприточный левый желудочек l ЕЖ, двуприточный правый желудочек l ЕЖ, атрезия митрального клапана l ЕЖ, атрезия трикуспидального клапана l ЕЖ, несбалансированная форма открытого атриовентрикулярного канала l ЕЖ, синдром гетеротаксии l ЕЖ, синдром гипоплазии левого сердца l ЕЖ, другое
Единственный желудочек l Классификация l ЕЖ, двуприточный левый желудочек l ЕЖ, двуприточный правый желудочек l ЕЖ, атрезия митрального клапана l ЕЖ, атрезия трикуспидального клапана l ЕЖ, несбалансированная форма открытого атриовентрикулярного канала l ЕЖ, синдром гетеротаксии l ЕЖ, синдром гипоплазии левого сердца l ЕЖ, другое
 Единственный желудочек l Патофизиология и естественное течение l l l Перфузия большого и малого кругов кровообращения в «параллельном режиме» Единственный желудочек испытывает двойную объемную нагрузку Соотношение перфузии БКК и МКК определяется сопротивлением, в т. ч. в следствие наличия шлюзов – Сбалансированная перфузия БКК и МКК – Минутный объем БКК и МКК примерно равны, умеренный цианоз (~80%) – Относительно стабильная гемодинамическая ситуация на протяжении многих лет – Объемная перфузия БКК превышает МКК (выраженный стеноз пути оттока в ЛА) – сопровождается более выраженным цианозом (полицитемия, нарушения мозгового кровообращения, абсцессы головного мозга) – Объемная перфузия МКК превышает БКК (невыраженный стеноз пути оттока в ЛА, стеноз пути оттока в Ао) – прогрессирующая сердечная недостаточность, гипертензионные изменения легочного русла
Единственный желудочек l Патофизиология и естественное течение l l l Перфузия большого и малого кругов кровообращения в «параллельном режиме» Единственный желудочек испытывает двойную объемную нагрузку Соотношение перфузии БКК и МКК определяется сопротивлением, в т. ч. в следствие наличия шлюзов – Сбалансированная перфузия БКК и МКК – Минутный объем БКК и МКК примерно равны, умеренный цианоз (~80%) – Относительно стабильная гемодинамическая ситуация на протяжении многих лет – Объемная перфузия БКК превышает МКК (выраженный стеноз пути оттока в ЛА) – сопровождается более выраженным цианозом (полицитемия, нарушения мозгового кровообращения, абсцессы головного мозга) – Объемная перфузия МКК превышает БКК (невыраженный стеноз пути оттока в ЛА, стеноз пути оттока в Ао) – прогрессирующая сердечная недостаточность, гипертензионные изменения легочного русла
 Единственный желудочек l Клиническая картина l Зависит от баланса между объемом перфузии большого и малого кругов кровообращения l Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия, катетеризация сердца
Единственный желудочек l Клиническая картина l Зависит от баланса между объемом перфузии большого и малого кругов кровообращения l Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия, катетеризация сердца
 Единственный желудочек l Тактика ведения l l 0 -6 мес – уменьшение симптомов сердечной недостаточности/цианоза (суживание ЛА, системно-легочный анастомоз) 4 -8 мес – двунаправленный кавапульмональный анастомоз, устранение субаортального стеноза, деформаций ЛА 12 -24 мес – операция Фонтена Результаты l l Операция Фонтена: операционная летальность 5%, 15 -летняя выживаемость 60 -70% Все хирургические вмешательства являются паллиативными, в будущем требуется пересадка сердца или сердце-легкие
Единственный желудочек l Тактика ведения l l 0 -6 мес – уменьшение симптомов сердечной недостаточности/цианоза (суживание ЛА, системно-легочный анастомоз) 4 -8 мес – двунаправленный кавапульмональный анастомоз, устранение субаортального стеноза, деформаций ЛА 12 -24 мес – операция Фонтена Результаты l l Операция Фонтена: операционная летальность 5%, 15 -летняя выживаемость 60 -70% Все хирургические вмешательства являются паллиативными, в будущем требуется пересадка сердца или сердце-легкие
 Атрезия легочной артерии с интактной межжелудочковой перегородкой l Менее 1% от всех ВПС, 4, 5/100000 новорожденных l Нет физиологического сообщения между правым желудочком и легочной артерией l Сопровождается сопутствующими аномалиями правых отделов сердца и коронарных артерий
Атрезия легочной артерии с интактной межжелудочковой перегородкой l Менее 1% от всех ВПС, 4, 5/100000 новорожденных l Нет физиологического сообщения между правым желудочком и легочной артерией l Сопровождается сопутствующими аномалиями правых отделов сердца и коронарных артерий
 Атрезия легочной артерии с интактной межжелудочковой перегородкой l Классификация l АЛА с правый желудочек-зависимым коронарным кровотоком l АЛА без правый желудочек-зависимого коронарного кровотока
Атрезия легочной артерии с интактной межжелудочковой перегородкой l Классификация l АЛА с правый желудочек-зависимым коронарным кровотоком l АЛА без правый желудочек-зависимого коронарного кровотока
 Атрезия легочной артерии с интактной межжелудочковой перегородкой l Патофизиология и естественное течение l Различной степени гипоплазия ПЖ, ТК l Единственный источник легочного кровотока – ОАП l Право-левый сброс на уровне межпредсердной перегородки l Давление в полости ПЖ равно или превышает системное l Правый желудочек-зависимый коронарный кровоток 10% l l Выраженная гипертрофия ПЖ, может сопровождаться фиброэластозом миокарда ПЖ Летальность в течении 2 недель 50%, 6 мес. – 85%
Атрезия легочной артерии с интактной межжелудочковой перегородкой l Патофизиология и естественное течение l Различной степени гипоплазия ПЖ, ТК l Единственный источник легочного кровотока – ОАП l Право-левый сброс на уровне межпредсердной перегородки l Давление в полости ПЖ равно или превышает системное l Правый желудочек-зависимый коронарный кровоток 10% l l Выраженная гипертрофия ПЖ, может сопровождаться фиброэластозом миокарда ПЖ Летальность в течении 2 недель 50%, 6 мес. – 85%
 Атрезия легочной артерии с интактной межжелудочковой перегородкой l Клинические проявления l Прогрессирующий цианоз сразу после рождения l Шум открытого артериального протока и трикуспидальной регургитации l Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия, катетеризация сердца
Атрезия легочной артерии с интактной межжелудочковой перегородкой l Клинические проявления l Прогрессирующий цианоз сразу после рождения l Шум открытого артериального протока и трикуспидальной регургитации l Диагностика l ЭКГ, рентгенография, ЭХО-кардиоскопия, катетеризация сердца
 Атрезия легочной артерии с интактной межжелудочковой перегородкой l Тактика ведения l l l Новорожденные дети с первых часов зависимы от введения простагландина, для поддержания функции ОАП Хирургическое вмешательство показано как можно раньше Результаты l Госпитальная летальность 20%
Атрезия легочной артерии с интактной межжелудочковой перегородкой l Тактика ведения l l l Новорожденные дети с первых часов зависимы от введения простагландина, для поддержания функции ОАП Хирургическое вмешательство показано как можно раньше Результаты l Госпитальная летальность 20%


