Лабораторная работа 1 и 2.ppt
- Количество слайдов: 21
 Воронежский государственный университет Физический факультет Кафедра физики полупроводников и микроэлектроники НАНОТЕХНОЛОГИИ И НАНОМАТЕРИАЛЫ ВЫЧИСЛИТЕЛЬНЫЙ ПРАКТИКУМ Часть 1. КОМПЬЮТЕРНОЕ МОДЕЛИРОВАНИЕ ЭЛЕКТРОННОЙ СТРУКТУРЫ ФУЛЛЕРЕНА С 60
Воронежский государственный университет Физический факультет Кафедра физики полупроводников и микроэлектроники НАНОТЕХНОЛОГИИ И НАНОМАТЕРИАЛЫ ВЫЧИСЛИТЕЛЬНЫЙ ПРАКТИКУМ Часть 1. КОМПЬЮТЕРНОЕ МОДЕЛИРОВАНИЕ ЭЛЕКТРОННОЙ СТРУКТУРЫ ФУЛЛЕРЕНА С 60
 Учебные пособия “Компьютерное моделирование электронной структуры фуллерена С 60” является выпуском цикла практических работ по направлению “нанотехнологии и наноматериалы” серии “вычислительный практикум в программном комплексе Gaussian 03 с использованием редактора Gauss. View”. Пособие содержит 4 лабораторные работы, позволяющие познакомиться c современными методами вычислительной физики и химии, приобрести практические навыки численного моделирования электронной структуры, строения и ИК-спектра самоорганизованных кластеров и молекул. 1. «Основы работы в редакторе Gauss. View пакета Gaussian 03» . 2. «Численное моделирование электронной структуры молекул с использованием пакета Gaussian 03» . 3. «Молекулярное строение и электронная структура молекулы фуллерена С 60» . 4. «ИК- спектр изолированной молекулы фуллерена С 60 и в присутствии растворителя» .
Учебные пособия “Компьютерное моделирование электронной структуры фуллерена С 60” является выпуском цикла практических работ по направлению “нанотехнологии и наноматериалы” серии “вычислительный практикум в программном комплексе Gaussian 03 с использованием редактора Gauss. View”. Пособие содержит 4 лабораторные работы, позволяющие познакомиться c современными методами вычислительной физики и химии, приобрести практические навыки численного моделирования электронной структуры, строения и ИК-спектра самоорганизованных кластеров и молекул. 1. «Основы работы в редакторе Gauss. View пакета Gaussian 03» . 2. «Численное моделирование электронной структуры молекул с использованием пакета Gaussian 03» . 3. «Молекулярное строение и электронная структура молекулы фуллерена С 60» . 4. «ИК- спектр изолированной молекулы фуллерена С 60 и в присутствии растворителя» .
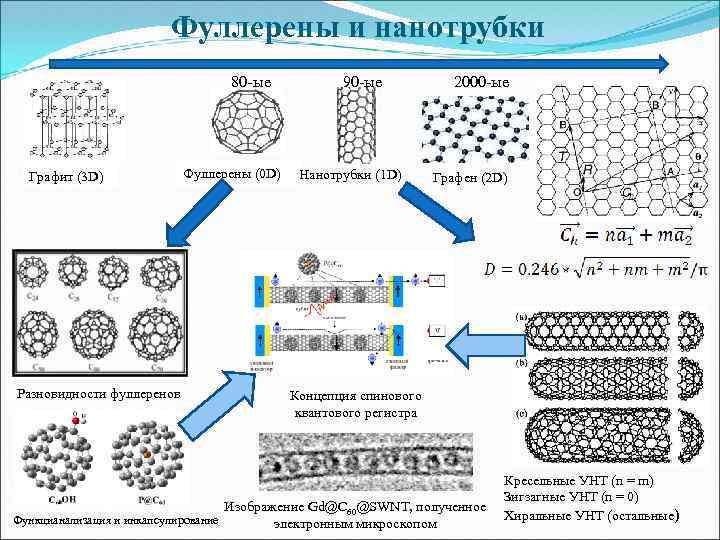 Фуллерены и нанотрубки 80 -ые 90 -ые 2000 -ые Графит (3 D) Разновидности фуллеренов Фуллерены (0 D) Нанотрубки (1 D) Графен (2 D) Концепция спинового квантового регистра Изображение Gd@C 60@SWNT, полученное Функцианализация и инкапсулирование электронным микроскопом Кресельные УНТ (n = m) Зигзагные УНТ (n = 0) Хиральные УНТ (остальные)
Фуллерены и нанотрубки 80 -ые 90 -ые 2000 -ые Графит (3 D) Разновидности фуллеренов Фуллерены (0 D) Нанотрубки (1 D) Графен (2 D) Концепция спинового квантового регистра Изображение Gd@C 60@SWNT, полученное Функцианализация и инкапсулирование электронным микроскопом Кресельные УНТ (n = m) Зигзагные УНТ (n = 0) Хиральные УНТ (остальные)
 Лабораторная работа № 1 «Основы работы в редакторе Gauss. View пакета Gaussian 03» Цель работы: знакомство с программным комплексом Gaussian 03, приобретение навыков работы в редакторе Gauss. View 4
Лабораторная работа № 1 «Основы работы в редакторе Gauss. View пакета Gaussian 03» Цель работы: знакомство с программным комплексом Gaussian 03, приобретение навыков работы в редакторе Gauss. View 4
 1. Программный комплекс Gaussian 03 Gaussian 03 - пакет моделирования электронных структур, использующийся в области физики, биофизики, химии, биохимии. Gaussian позволяет предсказать энергии, молекулярные структуры, колебательные частоты молекулярных систем наряду со многими другими свойствами молекул, кластеров и конденсированных сред. Методология моделирования основана на фундаментальных законах квантовой механики. www. gaussian. com %mem – максимальное количество оперативной памяти, которое может использовать программа; %chk – имя chek-point файла, в котором содержится информация о промежуточных вычислениях; %nproc – число используемых процессоров; # - данные о промежуточных расчетах выводятся в стандартной форме (#T – в сжатой, #P – в развернутой). 5
1. Программный комплекс Gaussian 03 Gaussian 03 - пакет моделирования электронных структур, использующийся в области физики, биофизики, химии, биохимии. Gaussian позволяет предсказать энергии, молекулярные структуры, колебательные частоты молекулярных систем наряду со многими другими свойствами молекул, кластеров и конденсированных сред. Методология моделирования основана на фундаментальных законах квантовой механики. www. gaussian. com %mem – максимальное количество оперативной памяти, которое может использовать программа; %chk – имя chek-point файла, в котором содержится информация о промежуточных вычислениях; %nproc – число используемых процессоров; # - данные о промежуточных расчетах выводятся в стандартной форме (#T – в сжатой, #P – в развернутой). 5
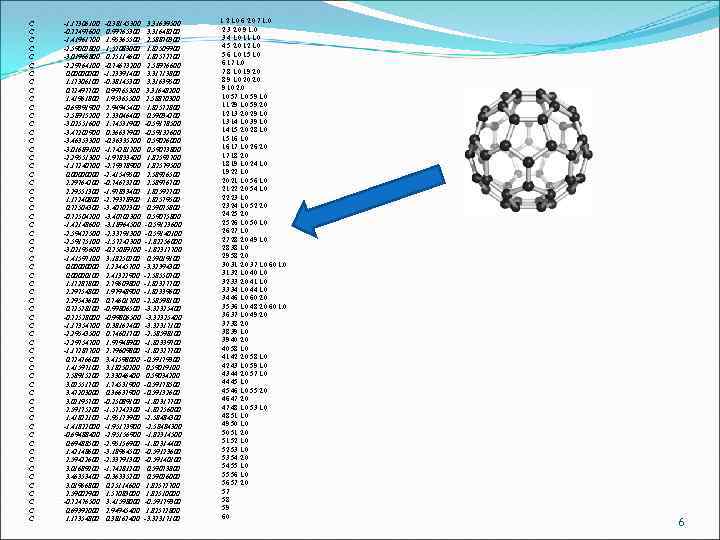 C C C C C C C C C C C C C C C -1. 17306100 -0. 72497600 -1. 41961700 -2. 59002800 -3. 01966800 -2. 29764100 0. 0000 1. 17306100 0. 72497700 1. 41961800 -0. 69391900 -2. 58915200 -3. 02551600 -3. 47202900 -3. 46353300 -3. 01689100 -2. 29551300 -1. 17240700 0. 0000 2. 29764200 2. 29551300 1. 17240800 0. 72504300 -0. 72504200 -1. 42148600 -2. 59422500 -2. 59175100 -3. 02195600 -1. 41597100 0. 00000100 1. 17287800 2. 29754800 2. 29543600 0. 72528100 -0. 72528000 -1. 17354700 -2. 29543500 -2. 29754700 -1. 17287700 0. 72476600 1. 41597100 2. 58915200 3. 02551700 3. 47203000 3. 02195700 2. 59175200 1. 41822100 -1. 41822000 -0. 69488400 0. 69488500 1. 42148600 2. 59422600 3. 01689200 3. 46353400 3. 01966800 2. 59002900 -0. 72476500 0. 69392000 1. 17354800 -0. 38145300 0. 99765300 1. 95365500 1. 57083000 0. 25114600 -0. 74673200 -1. 23391400 -0. 38145300 0. 99765300 1. 95365500 2. 94945400 2. 33046400 1. 74531900 0. 36637900 -0. 36335200 -1. 74281200 -1. 97833400 -2. 79378900 -2. 41549500 -0. 74673200 -1. 97833400 -2. 79378900 -3. 40702300 -3. 18964500 -2. 33791300 -1. 57242300 -0. 25089100 3. 18250200 1. 23445700 2. 41322900 2. 79609800 1. 97948900 0. 74601700 -0. 99806500 0. 38162400 0. 74601700 1. 97948900 2. 79609800 3. 41598000 3. 18250200 2. 33046400 1. 74531900 0. 36637900 -0. 25089100 -1. 57242300 -1. 95173900 -2. 95156900 -3. 18964500 -2. 33791300 -1. 74281200 -0. 36335200 0. 25114600 1. 57083000 3. 41598000 2. 94945400 0. 38162400 3. 31639500 3. 31648200 2. 58870300 1. 82509900 1. 82572700 2. 58976600 3. 31713800 3. 31639500 3. 31648200 2. 58870300 1. 82572800 0. 59034200 -0. 59178500 -0. 59132600 0. 59026000 0. 59073800 1. 82592700 1. 82579500 2. 58926500 2. 58976700 1. 82592700 1. 82579500 0. 59075800 -0. 59123600 -0. 59140100 -1. 82256000 -1. 82317700 0. 59019100 -3. 32394300 -2. 58550700 -1. 82327700 -1. 82339600 -2. 58598100 -3. 32325400 -3. 32317100 -2. 58598100 -1. 82339700 -1. 82327700 -0. 59179300 0. 59019100 0. 59034200 -0. 59178500 -0. 59132600 -1. 82317700 -1. 82256000 -2. 58484300 -1. 82314500 -1. 82314400 -0. 59123600 -0. 59140100 0. 59073800 0. 59026000 1. 82572700 1. 82510000 -0. 59179300 1. 82572800 -3. 32317100 1 2 1. 0 6 2. 0 7 1. 0 2 3 2. 0 9 1. 0 3 4 1. 0 11 1. 0 4 5 2. 0 12 1. 0 5 6 1. 0 15 1. 0 6 17 1. 0 7 8 1. 0 19 2. 0 8 9 1. 0 20 2. 0 9 10 2. 0 10 57 1. 0 59 1. 0 11 29 1. 0 59 2. 0 12 13 2. 0 29 1. 0 13 14 1. 0 39 1. 0 14 15 2. 0 28 1. 0 15 16 1. 0 16 17 1. 0 26 2. 0 17 18 2. 0 18 19 1. 0 24 1. 0 19 22 1. 0 20 21 1. 0 56 1. 0 21 22 2. 0 54 1. 0 22 23 1. 0 23 24 1. 0 52 2. 0 24 25 2. 0 25 26 1. 0 50 1. 0 26 27 1. 0 27 28 2. 0 49 1. 0 28 38 1. 0 29 58 2. 0 30 31 2. 0 37 1. 0 60 1. 0 31 32 1. 0 40 1. 0 32 33 2. 0 41 1. 0 33 34 1. 0 44 1. 0 34 46 1. 0 60 2. 0 35 36 1. 0 48 2. 0 60 1. 0 36 37 1. 0 49 2. 0 37 38 2. 0 38 39 1. 0 39 40 2. 0 40 58 1. 0 41 42 2. 0 58 1. 0 42 43 1. 0 59 1. 0 43 44 2. 0 57 1. 0 44 45 1. 0 45 46 1. 0 55 2. 0 46 47 2. 0 47 48 1. 0 53 1. 0 48 51 1. 0 49 50 1. 0 50 51 2. 0 51 52 1. 0 52 53 1. 0 53 54 2. 0 54 55 1. 0 55 56 1. 0 56 57 2. 0 57 58 59 60 6
C C C C C C C C C C C C C C C -1. 17306100 -0. 72497600 -1. 41961700 -2. 59002800 -3. 01966800 -2. 29764100 0. 0000 1. 17306100 0. 72497700 1. 41961800 -0. 69391900 -2. 58915200 -3. 02551600 -3. 47202900 -3. 46353300 -3. 01689100 -2. 29551300 -1. 17240700 0. 0000 2. 29764200 2. 29551300 1. 17240800 0. 72504300 -0. 72504200 -1. 42148600 -2. 59422500 -2. 59175100 -3. 02195600 -1. 41597100 0. 00000100 1. 17287800 2. 29754800 2. 29543600 0. 72528100 -0. 72528000 -1. 17354700 -2. 29543500 -2. 29754700 -1. 17287700 0. 72476600 1. 41597100 2. 58915200 3. 02551700 3. 47203000 3. 02195700 2. 59175200 1. 41822100 -1. 41822000 -0. 69488400 0. 69488500 1. 42148600 2. 59422600 3. 01689200 3. 46353400 3. 01966800 2. 59002900 -0. 72476500 0. 69392000 1. 17354800 -0. 38145300 0. 99765300 1. 95365500 1. 57083000 0. 25114600 -0. 74673200 -1. 23391400 -0. 38145300 0. 99765300 1. 95365500 2. 94945400 2. 33046400 1. 74531900 0. 36637900 -0. 36335200 -1. 74281200 -1. 97833400 -2. 79378900 -2. 41549500 -0. 74673200 -1. 97833400 -2. 79378900 -3. 40702300 -3. 18964500 -2. 33791300 -1. 57242300 -0. 25089100 3. 18250200 1. 23445700 2. 41322900 2. 79609800 1. 97948900 0. 74601700 -0. 99806500 0. 38162400 0. 74601700 1. 97948900 2. 79609800 3. 41598000 3. 18250200 2. 33046400 1. 74531900 0. 36637900 -0. 25089100 -1. 57242300 -1. 95173900 -2. 95156900 -3. 18964500 -2. 33791300 -1. 74281200 -0. 36335200 0. 25114600 1. 57083000 3. 41598000 2. 94945400 0. 38162400 3. 31639500 3. 31648200 2. 58870300 1. 82509900 1. 82572700 2. 58976600 3. 31713800 3. 31639500 3. 31648200 2. 58870300 1. 82572800 0. 59034200 -0. 59178500 -0. 59132600 0. 59026000 0. 59073800 1. 82592700 1. 82579500 2. 58926500 2. 58976700 1. 82592700 1. 82579500 0. 59075800 -0. 59123600 -0. 59140100 -1. 82256000 -1. 82317700 0. 59019100 -3. 32394300 -2. 58550700 -1. 82327700 -1. 82339600 -2. 58598100 -3. 32325400 -3. 32317100 -2. 58598100 -1. 82339700 -1. 82327700 -0. 59179300 0. 59019100 0. 59034200 -0. 59178500 -0. 59132600 -1. 82317700 -1. 82256000 -2. 58484300 -1. 82314500 -1. 82314400 -0. 59123600 -0. 59140100 0. 59073800 0. 59026000 1. 82572700 1. 82510000 -0. 59179300 1. 82572800 -3. 32317100 1 2 1. 0 6 2. 0 7 1. 0 2 3 2. 0 9 1. 0 3 4 1. 0 11 1. 0 4 5 2. 0 12 1. 0 5 6 1. 0 15 1. 0 6 17 1. 0 7 8 1. 0 19 2. 0 8 9 1. 0 20 2. 0 9 10 2. 0 10 57 1. 0 59 1. 0 11 29 1. 0 59 2. 0 12 13 2. 0 29 1. 0 13 14 1. 0 39 1. 0 14 15 2. 0 28 1. 0 15 16 1. 0 16 17 1. 0 26 2. 0 17 18 2. 0 18 19 1. 0 24 1. 0 19 22 1. 0 20 21 1. 0 56 1. 0 21 22 2. 0 54 1. 0 22 23 1. 0 23 24 1. 0 52 2. 0 24 25 2. 0 25 26 1. 0 50 1. 0 26 27 1. 0 27 28 2. 0 49 1. 0 28 38 1. 0 29 58 2. 0 30 31 2. 0 37 1. 0 60 1. 0 31 32 1. 0 40 1. 0 32 33 2. 0 41 1. 0 33 34 1. 0 44 1. 0 34 46 1. 0 60 2. 0 35 36 1. 0 48 2. 0 60 1. 0 36 37 1. 0 49 2. 0 37 38 2. 0 38 39 1. 0 39 40 2. 0 40 58 1. 0 41 42 2. 0 58 1. 0 42 43 1. 0 59 1. 0 43 44 2. 0 57 1. 0 44 45 1. 0 45 46 1. 0 55 2. 0 46 47 2. 0 47 48 1. 0 53 1. 0 48 51 1. 0 49 50 1. 0 50 51 2. 0 51 52 1. 0 52 53 1. 0 53 54 2. 0 54 55 1. 0 55 56 1. 0 56 57 2. 0 57 58 59 60 6
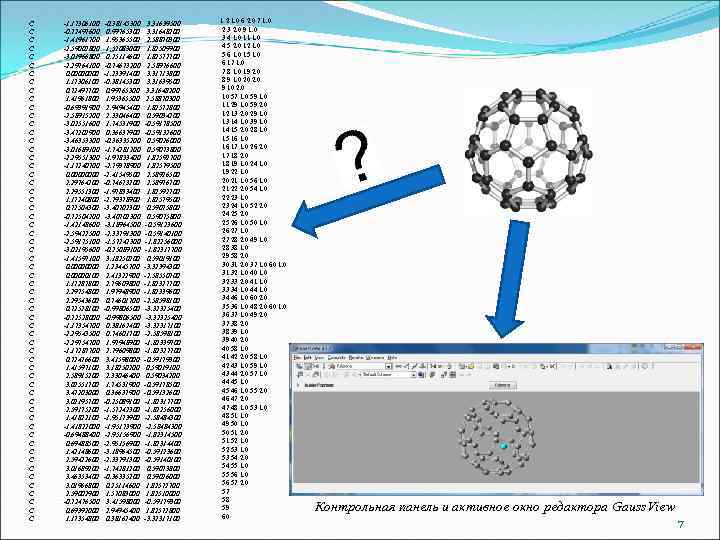 C C C C C C C C C C C C C C C -1. 17306100 -0. 72497600 -1. 41961700 -2. 59002800 -3. 01966800 -2. 29764100 0. 0000 1. 17306100 0. 72497700 1. 41961800 -0. 69391900 -2. 58915200 -3. 02551600 -3. 47202900 -3. 46353300 -3. 01689100 -2. 29551300 -1. 17240700 0. 0000 2. 29764200 2. 29551300 1. 17240800 0. 72504300 -0. 72504200 -1. 42148600 -2. 59422500 -2. 59175100 -3. 02195600 -1. 41597100 0. 00000100 1. 17287800 2. 29754800 2. 29543600 0. 72528100 -0. 72528000 -1. 17354700 -2. 29543500 -2. 29754700 -1. 17287700 0. 72476600 1. 41597100 2. 58915200 3. 02551700 3. 47203000 3. 02195700 2. 59175200 1. 41822100 -1. 41822000 -0. 69488400 0. 69488500 1. 42148600 2. 59422600 3. 01689200 3. 46353400 3. 01966800 2. 59002900 -0. 72476500 0. 69392000 1. 17354800 -0. 38145300 0. 99765300 1. 95365500 1. 57083000 0. 25114600 -0. 74673200 -1. 23391400 -0. 38145300 0. 99765300 1. 95365500 2. 94945400 2. 33046400 1. 74531900 0. 36637900 -0. 36335200 -1. 74281200 -1. 97833400 -2. 79378900 -2. 41549500 -0. 74673200 -1. 97833400 -2. 79378900 -3. 40702300 -3. 18964500 -2. 33791300 -1. 57242300 -0. 25089100 3. 18250200 1. 23445700 2. 41322900 2. 79609800 1. 97948900 0. 74601700 -0. 99806500 0. 38162400 0. 74601700 1. 97948900 2. 79609800 3. 41598000 3. 18250200 2. 33046400 1. 74531900 0. 36637900 -0. 25089100 -1. 57242300 -1. 95173900 -2. 95156900 -3. 18964500 -2. 33791300 -1. 74281200 -0. 36335200 0. 25114600 1. 57083000 3. 41598000 2. 94945400 0. 38162400 3. 31639500 3. 31648200 2. 58870300 1. 82509900 1. 82572700 2. 58976600 3. 31713800 3. 31639500 3. 31648200 2. 58870300 1. 82572800 0. 59034200 -0. 59178500 -0. 59132600 0. 59026000 0. 59073800 1. 82592700 1. 82579500 2. 58926500 2. 58976700 1. 82592700 1. 82579500 0. 59075800 -0. 59123600 -0. 59140100 -1. 82256000 -1. 82317700 0. 59019100 -3. 32394300 -2. 58550700 -1. 82327700 -1. 82339600 -2. 58598100 -3. 32325400 -3. 32317100 -2. 58598100 -1. 82339700 -1. 82327700 -0. 59179300 0. 59019100 0. 59034200 -0. 59178500 -0. 59132600 -1. 82317700 -1. 82256000 -2. 58484300 -1. 82314500 -1. 82314400 -0. 59123600 -0. 59140100 0. 59073800 0. 59026000 1. 82572700 1. 82510000 -0. 59179300 1. 82572800 -3. 32317100 1 2 1. 0 6 2. 0 7 1. 0 2 3 2. 0 9 1. 0 3 4 1. 0 11 1. 0 4 5 2. 0 12 1. 0 5 6 1. 0 15 1. 0 6 17 1. 0 7 8 1. 0 19 2. 0 8 9 1. 0 20 2. 0 9 10 2. 0 10 57 1. 0 59 1. 0 11 29 1. 0 59 2. 0 12 13 2. 0 29 1. 0 13 14 1. 0 39 1. 0 14 15 2. 0 28 1. 0 15 16 1. 0 16 17 1. 0 26 2. 0 17 18 2. 0 18 19 1. 0 24 1. 0 19 22 1. 0 20 21 1. 0 56 1. 0 21 22 2. 0 54 1. 0 22 23 1. 0 23 24 1. 0 52 2. 0 24 25 2. 0 25 26 1. 0 50 1. 0 26 27 1. 0 27 28 2. 0 49 1. 0 28 38 1. 0 29 58 2. 0 30 31 2. 0 37 1. 0 60 1. 0 31 32 1. 0 40 1. 0 32 33 2. 0 41 1. 0 33 34 1. 0 44 1. 0 34 46 1. 0 60 2. 0 35 36 1. 0 48 2. 0 60 1. 0 36 37 1. 0 49 2. 0 37 38 2. 0 38 39 1. 0 39 40 2. 0 40 58 1. 0 41 42 2. 0 58 1. 0 42 43 1. 0 59 1. 0 43 44 2. 0 57 1. 0 44 45 1. 0 45 46 1. 0 55 2. 0 46 47 2. 0 47 48 1. 0 53 1. 0 48 51 1. 0 49 50 1. 0 50 51 2. 0 51 52 1. 0 52 53 1. 0 53 54 2. 0 54 55 1. 0 55 56 1. 0 56 57 2. 0 57 58 59 60 Контрольная панель и активное окно редактора Gauss. View 7
C C C C C C C C C C C C C C C -1. 17306100 -0. 72497600 -1. 41961700 -2. 59002800 -3. 01966800 -2. 29764100 0. 0000 1. 17306100 0. 72497700 1. 41961800 -0. 69391900 -2. 58915200 -3. 02551600 -3. 47202900 -3. 46353300 -3. 01689100 -2. 29551300 -1. 17240700 0. 0000 2. 29764200 2. 29551300 1. 17240800 0. 72504300 -0. 72504200 -1. 42148600 -2. 59422500 -2. 59175100 -3. 02195600 -1. 41597100 0. 00000100 1. 17287800 2. 29754800 2. 29543600 0. 72528100 -0. 72528000 -1. 17354700 -2. 29543500 -2. 29754700 -1. 17287700 0. 72476600 1. 41597100 2. 58915200 3. 02551700 3. 47203000 3. 02195700 2. 59175200 1. 41822100 -1. 41822000 -0. 69488400 0. 69488500 1. 42148600 2. 59422600 3. 01689200 3. 46353400 3. 01966800 2. 59002900 -0. 72476500 0. 69392000 1. 17354800 -0. 38145300 0. 99765300 1. 95365500 1. 57083000 0. 25114600 -0. 74673200 -1. 23391400 -0. 38145300 0. 99765300 1. 95365500 2. 94945400 2. 33046400 1. 74531900 0. 36637900 -0. 36335200 -1. 74281200 -1. 97833400 -2. 79378900 -2. 41549500 -0. 74673200 -1. 97833400 -2. 79378900 -3. 40702300 -3. 18964500 -2. 33791300 -1. 57242300 -0. 25089100 3. 18250200 1. 23445700 2. 41322900 2. 79609800 1. 97948900 0. 74601700 -0. 99806500 0. 38162400 0. 74601700 1. 97948900 2. 79609800 3. 41598000 3. 18250200 2. 33046400 1. 74531900 0. 36637900 -0. 25089100 -1. 57242300 -1. 95173900 -2. 95156900 -3. 18964500 -2. 33791300 -1. 74281200 -0. 36335200 0. 25114600 1. 57083000 3. 41598000 2. 94945400 0. 38162400 3. 31639500 3. 31648200 2. 58870300 1. 82509900 1. 82572700 2. 58976600 3. 31713800 3. 31639500 3. 31648200 2. 58870300 1. 82572800 0. 59034200 -0. 59178500 -0. 59132600 0. 59026000 0. 59073800 1. 82592700 1. 82579500 2. 58926500 2. 58976700 1. 82592700 1. 82579500 0. 59075800 -0. 59123600 -0. 59140100 -1. 82256000 -1. 82317700 0. 59019100 -3. 32394300 -2. 58550700 -1. 82327700 -1. 82339600 -2. 58598100 -3. 32325400 -3. 32317100 -2. 58598100 -1. 82339700 -1. 82327700 -0. 59179300 0. 59019100 0. 59034200 -0. 59178500 -0. 59132600 -1. 82317700 -1. 82256000 -2. 58484300 -1. 82314500 -1. 82314400 -0. 59123600 -0. 59140100 0. 59073800 0. 59026000 1. 82572700 1. 82510000 -0. 59179300 1. 82572800 -3. 32317100 1 2 1. 0 6 2. 0 7 1. 0 2 3 2. 0 9 1. 0 3 4 1. 0 11 1. 0 4 5 2. 0 12 1. 0 5 6 1. 0 15 1. 0 6 17 1. 0 7 8 1. 0 19 2. 0 8 9 1. 0 20 2. 0 9 10 2. 0 10 57 1. 0 59 1. 0 11 29 1. 0 59 2. 0 12 13 2. 0 29 1. 0 13 14 1. 0 39 1. 0 14 15 2. 0 28 1. 0 15 16 1. 0 16 17 1. 0 26 2. 0 17 18 2. 0 18 19 1. 0 24 1. 0 19 22 1. 0 20 21 1. 0 56 1. 0 21 22 2. 0 54 1. 0 22 23 1. 0 23 24 1. 0 52 2. 0 24 25 2. 0 25 26 1. 0 50 1. 0 26 27 1. 0 27 28 2. 0 49 1. 0 28 38 1. 0 29 58 2. 0 30 31 2. 0 37 1. 0 60 1. 0 31 32 1. 0 40 1. 0 32 33 2. 0 41 1. 0 33 34 1. 0 44 1. 0 34 46 1. 0 60 2. 0 35 36 1. 0 48 2. 0 60 1. 0 36 37 1. 0 49 2. 0 37 38 2. 0 38 39 1. 0 39 40 2. 0 40 58 1. 0 41 42 2. 0 58 1. 0 42 43 1. 0 59 1. 0 43 44 2. 0 57 1. 0 44 45 1. 0 45 46 1. 0 55 2. 0 46 47 2. 0 47 48 1. 0 53 1. 0 48 51 1. 0 49 50 1. 0 50 51 2. 0 51 52 1. 0 52 53 1. 0 53 54 2. 0 54 55 1. 0 55 56 1. 0 56 57 2. 0 57 58 59 60 Контрольная панель и активное окно редактора Gauss. View 7
 1. Графический редактор Gauss. View 1. Позволяет легко конструировать рассчитываемые молекулярные и кластерные структуры в удобном и наглядном для пользователя представлении. 2. Задание используемого расчетного метод а и базиса. Создание пользовательских схем расчетов (т. е. метод, базис, выделяемый объем памяти и др. , используемые по умолчанию) позволяет сократить время на подготовку входного файла 3. Перевод результатов расчетов в графическое наглядное представление, построение различных графиков. Gauss. View позволяет визуализировать: - оптимизированную молекулярную структур, отвечающую минимуму энергии; - молекулярные орбитали; - поверхности и контуры электронной плотности; - заряды атомов и дипольные моменты; - анимацию вибрационных мод; - ИК-, ЯМР- и Рамановские спектры; 2. 1. 3. 8
1. Графический редактор Gauss. View 1. Позволяет легко конструировать рассчитываемые молекулярные и кластерные структуры в удобном и наглядном для пользователя представлении. 2. Задание используемого расчетного метод а и базиса. Создание пользовательских схем расчетов (т. е. метод, базис, выделяемый объем памяти и др. , используемые по умолчанию) позволяет сократить время на подготовку входного файла 3. Перевод результатов расчетов в графическое наглядное представление, построение различных графиков. Gauss. View позволяет визуализировать: - оптимизированную молекулярную структур, отвечающую минимуму энергии; - молекулярные орбитали; - поверхности и контуры электронной плотности; - заряды атомов и дипольные моменты; - анимацию вибрационных мод; - ИК-, ЯМР- и Рамановские спектры; 2. 1. 3. 8
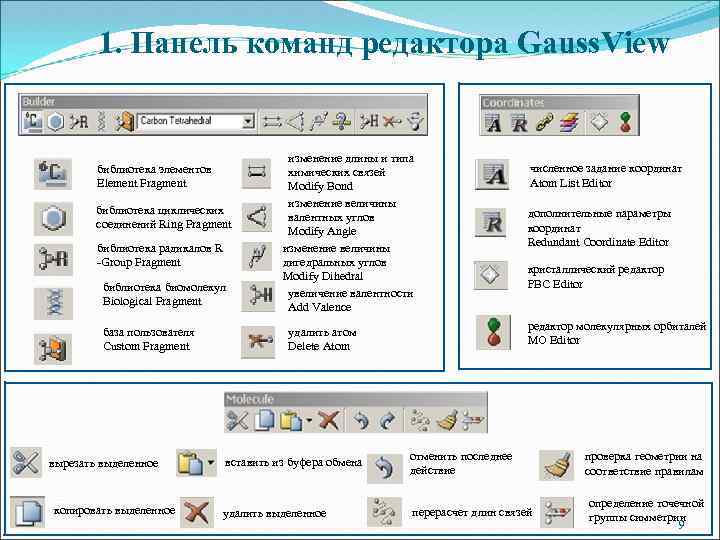 1. Панель команд редактора Gauss. View библиотека элементов Element Fragment библиотека циклических соединений Ring Fragment библиотека радикалов R -Group Fragment библиотека биомолекул Biological Fragment база пользователя Custom Fragment вырезать выделенное копировать выделенное изменение длины и типа химических связей Modify Bond изменение величины валентных углов Modify Angle изменение величины дигедральных углов Modify Dihedral увеличение валентности Add Valence численное задание координат Atom List Editor дополнительные параметры координат Redundant Coordinate Editor кристаллический редактор PBC Editor редактор молекулярных орбиталей MO Editor удалить атом Delete Atom вставить из буфера обмена отменить последнее действие удалить выделенное перерасчет длин связей проверка геометрии на соответствие правилам определение точечной группы симметрии 9
1. Панель команд редактора Gauss. View библиотека элементов Element Fragment библиотека циклических соединений Ring Fragment библиотека радикалов R -Group Fragment библиотека биомолекул Biological Fragment база пользователя Custom Fragment вырезать выделенное копировать выделенное изменение длины и типа химических связей Modify Bond изменение величины валентных углов Modify Angle изменение величины дигедральных углов Modify Dihedral увеличение валентности Add Valence численное задание координат Atom List Editor дополнительные параметры координат Redundant Coordinate Editor кристаллический редактор PBC Editor редактор молекулярных орбиталей MO Editor удалить атом Delete Atom вставить из буфера обмена отменить последнее действие удалить выделенное перерасчет длин связей проверка геометрии на соответствие правилам определение точечной группы симметрии 9
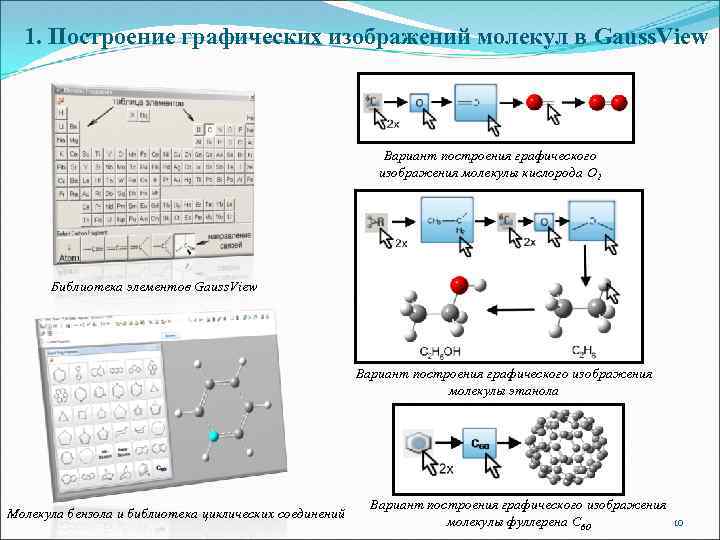 1. Построение графических изображений молекул в Gauss. View Вариант построения графического изображения молекулы кислорода О 2 Библиотека элементов Gauss. View Вариант построения графического изображения молекулы этанола Молекула бензола и библиотека циклических соединений Вариант построения графического изображения 10 молекулы фуллерена С 60
1. Построение графических изображений молекул в Gauss. View Вариант построения графического изображения молекулы кислорода О 2 Библиотека элементов Gauss. View Вариант построения графического изображения молекулы этанола Молекула бензола и библиотека циклических соединений Вариант построения графического изображения 10 молекулы фуллерена С 60
 Задания к лабораторной работе № 1 1. Получить графическое представление неорганических молекул: CO 2, NH 3, CO, NO 2, H 2 S, HF, N 2, H 2 SO 4, HNO 3, H 2 O, H 2 SO 4 (см. приложение 3 учебного пособия). 2. Получить графическое представление молекул органических молекул: бензола (С 6 Н 6), гексана (C 6 H 14), метана (СН 4), муравьиной кислоты (HCOOH), нафталина (С 10 Н 8), стирола (C 8 H 8), толуола (С 6 Н 5 СН 3), тринитротолуола (C 7 H 5 N 3 O 6), трифенилметана (C 19 H 16), уксусной кислоты (CH 3 COOH), фурана (С 4 Н 4 О), этана (C 2 H 6), этанола (C 2 H 5 OH), этилена (С 2 Н 4), хлорбензола С 6 Н 5 Cl (см. приложение 4 учебного пособия) 3. Определить число пентагонов, гексагонов, двойных и одинарных связей фуллерена С 60. 11
Задания к лабораторной работе № 1 1. Получить графическое представление неорганических молекул: CO 2, NH 3, CO, NO 2, H 2 S, HF, N 2, H 2 SO 4, HNO 3, H 2 O, H 2 SO 4 (см. приложение 3 учебного пособия). 2. Получить графическое представление молекул органических молекул: бензола (С 6 Н 6), гексана (C 6 H 14), метана (СН 4), муравьиной кислоты (HCOOH), нафталина (С 10 Н 8), стирола (C 8 H 8), толуола (С 6 Н 5 СН 3), тринитротолуола (C 7 H 5 N 3 O 6), трифенилметана (C 19 H 16), уксусной кислоты (CH 3 COOH), фурана (С 4 Н 4 О), этана (C 2 H 6), этанола (C 2 H 5 OH), этилена (С 2 Н 4), хлорбензола С 6 Н 5 Cl (см. приложение 4 учебного пособия) 3. Определить число пентагонов, гексагонов, двойных и одинарных связей фуллерена С 60. 11
 Лабораторная работа № 2 «Численное моделирование электронной структуры молекул с использованием пакета Gaussian 03» Цель работы: знакомство с основными методами расчета электронного строения молекулярных структур и кластеров, приобретение навыков моделирования в программном комплексе Gaussian 03 на примере молекулы кислорода. 12
Лабораторная работа № 2 «Численное моделирование электронной структуры молекул с использованием пакета Gaussian 03» Цель работы: знакомство с основными методами расчета электронного строения молекулярных структур и кластеров, приобретение навыков моделирования в программном комплексе Gaussian 03 на примере молекулы кислорода. 12
 2. Основные методы расчета молекулярных структур 1. Метод молекулярной динамики. Атомы рассматриваются как Ньютоновские частицы, находящиеся в силовом поле. Взаимодействие между частицами описывается потенциальной энергией, зависящей от длин связей, углов между связями, углов кручения и др. В Gaussian 03 реализованы методы UFF, Dreiding, Amber. 2. Неэмпирические методы. Для расчета электронной структуры используется информация об элементном составе, пространственном положении ядер атомов и числа электронов в системе. В расчетах применяются только фундаментальные константы, все интегралы вычисляются в рамках допущений конкретного метода. Основными неэмпирическими методами являются метод Хартри-Фока и метод теории функционала плотности. 3. Полуэмпирические методы. Используют некоторые эмпирические параметры и экспериментальные данные для расчета значений интегралов (перекрывания, кулоновских, обменных и т. д. ), вследствие чего время расчетов значительно уменьшается. Одним из основных является метод сильной связи. В Gaussian реализованы следующие полуэмпирические методы: AM 1, PM 3 MM, MNDO, MINDO/3, INDO, CNDO. Области применения методов расчетов 13
2. Основные методы расчета молекулярных структур 1. Метод молекулярной динамики. Атомы рассматриваются как Ньютоновские частицы, находящиеся в силовом поле. Взаимодействие между частицами описывается потенциальной энергией, зависящей от длин связей, углов между связями, углов кручения и др. В Gaussian 03 реализованы методы UFF, Dreiding, Amber. 2. Неэмпирические методы. Для расчета электронной структуры используется информация об элементном составе, пространственном положении ядер атомов и числа электронов в системе. В расчетах применяются только фундаментальные константы, все интегралы вычисляются в рамках допущений конкретного метода. Основными неэмпирическими методами являются метод Хартри-Фока и метод теории функционала плотности. 3. Полуэмпирические методы. Используют некоторые эмпирические параметры и экспериментальные данные для расчета значений интегралов (перекрывания, кулоновских, обменных и т. д. ), вследствие чего время расчетов значительно уменьшается. Одним из основных является метод сильной связи. В Gaussian реализованы следующие полуэмпирические методы: AM 1, PM 3 MM, MNDO, MINDO/3, INDO, CNDO. Области применения методов расчетов 13
 2. Неэмпирические методы расчета Метод Хартри-Фока (или метод самосогласованного поля), является одним из эффективных методов решения задач квантовой химии. Его идея состоит в том, что взаимодействие электрона с его окружением заменяется взаимодействием с неким усредненным полем. энергия системы: ξi - обобщенные координаты, включающие в себя пространственную и спиновую часть ψp(ξi) - нормированная одноэлектронная волновая функция для i-го электрона, находящегося на p-й орбитали, Метод теории функционала плотности (Density functional theory – DFT) метод расчёта электронной структуры систем многих частиц в квантовой физике и квантовой химии. Является одним из наиболее широко используемых и универсальных методов в вычислительной физике и вычислительной химии. Walter Kohn Первая теорема Хоэнберга—Кона утверждает, что существует взаимно однозначное соответствие между плотностью основного состояния электронной подсистемы, находящейся во внешнем потенциале атомных ядер, и самим потенциалом ядер. Нобелевская премия 1998 г. Вторая теорема утверждает, что энергия электронной подсистемы, записанная как функционал электронной плотности, имеет минимум, равный энергии основного состояния. Т - кинетическая энергия, второе слагаемое обеспечивает электростатическое отталкивание электронов. 14 Vext - потенциал взаимодействия электрона с ядрами, а Exс - обменная корреляционная энергия.
2. Неэмпирические методы расчета Метод Хартри-Фока (или метод самосогласованного поля), является одним из эффективных методов решения задач квантовой химии. Его идея состоит в том, что взаимодействие электрона с его окружением заменяется взаимодействием с неким усредненным полем. энергия системы: ξi - обобщенные координаты, включающие в себя пространственную и спиновую часть ψp(ξi) - нормированная одноэлектронная волновая функция для i-го электрона, находящегося на p-й орбитали, Метод теории функционала плотности (Density functional theory – DFT) метод расчёта электронной структуры систем многих частиц в квантовой физике и квантовой химии. Является одним из наиболее широко используемых и универсальных методов в вычислительной физике и вычислительной химии. Walter Kohn Первая теорема Хоэнберга—Кона утверждает, что существует взаимно однозначное соответствие между плотностью основного состояния электронной подсистемы, находящейся во внешнем потенциале атомных ядер, и самим потенциалом ядер. Нобелевская премия 1998 г. Вторая теорема утверждает, что энергия электронной подсистемы, записанная как функционал электронной плотности, имеет минимум, равный энергии основного состояния. Т - кинетическая энергия, второе слагаемое обеспечивает электростатическое отталкивание электронов. 14 Vext - потенциал взаимодействия электрона с ядрами, а Exс - обменная корреляционная энергия.
 2. Основные квантово-механические базисы Расчет орбиталей многоатомных систем оказывается существенно более трудоемкой задачей, чем расчет АО атомов, из-за более низкой симметрии. Поэтому используются дальнейшие приближения. Стандартный подход здесь состоит в том, что искомые орбитали представляют в виде: где χi – базисные функции, вид которых зависит от расчетного метода, n – общее число включенных в базис функций, aμi – коэффициенты, определяющие вклад базисной функции χi в собственную функцию ψμ. На данный момент широко используются следующие наборы базисных функций: - плоские волны - слэтеровские орбитали - гауссовы орбитали Наиболее простым типом базисных наборов является STO-n. G, где каждая атомная орбиталь (АО) состоит из суммы n (обычно от двух до шести) функций гауссова типа Сравнение экспоненциальной и гауссовой функции (а) и той же экспоненциальной В валентно-расщепленных базисных наборах валентные орбитали функции и комбинации трех гауссовых расщеплены на компактную и диффузную составляющие. Схема функций (b). записывается как m-np. G, где m - число гауссовых функций, заменяющих каждую внутреннюю АО, n и p - число гауссовых функций с разными значениями экспонент, аппроксимирующих каждую валентную АО. 15
2. Основные квантово-механические базисы Расчет орбиталей многоатомных систем оказывается существенно более трудоемкой задачей, чем расчет АО атомов, из-за более низкой симметрии. Поэтому используются дальнейшие приближения. Стандартный подход здесь состоит в том, что искомые орбитали представляют в виде: где χi – базисные функции, вид которых зависит от расчетного метода, n – общее число включенных в базис функций, aμi – коэффициенты, определяющие вклад базисной функции χi в собственную функцию ψμ. На данный момент широко используются следующие наборы базисных функций: - плоские волны - слэтеровские орбитали - гауссовы орбитали Наиболее простым типом базисных наборов является STO-n. G, где каждая атомная орбиталь (АО) состоит из суммы n (обычно от двух до шести) функций гауссова типа Сравнение экспоненциальной и гауссовой функции (а) и той же экспоненциальной В валентно-расщепленных базисных наборах валентные орбитали функции и комбинации трех гауссовых расщеплены на компактную и диффузную составляющие. Схема функций (b). записывается как m-np. G, где m - число гауссовых функций, заменяющих каждую внутреннюю АО, n и p - число гауссовых функций с разными значениями экспонент, аппроксимирующих каждую валентную АО. 15
 2. Использование Gaussian Calculation Setup для установки параметров расчетов Calculate → Gaussian Calculation Setup Окно Gaussian Calculation Setup Во вкладке Job Type задается тип расчета: - Energy – расчет энергии заданной молекулярной структуры; - Optimization - запуск процесса оптимизации, заключающегося в расчете равновесных расстояний и конфигураций молекулярных структур, соответствующих минимальному значению полной энергии. - Frequency - расчет вибрационного спектра; - Opt+Frequency – выполнение процесса оптимизации с последующим расчетом вибрационного спектра; - IRC – моделирование пути реакции; - Scan – сканирование поверхности потенциальной энергии; - Stability - переоптимизация волновой функции; - NMR – расчет спектра ядерно-магнитного резонанса. - Во вкладке Method пользователь задает расчетный метод, базис, спиновую мультиплетность, заряд молекулы. - В свободном поле вкладки Title указываем название файла - Максимальный объем выделяемый оперативной и памяти, место сохранения промежуточных результатов, количество используемых процессоров задается в Link 0 - В General доступны дополнительные опции расчетов (критерий сходимости, использование симметрии и др. ) 16
2. Использование Gaussian Calculation Setup для установки параметров расчетов Calculate → Gaussian Calculation Setup Окно Gaussian Calculation Setup Во вкладке Job Type задается тип расчета: - Energy – расчет энергии заданной молекулярной структуры; - Optimization - запуск процесса оптимизации, заключающегося в расчете равновесных расстояний и конфигураций молекулярных структур, соответствующих минимальному значению полной энергии. - Frequency - расчет вибрационного спектра; - Opt+Frequency – выполнение процесса оптимизации с последующим расчетом вибрационного спектра; - IRC – моделирование пути реакции; - Scan – сканирование поверхности потенциальной энергии; - Stability - переоптимизация волновой функции; - NMR – расчет спектра ядерно-магнитного резонанса. - Во вкладке Method пользователь задает расчетный метод, базис, спиновую мультиплетность, заряд молекулы. - В свободном поле вкладки Title указываем название файла - Максимальный объем выделяемый оперативной и памяти, место сохранения промежуточных результатов, количество используемых процессоров задается в Link 0 - В General доступны дополнительные опции расчетов (критерий сходимости, использование симметрии и др. ) 16
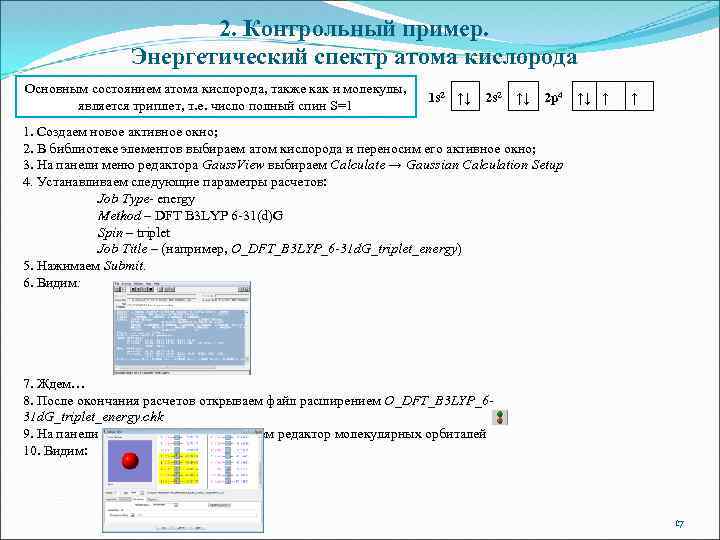 2. Контрольный пример. Энергетический спектр атома кислорода Основным состоянием атома кислорода, также как и молекулы, является триплет, т. е. число полный спин S=1 1 s 2 ↑↓ 2 p 4 ↑↓ ↑ ↑ 1. Создаем новое активное окно; 2. В библиотеке элементов выбираем атом кислорода и переносим его активное окно; 3. На панели меню редактора Gauss. View выбираем Calculate → Gaussian Calculation Setup 4. Устанавливаем следующие параметры расчетов: Job Type- energy Method – DFT B 3 LYP 6 -31(d)G Spin – triplet Job Title – (например, O_DFT_B 3 LYP_6 -31 d. G_triplet_energy) 5. Нажимаем Submit. 6. Видим: 7. Ждем… 8. После окончания расчетов открываем файл расширением O_DFT_B 3 LYP_631 d. G_triplet_energy. chk 9. На панели команд Gauss. View выбираем редактор молекулярных орбиталей 10. Видим: 17
2. Контрольный пример. Энергетический спектр атома кислорода Основным состоянием атома кислорода, также как и молекулы, является триплет, т. е. число полный спин S=1 1 s 2 ↑↓ 2 p 4 ↑↓ ↑ ↑ 1. Создаем новое активное окно; 2. В библиотеке элементов выбираем атом кислорода и переносим его активное окно; 3. На панели меню редактора Gauss. View выбираем Calculate → Gaussian Calculation Setup 4. Устанавливаем следующие параметры расчетов: Job Type- energy Method – DFT B 3 LYP 6 -31(d)G Spin – triplet Job Title – (например, O_DFT_B 3 LYP_6 -31 d. G_triplet_energy) 5. Нажимаем Submit. 6. Видим: 7. Ждем… 8. После окончания расчетов открываем файл расширением O_DFT_B 3 LYP_631 d. G_triplet_energy. chk 9. На панели команд Gauss. View выбираем редактор молекулярных орбиталей 10. Видим: 17
 2. Визуализация атомных орбиталей 1 s 2 ↑↓ 2 p 4 ↑↓ ↑ ↑ HOMO 1 a. u. =1 Хартри=27. 2 э. В потенциал ионизации определяется как энергия электронов на высшей занятой орбитали HOMO (High Occupied Molecular Orbital), взятая с противоположным знаком. Задание 1. Визуализировать электронную плотность атомных орбиталей и соотнести с электронной конфигурацией атома углерода (1 s 22 s 12 p 3) используя метод DFT B 3 LYP 6 -31(d)G Электронная плотность атомных орбиталей атома кислорода 18
2. Визуализация атомных орбиталей 1 s 2 ↑↓ 2 p 4 ↑↓ ↑ ↑ HOMO 1 a. u. =1 Хартри=27. 2 э. В потенциал ионизации определяется как энергия электронов на высшей занятой орбитали HOMO (High Occupied Molecular Orbital), взятая с противоположным знаком. Задание 1. Визуализировать электронную плотность атомных орбиталей и соотнести с электронной конфигурацией атома углерода (1 s 22 s 12 p 3) используя метод DFT B 3 LYP 6 -31(d)G Электронная плотность атомных орбиталей атома кислорода 18
 2. Gaussian Calculation Summary 1. File → Open (например, O_DFT_B 3 LYP_6 -31 d. G_trip_energy. log) 2. Results → Summary Полную энергию E многоэлектронных систем, в общем tot виде можно представить в виде следующих слагаемых: Tn – кинетическая энергия ядер: Te- кинетическая энергия электронов: Eee – энергия взаимодействия электронов между собой. Потенциал взаимодействия электронов при кулоновском взаимодействии: Основные результаты расчетов, представленные в Gaussian Calculation Summary rij – расстояние между электронами с индексами i и j. Een – энергия взаимодействия электронов с ядрами. Zα – заряд ядра α, Riα – расстояние между электроном i и ядром α. Enn- энергия взаимодействия ядер между собой. Rαβ – расстояние между ядрами с индексами α и β. 19
2. Gaussian Calculation Summary 1. File → Open (например, O_DFT_B 3 LYP_6 -31 d. G_trip_energy. log) 2. Results → Summary Полную энергию E многоэлектронных систем, в общем tot виде можно представить в виде следующих слагаемых: Tn – кинетическая энергия ядер: Te- кинетическая энергия электронов: Eee – энергия взаимодействия электронов между собой. Потенциал взаимодействия электронов при кулоновском взаимодействии: Основные результаты расчетов, представленные в Gaussian Calculation Summary rij – расстояние между электронами с индексами i и j. Een – энергия взаимодействия электронов с ядрами. Zα – заряд ядра α, Riα – расстояние между электроном i и ядром α. Enn- энергия взаимодействия ядер между собой. Rαβ – расстояние между ядрами с индексами α и β. 19
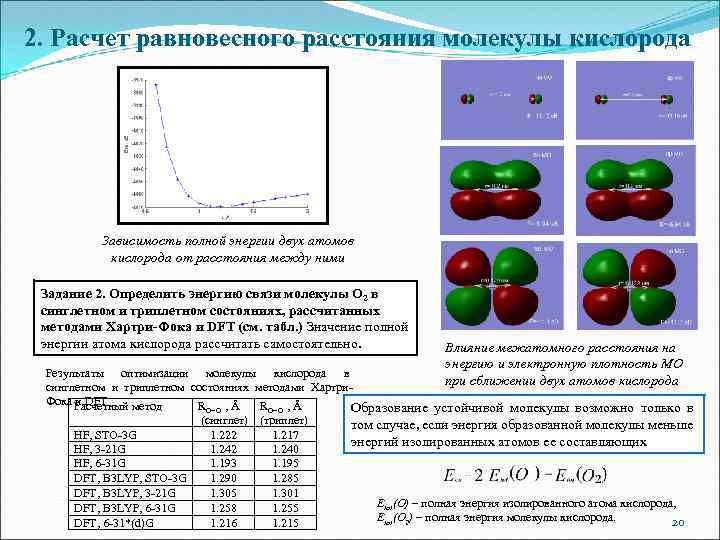 2. Расчет равновесного расстояния молекулы кислорода Зависимость полной энергии двух атомов кислорода от расстояния между ними Задание 2. Определить энергию связи молекулы O 2 в синглетном и триплетном состояниях, рассчитанных методами Хартри-Фока и DFT (см. табл. ) Значение полной энергии атома кислорода рассчитать самостоятельно. Результаты оптимизации молекулы кислорода в синглетном и триплетном состояниях методами Хартри. Фока и DFT Расчетный метод R , Å O=O (синглет) (триплет) HF, STO-3 G 1. 222 1. 217 HF, 3 -21 G 1. 242 1. 240 HF, 6 -31 G 1. 193 1. 195 DFT, B 3 LYP, STO-3 G 1. 290 1. 285 DFT, B 3 LYP, 3 -21 G 1. 305 1. 301 DFT, B 3 LYP, 6 -31 G 1. 258 1. 255 DFT, 6 -31*(d)G 1. 216 1. 215 Влияние межатомного расстояния на энергию и электронную плотность МО при сближении двух атомов кислорода Образование устойчивой молекулы возможно только в том случае, если энергия образованной молекулы меньше энергий изолированных атомов ее составляющих Etot(O) – полная энергия изолированного атома кислорода, Etot(O 2) – полная энергия молекулы кислорода. 20
2. Расчет равновесного расстояния молекулы кислорода Зависимость полной энергии двух атомов кислорода от расстояния между ними Задание 2. Определить энергию связи молекулы O 2 в синглетном и триплетном состояниях, рассчитанных методами Хартри-Фока и DFT (см. табл. ) Значение полной энергии атома кислорода рассчитать самостоятельно. Результаты оптимизации молекулы кислорода в синглетном и триплетном состояниях методами Хартри. Фока и DFT Расчетный метод R , Å O=O (синглет) (триплет) HF, STO-3 G 1. 222 1. 217 HF, 3 -21 G 1. 242 1. 240 HF, 6 -31 G 1. 193 1. 195 DFT, B 3 LYP, STO-3 G 1. 290 1. 285 DFT, B 3 LYP, 3 -21 G 1. 305 1. 301 DFT, B 3 LYP, 6 -31 G 1. 258 1. 255 DFT, 6 -31*(d)G 1. 216 1. 215 Влияние межатомного расстояния на энергию и электронную плотность МО при сближении двух атомов кислорода Образование устойчивой молекулы возможно только в том случае, если энергия образованной молекулы меньше энергий изолированных атомов ее составляющих Etot(O) – полная энергия изолированного атома кислорода, Etot(O 2) – полная энергия молекулы кислорода. 20
 Задания к лабораторной работе № 2 Задание 1. Визуализировать электронную плотность атомных орбиталей и соотнести с электронной конфигурацией атома углерода (1 s 22 s 12 p 3) используя метод DFT B 3 LYP 6 -31(d)G Задание 2. Определить энергию связи молекулы O 2 в синглетном и триплетном состояниях, рассчитанных методами Хартри-Фока и DFT (см. табл. 2. 1 учебного пособия) Значение полной энергии атома кислорода рассчитать самостоятельно. Задание 3. Построить зависимость полной энергии двух атомов углерода от расстояния между ними в интервале r от 0. 5 до 2 Å методом DFT B 3 LYP 6 -31(d)G в синглетном и триплетном состояниях. 21
Задания к лабораторной работе № 2 Задание 1. Визуализировать электронную плотность атомных орбиталей и соотнести с электронной конфигурацией атома углерода (1 s 22 s 12 p 3) используя метод DFT B 3 LYP 6 -31(d)G Задание 2. Определить энергию связи молекулы O 2 в синглетном и триплетном состояниях, рассчитанных методами Хартри-Фока и DFT (см. табл. 2. 1 учебного пособия) Значение полной энергии атома кислорода рассчитать самостоятельно. Задание 3. Построить зависимость полной энергии двух атомов углерода от расстояния между ними в интервале r от 0. 5 до 2 Å методом DFT B 3 LYP 6 -31(d)G в синглетном и триплетном состояниях. 21


