Вольфрам.ppt
- Количество слайдов: 19

Вольфрам-хімічний елемент Виконала: учениця 8 -Б класу Волкова Вікторія

Вольфрам (англ. tungsten, нім. Wolfram n) — хімічний елемент. Символ W, ат. н. 74, ат. маса — 183, 85. Сріблясто-білий метал. Найбільш характерними і стійкими є сполуки В. зі ступенем окиснення +6. В. має схильність до комплексоутворень. Металічний В. у звичайних умовах хімічно стійкий. З киснем починає взаємодіяти при т-рі вище 400 °C. Протистоїть дії води, але при т-рі червоного розжарювання легко окиснюється водяною парою. Найважливіші із сполук В. : триоксид вольфраму WO 3, вольфрамова кислота H 2 WO 4 і її солі —вольфрамати.

Історія та походження назви Назва Wolframium перейшло на елемент з мінералу вольфраму, відомого ще в XVI ст. під назвою "вовча піна" - "Spuma lupi" на латині, або "Wolf Rahm" по-німецьки. Назва була пов'язана з тим, що вольфрам, супроводжуючи олов'яні руди, заважав виплавці олова, переводячи його в піну шлаків ("пожирає олово як вовк вівцю"). В даний час в США, Великобританії і Франції для вольфраму використовують назву "tungsten" ( швед. tung sten - "Важкий камінь"). У 1781 знаменитий шведський хімік Шееле, обробляючи азотною кислотою мінерал шеєліт, отримав жовтий "важкий камінь". У 1783 іспанські хіміки брати Елюар повідомили про отримання з саксонського мінералу вольфраміту жовтої окису нового металу, розчинної в аміаку. При цьому один з братів, Фаусто, був у Швеції в 1781 і спілкувався з Шеєле. Шееле не претендував на відкриття вольфраму, а брати Елюар не наполягали на своєму пріоритеті.

Властивості атома Атомна маса (молярна маса) 183, 84 а. о. м. (г/моль) Радіус атома 141 пм Енергія іонізації (перший електрон 769, 7(7, 98) к. Дж/моль (е. В) Електронна конфігурація [Xe] 4 f 14 5 d 4 6 s 2

Поширення В. мало поширений в природі; вміст в земній корі 1, 3 х10− 4% (за масою). У вільному стані не зустрічається. Утворює власні мінерали (вольфрамати Са, Fe, Mn, іноді Pb, Zn, рідше оксиди WO 3, H 2 WO 4, ще рідше сульфіди WS 2) або входить у вигляді ізоморфної домішки в інші мінерали, переважно в мінерали Мо, Ti, а також в деякі силікати (слюда, польові шпати). Найбільш важливими мінералами В. є вольфраміт та шеєліт, які можуть утворюватися і нагромаджуватися до рівня промислових концентрацій у скарновому, ґрейзеновому і гідротермальному процесах. У природних мінеральних парагенезисах В. часто асоціює з Si, Мо, Sn, Be, Та, F, рідше — з Au, Sb, Hg.

Отримання Процес отримання вольфраму проходить через стадію виділення триоксиду WO 3 з рудних концентратів та подальшому відновленні до металевого порошку воднем при температурі бл. 700° C. Через високу температуру плавлення вольфраму для отримання компактної форми використовуються методи порошкової металургії: отриманий порошок пресують, спікають в атмосфері водню при температурі 1200— 1300° C, потім пропускають через нього електричний струм. Метал нагрівається до 3000° C, при цьому відбувається спікання в монолітний матеріал. Для подальшої очистки та отримання монокристалічної форми використовується зонна плавка Вольфрамовий порошок

Ізотопи Природний вольфрам складається з п'яти ізотопів (180 W, 182 W, 183 W, 184 W, 186 W). Штучно створені та ідентифіковані є ще 27 радіонуклідів. У 2003 відкрита надзвичайно слабка радіоактивність природного вольфраму (приблизно два розпади на грам елемента в рік), зумовлена α-активністю 180 W, який має період напіврозпаду 1, 8× 1018 років. Біологічна роль Вольфрам не відіграє значної біологічної ролі. У деяких архей і бактерій є ферменти, які включають вольфрам до свого активного центру. Існують облігатно-залежні від вольфраму форми архейгіпертермофілів, що живуть навколо глибоководних гідротермальних джерел. Присутність вольфраму в складі ферментів може розглядатися як фізіологічний релікт раннього архея — існують припущення, що вольфрам грав роль в ранніх етапах виникнення життя.

Горіння вольфрамової нитки на повітрі з утворенням оксиду вольфраму при розгерметизації колби лампи.

Властивості атома Вольфрам застосовують для легування сталі, як основу для сплавів вольфраму, в електротехніці та радіоелектроніці тощо. Металічний вольфрам Тугоплавкість та пластичність вольфраму роблять його незамінним для ниток розжарювання в освітлювальних приладах, а також в кінескопах і інших вакуумних трубках. Вольфрам використовують в якості електродів для аргоно-дугового зварювання. Сплави вольфраму отримують методом порошкової металургії. З них виготовляють хірургічні інструменти, танкову броню, оболонки торпед і снарядів, найбільш важливі деталі літаків і двигунів, контейнери для зберігання радіоактивних речовин. Сполуки вольфраму Для механічної обробки металів і неметалічних конструкційних матеріалів в машинобудівництві. Сульфід вольфраму WS 2 використовується як високотемпературне (до 500 °C) мастило. Деякі сполуки використовуються як каталізатори і пігменти. WTe 2 використовується для перетворення теплової енергії в електричну.

Фізичні властивості • • Вольфрам - світло-сірий метал, що має найвищі доведені температури плавлення і кипіння (передбачається, що Сиборг ще більш тугоплавкий, але поки що про це твердо стверджувати не можна - час існування Сиборг дуже мало). Деякі фізичні властивості наведені в таблиці (див. вище). Інші фізичні властивості вольфраму: твердість по Брінеллю 488 кг / мм. питомий електричний опір при 20 C 55 10 -9 Ом м, при 2700 C - 904 10 -9 Ом м. швидкість звуку в отожженном вольфрамі 4290 м / с. Вольфрам є одним з найбільш важких, твердих і самим тугоплавким металом. У чистому вигляді являє собою метал сріблясто-білого кольору, схожий на платину, при температурі близько 1600 C добре піддається куванню і може бути витягнуть в тонку нитку.

Хімічні властивості Валентність від 2 до 6. Найбільш стійкий 6 -валентний вольфрам. Третій 2 -валентні з'єднання вольфраму нестійкі і практичного значення не мають. Вольфрам має високу корозійну стійкість: при кімнатній температурі не змінюється на повітрі; при температурі червоного розжарювання повільно окислюється в оксид вольфраму VI; в соляній, сірчаної і плавикової кислотах майже не розчинний. В азотній кислоті і царській горілці окислюється з поверхні. У суміші азотної і плавикової кислоти розчиняється, утворюючи вольфрамову кислоту. З сполук вольфраму найбільше значення мають: триоксид вольфраму або вольфрамовий ангідрид, вольфрамати, перекисні сполуки із загальною формулою Me 2 WO X, а також сполуки з галогенами, сіркою і вуглецем. Вольфрамати схильні до утворення полімерних аніонів, у тому числі гетерополисоединений з включенням інших перехідних металів.

Металевий вольфрам • • • Нитка розжарювання Тугоплавкість і пластичність вольфраму роблять його незамінним для ниток розжарювання в освітлювальних приладах, а також у кінескопах та інших вакуумних трубках. Завдяки високій щільності вольфрам використовується для противаг, бронебійних сердечників підкаліберних і стріловидний оперених снарядів артилерійських знарядь, сердечників бронебійних куль і надшвидкісних роторів гіроскопів для стабілізації польоту балістичних ракет (до 180 тис. об / хв). Вольфрам використовують як електродів для аргонодугового зварювання. Сплави вольфраму, зважаючи на його високу температуру плавлення, отримують методом порошкової металургії. Сплави, що містять вольфрам, відрізняються жаропрочностью, кислотостійкістю, твердістю і стійкістю до стирання. З них виготовляють хірургічні інструменти (сплав "Амаль"), танкову броню, оболонки торпед і снарядів, найбільш важливі деталі літаків і двигунів, контейнери для зберігання радіоактивних речовин. Вольфрам - важливий компонент кращих марок інструментальних сталей. Карбід вольфраму (часто поряд або замість карбіду титану) використовують як наповнювач в твердих сплавах - кермети ( переможе), де матрицею служить кобальт (5 -16%). Вольфрам застосовується у високотемпературних вакуумних печах опору в якості нагрівальних елементів і теплоізоляції. Сплав вольфраму і ренію застосовується в таких печах як термопари.

Ринок вольфраму Інші сфери застосування Штучний радіонуклід 185 W використовується як радіоактивності при дослідженнях речовини. Стабільний 184 W використовується як компонент сплавів з ураном -235, що застосовуються в твердофазних ядерних ракетних двигунах, оскільки це єдиний з поширених ізотопів вольфраму, що має низький перетин захоплення теплових нейтронів (близько 2 барн).

Інші сфери застосування Штучний радіонуклід 185 W використовується як радіоактивності при дослідженнях речовини. Стабільний 184 W використовується як компонент сплавів з ураном 235, що застосовуються в твердофазних ядерних ракетних двигунах, оскільки це єдиний з поширених ізотопів вольфраму, що має низький перетин захоплення теплових нейтронів (близько 2 барн). Ринок вольфраму Ціни на металевий вольфрам чистотою близько 99% на кінець 2010 року становили близько 4042 доларів США за кілограм, в травні 2011 року становили близько 53 -55 доларів США за кілограм. Напівфабрикати від 58 USD (прутки) до 168 (тонка смуга).
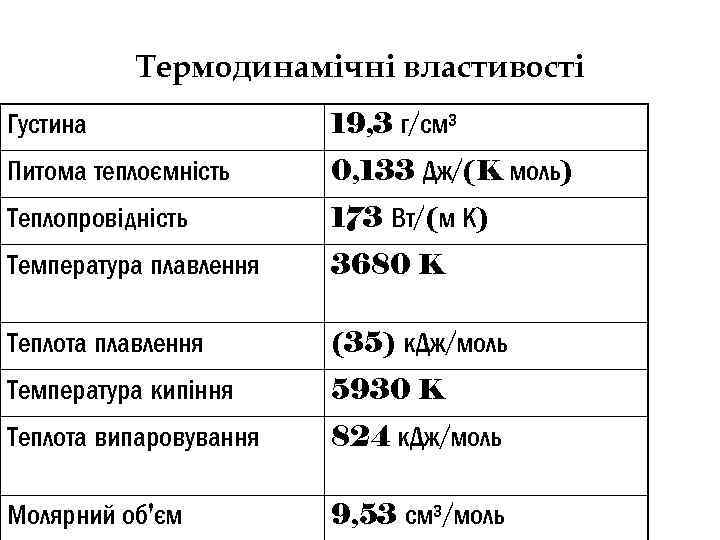
Термодинамічні властивості Густина 19, 3 г/см³ Питома теплоємність 0, 133 Дж/(K моль) Теплопровідність 173 Вт/(м К) Температура плавлення 3680 K Теплота плавлення (35) к. Дж/моль Температура кипіння 5930 K Теплота випаровування 824 к. Дж/моль Молярний об'єм 9, 53 см³/моль

Вольфрамовий дріт у лампі розжарювання.

Кристалічна ґратка Структура ґратки кубічна об'ємноцентрована Період ґратки 3, 160 Å Відношення c/a n/a Температура Дебая 310, 00 K

Сполуки вольфраму • Для механічної обробки металів і неметалевих конструкційних матеріалів в машинобудуванні ( точіння, фрезерування, стругання, довбання), буріння свердловин, в гірничодобувній промисловості широко використовуються тверді сплави та композитні матеріали на основі карбіду вольфраму (наприклад, переможе, що складається з кристалів WC в кобальтової матриці; широко застосовуються в Росії марки - ВК 2, ВК 4, ВК 6, ВК 8, ВК 15, ВК 25, Т 5 К 10, Т 15 К 6, Т 30 К 4), а також сумішей карбіду вольфраму, карбіду титану, карбіду танталу (марки ТТ для особливо важких умов обробки, наприклад, довбання і стругання поковок з жароміцних сталей і перфораторное ударноповоротне буріння міцного матеріалу). • Сульфід вольфраму WS 2 застосовується як високотемпературна (до 500 C) мастило. • Триокис вольфраму знаходить застосування для виробництва твердого електроліту високотемпературних паливних елементів. • Деякі сполуки вольфраму застосовуються як каталізатори і пігменти. • Монокристали вольфраматів ( вольфрамати свинцю, кадмію, кальцію) використовуються як сцинтиляційні детектори рентгенівського випромінювання та інших іонізуючих випромінювань в ядерної фізики та ядерній медицині. • Дітеллурід вольфраму WTe 2 застосовується для перетворення теплової енергії в електричну ( термо-ЕРС близько 57 мк. В / К).

Цікаві факти Вольфрам - найтугоплавкіший метал. Температура плавлення 3380 C, кипіння 5900 C. Щільність вольфраму майже дорівнює щільності золота: 19, 30 г / см проти 19, 32 г / см відповідно.
Вольфрам.ppt