Водород.ppt
- Количество слайдов: 17

Водород • Характеристика элемента • Особое место в ПС: электронная формула 1 S 1: • Сходство с элементами 1 группы: • проявление степени окисления +1 (восст-я активность, вытеснение малоактивных металлов из их соединений), • способность взаимодействия с неметаллами, • сходство атомных спектров.

• Сходство с элементами 17 группы: • двухатомность молекулы, ковалентная связь Н – Н и Н – Э в большинстве соединений, • проявление степени окисления – 1 (окислительные свойства), близость энергии ионизации ЕИ Н и галогенов, сходство гидридов и галогенидов, • неэлектропроводность в любом агрегатном состоянии, • закономерное изменение свойств в ряду Н-F-Cl. Br-I-At • Уникальные свойства: • один электрон, отсутствие внутренней электронной оболочки, ион H+ не имеет электронов, размер иона H+ (r =1, 5 10 6 нм) в 104 раз меньше размера атома Н (r =5, 7 10 2 нм).

Нахождение в природе • Самый распространенный элемент вселенной (92% ат. ). • В земной коре 1% масс. , 16% ат. (H 2 O, углеводороды, Н 2 в вулканических и природных газах, очень мало в виде Н и Н 2 в верхних слоях атмосферы). • Природный водород – смесь трех изотопов: протий (99, 8%), дейтерий или D (~0, 02%), тритий или Т (получен искусственно: 6 Li+ 1 n 4 He +3 H), радиоактивен: 3 H 3 He+e (Т 1/2=12, 5 лет).

Физические свойства • Молекула двухатомна Н 2. • Бесцветный газ, без вкуса и запаха, Тпл, = 259°С, Ткип = 253°С, мало растворим в воде (0, 02 объема на 1 объем H 2 O при 0°С), хорошо растворим во многих металлах - Zr, Ni, Co, металлах платиновой группы (особенно в палладии - до 900 объёмов на 1 объём Pd), самый легкий из газов (ρ=0, 0897 г/л). Жидкий водород бесцветная и очень легкая жидкость (плотность при − 253 °C 0, 0708 г/см 3). Твердый водород (Тпл. = 259°С), плотность 0, 0807 г/см 3 (при − 262°C) снегоподобная масса. Считается, что высоком давлении водород переходит в металлическое состояние; возможно, именно в таком состоянии он находится в ядрах планет-гигантов.

• Для водорода характерен особый вид аллотропии, связанный с различной ориентацией ядерных спинов в молекуле Н 2. В молекулах ортоводорода (о-Н 2) параллельная ориентация ядерных спинов, в молекулах пара-водорода (п-Н 2) антипараллельная. Это обусловливает некоторое различие магнитных, оптических и термических свойств указанных модификаций, но в химическом отношении они совершенно идентичны. При обычных и высоких температурах Н 2 представляет собой смесь 75% орто- и 25% пара-модификаций, которые могут взаимно превращаться друг в друга (орто-пара-превращение): • о-Н 2 п-Н 2 ΔНо= 1418 Дж/моль. • Такое превращение характерно и для других изотопов водорода.

Получение • В промышленности: конверсия (высоко t°, каталитическое (Fe 2 O 3 с добавками Cr 2 O 3, Al 2 O 3, K 2 O и др. )восстановление) метана: СН 4 + H 2 O=СО + 3 Н 2 ; 2 СН 4 + O 2 = 2 СО + 4 Н 2; • СО + H 2 O = СО 2 + Н 2 • Газификация твердого топлива (пропускание водяного пара над раскаленным углем): С + H 2 O=(СО + Н 2); ΔНо >0 для поддержания t° пропускание H 2 O чередуют с пропусканием воздуха: 2 С + O 2 =2 СО; ΔНо 0 • В результате получается смесь (СО и Н 2) водяной газ при отделении СО (окисление до СО 2 и поглощение его раствором Na. OH) получают Н 2. • Выделение Н 2 из коксового газа и газов переработки нефти глубоким охлаждением (все газы, кроме Н 2 сжижаются). • Водород высокой чистоты получают электролизом водных растворов щелочей. • В лаборатории: взаимодействие цинка с HCl или Н 2 SО 4, электролиз водных растворов Na. OH или KOH.

Химические свойства • Водород реагирует со многими простыми и сложными веществами, образуя соединения трёх типов: • солеподобные гидриды активных металлов (Li. H, Ca. H 2 и др) • ковалентные водородные соединения р-элементов (B 2 H 6, CH 4, NH 3, Н 2 O, HF и др. ), • металлоподобные фазы (d- и f-элементов). • Молекула Н 2 очень прочная (ЕСВ =436 к. Дж/моль), диссоциация на атомы может происходить при: • t° выше 2000°С (0, 13% при 2500°С, 95% при 5000°С); • действии электрического разряда или УФО; • при растворении Н 2 в некоторых металлах (Ni, Co, Pt, Pd); • при химических реакциях в момент выделения. • Атомарный водород имеет большую химическую активность (при обычной t° реагирует с со многими металлами и неметаллами). Существует ~1 сек.

• Молекулярный водород менее реакционноспособен (из-за прочности молекул Н 2); непосредственно реагирует с наиболее активными из неметаллов (F 2 при − 250°С со взрывом, с Сl 2 на свету или при поджигании). Для инициирования реакций с другими веществами требуется нагрев или другие способы активации (катализатор). • Са + Н 2 =Са. Н 2 Сu. O+ Н 2 =Сu+Н 2 O • N 2 + 3 H 2 =2 NH 3 O 2 + 2 H 2 =2 Н 2 O • S + H 2 =H 2 S; WO 3+ 3 Н 2 =W+3 Н 2 O • Смесь Н 2 и О 2 (гремучий газ (от 4 до 95% об. Н 2)) при поджигании сильно взрывает.
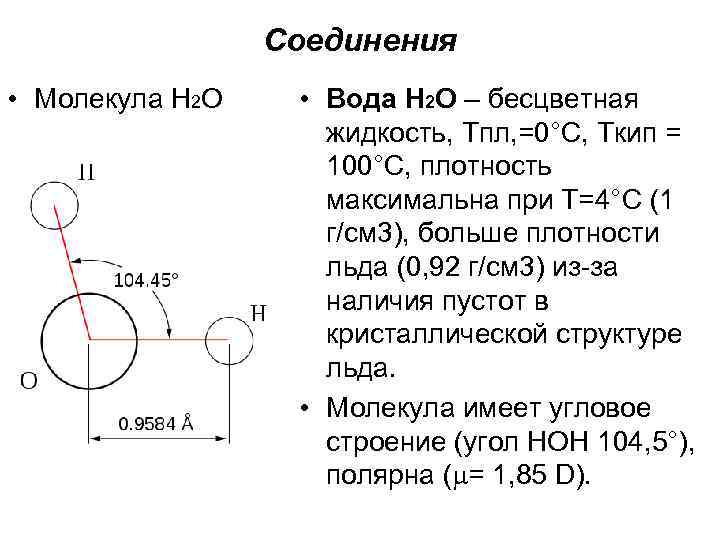
Соединения • Молекула Н 2 O • Вода Н 2 O – бесцветная жидкость, Тпл, =0°С, Ткип = 100°С, плотность максимальна при Т=4°С (1 г/см 3), больше плотности льда (0, 92 г/см 3) из-за наличия пустот в кристаллической структуре льда. • Молекула имеет угловое строение (угол НОН 104, 5°), полярна ( = 1, 85 D).
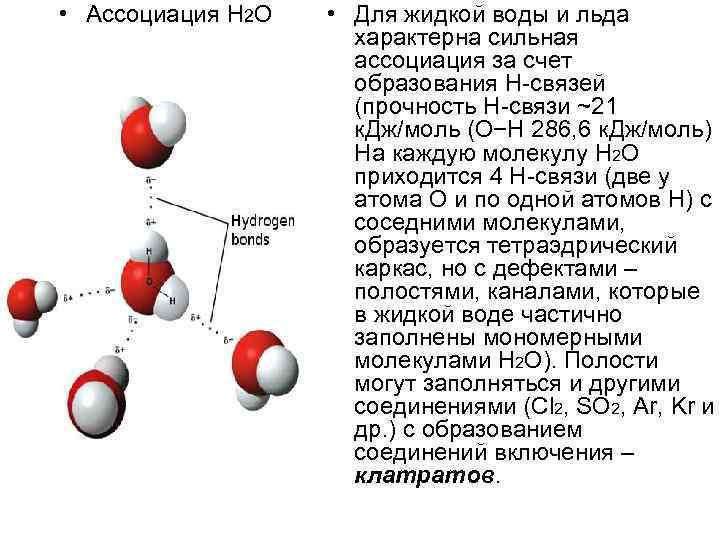
• Ассоциация Н 2 O • Для жидкой воды и льда характерна сильная ассоциация за счет образования Н-связей (прочность Н-связи ~21 к. Дж/моль (О−Н 286, 6 к. Дж/моль) На каждую молекулу Н 2 O приходится 4 Н-связи (две у атома О и по одной атомов Н) с соседними молекулами, образуется тетраэдрический каркас, но с дефектами – полостями, каналами, которые в жидкой воде частично заполнены мономерными молекулами Н 2 O). Полости могут заполняться и другими соединениями (Cl 2, SO 2, Ar, Kr и др. ) с образованием соединений включения – клатратов.

Химические свойства воды • Вода является идеальным амфолитом: Н 2 O↔H++ ОH , ионы H+ в воде мгновенно гидратируются с образованием ионов гидроксония H 3 О+, поэтому вернее: 2 Н 2 O↔H 3 О++ ОH Проявляет свойства восстановителя и окислителя: • 2 Н 2 O+2 e Н 2+ 2 ОH ( = 0, 059 p. H) • 2 Н 2 O 4 e 4 H++ O 2 ( =1, 23 0, 059 p. H) • Восстановление Н 2 O: действие активных металлов и некоторых ионов с малым (нехарактерным) зарядом: • 2 К+2 Н 2 O=2 КОН+Н 2; Cr 2++2 Н 2 O= Cr 3++Н 2+2 ОH (медленно) • Окисление Н 2 O: действие фтора, озона и некоторых других сильных окислителей: • 4 KMn. О 4+2 Н 2 O= 3 O 2+ 4 Mn. О 2+4 КОН • Водяной пар катализатор многих процессов (в сухом О 2 не окисляется Na, белый фосфор, СО) • Осушители газов и жидкостей – поглотители воды (Р 2 О 5, Mg(Cl. О 4)2, Н 2 SО 4(конц), Са. О, Са. Сl 2, Са. H 2, KOH, Na. OH и др. ) уменьшают содержание Н 2 O до определенного предела (р насыщ. пара над гидратированным осушителем)

• Тяжелая вода D 2 O Отличия в физических параметрах изотопов оказывают влияние и на соединения. Дейтериевая (тяжелая) вода (один (DНO) или оба (D 2 O)атома Н являются дейтерием) Тпл, =3, 82°С, Ткип = 101, 42°С, плотность 1, 1050 г/см 3 (20°С) (на 10% больше обычной воды); Заметно различаются энтальпии растворения солей, константы диссоциации кислот в Н 2 O и D 2 O. Она вредна для живых организмов. • Тритиевая вода Т 2 O затвердевает и закипает при еще более высоких температурах; она также опасна для живых организмов вследствие радиоактивности.

• Пероксид водорода Н 2 O 2 • Вязкая бесцветная жидкость Тпл, = 0, 43°С, (Ткип = 150°С – расчет), на свету легко разлагается, особенно бурно с катализаторами (Mn. O 2, высокодисперсные Pt, Ag, многие ионы d-элементов (Cu 2+, Fe 3+, Mn 2+и др. ); для предотвращения разложения добавляют стабилизаторы (например, Na 4 Р 2 O 7 (пирофосфат Na связывает ионы dэлементов в прочные комплексы)), хранят в темноте. Н 2 O 2 взрывается при соприкосновении с окисляющейся органикой; обычно используют 30%-й водный раствор называемый пергидролем.
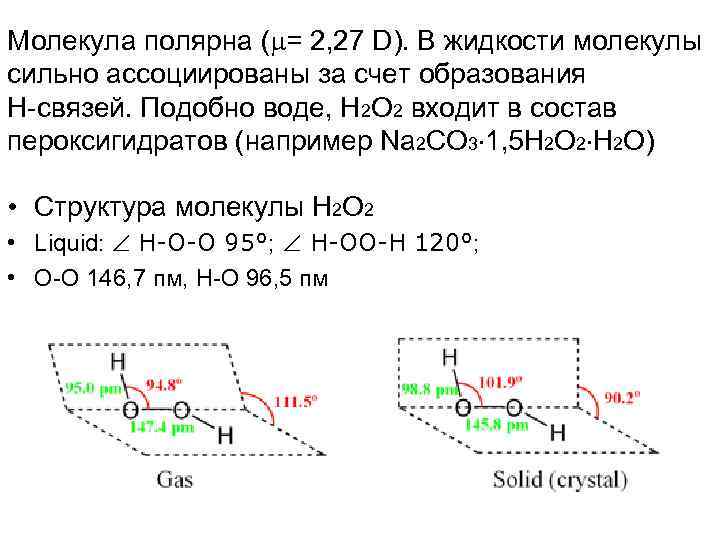
Молекула полярна ( = 2, 27 D). В жидкости молекулы сильно ассоциированы за счет образования Н-связей. Подобно воде, Н 2 O 2 входит в состав пероксигидратов (например Na 2 CO 3 1, 5 Н 2 O 2 Н 2 O) • Структура молекулы Н 2 O 2 • Liquid: Н-О-О 95°; Н-ОО-Н 120°; • О-О 146, 7 пм, Н-О 96, 5 пм

Получение Н 2 O 2 • В промышленности: • 1) электрохимическое окисление Н 2 SО 4: SО 42 2 e S 2 О 82 , • при нагревании полученного водного раствора пероксодисерной кислоты образуется Н 2 O 2, который отделяют от Н 2 SО 4 перегонкой под вакуумом: Н 2 S 2 О 8+2 Н 2 O = 2 Н 2 SО 4+ Н 2 O 2 • 2) каталитическое окисление органических веществ (например, изопропанола): • (СН 3)2 -СН-ОН+О 2=(СН 3)2 -СО+Н 2 O 2 • В лаборатории: • Ва. O 2 +Н 2 SО 4(разб)= Ва. SО 4 +Н 2 O 2

Химические свойства Н 2 O 2 • • • Н 2 O 2 - очень слабая кислота (Кд =1, 4 10 12). Разложение: 2 Н 2 O 2= 2 Н 2 O + O 2 Сильный окислитель: Н 2 O 2+2 e 2 OH (p. H 7) Н 2 O 2+2 H++2 e 2 Н 2 O (p. H 7) KI+ Н 2 O 2 +Н 2 SО 4= I 2 +K 2 SО 4 +2 Н 2 O 2 KI+ Н 2 O 2 = I 2 +2 KOH 2 K 3[Cr(OH)6] +3 Н 2 O 2= K 2 Cr. О 4 +2 KOH +8 Н 2 O Pb. S+3 Н 2 O 2= Pb. SО 4 +4 Н 2 O (реставрация) С сильными окислителями – восстановитель: Н 2 O 2 +2 OH 2 e Н 2 O+ O 2 (p. H 7) Н 2 O 2 2 e 2 H++ O 2 (p. H 7) 2 KMn. О 4+5 Н 2 O 2+3 Н 2 SО 4= 5 O 2+K 2 SО 4+ Mn. SО 4+8 Н 2 O

Применение водорода и его соединений • В промышленности для синтеза NH 3, НСl, метанола, получения жиров, восстановления металлов, кислород-водородное пламя (2200°С) для сварки и резки металлов, выращивания кристаллов искусственных рубинов, изумрудов и др. ), перспективное топливо. • Дейтерий и тритий – для проведения термоядерной реакции. • Мировое потребление водорода - более 1 млн. тонн в год. • Тяжелая вода замедлитель нейтронов в ядерных реакторах. • Пероксид водорода как окислитель (отбеливание, дезинфекция, антисептик), реактивная техника (ФАУ 1, 2)
Водород.ppt