 ВОДОРОД И ЕГО СВОЙСТВА
ВОДОРОД И ЕГО СВОЙСТВА
 ПЛАН 1. 2. 3. 4. 5. 6. 7. 8. Строение атома водорода и его положение в периодической системе Изотопы водорода Водород в природе Открытие и получение водорода Физические свойства водорода Химические свойства водорода Соединения водорода: гидриды металлов, водородные соединения неметаллов, пероксид водорода Применение водорода
ПЛАН 1. 2. 3. 4. 5. 6. 7. 8. Строение атома водорода и его положение в периодической системе Изотопы водорода Водород в природе Открытие и получение водорода Физические свойства водорода Химические свойства водорода Соединения водорода: гидриды металлов, водородные соединения неметаллов, пероксид водорода Применение водорода
 СТРОЕНИЕ АТОМА И ПОЛОЖЕНИЕ В ПС № 1; 1 электрон, 1 протон; Энергия ионизации – 1323 кдж/моль; В ПС – двойственное положение 1. 1 электрон на внешнем уровне 2. Восстановитель 1. Предшествует инертному газу (гелию) 2. Двухатомная молекула 3. В твердом состоянии – диэлектрик 4. С металлами образует солеподобные вещества 5. Большое значение энергии ионизации
СТРОЕНИЕ АТОМА И ПОЛОЖЕНИЕ В ПС № 1; 1 электрон, 1 протон; Энергия ионизации – 1323 кдж/моль; В ПС – двойственное положение 1. 1 электрон на внешнем уровне 2. Восстановитель 1. Предшествует инертному газу (гелию) 2. Двухатомная молекула 3. В твердом состоянии – диэлектрик 4. С металлами образует солеподобные вещества 5. Большое значение энергии ионизации
 МОДЕЛЬ АТОМА ВОДОРОДА Модель протия Водород, сжатый до состояния металла
МОДЕЛЬ АТОМА ВОДОРОДА Модель протия Водород, сжатый до состояния металла
 ИЗОТОПЫ ВОДОРОДА Три изотопа известны, четвертый получен искусственно Н 11 - протий; Н 21 - дейтерий; Н 31 - тритий; Н 41 – получен в лаборатории.
ИЗОТОПЫ ВОДОРОДА Три изотопа известны, четвертый получен искусственно Н 11 - протий; Н 21 - дейтерий; Н 31 - тритий; Н 41 – получен в лаборатории.
 ВОДОРОД В ПРИРОДЕ На каждые 100 атомов – 17 атомов водорода; На земле – 1% (по массе) Превращение водорода в гелий – светимость звезд За 1 сек. Уменьшение массы Солнца - 4 млн. тонн, 1% энергии достигает Земли При термоядерном взрыве самой большой мощности 1 кг вещества превращается в энергию « 1 г» протонов выделяет в 20 млн раз больше энергии, чем 1 г каменного угля
ВОДОРОД В ПРИРОДЕ На каждые 100 атомов – 17 атомов водорода; На земле – 1% (по массе) Превращение водорода в гелий – светимость звезд За 1 сек. Уменьшение массы Солнца - 4 млн. тонн, 1% энергии достигает Земли При термоядерном взрыве самой большой мощности 1 кг вещества превращается в энергию « 1 г» протонов выделяет в 20 млн раз больше энергии, чем 1 г каменного угля
 ОТКРЫТИЕ И ПОЛУЧЕНИЕ ВОДОРОДА Р. Бойль – «горючее тело» 1766, Г. Кавендиш – совйства водорода; 1783, А. Лавуазье, «железопаровой способ» , hydrohenium; В лаборатории – аппарат Киппа; В промышленности – из природного газа, из коксового газа, электролизом воды
ОТКРЫТИЕ И ПОЛУЧЕНИЕ ВОДОРОДА Р. Бойль – «горючее тело» 1766, Г. Кавендиш – совйства водорода; 1783, А. Лавуазье, «железопаровой способ» , hydrohenium; В лаборатории – аппарат Киппа; В промышленности – из природного газа, из коксового газа, электролизом воды
 ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА Существует 12 разновидностей водорода! Молекула – неполярна, расстояние между ядрами – 7, 4 • 10 -11 м, Н+Н = НН, Δ Н=-436, 7 кдж; Диссоциирует на 64% при 40000; Имеет аллотропные модификации: орто- и пара водород (3: 1) Ортоводород: протоны вращаются в одну сторону Параводород: протоны вращаются в разные стороны Пара ē – в невозбужденном состоянии, σs 2 - связывающая орбиталь Температура плавления - -254, 40 С, температура кипения - -249, 60 С Есть предположение: р=2, 02 • 10 -11 н/м металлоподобная структура: в узлах – протоны, ē- свободны
ФИЗИЧЕСКИЕ СВОЙСТВА ВОДОРОДА Существует 12 разновидностей водорода! Молекула – неполярна, расстояние между ядрами – 7, 4 • 10 -11 м, Н+Н = НН, Δ Н=-436, 7 кдж; Диссоциирует на 64% при 40000; Имеет аллотропные модификации: орто- и пара водород (3: 1) Ортоводород: протоны вращаются в одну сторону Параводород: протоны вращаются в разные стороны Пара ē – в невозбужденном состоянии, σs 2 - связывающая орбиталь Температура плавления - -254, 40 С, температура кипения - -249, 60 С Есть предположение: р=2, 02 • 10 -11 н/м металлоподобная структура: в узлах – протоны, ē- свободны
 ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА Малоактивен Н- ē Н+ ; Δ Н >0 Н+ ē Н- ; Δ Н <0 Окислитель: 2 Na+H 2 =2 Na. H Восстановитель: Н 2 + Cl 2 = 2 НCl
ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА Малоактивен Н- ē Н+ ; Δ Н >0 Н+ ē Н- ; Δ Н <0 Окислитель: 2 Na+H 2 =2 Na. H Восстановитель: Н 2 + Cl 2 = 2 НCl
 ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия: Н 2 = 2 Н − 432 к. Дж
ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА Молекулы водорода достаточно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия: Н 2 = 2 Н − 432 к. Дж
 ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция: Ca + Н 2 = Са. Н 2 и с единственным неметаллом — фтором, образуя фтороводород: F 2 + H 2 = 2 HF
ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция: Ca + Н 2 = Са. Н 2 и с единственным неметаллом — фтором, образуя фтороводород: F 2 + H 2 = 2 HF
 ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении: О 2 + 2 Н 2 = 2 Н 2 О Он может «отнимать» кислород от некоторых оксидов, например: Cu. O + Н 2 = Cu + Н 2 O Записанное уравнение отражает восстановительные свойства водорода.
ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении: О 2 + 2 Н 2 = 2 Н 2 О Он может «отнимать» кислород от некоторых оксидов, например: Cu. O + Н 2 = Cu + Н 2 O Записанное уравнение отражает восстановительные свойства водорода.
 ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА N 2 + 3 H 2 → 2 NH 3 С галогенами образует галогеноводороды: F 2 + H 2 → 2 HF, реакция протекает со взрывом в темноте и при любой температуре, Cl 2 + H 2 → 2 HCl, реакция протекает со взрывом, только на свету. С сажей взаимодействует при сильном нагревании: C + 2 H 2 → CH 4
ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА N 2 + 3 H 2 → 2 NH 3 С галогенами образует галогеноводороды: F 2 + H 2 → 2 HF, реакция протекает со взрывом в темноте и при любой температуре, Cl 2 + H 2 → 2 HCl, реакция протекает со взрывом, только на свету. С сажей взаимодействует при сильном нагревании: C + 2 H 2 → CH 4
 ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА Взаимодействие со щелочными и щёлочноземельными металлами При взаимодействии с активными металлами водород образует гидриды: 2 Na + H 2 → 2 Na. H Ca + H 2 → Ca. H 2 Mg + H 2 → Mg. H 2 Гидриды — солеобразные, твёрдые вещества, легко гидролизуются: Ca. H 2 + 2 H 2 O → Ca(OH)2 + 2 H 2↑
ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА Взаимодействие со щелочными и щёлочноземельными металлами При взаимодействии с активными металлами водород образует гидриды: 2 Na + H 2 → 2 Na. H Ca + H 2 → Ca. H 2 Mg + H 2 → Mg. H 2 Гидриды — солеобразные, твёрдые вещества, легко гидролизуются: Ca. H 2 + 2 H 2 O → Ca(OH)2 + 2 H 2↑
 ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА Получение гидрида алюминия: Используемый сегодня принципиальный метод получения чистого гидрида алюминия из гидрида лития в среде диэтилового эфира был предложен ещё в 1947 году: Al. Cl 3 +4 Li. H = Li. Al. H 4 + 3 Li. Cl Al. Cl 3 + 3 Li. Al. H 4 = 4 Al. H 3 + 3 Li. Cl
ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА Получение гидрида алюминия: Используемый сегодня принципиальный метод получения чистого гидрида алюминия из гидрида лития в среде диэтилового эфира был предложен ещё в 1947 году: Al. Cl 3 +4 Li. H = Li. Al. H 4 + 3 Li. Cl Al. Cl 3 + 3 Li. Al. H 4 = 4 Al. H 3 + 3 Li. Cl
 ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА Взаимодействие с оксидами металлов (как правило, d-элементов) Оксиды восстанавливаются до металлов: Co. O + H 2 → Co + H 2 O Fe 2 O 3 + 3 H 2 → 2 Fe + 3 H 2 O WO 3 + 3 H 2 → W + 3 H 2 O Гидрирование органических соединений Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования.
ХИМИЧЕСКИЕ СВОЙСТВА ВОДОРОДА Взаимодействие с оксидами металлов (как правило, d-элементов) Оксиды восстанавливаются до металлов: Co. O + H 2 → Co + H 2 O Fe 2 O 3 + 3 H 2 → 2 Fe + 3 H 2 O WO 3 + 3 H 2 → W + 3 H 2 O Гидрирование органических соединений Молекулярный водород широко применяется в органическом синтезе для восстановления органических соединений. Эти процессы называют реакциями гидрирования.
 СОЕДИНЕНИЯ ВОДОРОДА 1. Гидриды металлов и неметаллов KH+H 2 O = KOH + H 2 2. Водородные соединения неметаллов 3. Металлоподобные соединения с d-и fэлементами: Al. Cl 3 +4 Li. H Li. Al. H 4 + 3 Li. Cl (С Н ) 0 Al. Cl 3 + 3 Li. Al. H 4 4 Al. H 3 + 3 Li. Cl (С Н ) 0 2 5 2
СОЕДИНЕНИЯ ВОДОРОДА 1. Гидриды металлов и неметаллов KH+H 2 O = KOH + H 2 2. Водородные соединения неметаллов 3. Металлоподобные соединения с d-и fэлементами: Al. Cl 3 +4 Li. H Li. Al. H 4 + 3 Li. Cl (С Н ) 0 Al. Cl 3 + 3 Li. Al. H 4 4 Al. H 3 + 3 Li. Cl (С Н ) 0 2 5 2
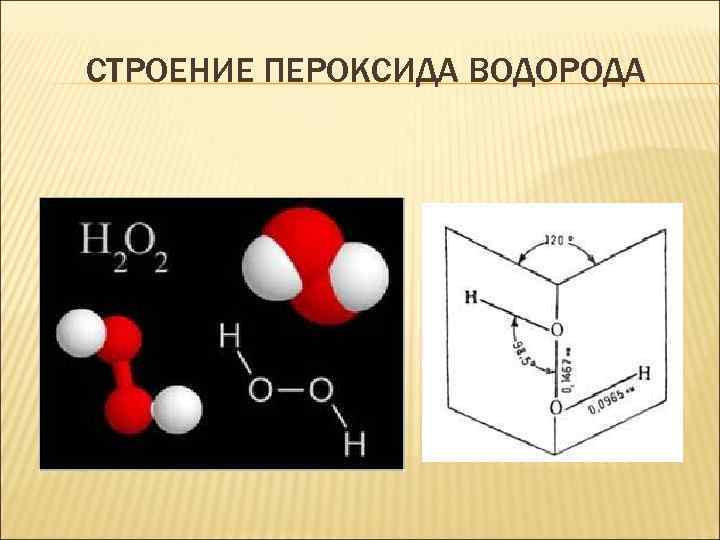 СТРОЕНИЕ ПЕРОКСИДА ВОДОРОДА
СТРОЕНИЕ ПЕРОКСИДА ВОДОРОДА
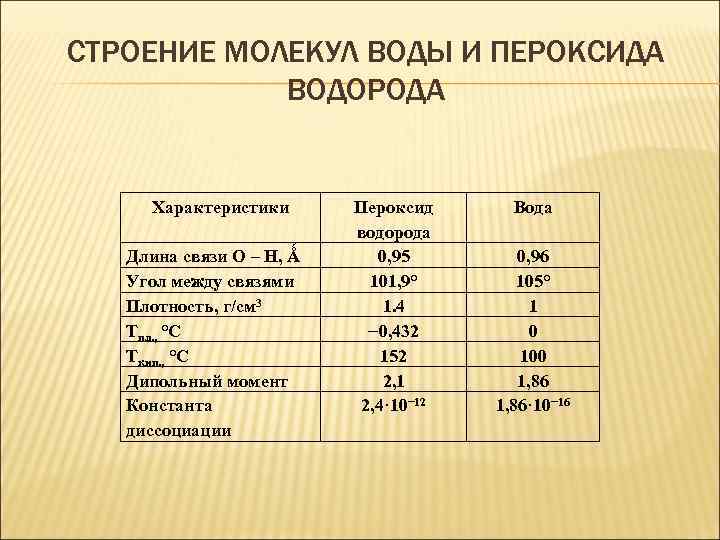 СТРОЕНИЕ МОЛЕКУЛ ВОДЫ И ПЕРОКСИДА ВОДОРОДА Характеристики Длина связи О – Н, Ǻ Угол между связями Плотность, г/см 3 Тпл. , °С Ткип. , °С Дипольный момент Константа диссоциации Пероксид водорода 0, 95 101, 9° 1. 4 − 0, 432 152 2, 1 2, 4· 10− 12 Вода 0, 96 105° 1 0 100 1, 86· 10− 16
СТРОЕНИЕ МОЛЕКУЛ ВОДЫ И ПЕРОКСИДА ВОДОРОДА Характеристики Длина связи О – Н, Ǻ Угол между связями Плотность, г/см 3 Тпл. , °С Ткип. , °С Дипольный момент Константа диссоциации Пероксид водорода 0, 95 101, 9° 1. 4 − 0, 432 152 2, 1 2, 4· 10− 12 Вода 0, 96 105° 1 0 100 1, 86· 10− 16
 ПЕРОКСИД ВОДОРОДА H 2 O 2 ; H 2 O 2 = H 2 O + O; O+O=O 2; O 22 - - ион - окислитель O 22 - + 2ē 2 O 2 - ;
ПЕРОКСИД ВОДОРОДА H 2 O 2 ; H 2 O 2 = H 2 O + O; O+O=O 2; O 22 - - ион - окислитель O 22 - + 2ē 2 O 2 - ;
 ПРИМЕНЕНИЕ ВОДОРОДА Синтез аммиак Синтез метанола Синтез хлороводорода Гидрирование жиров Гидрогенизация топлива Сварка резка плавка Реактивное топливо Экологически чистое горючее Органический синтез Ядерные реакции (Д, Т)
ПРИМЕНЕНИЕ ВОДОРОДА Синтез аммиак Синтез метанола Синтез хлороводорода Гидрирование жиров Гидрогенизация топлива Сварка резка плавка Реактивное топливо Экологически чистое горючее Органический синтез Ядерные реакции (Д, Т)


