ггеохимия2-миграц2014-2015.ppt
- Количество слайдов: 45
 ВОДНАЯ МИГРАЦИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Водная миграция химических элементов - важнейшая часть переноса и перераспределения атомов в земных недрах. Факторы (внешние и внутренние) миграции химических элементов в подземных водах. Коэффициенты водной миграции. Ряды водной миграции. Подвижность химических элементов в водах и методы ее определения. Формы миграции химических элементов в подземных водах. Методы изучения форм миграции. Методы расчета миграционных форм химических элементов в подземных водах. Геохимические барьеры. Общие понятия, типы геохимических барьеров. Роль геохимических барьеров в миграции элементов. Особенности миграции и концентрирования химических элементов в различных типах природных вод. Оценка форм миграции макроэлементов в природных водах средствами пакета Hydro. Geo. Оценка форм миграции микроэлементов в природных водах средствами пакета Hydro. Geo.
ВОДНАЯ МИГРАЦИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Водная миграция химических элементов - важнейшая часть переноса и перераспределения атомов в земных недрах. Факторы (внешние и внутренние) миграции химических элементов в подземных водах. Коэффициенты водной миграции. Ряды водной миграции. Подвижность химических элементов в водах и методы ее определения. Формы миграции химических элементов в подземных водах. Методы изучения форм миграции. Методы расчета миграционных форм химических элементов в подземных водах. Геохимические барьеры. Общие понятия, типы геохимических барьеров. Роль геохимических барьеров в миграции элементов. Особенности миграции и концентрирования химических элементов в различных типах природных вод. Оценка форм миграции макроэлементов в природных водах средствами пакета Hydro. Geo. Оценка форм миграции микроэлементов в природных водах средствами пакета Hydro. Geo.
 ВОДНАЯ МИГРАЦИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Основоположники геохимии В. И. Вернадский, А. Е. Ферсман, В. М. Гольдшмидт и др. придавали огромное значение миграции химических элементов в земной коре, полагая, что законы ее определяющие являются важнейшими в геохимии. Водную миграцию элементов наиболее полно изучали Б. Б. Полынов, А. И. Перельман, А. М. Овчинников, П. А. Удодов и многие другие.
ВОДНАЯ МИГРАЦИЯ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Основоположники геохимии В. И. Вернадский, А. Е. Ферсман, В. М. Гольдшмидт и др. придавали огромное значение миграции химических элементов в земной коре, полагая, что законы ее определяющие являются важнейшими в геохимии. Водную миграцию элементов наиболее полно изучали Б. Б. Полынов, А. И. Перельман, А. М. Овчинников, П. А. Удодов и многие другие.
 Водная миграция химических элементов — важнейшая часть переноса и перераспределения атомов в земных недрах. Водная миграция — это непрерывный обменный процесс, результаты которого особенно ярко проявляются за геологически длительное время.
Водная миграция химических элементов — важнейшая часть переноса и перераспределения атомов в земных недрах. Водная миграция — это непрерывный обменный процесс, результаты которого особенно ярко проявляются за геологически длительное время.
 Академик А. Е. Ферсман предложил различать внутренние и внешние факторы миграции. К внутренним факторам он относил свойства химических элементов образовывать летучие или растворимые соединения, осаждаться из растворов и расплавов, сорбироваться и т. д. Все эти свойства определяются строением атомов. К внешним факторам относятся параметры обстановки миграции — температура Т, давление Р, кислотно щелочные р. Н и окислительно восстановительные Eh характеристики растворов и т. д. Параметры среды (р. Н, Eh и сумма солей) имеют особо важное значение в миграции элементов.
Академик А. Е. Ферсман предложил различать внутренние и внешние факторы миграции. К внутренним факторам он относил свойства химических элементов образовывать летучие или растворимые соединения, осаждаться из растворов и расплавов, сорбироваться и т. д. Все эти свойства определяются строением атомов. К внешним факторам относятся параметры обстановки миграции — температура Т, давление Р, кислотно щелочные р. Н и окислительно восстановительные Eh характеристики растворов и т. д. Параметры среды (р. Н, Eh и сумма солей) имеют особо важное значение в миграции элементов.
 Рассмотренные выше закономерности в распределении р. Н и Eh подземных вод позволили А. И. Перельману выделить основные геохимические классы подземных вод.
Рассмотренные выше закономерности в распределении р. Н и Eh подземных вод позволили А. И. Перельману выделить основные геохимические классы подземных вод.
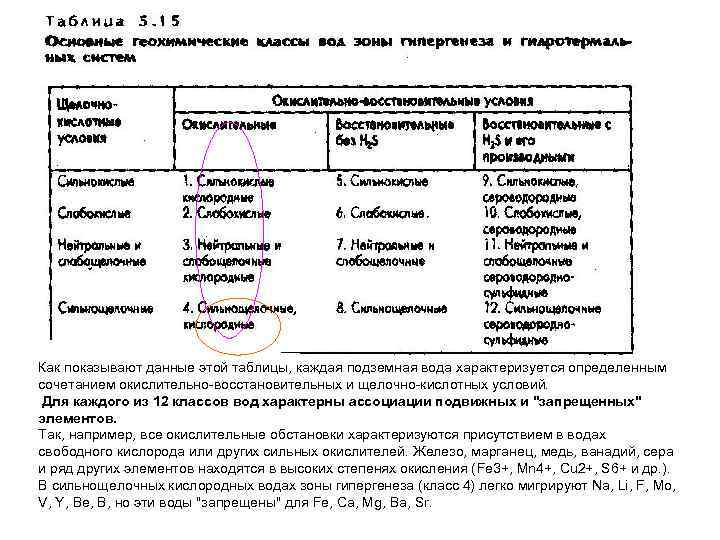 Как показывают данные этой таблицы, каждая подземная вода характеризуется определенным сочетанием окислительно восстановительных и щелочно кислотных условий. Для каждого из 12 классов вод характерны ассоциации подвижных и "запрещенных" элементов. Так, например, все окислительные обстановки характеризуются присутствием в водах свободного кислорода или других сильных окислителей. Железо, марганец, медь, ванадий, сера и ряд других элементов находятся в высоких степенях окисления (Fe 3+, Mn 4+, Cu 2+, S 6+ и др. ). В сильнощелочных кислородных водах зоны гипергенеза (класс 4) легко мигрируют Na, Li, F, Mo, V, Y, Be, В, но эти воды "запрещены" для Fe, Ca, Mg, Ba, Sr.
Как показывают данные этой таблицы, каждая подземная вода характеризуется определенным сочетанием окислительно восстановительных и щелочно кислотных условий. Для каждого из 12 классов вод характерны ассоциации подвижных и "запрещенных" элементов. Так, например, все окислительные обстановки характеризуются присутствием в водах свободного кислорода или других сильных окислителей. Железо, марганец, медь, ванадий, сера и ряд других элементов находятся в высоких степенях окисления (Fe 3+, Mn 4+, Cu 2+, S 6+ и др. ). В сильнощелочных кислородных водах зоны гипергенеза (класс 4) легко мигрируют Na, Li, F, Mo, V, Y, Be, В, но эти воды "запрещены" для Fe, Ca, Mg, Ba, Sr.
 Показатели р. Н и Eh, как важнейшие параметры геохимической среды, широко используются для построения диаграмм р. Н — Eh, на которых наглядно видны поля устойчивости отдельных минералов, форм миграции элементов, соотношение твердых и растворенных фаз. Наиболее полно методика построения таких диаграмм изложена в книге американских исследователей P. M. Гаррелса и Ч. Л. Крайста.
Показатели р. Н и Eh, как важнейшие параметры геохимической среды, широко используются для построения диаграмм р. Н — Eh, на которых наглядно видны поля устойчивости отдельных минералов, форм миграции элементов, соотношение твердых и растворенных фаз. Наиболее полно методика построения таких диаграмм изложена в книге американских исследователей P. M. Гаррелса и Ч. Л. Крайста.
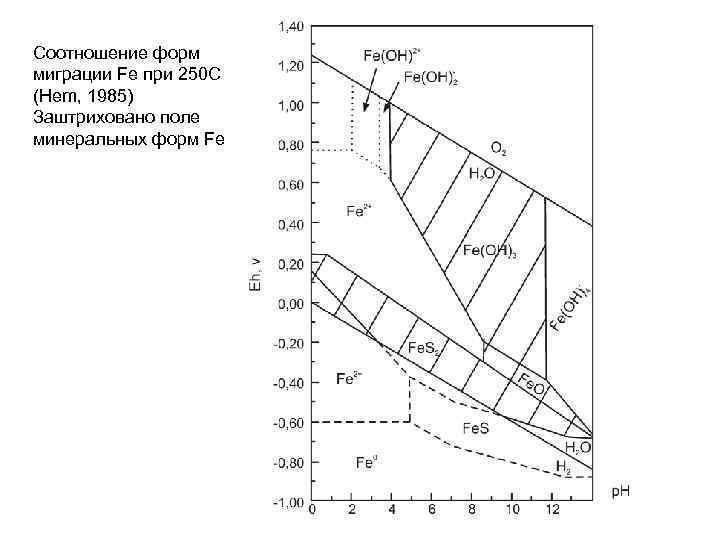 Соотношение форм миграции Fe при 250 С (Hem, 1985) Заштриховано поле минеральных форм Fe
Соотношение форм миграции Fe при 250 С (Hem, 1985) Заштриховано поле минеральных форм Fe
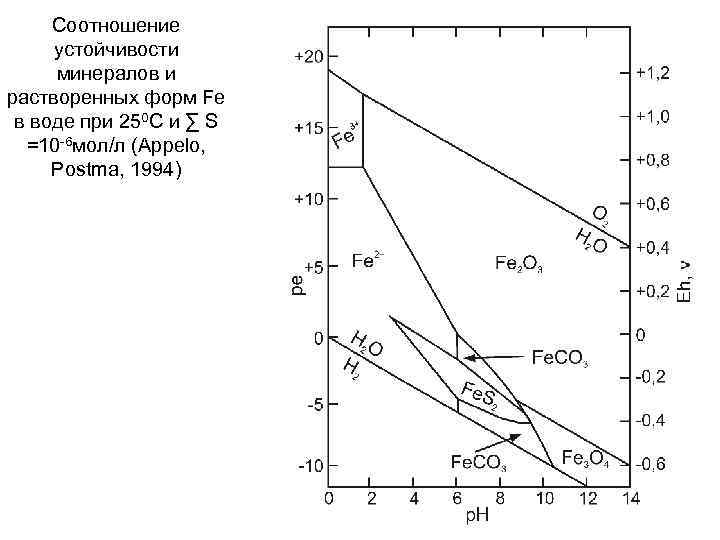 Соотношение устойчивости минералов и растворенных форм Fe в воде при 250 С и ∑ S =10 6 мол/л (Appelo, Postma, 1994)
Соотношение устойчивости минералов и растворенных форм Fe в воде при 250 С и ∑ S =10 6 мол/л (Appelo, Postma, 1994)
 Интенсивность водной миграции элементов Для оценки водной миграции элементов А. И. Перельман предложил использовать коэффициент водной миграции Кх, который равен отношению содержания химического элемента в минеральном остатке воды к его содержанию в водовмещающих породах или к кларку литосферы Кх = (тх∙ 100)/(а∙пх) , где тх — содержание элемента х в воде; а — минерализация воды; пх — содержание элемента х в водовмещающих породах или в литосфере. Использование Кх позволяет сравнивать интенсивность миграции и концентрации распространенных и редких элементов.
Интенсивность водной миграции элементов Для оценки водной миграции элементов А. И. Перельман предложил использовать коэффициент водной миграции Кх, который равен отношению содержания химического элемента в минеральном остатке воды к его содержанию в водовмещающих породах или к кларку литосферы Кх = (тх∙ 100)/(а∙пх) , где тх — содержание элемента х в воде; а — минерализация воды; пх — содержание элемента х в водовмещающих породах или в литосфере. Использование Кх позволяет сравнивать интенсивность миграции и концентрации распространенных и редких элементов.

 . По значениям Кх А. И. Перельман составил ряды интенсивности выноса химических элементов из коры выветривания.
. По значениям Кх А. И. Перельман составил ряды интенсивности выноса химических элементов из коры выветривания.
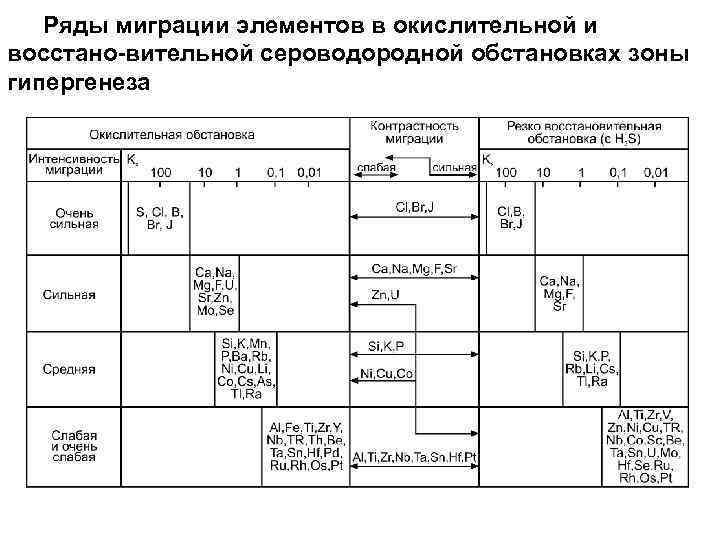 Ряды миграции элементов в окислительной и восстано-вительной сероводородной обстановках зоны гипергенеза
Ряды миграции элементов в окислительной и восстано-вительной сероводородной обстановках зоны гипергенеза
 С. Л. Шварцев предлагает оценивать интенсивность миграции химических элементов в природных водах отношением содержания элемента в растворе к его содержанию в продуктах, образованных в результате разрушения водой первичных пород Кп = где тх — содержание элемента х в воде; а — минерализация воды; nn - содержание исследуемого элемента в продуктах химического выветривания или их аналогах (почвах, торфах, осаждающихся гидроксидах, карбонатах и т. д. ). Кп так же как и Кх , - условная величина, которая в отличие от Кх характеризует не вынос элемента из горных пород, а долю его выноса раствором относительно доли связываемой вторичными минералами.
С. Л. Шварцев предлагает оценивать интенсивность миграции химических элементов в природных водах отношением содержания элемента в растворе к его содержанию в продуктах, образованных в результате разрушения водой первичных пород Кп = где тх — содержание элемента х в воде; а — минерализация воды; nn - содержание исследуемого элемента в продуктах химического выветривания или их аналогах (почвах, торфах, осаждающихся гидроксидах, карбонатах и т. д. ). Кп так же как и Кх , - условная величина, которая в отличие от Кх характеризует не вынос элемента из горных пород, а долю его выноса раствором относительно доли связываемой вторичными минералами.
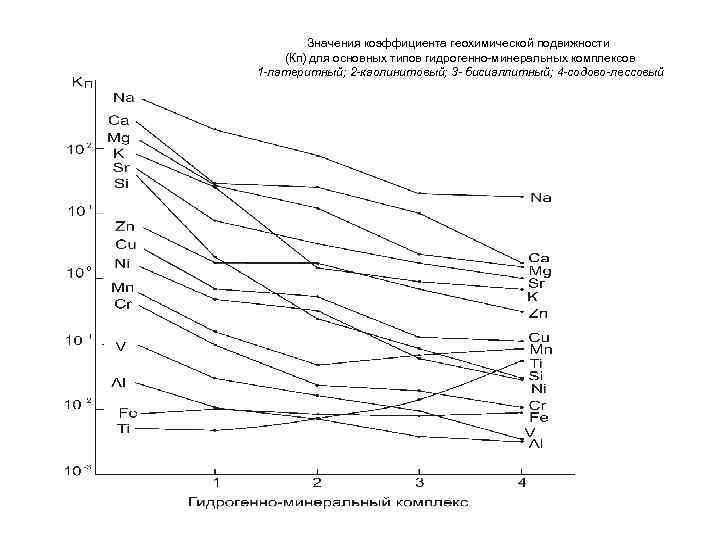 Значения коэффициента геохимической подвижности (Кп) для основных типов гидрогенно минеральных комплексов 1 -латеритный; 2 -каолинитовый; 3 - бисиаллитный; 4 -содово-лессовый
Значения коэффициента геохимической подвижности (Кп) для основных типов гидрогенно минеральных комплексов 1 -латеритный; 2 -каолинитовый; 3 - бисиаллитный; 4 -содово-лессовый
 Формы миграции химических элементов В природных водах элементы могут мигрировать в коллоидной, взвешенной и истинно растворенных формах.
Формы миграции химических элементов В природных водах элементы могут мигрировать в коллоидной, взвешенной и истинно растворенных формах.
 Размер взвешенных частиц превышает 10 -6 м Во взвешенной (механической) форме в природных водах чаще всего мигрируют элементы, образующие устойчивые минеральные формы. Входя в состав минералов, элемент как бы теряет свои индивидуальные свойства и его дальнейшая миграция определяется податливостью к разрушению кристаллической решетки. Поэтому форма миграции элемента в данной системе часто зависит не от его химических свойств, а от степени разрушаемости кристаллической решетки минералов, в состав которых он входит.
Размер взвешенных частиц превышает 10 -6 м Во взвешенной (механической) форме в природных водах чаще всего мигрируют элементы, образующие устойчивые минеральные формы. Входя в состав минералов, элемент как бы теряет свои индивидуальные свойства и его дальнейшая миграция определяется податливостью к разрушению кристаллической решетки. Поэтому форма миграции элемента в данной системе часто зависит не от его химических свойств, а от степени разрушаемости кристаллической решетки минералов, в состав которых он входит.
 Размеры коллоидных частиц изменяются от 10 -6 до 10 -9 м. В коллоидной форме миграция химических элементов происходит при значительных скоростях течения в поверхностных водах и высоких скоростях фильтрации в подземных водах. В форме коллоидов могут мигрировать в той или иной мере практически все химические элементы. Так, в районах с влажным климатом большая часть железа, алюминия, марганца, мышьяка, циркония, молибдена, титана, ванадия, хрома, по данным А. И. Перельмана, мигрирует в коллоидной форме.
Размеры коллоидных частиц изменяются от 10 -6 до 10 -9 м. В коллоидной форме миграция химических элементов происходит при значительных скоростях течения в поверхностных водах и высоких скоростях фильтрации в подземных водах. В форме коллоидов могут мигрировать в той или иной мере практически все химические элементы. Так, в районах с влажным климатом большая часть железа, алюминия, марганца, мышьяка, циркония, молибдена, титана, ванадия, хрома, по данным А. И. Перельмана, мигрирует в коллоидной форме.
 Методы изучения форм миграции
Методы изучения форм миграции
 Размер истинно растворенных форм элементов менее 10 9 м (по другим оценкам меньше 0, 45∙ 10 9 м). Среди истинно растворенных форм элементов различают нейтральные молекулы, простые и комплексные ионы. В виде простых ионов мигрируют подавляющая часть макрокомпонентов (Na+, K+, Са 2+, Mg 2+, Cl , Вг и др. ), а также многие микрокомпоненты (Cu 2+, Zn 2+, Ni 2+, Li+, Rb+, Cs+ и др. ) Комплексные ионы образуются в результате взаимодействия простых ионов разного заряда. При этом важную роль играют ионы комплексообразователи, обычно называемые лигандами. В качестве последних в природных водах чаще всего выступают отрицательно заряженные ионы: СО 32 , SO 42 , С 1 , ОН , Br , F , а также органические соединения. Широко распространены в подземных водах и нейтральные молекулы типа Zn. SO 40, Cu. Cl 20 , Cu. SO 40, Na. OH 0 и др.
Размер истинно растворенных форм элементов менее 10 9 м (по другим оценкам меньше 0, 45∙ 10 9 м). Среди истинно растворенных форм элементов различают нейтральные молекулы, простые и комплексные ионы. В виде простых ионов мигрируют подавляющая часть макрокомпонентов (Na+, K+, Са 2+, Mg 2+, Cl , Вг и др. ), а также многие микрокомпоненты (Cu 2+, Zn 2+, Ni 2+, Li+, Rb+, Cs+ и др. ) Комплексные ионы образуются в результате взаимодействия простых ионов разного заряда. При этом важную роль играют ионы комплексообразователи, обычно называемые лигандами. В качестве последних в природных водах чаще всего выступают отрицательно заряженные ионы: СО 32 , SO 42 , С 1 , ОН , Br , F , а также органические соединения. Широко распространены в подземных водах и нейтральные молекулы типа Zn. SO 40, Cu. Cl 20 , Cu. SO 40, Na. OH 0 и др.
 Как установлено в последние годы, большинство металлов в водах находится в виде гидроксокомплексов, полимерных ионов и комплексных соединений с анионами. Например, шестивалентный уран в растворах образует сложный катион уранил UO 22+, который нередко дает гидроксокомплексы или входит в состав комплексных анионов. Поэтому в водах в зависимости от их свойств могут присутствовать UO 22+, UО 2(СО 3)2(Н 2 О)22 , UО 2(СО 3)4 и другие ионы, а также недиссоциированные молекулы U(OH)40 и др. Соотношение различных форм металлов в водах изменяется в зависимости от конкретных геохимических условий среды их миграции, а также наличия соответствующих ионов — комплексообразователей (лигандов). В обычных подземных водах часто в значи тельных количествах присутствуют фосфатные, фторидные, суль фатные ионы и органические соединения, которые и выступают ведущими комплексообразователями.
Как установлено в последние годы, большинство металлов в водах находится в виде гидроксокомплексов, полимерных ионов и комплексных соединений с анионами. Например, шестивалентный уран в растворах образует сложный катион уранил UO 22+, который нередко дает гидроксокомплексы или входит в состав комплексных анионов. Поэтому в водах в зависимости от их свойств могут присутствовать UO 22+, UО 2(СО 3)2(Н 2 О)22 , UО 2(СО 3)4 и другие ионы, а также недиссоциированные молекулы U(OH)40 и др. Соотношение различных форм металлов в водах изменяется в зависимости от конкретных геохимических условий среды их миграции, а также наличия соответствующих ионов — комплексообразователей (лигандов). В обычных подземных водах часто в значи тельных количествах присутствуют фосфатные, фторидные, суль фатные ионы и органические соединения, которые и выступают ведущими комплексообразователями.
 • Однако ионная форма главных компонентов свойственна в полной мере лишь маломинерализованным водам. При увеличении концентрации между ионами усиливается взаимодействие, направленное на ассоциацию, т. е. процесс, обратный диссоциации. При этом образуются ассоциированные ионные пары, например Mg. HCO 3+, Ca. HCO 3+.
• Однако ионная форма главных компонентов свойственна в полной мере лишь маломинерализованным водам. При увеличении концентрации между ионами усиливается взаимодействие, направленное на ассоциацию, т. е. процесс, обратный диссоциации. При этом образуются ассоциированные ионные пары, например Mg. HCO 3+, Ca. HCO 3+.
 Активность, • ai= Ci*Ji • • ai активная концентрация Ci аналитическая концентрация Ji коэффициент активности растворенных соединений (термодинамические концентрации) в водном раство ре ( i), связаны с a аналитически определяемыми концент рациями ( i) того же соединения с через коэффициенты активности (Ji)
Активность, • ai= Ci*Ji • • ai активная концентрация Ci аналитическая концентрация Ji коэффициент активности растворенных соединений (термодинамические концентрации) в водном раство ре ( i), связаны с a аналитически определяемыми концент рациями ( i) того же соединения с через коэффициенты активности (Ji)
 Коэффициент активности служит мерой отклонения поведения раствора (или компонента раствора) от идеального и вычисляются по уравнению Дебая Хюккеля (для маломинерализованных вод) lg. Ji=-A*zi 2√I A константа, зависящая от свойств воды, от Т и Р, Zi заряд иона I ионная сила I=0. 5∑Ci*zi 2
Коэффициент активности служит мерой отклонения поведения раствора (или компонента раствора) от идеального и вычисляются по уравнению Дебая Хюккеля (для маломинерализованных вод) lg. Ji=-A*zi 2√I A константа, зависящая от свойств воды, от Т и Р, Zi заряд иона I ионная сила I=0. 5∑Ci*zi 2
 Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Ионная сила раствора равна полусумме произведений концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом: I=0. 5∑Ci*zi 2 Cii – молярность Молярность (моль/л) = масса (г) растворенного вещества в литре воды (Моляльность (моль/кг Н 2 О) = масса (г) растворенного вещества в 1 кг воды) Zi – заряд иона I в данном растворе; суммируются все ионы, положительные и отрицательные. Ионная сила в пресных водах изменяется от 0, 00 n до 0, 0 n для морской воды, минерализация который равна 35, 5 г/л, ионная сила составляет 0, 69 моль/л.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Ионная сила раствора равна полусумме произведений концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом: I=0. 5∑Ci*zi 2 Cii – молярность Молярность (моль/л) = масса (г) растворенного вещества в литре воды (Моляльность (моль/кг Н 2 О) = масса (г) растворенного вещества в 1 кг воды) Zi – заряд иона I в данном растворе; суммируются все ионы, положительные и отрицательные. Ионная сила в пресных водах изменяется от 0, 00 n до 0, 0 n для морской воды, минерализация который равна 35, 5 г/л, ионная сила составляет 0, 69 моль/л.



 Геохимические барьеры – это участки земной коры, в которых на коротком расстоянии происходит резкое уменьшение интенсивности миграции химических элементов, и как следствие, их концентрирование или накопление. .
Геохимические барьеры – это участки земной коры, в которых на коротком расстоянии происходит резкое уменьшение интенсивности миграции химических элементов, и как следствие, их концентрирование или накопление. .
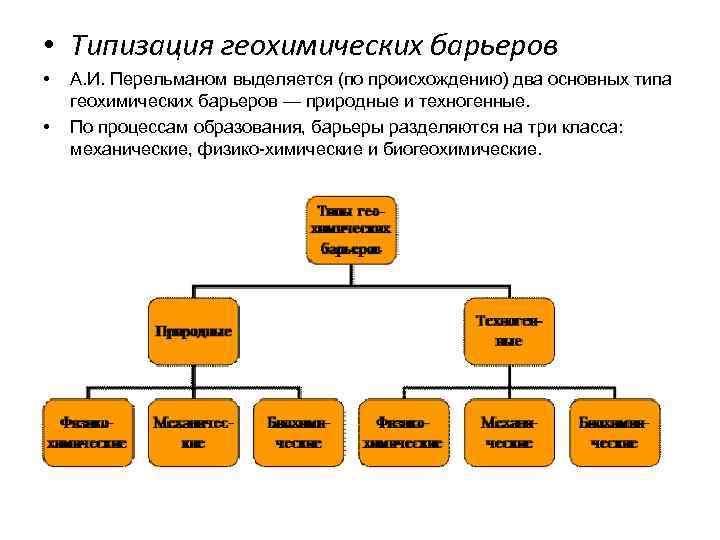 • Типизация геохимических барьеров • • А. И. Перельманом выделяется (по происхождению) два основных типа геохимических барьеров — природные и техногенные. По процессам образования, барьеры разделяются на три класса: механические, физико химические и биогеохимические.
• Типизация геохимических барьеров • • А. И. Перельманом выделяется (по происхождению) два основных типа геохимических барьеров — природные и техногенные. По процессам образования, барьеры разделяются на три класса: механические, физико химические и биогеохимические.
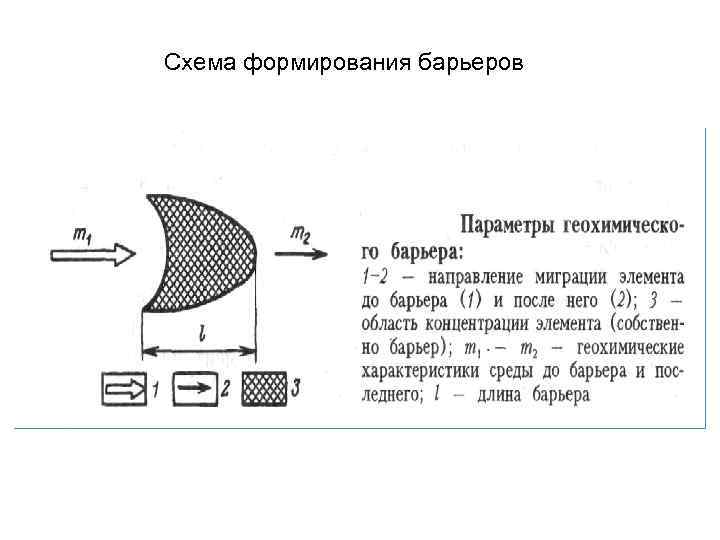 Схема формирования барьеров
Схема формирования барьеров
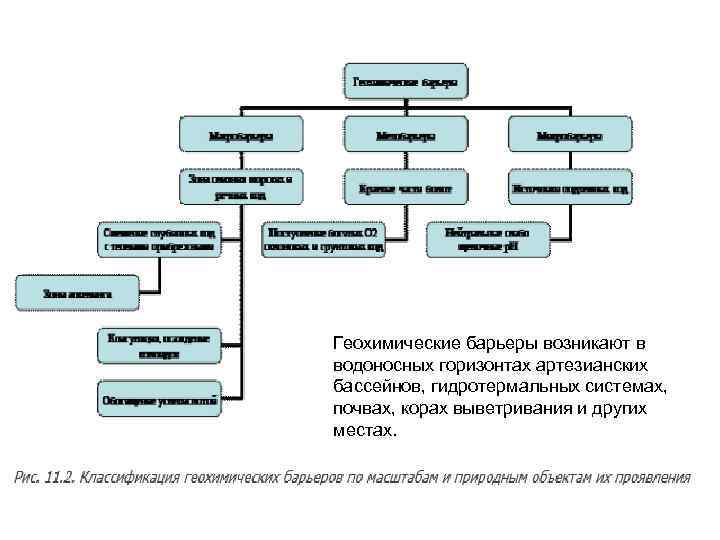 Геохимические барьеры возникают в водоносных горизонтах артезианских бассейнов, гидротермальных системах, почвах, корах выветривания и других местах.
Геохимические барьеры возникают в водоносных горизонтах артезианских бассейнов, гидротермальных системах, почвах, корах выветривания и других местах.
 Размеры барьеров различны и рационально говорить о макро-, мезо-, и микробарьерах. • Примером макробарьеров могут служить зоны смешения речной и морской воды в устьях рек, иногда имеющие ширину до первых километров. Эти барьеры являются зонами массовой коагуляции и осаждения коллоидных частиц. Другой случай макробарьера – зоны апвеллинга (подъёма глубинных холодных вод в океане, обогащённых СО 2, и их смешения с тёплыми прибрежными водами. • Пример мезобарьера – краевые части болот, где в болото (восстановительная среда) поступают с окружающих возвышенностей богатые кислородом поверхностные и грунтовые воды. • Пример микробарьера – место выхода на поверхность источника с восстановительными водами.
Размеры барьеров различны и рационально говорить о макро-, мезо-, и микробарьерах. • Примером макробарьеров могут служить зоны смешения речной и морской воды в устьях рек, иногда имеющие ширину до первых километров. Эти барьеры являются зонами массовой коагуляции и осаждения коллоидных частиц. Другой случай макробарьера – зоны апвеллинга (подъёма глубинных холодных вод в океане, обогащённых СО 2, и их смешения с тёплыми прибрежными водами. • Пример мезобарьера – краевые части болот, где в болото (восстановительная среда) поступают с окружающих возвышенностей богатые кислородом поверхностные и грунтовые воды. • Пример микробарьера – место выхода на поверхность источника с восстановительными водами.
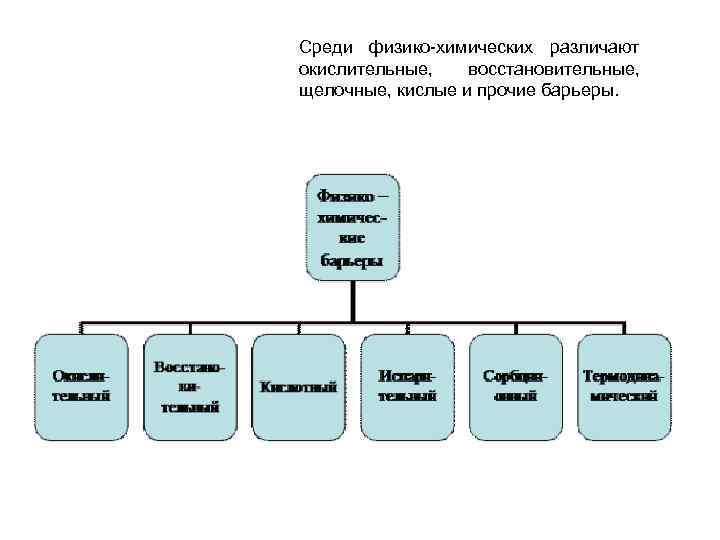 Среди физико химических различают окислительные, восстановительные, щелочные, кислые и прочие барьеры.
Среди физико химических различают окислительные, восстановительные, щелочные, кислые и прочие барьеры.



 Железистые осадки на крыльчатке водомера и внутри водомерного фланца. Водозабор Академгородка (Колывань Томская зона) Травертиноподобные осадки на оборудовании. Водозабор п. Жемчужный (Минусинская котловина)
Железистые осадки на крыльчатке водомера и внутри водомерного фланца. Водозабор Академгородка (Колывань Томская зона) Травертиноподобные осадки на оборудовании. Водозабор п. Жемчужный (Минусинская котловина)



 • Техногенные геохимические барьеры и защита окружающей среды • в последние десятилетия для защиты окружающей среды от загрязнения наметилась тенденция использования геохимических барьеров • сущность методов защиты окружающей среды от загрязнения с помощью геохимических барьеров заключается в переводе загрязняющих компонентов в малоподвижные формы. При этом возможно использование как существующих природных геохимических барьеров, так и целенаправленное создание техногенных барьеров. В качестве материалов для создания барьеров в зависимости от состава загрязнителей могут применяться природные образования (грунты, горные породы и т. д. ) или иные вещества, например, производственные отходы.
• Техногенные геохимические барьеры и защита окружающей среды • в последние десятилетия для защиты окружающей среды от загрязнения наметилась тенденция использования геохимических барьеров • сущность методов защиты окружающей среды от загрязнения с помощью геохимических барьеров заключается в переводе загрязняющих компонентов в малоподвижные формы. При этом возможно использование как существующих природных геохимических барьеров, так и целенаправленное создание техногенных барьеров. В качестве материалов для создания барьеров в зависимости от состава загрязнителей могут применяться природные образования (грунты, горные породы и т. д. ) или иные вещества, например, производственные отходы.
 • • • Очистка сточных вод от взвешенных частиц. Для очистки дражных стоков от взвешенных частиц на месторождении алмазов в Пермской области предложено использовать грунтовые фильтры, укладываемые в русле реки. В качестве материала для фильтров использовались дражные отвалы. Опытные натурные работы показали, что в зависимости от длины пути фильтрации концентрация взвешенных частиц в стоках может снижаться в десятки и сотни раз. Нейтрализация кислых стоков. Шахты Кизеловского угольного бассейна сбрасывают практически без очистки в гидрографическую сеть кислые (р. Н=2 4) высокоминерализованные сульфатные воды, имеющие в составе повышенные содержания железа, алюминия, тяжелых металлов. Нейтрализацию кислых шахтных вод возможно проводить с использованием отходов щелочного состава. Лабораторные работы показали, что при использовании щелочных отходов содового производства р. Н шахтных вод можно повышать до нейтральных значений. При этом содержание загрязнителей снижается до допустимых концентраций. Снижение интенсивности загрязнения подземных вод в районах складирования шахтных отвалов. Отходы в угледобычи в Кизеловском бассейне интенсивно загрязняют подземные воды. В районах породных отвалов они имеют низкие значения р. Н, повышенную минерализацию, а также высокие содержания сульфатов, железа, алюминия, тяжелых металлов. Для нормализации состава подземных вод в качестве реагента предложено использовать соединения бария, а также дробленые карбонатные породы, укладываемые в траншеи в зоне стока с отвалов. Натурные исследования показали, что в результате применения метода на опытном участке водородный показатель подземных вод повысился с 1, 8 до 6, 4 и сохранял близкие значения в течение года. Существенно снизились минерализация воды с 24 до 3 г/л, а также содержание основных загрязняющих компонентов.
• • • Очистка сточных вод от взвешенных частиц. Для очистки дражных стоков от взвешенных частиц на месторождении алмазов в Пермской области предложено использовать грунтовые фильтры, укладываемые в русле реки. В качестве материала для фильтров использовались дражные отвалы. Опытные натурные работы показали, что в зависимости от длины пути фильтрации концентрация взвешенных частиц в стоках может снижаться в десятки и сотни раз. Нейтрализация кислых стоков. Шахты Кизеловского угольного бассейна сбрасывают практически без очистки в гидрографическую сеть кислые (р. Н=2 4) высокоминерализованные сульфатные воды, имеющие в составе повышенные содержания железа, алюминия, тяжелых металлов. Нейтрализацию кислых шахтных вод возможно проводить с использованием отходов щелочного состава. Лабораторные работы показали, что при использовании щелочных отходов содового производства р. Н шахтных вод можно повышать до нейтральных значений. При этом содержание загрязнителей снижается до допустимых концентраций. Снижение интенсивности загрязнения подземных вод в районах складирования шахтных отвалов. Отходы в угледобычи в Кизеловском бассейне интенсивно загрязняют подземные воды. В районах породных отвалов они имеют низкие значения р. Н, повышенную минерализацию, а также высокие содержания сульфатов, железа, алюминия, тяжелых металлов. Для нормализации состава подземных вод в качестве реагента предложено использовать соединения бария, а также дробленые карбонатные породы, укладываемые в траншеи в зоне стока с отвалов. Натурные исследования показали, что в результате применения метода на опытном участке водородный показатель подземных вод повысился с 1, 8 до 6, 4 и сохранял близкие значения в течение года. Существенно снизились минерализация воды с 24 до 3 г/л, а также содержание основных загрязняющих компонентов.

 • • • . Снижение содержания сульфатов в технических водах. На Холбольджинском угольном разрезе (Бурятия) использование для полива технической воды, большие запасы которой сосредоточены в выработанном карьере, затруднено повышенным содержанием в ней сульфатов – до 1200 мг/л. Для снижения содержания сульфатов использовались соединения бария. В результате опытных натурных работ содержание сульфатов снизилось до 440 мг/л (при максимально допустимой концентрации 500 мг/л). Содержание остальных компонентов не превышало нормативных значений. Снижение сульфатной агрессивности подземных вод. При планировочных работах на промплощадке Губахинского химического завода использовались породы отвалов угольных шахт Кизеловского бассейна, характеризующиеся высоким содержанием различных форм серы. В результате подтопления в насыпных грунтах, на отметках выше заложения фундаментов, сформировались подземные воды, обладающие сульфатной агрессивностью к бетону. Снижение содержания сульфатов в подземных водах проводилось путем применения реагентов, содержащих барий. Проведенные на площадке опытные натурные работы показали, что в результате применения метода подземные воды, обладавшие средней и сильной сульфатной агрессивностью, становились неагрессивными по отношению к бетону. Положительный эффект сохранялся в течение двух лет наблюдений. Защита подземных вод от загрязнения в районах шламохранилищ. Складирование отходов Пашийского металлургическо цементного завода привело к загрязнению подземных вод в районе действующего шламохранилища. В пульпе с щелочной реакцией среды выявлены повышенные содержания Cu, Cd, Pb, Zn, Ni, Mo, As, Ti, значительно превышающие ПДК. Металлы образуют устойчивые комплексы с органическими веществами, подвижные в щелочной среде. Совместно с лабораторией ОГС МГУ предложено создание комплексного, многослойного экрана для снижения интенсивности загрязнения подземных вод. Основной слой, выполняющий функцию перехвата загрязнителей, предлагается создавать из смеси торфа и пиритных огарков, что позволяет связывать металлы в сульфиды в анаэробных восстановительных условиях. Лабораторные исследования показали, что применение метода обеспечивает защиту подземных вод
• • • . Снижение содержания сульфатов в технических водах. На Холбольджинском угольном разрезе (Бурятия) использование для полива технической воды, большие запасы которой сосредоточены в выработанном карьере, затруднено повышенным содержанием в ней сульфатов – до 1200 мг/л. Для снижения содержания сульфатов использовались соединения бария. В результате опытных натурных работ содержание сульфатов снизилось до 440 мг/л (при максимально допустимой концентрации 500 мг/л). Содержание остальных компонентов не превышало нормативных значений. Снижение сульфатной агрессивности подземных вод. При планировочных работах на промплощадке Губахинского химического завода использовались породы отвалов угольных шахт Кизеловского бассейна, характеризующиеся высоким содержанием различных форм серы. В результате подтопления в насыпных грунтах, на отметках выше заложения фундаментов, сформировались подземные воды, обладающие сульфатной агрессивностью к бетону. Снижение содержания сульфатов в подземных водах проводилось путем применения реагентов, содержащих барий. Проведенные на площадке опытные натурные работы показали, что в результате применения метода подземные воды, обладавшие средней и сильной сульфатной агрессивностью, становились неагрессивными по отношению к бетону. Положительный эффект сохранялся в течение двух лет наблюдений. Защита подземных вод от загрязнения в районах шламохранилищ. Складирование отходов Пашийского металлургическо цементного завода привело к загрязнению подземных вод в районе действующего шламохранилища. В пульпе с щелочной реакцией среды выявлены повышенные содержания Cu, Cd, Pb, Zn, Ni, Mo, As, Ti, значительно превышающие ПДК. Металлы образуют устойчивые комплексы с органическими веществами, подвижные в щелочной среде. Совместно с лабораторией ОГС МГУ предложено создание комплексного, многослойного экрана для снижения интенсивности загрязнения подземных вод. Основной слой, выполняющий функцию перехвата загрязнителей, предлагается создавать из смеси торфа и пиритных огарков, что позволяет связывать металлы в сульфиды в анаэробных восстановительных условиях. Лабораторные исследования показали, что применение метода обеспечивает защиту подземных вод


