Лекция 1. Вода. растворы..pptx
- Количество слайдов: 26
 Вода, растворы Лекция 1
Вода, растворы Лекция 1
 «Вода! У тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни, ты – сама жизнь… Ты самое большое богатство на свете…» . Антуан-Сент-Экзюпери
«Вода! У тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобою наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни, ты – сама жизнь… Ты самое большое богатство на свете…» . Антуан-Сент-Экзюпери
 План 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. Вода вокруг нас. Физические свойства воды и химические свойства воды. Растворение твердых веществ и газов. Концентрация раствора. Водные ресурсы Земли. Качество воды. Загрязнители воды и способы очистки. Жесткая вода и ее умягчение Методы очистки воды
План 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. Вода вокруг нас. Физические свойства воды и химические свойства воды. Растворение твердых веществ и газов. Концентрация раствора. Водные ресурсы Земли. Качество воды. Загрязнители воды и способы очистки. Жесткая вода и ее умягчение Методы очистки воды
 1. Вода вокруг нас Вода самое распространенное вещество на Земле: 3/4 поверхности планеты состоит из воды: моря, океаны, реки, ледники…; вода в больших количествах содержится в земной коре (подземные воды, в составе почвы); вода входит в состав минералов, горных пород (глина, гипс и др. ); вода содержится в составе растительных и животных организмов, достигая в некоторых случаях до 99% их массы; вода входит в состав атмосферы.
1. Вода вокруг нас Вода самое распространенное вещество на Земле: 3/4 поверхности планеты состоит из воды: моря, океаны, реки, ледники…; вода в больших количествах содержится в земной коре (подземные воды, в составе почвы); вода входит в состав минералов, горных пород (глина, гипс и др. ); вода содержится в составе растительных и животных организмов, достигая в некоторых случаях до 99% их массы; вода входит в состав атмосферы.
 Запасы воды на Земле: в морях и океанах - 1, 4 млрд. км 3 в ледниках - 30 млн. км 3 в реках и озёрах - 2 млн. км 3 в атмосфере - 14 тыс. км 3 В живых организмах ~ 65% воды
Запасы воды на Земле: в морях и океанах - 1, 4 млрд. км 3 в ледниках - 30 млн. км 3 в реках и озёрах - 2 млн. км 3 в атмосфере - 14 тыс. км 3 В живых организмах ~ 65% воды
 2. Физические свойства воды ВОДА, ЛЁД И ПАР, соответственно жидкое, твердое и газообразное состояния Н 2 О. Благодаря сильному притяжению между молекулами имеет высокие температуры плавления (0 о. С) и кипения (100 о. С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Плотность воды максимальна при 4 о. С она равна 1 г/см 3. Лёд имеет меньшую плотность, чем жидкая вода и всплывает на её поверхность. При замерзании воды происходит расширение объёма. Самая большая теплоёмкость (в 3100 раз больше, чем у воздуха; в 4 раза больше, чем у горных пород). Дистиллированная вода - очень плохой проводник электричества. Но уже небольшое количество примесей резко увеличивают её электропроводность.
2. Физические свойства воды ВОДА, ЛЁД И ПАР, соответственно жидкое, твердое и газообразное состояния Н 2 О. Благодаря сильному притяжению между молекулами имеет высокие температуры плавления (0 о. С) и кипения (100 о. С). Толстый слой воды имеет голубой цвет, что обусловливается не только ее физическими свойствами, но и присутствием взвешенных частиц примесей. Вода горных рек зеленоватая из-за содержащихся в ней взвешенных частиц карбоната кальция. Плотность воды максимальна при 4 о. С она равна 1 г/см 3. Лёд имеет меньшую плотность, чем жидкая вода и всплывает на её поверхность. При замерзании воды происходит расширение объёма. Самая большая теплоёмкость (в 3100 раз больше, чем у воздуха; в 4 раза больше, чем у горных пород). Дистиллированная вода - очень плохой проводник электричества. Но уже небольшое количество примесей резко увеличивают её электропроводность.
 3. Химические свойства воды Молекула воды состоит из атома кислорода и двух атомов водорода, присоединившихся к нему под углом 104, 5°. Вода – весьма активное в химическом отношении вещество. 1) Вода реагирует со многими металлами с выделением водорода: 2 Na + 2 H 2 O = H 2 + 2 Na. OH (бурно) 2 K + 2 H 2 O = H 2 + 2 KOH (бурно) 3 Fe + 4 H 2 O = 4 H 2 + Fe 3 O 4 (только при нагревании) Только активные металлы могут участвовать в окислительновосстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп. 2) Из неметаллов с водой реагируют, например: C + H 2 O = H 2 + CO (при сильном нагревании) CH 4 + 2 H 2 O = 4 H 2 + CO 2 (при сильном нагревании) метан
3. Химические свойства воды Молекула воды состоит из атома кислорода и двух атомов водорода, присоединившихся к нему под углом 104, 5°. Вода – весьма активное в химическом отношении вещество. 1) Вода реагирует со многими металлами с выделением водорода: 2 Na + 2 H 2 O = H 2 + 2 Na. OH (бурно) 2 K + 2 H 2 O = H 2 + 2 KOH (бурно) 3 Fe + 4 H 2 O = 4 H 2 + Fe 3 O 4 (только при нагревании) Только активные металлы могут участвовать в окислительновосстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп. 2) Из неметаллов с водой реагируют, например: C + H 2 O = H 2 + CO (при сильном нагревании) CH 4 + 2 H 2 O = 4 H 2 + CO 2 (при сильном нагревании) метан
 3) Вода разлагается на водород и кислород при действии электрического тока: 4) Вода реагирует со многими оксидами неметаллов: SO 2 + H 2 O = H 2 SO 3 сернистая кислота SO 3 + H 2 O = H 2 SO 4 серная кислота CO 2 + H 2 O ↔ H 2 CO 3 угольная кислота 5) Некоторые оксиды металлов могут вступать в реакции соединения с водой: Ca. O + H 2 O = Ca(OH)2 гидроксид кальция (гашеная известь) 6) Синтез растениями крахмала (C 6 H 10 O 5)n и других подобных соединений (углеводов), происходящая с выделением кислорода: 6 n CO 2 + 5 n H 2 O = (C 6 H 10 O 5)n + 6 n O 2 (при действии света)
3) Вода разлагается на водород и кислород при действии электрического тока: 4) Вода реагирует со многими оксидами неметаллов: SO 2 + H 2 O = H 2 SO 3 сернистая кислота SO 3 + H 2 O = H 2 SO 4 серная кислота CO 2 + H 2 O ↔ H 2 CO 3 угольная кислота 5) Некоторые оксиды металлов могут вступать в реакции соединения с водой: Ca. O + H 2 O = Ca(OH)2 гидроксид кальция (гашеная известь) 6) Синтез растениями крахмала (C 6 H 10 O 5)n и других подобных соединений (углеводов), происходящая с выделением кислорода: 6 n CO 2 + 5 n H 2 O = (C 6 H 10 O 5)n + 6 n O 2 (при действии света)
 7) Вода образует гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
7) Вода образует гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
 4. Растворение твердых веществ и газов Растворами называются гомогенные (т. е. однородные) смеси переменного состава из двух или более веществ. Любой раствор состоит из растворителя и растворенного вещества. Из двух или нескольких компонентов раствора растворителем является тот, который взят в большем количестве и имеет то же агрегатное состояние, что и раствор в целом. В зависимости от агрегатного состояния растворителя различают растворы: газообразные, жидкие твердые. Газообразными растворами являются воздух и другие смеси газов. К жидким растворам относят гомогенные смеси газов, жидкостей и твердых тел с жидкостями. Твердыми растворами являются многие сплавы, например, металлов друг с другом, стёкла. Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость.
4. Растворение твердых веществ и газов Растворами называются гомогенные (т. е. однородные) смеси переменного состава из двух или более веществ. Любой раствор состоит из растворителя и растворенного вещества. Из двух или нескольких компонентов раствора растворителем является тот, который взят в большем количестве и имеет то же агрегатное состояние, что и раствор в целом. В зависимости от агрегатного состояния растворителя различают растворы: газообразные, жидкие твердые. Газообразными растворами являются воздух и другие смеси газов. К жидким растворам относят гомогенные смеси газов, жидкостей и твердых тел с жидкостями. Твердыми растворами являются многие сплавы, например, металлов друг с другом, стёкла. Наибольшее значение имеют жидкие смеси, в которых растворителем является жидкость.
 Растворимость НАСЫЩЕННЫМ называется раствор, в котором данное вещество при данной температуре уже больше не растворяется. РАСТВОРИМОСТЬЮ называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях является его содержание в насыщенном растворе. Растворимость, выраженная при помощи массы вещества, которое может раствориться в 100 г воды при данной температуре, называют также коэффициентом растворимости (Р).
Растворимость НАСЫЩЕННЫМ называется раствор, в котором данное вещество при данной температуре уже больше не растворяется. РАСТВОРИМОСТЬЮ называется способность вещества растворяться в том или ином растворителе. Мерой растворимости вещества при данных условиях является его содержание в насыщенном растворе. Растворимость, выраженная при помощи массы вещества, которое может раствориться в 100 г воды при данной температуре, называют также коэффициентом растворимости (Р).
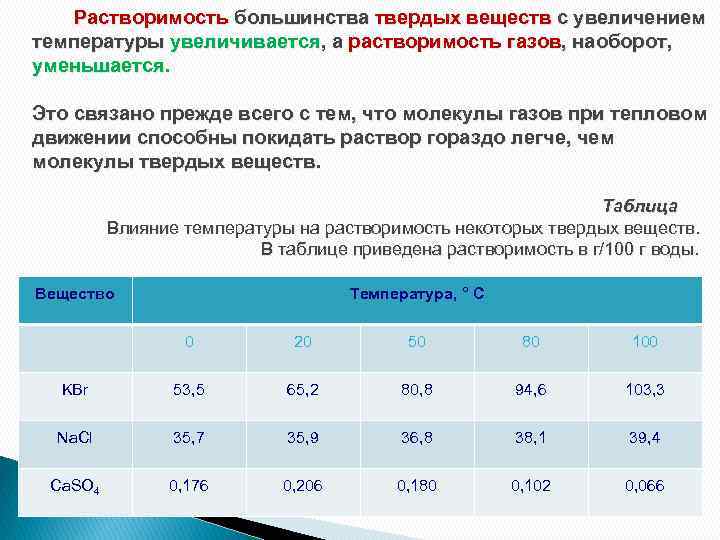 Растворимость большинства твердых веществ с увеличением температуры увеличивается, а растворимость газов, наоборот, уменьшается. Это связано прежде всего с тем, что молекулы газов при тепловом движении способны покидать раствор гораздо легче, чем молекулы твердых веществ. Таблица Влияние температуры на растворимость некоторых твердых веществ. В таблице приведена растворимость в г/100 г воды. Вещество Температура, ° C 0 20 50 80 100 KBr 53, 5 65, 2 80, 8 94, 6 103, 3 Na. Cl 35, 7 35, 9 36, 8 38, 1 39, 4 Ca. SO 4 0, 176 0, 206 0, 180 0, 102 0, 066
Растворимость большинства твердых веществ с увеличением температуры увеличивается, а растворимость газов, наоборот, уменьшается. Это связано прежде всего с тем, что молекулы газов при тепловом движении способны покидать раствор гораздо легче, чем молекулы твердых веществ. Таблица Влияние температуры на растворимость некоторых твердых веществ. В таблице приведена растворимость в г/100 г воды. Вещество Температура, ° C 0 20 50 80 100 KBr 53, 5 65, 2 80, 8 94, 6 103, 3 Na. Cl 35, 7 35, 9 36, 8 38, 1 39, 4 Ca. SO 4 0, 176 0, 206 0, 180 0, 102 0, 066
 5. Концентрация раствора Массовая доля растворенного вещества – это отношение массы растворенного вещества m(в-ва) к общей массе раствора m(р-ра), выраженное в процентах.
5. Концентрация раствора Массовая доля растворенного вещества – это отношение массы растворенного вещества m(в-ва) к общей массе раствора m(р-ра), выраженное в процентах.
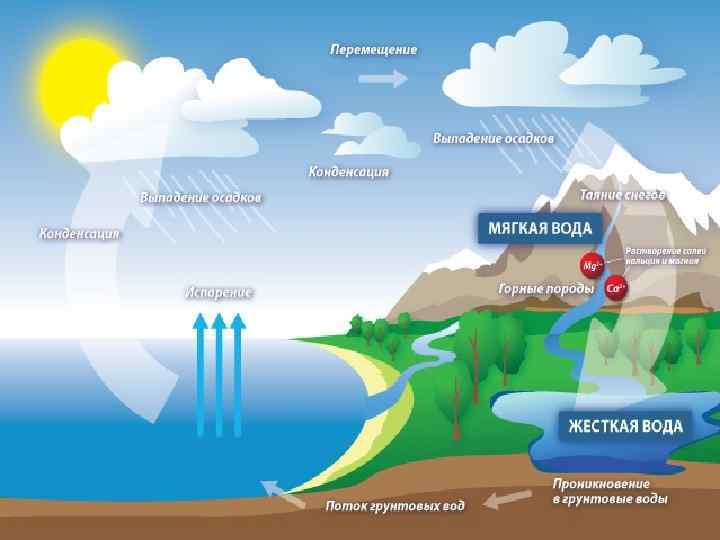
 6. Водные ресурсы Земли Водная оболочка земного шара — океаны, моря, реки, озера - называется гидросферой. Гидросфера покрывает 70, 8% земной поверхности. Объем гидросферы достигает 1370, 3 млн. км 3, 96, 5% гидросферы сосредоточено в океанах и морях, 1, 74% —в полярных и горных ледниках 0, 45% —в пресных водах—реках, болотах и озерах. Водная среда включает поверхностные и подземные воды. Поверхностные воды в основном сосредоточены в океане, содержанием 1 млрд. 338 млн. км 3 - около 98% всей воды на Земле. Поверхность океана (акватория) составляет 361 млн. км 2. Вода в океане соленая, причем большая ее часть (более 1 млрд. км 3) сохраняет постоянную соленость около 3, 5% и температуру, примерно равную 3, 7°С. Содержание растворенного кислорода в воде существенно уменьшается на глубине 50 -60 метров. Подземные воды бывают солеными, солоноватыми, пресными геотермальными
6. Водные ресурсы Земли Водная оболочка земного шара — океаны, моря, реки, озера - называется гидросферой. Гидросфера покрывает 70, 8% земной поверхности. Объем гидросферы достигает 1370, 3 млн. км 3, 96, 5% гидросферы сосредоточено в океанах и морях, 1, 74% —в полярных и горных ледниках 0, 45% —в пресных водах—реках, болотах и озерах. Водная среда включает поверхностные и подземные воды. Поверхностные воды в основном сосредоточены в океане, содержанием 1 млрд. 338 млн. км 3 - около 98% всей воды на Земле. Поверхность океана (акватория) составляет 361 млн. км 2. Вода в океане соленая, причем большая ее часть (более 1 млрд. км 3) сохраняет постоянную соленость около 3, 5% и температуру, примерно равную 3, 7°С. Содержание растворенного кислорода в воде существенно уменьшается на глубине 50 -60 метров. Подземные воды бывают солеными, солоноватыми, пресными геотермальными
 Пресная вода, количество которой составляет 2, 7% общего объема воды на Земле. Большая часть пресной воды содержится в снегах и пресноводных айсбергах, находящихся в районах в основном Южного полярного круга. При отсутствии пресной воды используют соленую поверхностную или подземную воду, производя ее опреснение или гиперфильтрацию. Опреснение воды — удаление из воды растворённых в ней солей с целью сделать её пригодной для питья или определённых технических целей. Гиперфильтрация – метод уменьшения засоленности воды, заключающийся в подаче их под давлением на мембрану полупроницаемую. Мембрана пропускает растворитель и полностью или частично задерживает растворённые соли.
Пресная вода, количество которой составляет 2, 7% общего объема воды на Земле. Большая часть пресной воды содержится в снегах и пресноводных айсбергах, находящихся в районах в основном Южного полярного круга. При отсутствии пресной воды используют соленую поверхностную или подземную воду, производя ее опреснение или гиперфильтрацию. Опреснение воды — удаление из воды растворённых в ней солей с целью сделать её пригодной для питья или определённых технических целей. Гиперфильтрация – метод уменьшения засоленности воды, заключающийся в подаче их под давлением на мембрану полупроницаемую. Мембрана пропускает растворитель и полностью или частично задерживает растворённые соли.
 7. Качество воды В природе вода никогда не встречается в виде химически чистого соединения. Обладая свойствами универсального растворителя, она постоянно несет большое количество различных элементов и соединений. Из грунта атмосферная вода поглощает углекислоту и становиться способной растворять по пути своего движения минеральные соли. Проходя через породы, вода приобретает свойства, характерные для них. Так, при прохождении через известковые породы, вода становится известковой, через доломитовые породы - магниевой. Проходя через каменную соль и гипс, вода насыщается сернокислыми и хлористыми солями и становится минеральной. Хозяйственно-питьевая вода относится к пищевым продуктам и ее показатели должны отвечать согласно Закону РФ «О санитарно-эпидемическом благополучии населения» от 19. 04. 91 года, санитарным правилам Сан. Пи. Н 4630 -88 и требованию ГОСТа 2874 -82 «Вода питьевая» .
7. Качество воды В природе вода никогда не встречается в виде химически чистого соединения. Обладая свойствами универсального растворителя, она постоянно несет большое количество различных элементов и соединений. Из грунта атмосферная вода поглощает углекислоту и становиться способной растворять по пути своего движения минеральные соли. Проходя через породы, вода приобретает свойства, характерные для них. Так, при прохождении через известковые породы, вода становится известковой, через доломитовые породы - магниевой. Проходя через каменную соль и гипс, вода насыщается сернокислыми и хлористыми солями и становится минеральной. Хозяйственно-питьевая вода относится к пищевым продуктам и ее показатели должны отвечать согласно Закону РФ «О санитарно-эпидемическом благополучии населения» от 19. 04. 91 года, санитарным правилам Сан. Пи. Н 4630 -88 и требованию ГОСТа 2874 -82 «Вода питьевая» .
 Качество - это характеристика состава и свойств воды, определяющая ее пригодность для конкретных видов водопользования. Для оценки качества воды в водном объекте или в источнике водоснабжения, используются физические, химические и санитарнобактериологические показатели. К физическим показателям качества воды относят температуру, запахи и привкусы, цветность и мутность. Химические показатели характеризуют химический состав воды. Обычно к числу химических показателей относят водородный показатель воды р. Н, жесткость и щелочность, минерализацию (сухой остаток), а также содержание главных ионов. К санитарно-бактериологическим показателям относят общую бактериальную загрязненность воды и загрязненность ее кишечной палочкой, содержание в воде токсичных и радиоактивных микрокомпонентов.
Качество - это характеристика состава и свойств воды, определяющая ее пригодность для конкретных видов водопользования. Для оценки качества воды в водном объекте или в источнике водоснабжения, используются физические, химические и санитарнобактериологические показатели. К физическим показателям качества воды относят температуру, запахи и привкусы, цветность и мутность. Химические показатели характеризуют химический состав воды. Обычно к числу химических показателей относят водородный показатель воды р. Н, жесткость и щелочность, минерализацию (сухой остаток), а также содержание главных ионов. К санитарно-бактериологическим показателям относят общую бактериальную загрязненность воды и загрязненность ее кишечной палочкой, содержание в воде токсичных и радиоактивных микрокомпонентов.
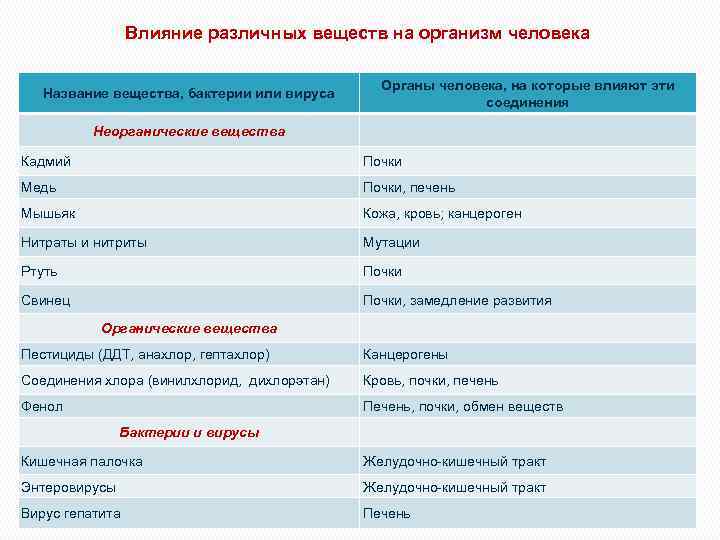 Влияние различных веществ на организм человека Органы человека, на которые влияют эти соединения Название вещества, бактерии или вируса Неорганические вещества Кадмий Почки Медь Почки, печень Мышьяк Кожа, кровь; канцероген Нитраты и нитриты Мутации Ртуть Почки Свинец Почки, замедление развития Органические вещества Пестициды (ДДТ, анахлор, гептахлор) Канцерогены Соединения хлора (винилхлорид, дихлорэтан) Кровь, почки, печень Фенол Печень, почки, обмен веществ Бактерии и вирусы Кишечная палочка Желудочно-кишечный тракт Энтеровирусы Желудочно-кишечный тракт Вирус гепатита Печень
Влияние различных веществ на организм человека Органы человека, на которые влияют эти соединения Название вещества, бактерии или вируса Неорганические вещества Кадмий Почки Медь Почки, печень Мышьяк Кожа, кровь; канцероген Нитраты и нитриты Мутации Ртуть Почки Свинец Почки, замедление развития Органические вещества Пестициды (ДДТ, анахлор, гептахлор) Канцерогены Соединения хлора (винилхлорид, дихлорэтан) Кровь, почки, печень Фенол Печень, почки, обмен веществ Бактерии и вирусы Кишечная палочка Желудочно-кишечный тракт Энтеровирусы Желудочно-кишечный тракт Вирус гепатита Печень
 9. Жесткая вода и ее умягчение Жесткость наиболее распространенная проблема качества воды. Российские нормы по качеству воды к жесткости: 7 мг-экв/л, по директивам Совета ЕС: 1 мг-экв/л. Жесткость воды определяется содержанием в воде солей жесткости (кальция и магния). Жесткость выражается в миллиграмм-эквивалентах на литр (мг-экв/л). Различают карбонатную (временную) жесткость, некарбонатную (постоянную) жесткость и общую жесткость воды. Карбонатная жесткость Жв (устранимая или временная), определяется наличием в воле двууглекислых солей кальция Сa(HCO 3)2 и магния Мg(HCO 3)2. Устраняют временную жесткость воды кипячением: при кипячении растворимые гидрокарбонаты переходят в нерастворимые карбонаты, и жесткость воды уменьшается. Сa(HCO 3)2 = Ca. CO 3 ↓ + H 2 O + CO 2↑ Мg(HCO 3)2 = Мg. CO 3 ↓ + H 2 O + CO 2↑ Накипь внутри чайника ‑ это осадок карбонатов кальция и магния с примесью сульфата кальция. Накипь можно удалить со стенок, используя разбавленный раствор уксусной или лимонной кислоты.
9. Жесткая вода и ее умягчение Жесткость наиболее распространенная проблема качества воды. Российские нормы по качеству воды к жесткости: 7 мг-экв/л, по директивам Совета ЕС: 1 мг-экв/л. Жесткость воды определяется содержанием в воде солей жесткости (кальция и магния). Жесткость выражается в миллиграмм-эквивалентах на литр (мг-экв/л). Различают карбонатную (временную) жесткость, некарбонатную (постоянную) жесткость и общую жесткость воды. Карбонатная жесткость Жв (устранимая или временная), определяется наличием в воле двууглекислых солей кальция Сa(HCO 3)2 и магния Мg(HCO 3)2. Устраняют временную жесткость воды кипячением: при кипячении растворимые гидрокарбонаты переходят в нерастворимые карбонаты, и жесткость воды уменьшается. Сa(HCO 3)2 = Ca. CO 3 ↓ + H 2 O + CO 2↑ Мg(HCO 3)2 = Мg. CO 3 ↓ + H 2 O + CO 2↑ Накипь внутри чайника ‑ это осадок карбонатов кальция и магния с примесью сульфата кальция. Накипь можно удалить со стенок, используя разбавленный раствор уксусной или лимонной кислоты.
 Некарбонатная или постоянная жесткость (Жп ) - содержание некарбонатных солей кальция и магния - сульфаты, хлориды, нитраты. При нагревании или кипячении воды они остаются в растворе. Общая жесткость (Ж) - определяется как суммарное содержание в воде солей кальция и магния, выражается как сумма карбонатной и некарбонатной жесткости. Ж = Жв + Жп При оценке жесткости воды обычно воду характеризуют следующим образом: Вода Жесткость, мг-экв/л очень мягкая вода до 1, 5 мг-экв/л мягкая вода средней жесткости от 1, 5 до 4 мг-экв/л от 4 до 8 мг-экв/л жесткая вода от 8 до 12 мг-экв/л очень жесткая вода более 12 мг-экв/л
Некарбонатная или постоянная жесткость (Жп ) - содержание некарбонатных солей кальция и магния - сульфаты, хлориды, нитраты. При нагревании или кипячении воды они остаются в растворе. Общая жесткость (Ж) - определяется как суммарное содержание в воде солей кальция и магния, выражается как сумма карбонатной и некарбонатной жесткости. Ж = Жв + Жп При оценке жесткости воды обычно воду характеризуют следующим образом: Вода Жесткость, мг-экв/л очень мягкая вода до 1, 5 мг-экв/л мягкая вода средней жесткости от 1, 5 до 4 мг-экв/л от 4 до 8 мг-экв/л жесткая вода от 8 до 12 мг-экв/л очень жесткая вода более 12 мг-экв/л
 Негативное воздействие жесткой воды: жесткая вода образует накипные отложения в водонагревательных системах и приборах; увеличивается расход моющих средств и мыла; Экспертами всемирной организации здравоохранения (ВОЗ) установлено, что 80% всех заболеваний в мире связано в той или иной степени связаны с неудовлетворительным качеством питьевой воды и нарушением санитарно-гигиенических и экологических норм водообеспечения.
Негативное воздействие жесткой воды: жесткая вода образует накипные отложения в водонагревательных системах и приборах; увеличивается расход моющих средств и мыла; Экспертами всемирной организации здравоохранения (ВОЗ) установлено, что 80% всех заболеваний в мире связано в той или иной степени связаны с неудовлетворительным качеством питьевой воды и нарушением санитарно-гигиенических и экологических норм водообеспечения.
 10. Методы очистки воды 10. 1. Механические способы водоочистки предполагают использование всевозможных фильтров. Фильтры бывают разные: грубые – для очистки воды от крупного мусора и песка – и тонкие – позволяющие отфильтровать очень мелкую пыль, а некоторые механические устройства очистки воды помогают удалить даже химические примеси и микроорганизмы. Преимущества: Системы умягчения способны очищать ионы различных солей. Умягчение устраняет угрозу отложения труднорастворимых соединений на стенках и ведущих элементах промышленного оборудования. Установки обратного осмоса предприятий позволяют производить очистку максимального качества по всем показателям при минимальных усилиях.
10. Методы очистки воды 10. 1. Механические способы водоочистки предполагают использование всевозможных фильтров. Фильтры бывают разные: грубые – для очистки воды от крупного мусора и песка – и тонкие – позволяющие отфильтровать очень мелкую пыль, а некоторые механические устройства очистки воды помогают удалить даже химические примеси и микроорганизмы. Преимущества: Системы умягчения способны очищать ионы различных солей. Умягчение устраняет угрозу отложения труднорастворимых соединений на стенках и ведущих элементах промышленного оборудования. Установки обратного осмоса предприятий позволяют производить очистку максимального качества по всем показателям при минимальных усилиях.
 10. 2. Химические способы очистки воды Химический процесс очистки воды, как правило, заключается в ее хлорировании или озонировании. Хлорирование воды - обработка воды хлором и его соединениями. Этот способ основан на способности свободного хлора и его соединений угнетать ферментные системы микробов, катализирующие окислительно-восстановительные процессы. Недостатки: Не позволяет должным образом очищать, способствует образованию вредных для организма человека примесей. Озонирование воды – это более высокотехнологичный способ обработки воды. Озон – О 3. Бактерицидное действие озона связано с активным проникновением этой химически активной формы кислорода через клеточные мембраны и последующим окислением органических веществ, что и вызывает гибель бактериальной клетки. Наряду с обеззараживанием, озонирование приводит к улучшению вкуса и уничтожению запахов воды.
10. 2. Химические способы очистки воды Химический процесс очистки воды, как правило, заключается в ее хлорировании или озонировании. Хлорирование воды - обработка воды хлором и его соединениями. Этот способ основан на способности свободного хлора и его соединений угнетать ферментные системы микробов, катализирующие окислительно-восстановительные процессы. Недостатки: Не позволяет должным образом очищать, способствует образованию вредных для организма человека примесей. Озонирование воды – это более высокотехнологичный способ обработки воды. Озон – О 3. Бактерицидное действие озона связано с активным проникновением этой химически активной формы кислорода через клеточные мембраны и последующим окислением органических веществ, что и вызывает гибель бактериальной клетки. Наряду с обеззараживанием, озонирование приводит к улучшению вкуса и уничтожению запахов воды.
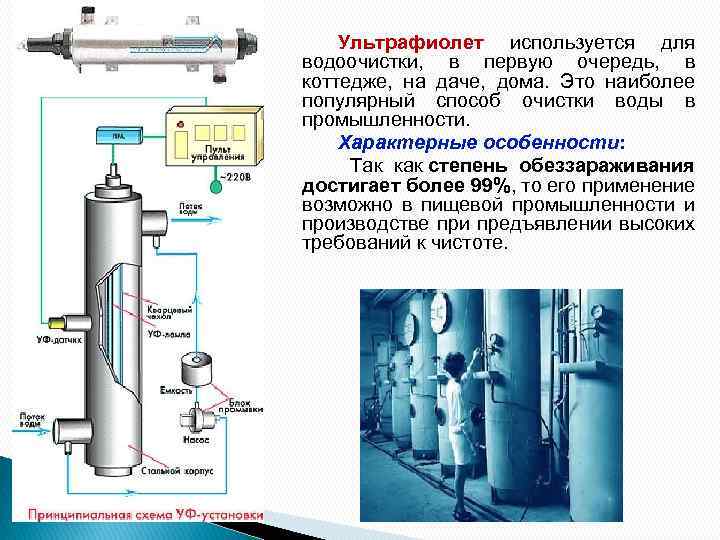 Ультрафиолет используется для водоочистки, в первую очередь, в коттедже, на даче, дома. Это наиболее популярный способ очистки воды в промышленности. Характерные особенности: Так как степень обеззараживания достигает более 99%, то его применение возможно в пищевой промышленности и производстве при предъявлении высоких требований к чистоте.
Ультрафиолет используется для водоочистки, в первую очередь, в коттедже, на даче, дома. Это наиболее популярный способ очистки воды в промышленности. Характерные особенности: Так как степень обеззараживания достигает более 99%, то его применение возможно в пищевой промышленности и производстве при предъявлении высоких требований к чистоте.
 10. 3. Биологический метод основан на использовании закономерностей биохимического и физиологического самоочищения рек и других водоемов. Есть несколько типов биологических устройств по очистке вод: биофильтры, биологические пруды и аэротенки. В биофильтрах воды пропускаются через слой крупнозернистого материала, покрытого тонкой бактериальной пленкой. Благодаря этой пленке интенсивно протекают процессы биологического окисления. Именно она служит действующим началом в биофильтрах. В биологических прудах в очистке сточных вод принимают участие все организмы, населяющие водоем. Аэротенки - огромные резервуары из железобетона. Здесь очищающее начало - активный ил из бактерий и микроскопических животных. Для дезинфекции используют также другие физико-химические приемы (ультразвук, электролиз, озонирование и др. )
10. 3. Биологический метод основан на использовании закономерностей биохимического и физиологического самоочищения рек и других водоемов. Есть несколько типов биологических устройств по очистке вод: биофильтры, биологические пруды и аэротенки. В биофильтрах воды пропускаются через слой крупнозернистого материала, покрытого тонкой бактериальной пленкой. Благодаря этой пленке интенсивно протекают процессы биологического окисления. Именно она служит действующим началом в биофильтрах. В биологических прудах в очистке сточных вод принимают участие все организмы, населяющие водоем. Аэротенки - огромные резервуары из железобетона. Здесь очищающее начало - активный ил из бактерий и микроскопических животных. Для дезинфекции используют также другие физико-химические приемы (ультразвук, электролиз, озонирование и др. )