 ВОДА Н 2 О
ВОДА Н 2 О
 Физические свойства воды Физические свойства: 1) Бесцветная прозрачная жидкость без вкуса и запаха. 2) Температура плавления Тпл = 0˚С. 3) Температура кипения Ткип = 100˚С. при давлении р = 101325 Па (1 атм) 4) Плотность ρ = 1 г/см 3 – максимальная плотность (при Т = 4˚С) 5) Теплоемкость Сp = 4, 184 к. Дж/(кг˚С) 6) Полярная жидкость – хорошо растворяет полярные вещества, например, этиловый спирт С 2 Н 5 ОН неограниченно растворяется в воде.
Физические свойства воды Физические свойства: 1) Бесцветная прозрачная жидкость без вкуса и запаха. 2) Температура плавления Тпл = 0˚С. 3) Температура кипения Ткип = 100˚С. при давлении р = 101325 Па (1 атм) 4) Плотность ρ = 1 г/см 3 – максимальная плотность (при Т = 4˚С) 5) Теплоемкость Сp = 4, 184 к. Дж/(кг˚С) 6) Полярная жидкость – хорошо растворяет полярные вещества, например, этиловый спирт С 2 Н 5 ОН неограниченно растворяется в воде.
 Особые свойства воды 1) Аномалия воды: плотность жидкой воды больше, чем твердой (льда). Плотность льда составляет около 0, 92 г/см 3. Такое значение плотности обусловлено тем, что в жидкой воде молекулы располагаются ближе друг к другу, а в структуре кльда имеются полости: е ь т о еи ур л а вк л н ы а об ав т д , ч аз о ст я р ме ю ь ору т ви кот а ст ку, о н и Структура льда рт ка Полости могут занимать молекулы других веществ (благородных газов Ar, Kr, Xe, галогены Cl 2, Br 2 и т. д. ). Такие соединения называются клатратами, например, 6 Ar ∙ 46 H 2 O, 6, 3 Cl 2 ∙ 46 H 2 O. Из-за того, что плотность льда меньше плотности жидкой воды, лед плавает на поверхности водоемов, что предотвращает их промерзание. 2) Вода и водные растворы могут переохлаждаться и перегреваться 3) Температура плавления льда уменьшается с увеличением внешнего давления
Особые свойства воды 1) Аномалия воды: плотность жидкой воды больше, чем твердой (льда). Плотность льда составляет около 0, 92 г/см 3. Такое значение плотности обусловлено тем, что в жидкой воде молекулы располагаются ближе друг к другу, а в структуре кльда имеются полости: е ь т о еи ур л а вк л н ы а об ав т д , ч аз о ст я р ме ю ь ору т ви кот а ст ку, о н и Структура льда рт ка Полости могут занимать молекулы других веществ (благородных газов Ar, Kr, Xe, галогены Cl 2, Br 2 и т. д. ). Такие соединения называются клатратами, например, 6 Ar ∙ 46 H 2 O, 6, 3 Cl 2 ∙ 46 H 2 O. Из-за того, что плотность льда меньше плотности жидкой воды, лед плавает на поверхности водоемов, что предотвращает их промерзание. 2) Вода и водные растворы могут переохлаждаться и перегреваться 3) Температура плавления льда уменьшается с увеличением внешнего давления
 Строение воды Свойства любого объекта определятся его составом и строением. Чтобы объяснить аномалию воды рассмотрим её строение. ол уг й и ны ад т р ен тет л ва е в те к чь тин на р оз а ка об н Молекула воды является уголковой и плоской. Валентный угол равен 105˚. Валентный угол – угол между связями О–Н. В жидкости за счет особых взаимодействий молекулы воды объединяются в так называемые ассоциаты – образования из n молекул воды (H 2 O)n. Образование ассоциатов – одна из причин аномалии воды (ρ(воды) > ρ(лед)). Отдельная молекула воды (слева) и ассоциат (справа)
Строение воды Свойства любого объекта определятся его составом и строением. Чтобы объяснить аномалию воды рассмотрим её строение. ол уг й и ны ад т р ен тет л ва е в те к чь тин на р оз а ка об н Молекула воды является уголковой и плоской. Валентный угол равен 105˚. Валентный угол – угол между связями О–Н. В жидкости за счет особых взаимодействий молекулы воды объединяются в так называемые ассоциаты – образования из n молекул воды (H 2 O)n. Образование ассоциатов – одна из причин аномалии воды (ρ(воды) > ρ(лед)). Отдельная молекула воды (слева) и ассоциат (справа)
 Классификация оксидов Вода – оксид водорода. Чтобы охарактеризовать её химические свойства рассмотрим классификацию оксидов: Оксиды … Основные оксиды металлов: Na 2 O, Mg. O, Cu. O и т. д. … Амфотерные Кислотные (промежуточные по оксиды неметаллов: свойствам между SO 3, SO 2, P 2 O 5 и т. д. основными и кислотными оксидами): H 2 O, Al 2 O 3, Zn. O и т. д. Оставьте примерно полстраницы (или больше) для дополнения!!! Вместо «…» потом впишем кое-что
Классификация оксидов Вода – оксид водорода. Чтобы охарактеризовать её химические свойства рассмотрим классификацию оксидов: Оксиды … Основные оксиды металлов: Na 2 O, Mg. O, Cu. O и т. д. … Амфотерные Кислотные (промежуточные по оксиды неметаллов: свойствам между SO 3, SO 2, P 2 O 5 и т. д. основными и кислотными оксидами): H 2 O, Al 2 O 3, Zn. O и т. д. Оставьте примерно полстраницы (или больше) для дополнения!!! Вместо «…» потом впишем кое-что
 Химические свойства воды I. Взаимодействие с простыми веществами: 1) с металлами (активными и средней активности): Na + H 2 O → Na. OH + H 2↑ t˚ Fe + H 2 O → Fe 3 O 4 + H 2↑ 2) с неметаллами (галогенами Cl 2, Br 2, I 2): Cl 2 + H 2 O → HCl + HCl. O хлорноватистая кислота
Химические свойства воды I. Взаимодействие с простыми веществами: 1) с металлами (активными и средней активности): Na + H 2 O → Na. OH + H 2↑ t˚ Fe + H 2 O → Fe 3 O 4 + H 2↑ 2) с неметаллами (галогенами Cl 2, Br 2, I 2): Cl 2 + H 2 O → HCl + HCl. O хлорноватистая кислота
 Химические свойства воды II. Взаимодействие со сложными веществами: 1) с основными оксидами: Na 2 O + H 2 O → Na. OH I I основный оксид I гидроксид Na (основание) Эту фразу писать не надо (нужно УЯСНИТЬ): многие оксиды (но не все – исключения ещё увидим) могут присоединять воду, в результате чего образуется соединение воды и оксида, т. е. гидроксид. При этом валентность элемента в оксиде равна валентности элемента в гидроксиде, т. е. она не меняется. Гидроксид может быть как кислотой, так и основанием!!! Ca. O + H 2 O → Ca(OH)2 II основный оксид II гидроксид Ca (основание)
Химические свойства воды II. Взаимодействие со сложными веществами: 1) с основными оксидами: Na 2 O + H 2 O → Na. OH I I основный оксид I гидроксид Na (основание) Эту фразу писать не надо (нужно УЯСНИТЬ): многие оксиды (но не все – исключения ещё увидим) могут присоединять воду, в результате чего образуется соединение воды и оксида, т. е. гидроксид. При этом валентность элемента в оксиде равна валентности элемента в гидроксиде, т. е. она не меняется. Гидроксид может быть как кислотой, так и основанием!!! Ca. O + H 2 O → Ca(OH)2 II основный оксид II гидроксид Ca (основание)
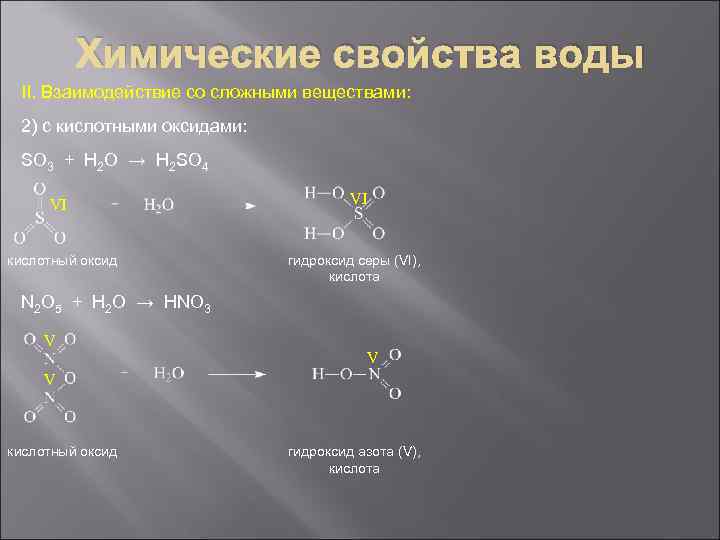 Химические свойства воды II. Взаимодействие со сложными веществами: 2) с кислотными оксидами: SO 3 + H 2 O → H 2 SO 4 VI кислотный оксид VI гидроксид серы (VI), кислота N 2 O 5 + H 2 O → HNO 3 V V V кислотный оксид гидроксид азота (V), кислота
Химические свойства воды II. Взаимодействие со сложными веществами: 2) с кислотными оксидами: SO 3 + H 2 O → H 2 SO 4 VI кислотный оксид VI гидроксид серы (VI), кислота N 2 O 5 + H 2 O → HNO 3 V V V кислотный оксид гидроксид азота (V), кислота
 Химические свойства воды II. Взаимодействие со сложными веществами: 2) с кислотными оксидами: P 2 O 5 + H 2 O → HPO 3 Дз P 2 O 5 + 3 H 2 O = 2 H 3 PO 4 V V V кислотный оксид один из гидроксидов фосфора (V), кислота Одному оксиду могут соответствовать несколько гидроксидов Д/з: написать в таком же формате взаимодействие с водой K 2 O, Ba. O, P 2 O 5 (до HPO 3) N 2 O 3 и Cl 2 O 7
Химические свойства воды II. Взаимодействие со сложными веществами: 2) с кислотными оксидами: P 2 O 5 + H 2 O → HPO 3 Дз P 2 O 5 + 3 H 2 O = 2 H 3 PO 4 V V V кислотный оксид один из гидроксидов фосфора (V), кислота Одному оксиду могут соответствовать несколько гидроксидов Д/з: написать в таком же формате взаимодействие с водой K 2 O, Ba. O, P 2 O 5 (до HPO 3) N 2 O 3 и Cl 2 O 7
 Диктант 1) Азотная кислота 2) Сульфид калия 3) Гидрид хлора 4) 2 атома железа 5) Ортофосфат натрия 6) Карбонат алюминия 7) 7 молекул аммиака 8) Дигидрат сульфата кальция 9) Поваренная соль 10)Нитрат железа (II) 11)Перманганат калия 12)Силикат кальция 13)Дихромовая кислота
Диктант 1) Азотная кислота 2) Сульфид калия 3) Гидрид хлора 4) 2 атома железа 5) Ортофосфат натрия 6) Карбонат алюминия 7) 7 молекул аммиака 8) Дигидрат сульфата кальция 9) Поваренная соль 10)Нитрат железа (II) 11)Перманганат калия 12)Силикат кальция 13)Дихромовая кислота


