Гидрология_тема2.ppt
- Количество слайдов: 27
 Вода как вещество
Вода как вещество
 Изотопный состав. Существует 9 устойчивых разновидностей воды. Содержание их в пресной воде в среднем следующее (%): 1 Н 216 О – 99, 73; 1 Н 218 O – 0, 2; 1 Н 217 О – 0, 04; 1 Н 2 Н 16 О – 0, 03; остальные пять изотопных разновидностей присутствуют в воде в ничтожных количествах. Кроме стабильных изотопных разновидностей, в воде содержится небольшое количество радиоактивного 3 Н 2 О (или Т 2 О). Изотопный состав природных вод разного происхождения варьируется. Особенно непостоянно отношение 1 Н/2 Н в пресных водах – в среднем 6900, в морской воде – 5500, во льдах – 5500 -9000. Строение молекулы и физические свойства. Атом водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи 0, 0957 нм; валентный угол Н—О—Н 104, 5°(рис. ; дипольный момент 6, 17 • 10 -30 Кл • м; поляризуемость молекулы 1, 45 • 10 -3 нм 3; средний квадрупольный момент – 1, 87 • 10 -41 Кл • м 2, энергия ионизации 12, 6 э. В, сродство к протону 7, 1 э. В. При взаимодействии молекулы воды с другими атомами, молекулами и ионами, в т. ч. с другими молекулами воды в конденсируемых фазах, эти параметры изменяются.
Изотопный состав. Существует 9 устойчивых разновидностей воды. Содержание их в пресной воде в среднем следующее (%): 1 Н 216 О – 99, 73; 1 Н 218 O – 0, 2; 1 Н 217 О – 0, 04; 1 Н 2 Н 16 О – 0, 03; остальные пять изотопных разновидностей присутствуют в воде в ничтожных количествах. Кроме стабильных изотопных разновидностей, в воде содержится небольшое количество радиоактивного 3 Н 2 О (или Т 2 О). Изотопный состав природных вод разного происхождения варьируется. Особенно непостоянно отношение 1 Н/2 Н в пресных водах – в среднем 6900, в морской воде – 5500, во льдах – 5500 -9000. Строение молекулы и физические свойства. Атом водорода и кислорода в молекуле воды расположены в углах равнобедренного треугольника с длиной связи 0, 0957 нм; валентный угол Н—О—Н 104, 5°(рис. ; дипольный момент 6, 17 • 10 -30 Кл • м; поляризуемость молекулы 1, 45 • 10 -3 нм 3; средний квадрупольный момент – 1, 87 • 10 -41 Кл • м 2, энергия ионизации 12, 6 э. В, сродство к протону 7, 1 э. В. При взаимодействии молекулы воды с другими атомами, молекулами и ионами, в т. ч. с другими молекулами воды в конденсируемых фазах, эти параметры изменяются.
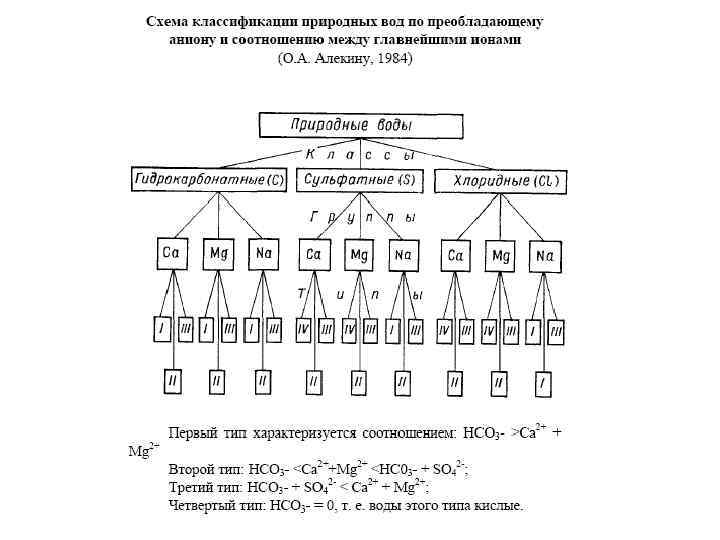
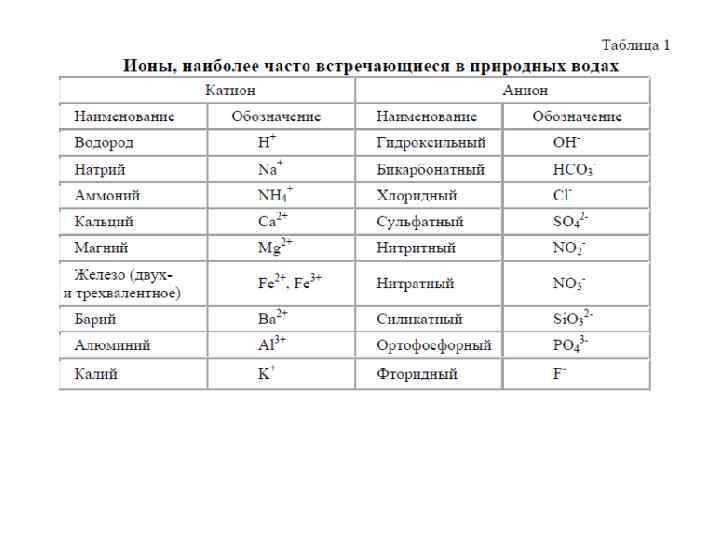
 Химический состав воды. В водных растворах подавляющее большинство солей существует в виде ионов. В природных водах преобладают 3 аниона (гидрокарбонат HCO 3 -, хлорид Cl- и сульфат SO 42 -) и 4 катиона (кальций Ca 2+, магний Mg 2+, натрий Na+ и калий K+) – их называют главными ионами. Хлорид-ионы придают воде соленый вкус, сульфат-ионы, ионы кальция и магния – горький, гидрокарбонат-ионы безвкусны. Они составляют в пресных водах свыше 90 -95%, а в высокоминерализованных – свыше 99 % всех растворенных веществ. Обычно нижним пределом концентрации для главных ионов считают 1 мг/л, поэтому в ряде случаев, например для морских и некоторых подземных вод, к главным компонентам можно отнести также Br-, B 3+, Sr 3+ и др. Отнесение ионов K+ к числу главных является спорным. Классификация природных вод по химическому составу. Соотношение указанных элементов определяет основные свойства вод – щелочность, соленость и жесткость.
Химический состав воды. В водных растворах подавляющее большинство солей существует в виде ионов. В природных водах преобладают 3 аниона (гидрокарбонат HCO 3 -, хлорид Cl- и сульфат SO 42 -) и 4 катиона (кальций Ca 2+, магний Mg 2+, натрий Na+ и калий K+) – их называют главными ионами. Хлорид-ионы придают воде соленый вкус, сульфат-ионы, ионы кальция и магния – горький, гидрокарбонат-ионы безвкусны. Они составляют в пресных водах свыше 90 -95%, а в высокоминерализованных – свыше 99 % всех растворенных веществ. Обычно нижним пределом концентрации для главных ионов считают 1 мг/л, поэтому в ряде случаев, например для морских и некоторых подземных вод, к главным компонентам можно отнести также Br-, B 3+, Sr 3+ и др. Отнесение ионов K+ к числу главных является спорным. Классификация природных вод по химическому составу. Соотношение указанных элементов определяет основные свойства вод – щелочность, соленость и жесткость.
 По преобладающему аниону воды делятся на три класса: гидрокарбонатные, сульфатные и хлоридные. Воды каждого класса делятся, в свою очередь, по преобладающему катиону на три группы: кальциевую, магниевую и натриевую. Каждая группа подразделяется на 4 типа по соотношению содержащихся в воде ионов (в эквивалентах). При этом класс природных вод обозначается символом соответствующего аниона: С — НСО 3 -, S — SO 42 -, Сl — Сl-; группа: символом катиона: К+, Na+, Са 2+, Мg 2+; тип – римской цифрой. Формула воды записывается следующим образом. К символу класса добавляется нижний индекс – значение минерализации (с точностью до 0, 1 г/л), к символу группы – верхний индекс – значение общего катионного состава (с точностью до целых единиц вещества в ммоль/л), например: С 1, 2 Nа 0, 5 – гидрокарбонатно-натриевая вода с общей минерализацией 1, 2 г/л и преобладающей концентрацией гидрокарбонатных ионов и ионов натрия. Или СсаІІ50, 4 – это значит, что вода гидрокарбонатного класса, группы кальция, типа ІІ, с минерализацией 0, 4 г/дм 3 и жесткостью 5 ммоль/дм 3 (мг-экв/л).
По преобладающему аниону воды делятся на три класса: гидрокарбонатные, сульфатные и хлоридные. Воды каждого класса делятся, в свою очередь, по преобладающему катиону на три группы: кальциевую, магниевую и натриевую. Каждая группа подразделяется на 4 типа по соотношению содержащихся в воде ионов (в эквивалентах). При этом класс природных вод обозначается символом соответствующего аниона: С — НСО 3 -, S — SO 42 -, Сl — Сl-; группа: символом катиона: К+, Na+, Са 2+, Мg 2+; тип – римской цифрой. Формула воды записывается следующим образом. К символу класса добавляется нижний индекс – значение минерализации (с точностью до 0, 1 г/л), к символу группы – верхний индекс – значение общего катионного состава (с точностью до целых единиц вещества в ммоль/л), например: С 1, 2 Nа 0, 5 – гидрокарбонатно-натриевая вода с общей минерализацией 1, 2 г/л и преобладающей концентрацией гидрокарбонатных ионов и ионов натрия. Или СсаІІ50, 4 – это значит, что вода гидрокарбонатного класса, группы кальция, типа ІІ, с минерализацией 0, 4 г/дм 3 и жесткостью 5 ммоль/дм 3 (мг-экв/л).
 Химические свойства воды. Химически чистая вода в обычных условиях – жидкость без цвета, вкуса и запаха. При нормальном атмосферном давлении (1013 г. Па или 760 мм. рт. ст. ) температура замерзания принята равной 0 С, а кипения 100 С. Вода является слабым электролитом. При температуре 25 С примерно 1 на 5 • 109 молекул подвергается электролитической диссоциации по схеме Н 2 О↔Н++ОН-. Вода хорошо растворяет многие полярные и диссоциирующие на ионы вещества. Концентрация ионов Н+ и связанная с ней концентрация ионов ОН- − являются важными характеристиками водных растворов и отражают водородный показатель (р. Н), который представляет десятичный логарифм концентрации водных ионов (моль/л), взятый с обратным знаком. Величина р. Н обусловливает кислотную или щелочную реакцию водной среды. р. Н=7 нейтральная среда; р. Н> 7 щелочная среда; р. Н< 7 кислая среда <4, 5 рудничные воды, 4, 5 -6 болотные, 5, 5 -7, 2 подземные, 6, 8 -8, 5 реки и озера, 7, 8 -8, 3 океаны, >8, 5 соленые озера
Химические свойства воды. Химически чистая вода в обычных условиях – жидкость без цвета, вкуса и запаха. При нормальном атмосферном давлении (1013 г. Па или 760 мм. рт. ст. ) температура замерзания принята равной 0 С, а кипения 100 С. Вода является слабым электролитом. При температуре 25 С примерно 1 на 5 • 109 молекул подвергается электролитической диссоциации по схеме Н 2 О↔Н++ОН-. Вода хорошо растворяет многие полярные и диссоциирующие на ионы вещества. Концентрация ионов Н+ и связанная с ней концентрация ионов ОН- − являются важными характеристиками водных растворов и отражают водородный показатель (р. Н), который представляет десятичный логарифм концентрации водных ионов (моль/л), взятый с обратным знаком. Величина р. Н обусловливает кислотную или щелочную реакцию водной среды. р. Н=7 нейтральная среда; р. Н> 7 щелочная среда; р. Н< 7 кислая среда <4, 5 рудничные воды, 4, 5 -6 болотные, 5, 5 -7, 2 подземные, 6, 8 -8, 5 реки и озера, 7, 8 -8, 3 океаны, >8, 5 соленые озера
 Минерализация воды. Общая минерализация представляет собой суммарный количественный показатель содержания растворенных в воде веществ. Этот параметр также называют содержанием растворимых твердых веществ или общим солесодержанием, так как растворенные в воде вещества находятся именно в виде солей. Минерализация выражается в мг/л или г/л. В подавляющем большинстве случаев солевой состав природных вод определяется главными ионами. Остальные ионы присутствуют в значительно меньших количествах и называются микрокомпонентами; они не определяют химический тип воды. Содержание растворенных в воде веществ, выраженное в г/л или промилле (одна тысячная доля, 1/10 процента обозначается дробью « 0 делить на 00» (‰), называется соленостью воды. К числу наиболее распространенных относятся неорганические соли и небольшое количество органических веществ, растворимых в воде. Классификация вод по величине минерализации: • Пресные – до 1 г/л; • Слабосолоноватые – 1– 3 г/л; • Солоноватые – 3– 10 г/л; • Соленые – 10– 50 г/; Рассолы – более 50 г/л. Очень часто общую минерализацию воды путают с сухим остатком. Сухой остаток определяется путем выпаривания литра воды и взвешивания того, что осталось. В результате не учитываются более летучие органические соединения, растворенные в воде.
Минерализация воды. Общая минерализация представляет собой суммарный количественный показатель содержания растворенных в воде веществ. Этот параметр также называют содержанием растворимых твердых веществ или общим солесодержанием, так как растворенные в воде вещества находятся именно в виде солей. Минерализация выражается в мг/л или г/л. В подавляющем большинстве случаев солевой состав природных вод определяется главными ионами. Остальные ионы присутствуют в значительно меньших количествах и называются микрокомпонентами; они не определяют химический тип воды. Содержание растворенных в воде веществ, выраженное в г/л или промилле (одна тысячная доля, 1/10 процента обозначается дробью « 0 делить на 00» (‰), называется соленостью воды. К числу наиболее распространенных относятся неорганические соли и небольшое количество органических веществ, растворимых в воде. Классификация вод по величине минерализации: • Пресные – до 1 г/л; • Слабосолоноватые – 1– 3 г/л; • Солоноватые – 3– 10 г/л; • Соленые – 10– 50 г/; Рассолы – более 50 г/л. Очень часто общую минерализацию воды путают с сухим остатком. Сухой остаток определяется путем выпаривания литра воды и взвешивания того, что осталось. В результате не учитываются более летучие органические соединения, растворенные в воде.
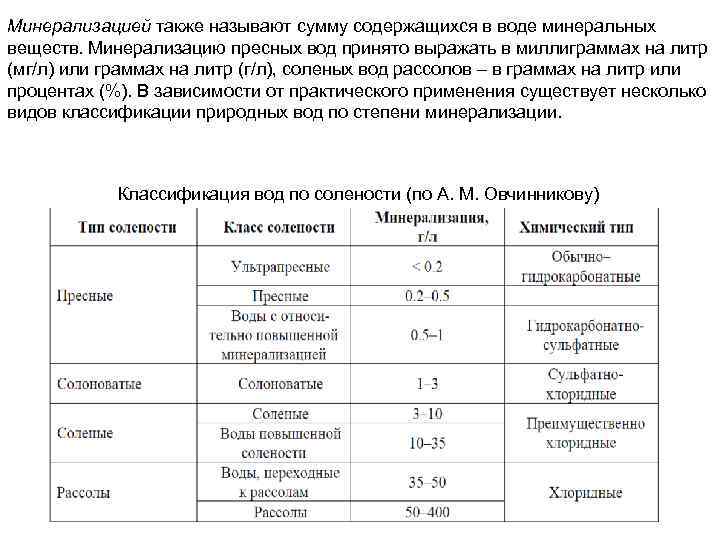 Минерализацией также называют сумму содержащихся в воде минеральных веществ. Минерализацию пресных вод принято выражать в миллиграммах на литр (мг/л) или граммах на литр (г/л), соленых вод рассолов – в граммах на литр или процентах (%). В зависимости от практического применения существует несколько видов классификации природных вод по степени минерализации. Классификация вод по солености (по А. М. Овчинникову)
Минерализацией также называют сумму содержащихся в воде минеральных веществ. Минерализацию пресных вод принято выражать в миллиграммах на литр (мг/л) или граммах на литр (г/л), соленых вод рассолов – в граммах на литр или процентах (%). В зависимости от практического применения существует несколько видов классификации природных вод по степени минерализации. Классификация вод по солености (по А. М. Овчинникову)
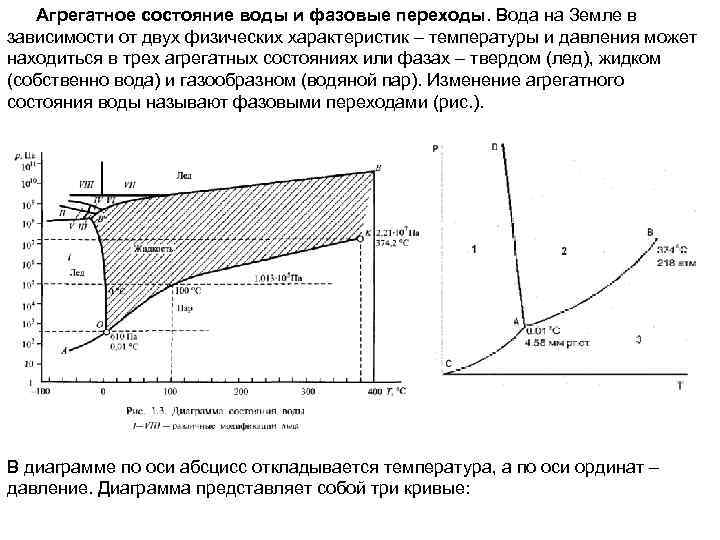 Агрегатное состояние воды и фазовые переходы. Вода на Земле в зависимости от двух физических характеристик – температуры и давления может находиться в трех агрегатных состояниях или фазах – твердом (лед), жидком (собственно вода) и газообразном (водяной пар). Изменение агрегатного состояния воды называют фазовыми переходами (рис. ). В диаграмме по оси абсцисс откладывается температура, а по оси ординат – давление. Диаграмма представляет собой три кривые:
Агрегатное состояние воды и фазовые переходы. Вода на Земле в зависимости от двух физических характеристик – температуры и давления может находиться в трех агрегатных состояниях или фазах – твердом (лед), жидком (собственно вода) и газообразном (водяной пар). Изменение агрегатного состояния воды называют фазовыми переходами (рис. ). В диаграмме по оси абсцисс откладывается температура, а по оси ординат – давление. Диаграмма представляет собой три кривые:
 Кривая АВ – кривая испарения – выражает зависимость давления пара жидкой воды от температуры (или, наоборот, представляет зависимость температуры кипения воды от давления). Другими словами, эта линия отвечает двухфазному равновесию: (жидкая вода) / (пар), и число степеней свободы, рассчитанное по правилу фаз, составляет С = 3 - 2 = 1. Такое равновесие называют моновариантным. Это означает, что для полного описания системы достаточно определить только одну переменную – либо температуру, либо давление, т. к. для данной температуры существует только одно равновесное давление и для данного давления – только одна равновесная температура. При давлениях и температурах, соответствующих точкам ниже линии АВ, жидкость будет полностью испаряться, и эта область является областью пара. Для описания системы в данной однофазной области необходимы две независимые переменные (С = 3 - 1 = 2): температура и давление. При давлениях и температурах, соответствующих точкам выше линии АВ, пар полностью сконденсирован в жидкость (С = 2). Верхний предел кривой испарения AB находится в точке В, которая называется критической точкой (для воды 374 o С и 218 атм). Выше этой температуры фазы жидкости и пара становятся неразличимыми (исчезает четкая межфазная граница жидкость/пар).
Кривая АВ – кривая испарения – выражает зависимость давления пара жидкой воды от температуры (или, наоборот, представляет зависимость температуры кипения воды от давления). Другими словами, эта линия отвечает двухфазному равновесию: (жидкая вода) / (пар), и число степеней свободы, рассчитанное по правилу фаз, составляет С = 3 - 2 = 1. Такое равновесие называют моновариантным. Это означает, что для полного описания системы достаточно определить только одну переменную – либо температуру, либо давление, т. к. для данной температуры существует только одно равновесное давление и для данного давления – только одна равновесная температура. При давлениях и температурах, соответствующих точкам ниже линии АВ, жидкость будет полностью испаряться, и эта область является областью пара. Для описания системы в данной однофазной области необходимы две независимые переменные (С = 3 - 1 = 2): температура и давление. При давлениях и температурах, соответствующих точкам выше линии АВ, пар полностью сконденсирован в жидкость (С = 2). Верхний предел кривой испарения AB находится в точке В, которая называется критической точкой (для воды 374 o С и 218 атм). Выше этой температуры фазы жидкости и пара становятся неразличимыми (исчезает четкая межфазная граница жидкость/пар).
 Линия АС – эта кривая возгонки льда (иногда ее называют линией сублимации), отражающая зависимость давления водяного пара надо льдом от температуры. Эта линия соответствует моновариантному равновесию (лед) / (пар) (С=1). Выше линии АС лежит область льда, ниже - область пара. Линия АD – кривая плавления, выражает зависимость температуры плавления льда от давления и соответствует моновариантному равновесию (лед) / (жидкая вода). Для большинства веществ линия АD отклоняется от вертикали вправо, но поведение воды аномально: жидкая вода занимает меньший объем, чем лед. На основании принципа Ле Шателье можно предсказать, что повышение давления будет вызывать сдвиг равновесия в сторону образования жидкости, т. е. точка замерзания будет понижаться. Исследования, проведенные Бриджменом для определения хода кривой плавления льда при высоких давлениях, показали, что существует семь различных кристаллических модификаций льда, каждая из которых, за исключением первой, плотнее воды. Таким образом, верхний предел линии AD – точка D, где в равновесии находятся лед I (обычный лед), лед III и жидкая вода. Эта точка находится при -220 о. С и 2450 атм.
Линия АС – эта кривая возгонки льда (иногда ее называют линией сублимации), отражающая зависимость давления водяного пара надо льдом от температуры. Эта линия соответствует моновариантному равновесию (лед) / (пар) (С=1). Выше линии АС лежит область льда, ниже - область пара. Линия АD – кривая плавления, выражает зависимость температуры плавления льда от давления и соответствует моновариантному равновесию (лед) / (жидкая вода). Для большинства веществ линия АD отклоняется от вертикали вправо, но поведение воды аномально: жидкая вода занимает меньший объем, чем лед. На основании принципа Ле Шателье можно предсказать, что повышение давления будет вызывать сдвиг равновесия в сторону образования жидкости, т. е. точка замерзания будет понижаться. Исследования, проведенные Бриджменом для определения хода кривой плавления льда при высоких давлениях, показали, что существует семь различных кристаллических модификаций льда, каждая из которых, за исключением первой, плотнее воды. Таким образом, верхний предел линии AD – точка D, где в равновесии находятся лед I (обычный лед), лед III и жидкая вода. Эта точка находится при -220 о. С и 2450 атм.
 Тройная точка воды (точка, отражающая равновесие трех фаз – жидкости, льда и пара) в отсутствие воздуха находится при 0, 0100 o. С и 4, 58 мм рт. ст. Число степеней свободы С=3 -3=0 и такое равновесие называют нонвариантным. В присутствии воздуха три фазы находятся в равновесии при 1 атм и при 0 o С. Понижение тройной точки на воздухе вызвано следующим причинами: 1. растворимостью воздуха в жидкой воде при 1 атм, что приводит к снижению тройной точки на 0, 0024 o С; 2. увеличением давления от 4, 58 мм рт. ст. до 1 атм, которое снижает тройную точку еще на 0, 0075 o С. Удельная теплота фазовых переходов воды очень велика. В тройной точке вода одновременно находится во всех трех агрегатных состояниях. Диаграмма состояния воды иллюстрирует две ее аномалии, оказывающие решающее влияние не только на поведение воды на Земле, но и природные условия планеты в целом. По сравнению с веществами, представляющими собой соединения водорода с элементами, находящимися в периодической таблице Менделеева, температура замерзания и кипения воды необычайно высока. Аномально высокие значения температуры замерзания и кипения предопределяют возможность существования воды на планете как в твердом, так и жидком состоянии и служат определяющими условиями основных гидрологических и других природных процессов на Земле.
Тройная точка воды (точка, отражающая равновесие трех фаз – жидкости, льда и пара) в отсутствие воздуха находится при 0, 0100 o. С и 4, 58 мм рт. ст. Число степеней свободы С=3 -3=0 и такое равновесие называют нонвариантным. В присутствии воздуха три фазы находятся в равновесии при 1 атм и при 0 o С. Понижение тройной точки на воздухе вызвано следующим причинами: 1. растворимостью воздуха в жидкой воде при 1 атм, что приводит к снижению тройной точки на 0, 0024 o С; 2. увеличением давления от 4, 58 мм рт. ст. до 1 атм, которое снижает тройную точку еще на 0, 0075 o С. Удельная теплота фазовых переходов воды очень велика. В тройной точке вода одновременно находится во всех трех агрегатных состояниях. Диаграмма состояния воды иллюстрирует две ее аномалии, оказывающие решающее влияние не только на поведение воды на Земле, но и природные условия планеты в целом. По сравнению с веществами, представляющими собой соединения водорода с элементами, находящимися в периодической таблице Менделеева, температура замерзания и кипения воды необычайно высока. Аномально высокие значения температуры замерзания и кипения предопределяют возможность существования воды на планете как в твердом, так и жидком состоянии и служат определяющими условиями основных гидрологических и других природных процессов на Земле.
 Плотность воды. Плотность – одна из важнейших физических характеристик любого вещества. Она представляет собой массу однородного вещества, приходящуюся на единицу объема и измеряется в кг/м 3. Плотность воды является функцией температуры, солености, давления, коллоидных взвесей. Вода – единственное вещество, у которого в твердом состоянии плотность меньше, чем в жидком. При нормальном давлении плотность жидкой воды в диапазоне от 0 до 4°С ведет себя аномально, увеличиваясь с возрастанием температуры от 999, 87 до 1000 кг/м 3. Поэтому при охлаждении от 4 до 0°С, т. е. непосредственно перед замерзанием, охлаждающаяся вода не опускается вниз, что сохраняет на глубинах в пресноводных водоемах положительную температуру и предохраняет воду от замерзания, а водные организмы от гибели. При последующем увеличении температуры выше 4°С плотность воды, как и у всех веществ, уменьшается. Плотность льда заметно меньше жидкой воды, что также аномально. При температуре меньшей 0°С с уменьшением температуры плотность падает и составляет 920 кг/м 3 при температуре — 20°С. Это приводит к тому, что лед, как вещество более легкое, чем вода всплывает и экранизирует водную толщу, защищая ее от охлаждения.
Плотность воды. Плотность – одна из важнейших физических характеристик любого вещества. Она представляет собой массу однородного вещества, приходящуюся на единицу объема и измеряется в кг/м 3. Плотность воды является функцией температуры, солености, давления, коллоидных взвесей. Вода – единственное вещество, у которого в твердом состоянии плотность меньше, чем в жидком. При нормальном давлении плотность жидкой воды в диапазоне от 0 до 4°С ведет себя аномально, увеличиваясь с возрастанием температуры от 999, 87 до 1000 кг/м 3. Поэтому при охлаждении от 4 до 0°С, т. е. непосредственно перед замерзанием, охлаждающаяся вода не опускается вниз, что сохраняет на глубинах в пресноводных водоемах положительную температуру и предохраняет воду от замерзания, а водные организмы от гибели. При последующем увеличении температуры выше 4°С плотность воды, как и у всех веществ, уменьшается. Плотность льда заметно меньше жидкой воды, что также аномально. При температуре меньшей 0°С с уменьшением температуры плотность падает и составляет 920 кг/м 3 при температуре — 20°С. Это приводит к тому, что лед, как вещество более легкое, чем вода всплывает и экранизирует водную толщу, защищая ее от охлаждения.
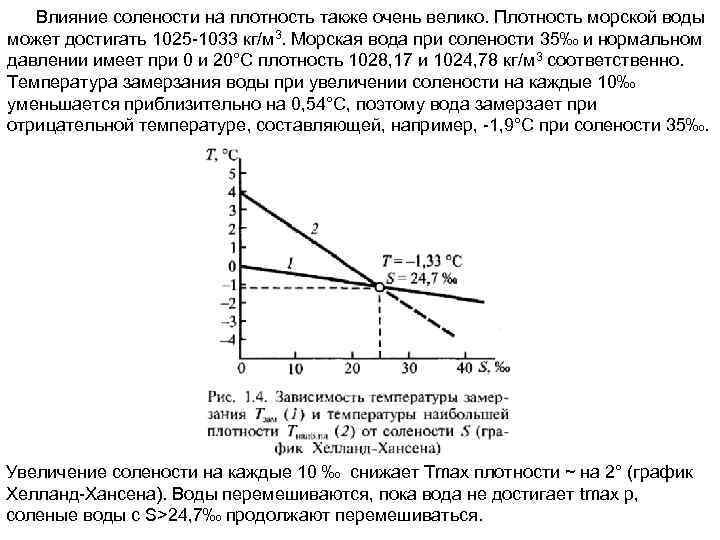 Влияние солености на плотность также очень велико. Плотность морской воды может достигать 1025 -1033 кг/м 3. Морская вода при солености 35‰ и нормальном давлении имеет при 0 и 20°С плотность 1028, 17 и 1024, 78 кг/м 3 соответственно. Температура замерзания воды при увеличении солености на каждые 10‰ уменьшается приблизительно на 0, 54°С, поэтому вода замерзает при отрицательной температуре, составляющей, например, -1, 9°С при солености 35‰. Увеличение солености на каждые 10 ‰ снижает Тmax плотности ~ на 2° (график Хелланд-Хансена). Воды перемешиваются, пока вода не достигает tmax p, соленые воды с S>24, 7‰ продолжают перемешиваться.
Влияние солености на плотность также очень велико. Плотность морской воды может достигать 1025 -1033 кг/м 3. Морская вода при солености 35‰ и нормальном давлении имеет при 0 и 20°С плотность 1028, 17 и 1024, 78 кг/м 3 соответственно. Температура замерзания воды при увеличении солености на каждые 10‰ уменьшается приблизительно на 0, 54°С, поэтому вода замерзает при отрицательной температуре, составляющей, например, -1, 9°С при солености 35‰. Увеличение солености на каждые 10 ‰ снижает Тmax плотности ~ на 2° (график Хелланд-Хансена). Воды перемешиваются, пока вода не достигает tmax p, соленые воды с S>24, 7‰ продолжают перемешиваться.
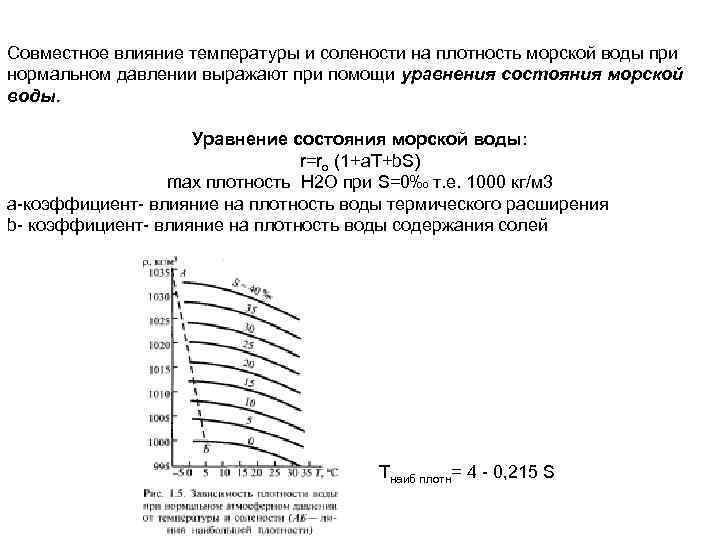 Совместное влияние температуры и солености на плотность морской воды при нормальном давлении выражают при помощи уравнения состояния морской воды. Уравнение состояния морской воды: r=rо (1+a. Т+b. S) max плотность Н 2 О при S=0‰ т. е. 1000 кг/м 3 a-коэффициент- влияние на плотность воды термического расширения b- коэффициент- влияние на плотность воды содержания солей Tнаиб плотн= 4 - 0, 215 S
Совместное влияние температуры и солености на плотность морской воды при нормальном давлении выражают при помощи уравнения состояния морской воды. Уравнение состояния морской воды: r=rо (1+a. Т+b. S) max плотность Н 2 О при S=0‰ т. е. 1000 кг/м 3 a-коэффициент- влияние на плотность воды термического расширения b- коэффициент- влияние на плотность воды содержания солей Tнаиб плотн= 4 - 0, 215 S
 Физические аномалии воды. Для воды характерны следующие физические аномалии и свойства: • высокая по сравнению с другими веществами температура плавления, поэтому вода на Земле может находиться в твердом состоянии (ледники, снег) и жидком (реки, озера, подземные воды); • плотность льда значительно меньше плотности воды, благодаря этому при замерзании водоема лед экранирует его от дальнейшего охлаждения (лед обладает небольшой теплоемкостью); • при увеличении температуры от 0 до 4°С плотность также увеличивается, поэтому при охлаждении поверхностного слоя до 4°С опускание и перемешивание слоев воды прекращается; • удельная теплота ледообразования (количество теплоты затрачиваемое при превращении единицы массы льда при температуре плавления и нормальном атмосферном давлении в воду) очень велика, поэтому процесс ледообразования идет замедленно; • удельная теплота парообразования (количество теплоты, необходимое для превращения единицы массы воды в пар) очень велика, поэтому процесс парообразования и идет замедленно.
Физические аномалии воды. Для воды характерны следующие физические аномалии и свойства: • высокая по сравнению с другими веществами температура плавления, поэтому вода на Земле может находиться в твердом состоянии (ледники, снег) и жидком (реки, озера, подземные воды); • плотность льда значительно меньше плотности воды, благодаря этому при замерзании водоема лед экранирует его от дальнейшего охлаждения (лед обладает небольшой теплоемкостью); • при увеличении температуры от 0 до 4°С плотность также увеличивается, поэтому при охлаждении поверхностного слоя до 4°С опускание и перемешивание слоев воды прекращается; • удельная теплота ледообразования (количество теплоты затрачиваемое при превращении единицы массы льда при температуре плавления и нормальном атмосферном давлении в воду) очень велика, поэтому процесс ледообразования идет замедленно; • удельная теплота парообразования (количество теплоты, необходимое для превращения единицы массы воды в пар) очень велика, поэтому процесс парообразования и идет замедленно.
 Тепловые характеристики воды Теплоемкость — это количество теплоты, поглощаемой телом при нагревании его на 1°С. Определяется она по формуле: C = d. Q/dt или C = Q/Δt, где d. Q – бесконечно малое количество теплоты, вызвавшее бесконечно малое повышение температуры dt; Δt = t 2 - t 1 – изменение температуры тела, происходящее в результате подвода к нему количества теплоты Q; t 1 и t 2 – температура тела до и после подвода к нему теплоты. Характеристикой теплоемкости вещества принята удельная теплоемкость – отношение теплоемкости тела к его массе: c = C/m или c = Q/(m Δt). Удельная теплоемкость воды – это количество теплоты, необходимое для нагревания 1 кг дистиллированной воды на 1°С в пределах 14, 5– 15, 5 °С. Удельная теплоемкость воды слабо зависит от температуры, поэтому в практических расчетах ее значение может быть принято постоянным, равным 4, 2 к. Дж/(кг·°С). Удельная теплоемкость воды уменьшается с повышением температуры. Этим свойством, а также довольно большим значением удельной теплоемкости, вода отличается от всех других веществ, кроме ртути. С увеличением минерализации воды теплоемкость ее уменьшается. Для морской воды при малой солености теплоемкость уменьшается примерно на 0, 006 к. Дж/(кг·°С) на 1‰.
Тепловые характеристики воды Теплоемкость — это количество теплоты, поглощаемой телом при нагревании его на 1°С. Определяется она по формуле: C = d. Q/dt или C = Q/Δt, где d. Q – бесконечно малое количество теплоты, вызвавшее бесконечно малое повышение температуры dt; Δt = t 2 - t 1 – изменение температуры тела, происходящее в результате подвода к нему количества теплоты Q; t 1 и t 2 – температура тела до и после подвода к нему теплоты. Характеристикой теплоемкости вещества принята удельная теплоемкость – отношение теплоемкости тела к его массе: c = C/m или c = Q/(m Δt). Удельная теплоемкость воды – это количество теплоты, необходимое для нагревания 1 кг дистиллированной воды на 1°С в пределах 14, 5– 15, 5 °С. Удельная теплоемкость воды слабо зависит от температуры, поэтому в практических расчетах ее значение может быть принято постоянным, равным 4, 2 к. Дж/(кг·°С). Удельная теплоемкость воды уменьшается с повышением температуры. Этим свойством, а также довольно большим значением удельной теплоемкости, вода отличается от всех других веществ, кроме ртути. С увеличением минерализации воды теплоемкость ее уменьшается. Для морской воды при малой солености теплоемкость уменьшается примерно на 0, 006 к. Дж/(кг·°С) на 1‰.
 Переход воды из жидкого состояния в твердое (кристаллическое – лед) сопровождается выделением теплоты кристаллизации Qкр. , а обратный ему процесс – таяние льда – поглощением теплоты плавления Qпл. . Эта способность вещества определяется удельной теплотой кристаллизации (плавления): Lкр. = Qкр. /m или Lпл. = Qпл. /m, где m – масса затвердевающего (тающего) тела. Удельная теплота кристаллизации воды Lкр. – это количество теплоты, которое выделяется при кристаллизации 1 кг воды при постоянной температуре. Для дистиллированной воды она равна 33, 3· 104 Дж/кг. Переход воды из жидкого состояния в газообразное (пар) сопровождается поглощением теплоты испарения Qи. Источником ее обычно служит внутренняя энергия самой жидкости, поэтому при испарении она охлаждается. Обратный испарению процесс – конденсация пара – сопровождается выделением теплоты Qк, равной теплоте испарения. Эта способность вещества определяется удельной теплотой испарения (конденсации): Lи = Qи/m или Lк = Qк/m. Итак, удельная теплота испарения воды – это количество теплоты, необходимое, чтобы перевести 1 кг воды в парообразное состояние при постоянной температуре. Удельная теплота испарения воды зависит от температуры, при которой испаряется вода. Эта зависимость определяется следующей эмпирической формулой: Lи = (25 – 0, 024 tп) 105, где 25· 105 Дж/кг – удельная теплота испарения при температуре поверхности воды, равной 0°С; tп – температура поверхности испаряющейся воды.
Переход воды из жидкого состояния в твердое (кристаллическое – лед) сопровождается выделением теплоты кристаллизации Qкр. , а обратный ему процесс – таяние льда – поглощением теплоты плавления Qпл. . Эта способность вещества определяется удельной теплотой кристаллизации (плавления): Lкр. = Qкр. /m или Lпл. = Qпл. /m, где m – масса затвердевающего (тающего) тела. Удельная теплота кристаллизации воды Lкр. – это количество теплоты, которое выделяется при кристаллизации 1 кг воды при постоянной температуре. Для дистиллированной воды она равна 33, 3· 104 Дж/кг. Переход воды из жидкого состояния в газообразное (пар) сопровождается поглощением теплоты испарения Qи. Источником ее обычно служит внутренняя энергия самой жидкости, поэтому при испарении она охлаждается. Обратный испарению процесс – конденсация пара – сопровождается выделением теплоты Qк, равной теплоте испарения. Эта способность вещества определяется удельной теплотой испарения (конденсации): Lи = Qи/m или Lк = Qк/m. Итак, удельная теплота испарения воды – это количество теплоты, необходимое, чтобы перевести 1 кг воды в парообразное состояние при постоянной температуре. Удельная теплота испарения воды зависит от температуры, при которой испаряется вода. Эта зависимость определяется следующей эмпирической формулой: Lи = (25 – 0, 024 tп) 105, где 25· 105 Дж/кг – удельная теплота испарения при температуре поверхности воды, равной 0°С; tп – температура поверхности испаряющейся воды.
 Температуропроводность – физический параметр вещества и, в частности, воды, способствующий передаче теплоты таким образом, что температура в каждой точке стремится к соответствующему в данный момент установившемуся состоянию. Характеристикой температуропроводности является коэффициент температуропроводности a = λ/(cρ), где λ – коэффициент теплопроводности. Коэффициент температуропроводности воды слабо зависит от температуры: при температуре, равной 0 и 10°С, a соответственно равно 0, 485· 10 -3 и 0, 504· 10 -3 м 2 ч.
Температуропроводность – физический параметр вещества и, в частности, воды, способствующий передаче теплоты таким образом, что температура в каждой точке стремится к соответствующему в данный момент установившемуся состоянию. Характеристикой температуропроводности является коэффициент температуропроводности a = λ/(cρ), где λ – коэффициент теплопроводности. Коэффициент температуропроводности воды слабо зависит от температуры: при температуре, равной 0 и 10°С, a соответственно равно 0, 485· 10 -3 и 0, 504· 10 -3 м 2 ч.
 Вязкость, поверхностное натяжение. Вязкость достаточно мала, поэтому вода является очень текучим веществом, она способна переносить различные объекты. Поверхностное натяжение воды достаточно велико, поэтому образуется мениск – капиллярные силы, благодаря которым растения способны брать воду из почвы. Вторым следствием является то, что водяные капли обладают большой ударной силой, и являются одной из причин возникновения эрозии. Вязкость есть физическое свойство вещества (жидкости, газа, твердого тела) оказывать сопротивление перемещению одной его части относительно другой. Вязкость является одним из главных свойств воды. Различают объемную и тангенциальную вязкость. Под объемной вязкостью понимают способность жидкости воспринимать растягивающие усилия. Этот вид вязкости воды проявляется, например, при распространении в ней звуковых и особенно ультразвуковых волн. Тангенциальная вязкость характеризует способность жидкости оказывать сопротивление сдвигающим усилиям. Поверхностное натяжение воды возникает на поверхности соприкосновения ее с воздухом, твердым телом или другой жидкостью. Оно обусловлено силами притяжения между молекулами. Внутри воды силы притяжения между молекулами взаимно компенсируются, а на молекулы, находящиеся вблизи поверхности, действует нескомпенсированная результирующая сила, направленная внутрь от ее поверхности. Поверхностное натяжение стремится уменьшить поверхность жидкости до минимума. Поэтому капли жидкости имеют сферическую форму – форму шариков (поверхность сферы- минимальна из всех геометрических фигур равного со сферой объема).
Вязкость, поверхностное натяжение. Вязкость достаточно мала, поэтому вода является очень текучим веществом, она способна переносить различные объекты. Поверхностное натяжение воды достаточно велико, поэтому образуется мениск – капиллярные силы, благодаря которым растения способны брать воду из почвы. Вторым следствием является то, что водяные капли обладают большой ударной силой, и являются одной из причин возникновения эрозии. Вязкость есть физическое свойство вещества (жидкости, газа, твердого тела) оказывать сопротивление перемещению одной его части относительно другой. Вязкость является одним из главных свойств воды. Различают объемную и тангенциальную вязкость. Под объемной вязкостью понимают способность жидкости воспринимать растягивающие усилия. Этот вид вязкости воды проявляется, например, при распространении в ней звуковых и особенно ультразвуковых волн. Тангенциальная вязкость характеризует способность жидкости оказывать сопротивление сдвигающим усилиям. Поверхностное натяжение воды возникает на поверхности соприкосновения ее с воздухом, твердым телом или другой жидкостью. Оно обусловлено силами притяжения между молекулами. Внутри воды силы притяжения между молекулами взаимно компенсируются, а на молекулы, находящиеся вблизи поверхности, действует нескомпенсированная результирующая сила, направленная внутрь от ее поверхности. Поверхностное натяжение стремится уменьшить поверхность жидкости до минимума. Поэтому капли жидкости имеют сферическую форму – форму шариков (поверхность сферы- минимальна из всех геометрических фигур равного со сферой объема).
 Смачивание. При соприкосновении твердого тела с водой смачивание наблюдается в том случае, когда взаимодействие между их молекулами сильнее взаимодействия между молекулами самой воды. В этом случае вода будет стремиться увеличить поверхность соприкосновения и растечется по твердому телу. Когда же взаимодействие между молекулами твердого тела и молекулами соприкасающейся с ним воды более слабое, чем между молекулами самой воды, вода будет стремиться сократить поверхность соприкосновения с твердым телом. По отношению к твердым телам вода обладает свойством полного и частичного смачивания и полного несмачивания. Явление смачивания имеет большое значение при изучении передвижения влаги по капиллярам в почвогрунтах и в снеге. Поверхность смачивающей жидкости, находящейся в узких капиллярах, принимает вогнутую форму.
Смачивание. При соприкосновении твердого тела с водой смачивание наблюдается в том случае, когда взаимодействие между их молекулами сильнее взаимодействия между молекулами самой воды. В этом случае вода будет стремиться увеличить поверхность соприкосновения и растечется по твердому телу. Когда же взаимодействие между молекулами твердого тела и молекулами соприкасающейся с ним воды более слабое, чем между молекулами самой воды, вода будет стремиться сократить поверхность соприкосновения с твердым телом. По отношению к твердым телам вода обладает свойством полного и частичного смачивания и полного несмачивания. Явление смачивания имеет большое значение при изучении передвижения влаги по капиллярам в почвогрунтах и в снеге. Поверхность смачивающей жидкости, находящейся в узких капиллярах, принимает вогнутую форму.
 Оптические свойства воды. Свет от поверхностной воды частично отражается, на границе раздела преломляется, а в толще рассеивается и поглощается. Альбедо - отношение энергии отраженного света от поверхности к энергии падающего света. Альбедо зависит от освещенности и состояния водной поверхности -4 -11%. Коэффициент преломления ~1, 33, уменьшается с повышением t°, увеличивается с соленостью. Свет в воде быстро затухает: таким образом, свет проникает лишь на небольшую глубину, и только здесь протекают процессы фотосинтеза. Акустические свойства воды. Вода хорошо проводит звук. В толще воды звук может распространяться на большие расстояния и с большой скоростью. Vзвука в воде=1400 -1600 м/с, т. е. в 4 -5 раз> Vзвука в воздухе Она увеличивается с повешением t° (~3 м/с на 1°С), с увеличением S (~1 м/с на 1‰), с ростом Р (на 1, 5 м/с на 100 м h)
Оптические свойства воды. Свет от поверхностной воды частично отражается, на границе раздела преломляется, а в толще рассеивается и поглощается. Альбедо - отношение энергии отраженного света от поверхности к энергии падающего света. Альбедо зависит от освещенности и состояния водной поверхности -4 -11%. Коэффициент преломления ~1, 33, уменьшается с повышением t°, увеличивается с соленостью. Свет в воде быстро затухает: таким образом, свет проникает лишь на небольшую глубину, и только здесь протекают процессы фотосинтеза. Акустические свойства воды. Вода хорошо проводит звук. В толще воды звук может распространяться на большие расстояния и с большой скоростью. Vзвука в воде=1400 -1600 м/с, т. е. в 4 -5 раз> Vзвука в воздухе Она увеличивается с повешением t° (~3 м/с на 1°С), с увеличением S (~1 м/с на 1‰), с ростом Р (на 1, 5 м/с на 100 м h)
 Электрические свойства воды. Удельное электрическое сопротивление воды ρэ существенно зависит от температуры. Минерализация воды резко понижает ее удельное электрическое сопротивление. Так, у ладожской воды оно составляет 2, 6· 104 (Ом • м)-1, а у морской – порядка 4 -6 (Ом • м)-1. По приведенным значениям удельного электрического сопротивления можем судить, что чистая вода является плохим проводником электричества. Электрическая проводимость воды может служить показателем загрязнения, как части водоема так и его в целом. Вода является хорошим растворителем. Характеристикой жидкости как растворителя является дипольный момент. У воды он весьма высокий (6, 13· 10 -29 Кл·м), что обусловливает ее свойства хорошего растворителя веществ, молекулы которых тоже полярны. Однако для сравнения способности одних веществ растворять в себе другие более удобным, чем дипольный момент, оказалось понятие диэлектрической проницаемости. Диэлектрическая проницаемость ε показывает, во сколько раз напряженность поля с данным веществом ниже, чем в вакууме. Диэлектрическая проницаемость воды при 20°С ε = 81. Способность воды растворять соли возрастает с повышением температуры и понижается с ее уменьшением. Этим обстоятельством объясняется выпадение солей из воды сильно минерализованных озер осенью и в зимний период.
Электрические свойства воды. Удельное электрическое сопротивление воды ρэ существенно зависит от температуры. Минерализация воды резко понижает ее удельное электрическое сопротивление. Так, у ладожской воды оно составляет 2, 6· 104 (Ом • м)-1, а у морской – порядка 4 -6 (Ом • м)-1. По приведенным значениям удельного электрического сопротивления можем судить, что чистая вода является плохим проводником электричества. Электрическая проводимость воды может служить показателем загрязнения, как части водоема так и его в целом. Вода является хорошим растворителем. Характеристикой жидкости как растворителя является дипольный момент. У воды он весьма высокий (6, 13· 10 -29 Кл·м), что обусловливает ее свойства хорошего растворителя веществ, молекулы которых тоже полярны. Однако для сравнения способности одних веществ растворять в себе другие более удобным, чем дипольный момент, оказалось понятие диэлектрической проницаемости. Диэлектрическая проницаемость ε показывает, во сколько раз напряженность поля с данным веществом ниже, чем в вакууме. Диэлектрическая проницаемость воды при 20°С ε = 81. Способность воды растворять соли возрастает с повышением температуры и понижается с ее уменьшением. Этим обстоятельством объясняется выпадение солей из воды сильно минерализованных озер осенью и в зимний период.
 Классификация видов движения воды в водных объектах. Благодаря малой вязкости вода подвижна и перемещается в сторону уклона поверхности. Водные потоки делятся исходя из типов движения воды на стационарные (если скорость течения не изменяется во времени, dv/dt = 0) и нестационарные (если скорость течения во времени величина переменная, dv/dt ≠ 0). Стационарные водные потоки делятся на равномерные (если скорость вдоль потока остается неизменной, dv/dх = 0) и неравномерные (если скорость движения вдоль потока изменяется, dv/dх ≠ 0). Существуют два гидродинамических режима движения воды: ламинарный и турбулентный. В ламинарном режиме частицы воды движутся по параллельным траекториям, скорость их движения невелика. Примером ламинарного движения могут служить подземные воды, ледники. В турбулентном режиме движение частиц воды имеет хаотический характер, с относительно большой скоростью. Таким режимом отличаются движения вод в океанах, морях, реках, озерах. Характер движения определяется скоростью движения, гидродинамический режим потока характеризуется числом Рейнольдса (Rе): Rе = Vh/v, где V – средняя скорость, м/с , h – глубина водоема; ν – кинематический коэффициент вязкости, при температуре ≈15°С, ν = 1 • 10 -6 м 2/с. Если Rе < 300, то поток является ламинарным, если Rе > 3000 – турбулентным, 300< Rе <3000 соответствует переходному гидродинамическому режиму потока.
Классификация видов движения воды в водных объектах. Благодаря малой вязкости вода подвижна и перемещается в сторону уклона поверхности. Водные потоки делятся исходя из типов движения воды на стационарные (если скорость течения не изменяется во времени, dv/dt = 0) и нестационарные (если скорость течения во времени величина переменная, dv/dt ≠ 0). Стационарные водные потоки делятся на равномерные (если скорость вдоль потока остается неизменной, dv/dх = 0) и неравномерные (если скорость движения вдоль потока изменяется, dv/dх ≠ 0). Существуют два гидродинамических режима движения воды: ламинарный и турбулентный. В ламинарном режиме частицы воды движутся по параллельным траекториям, скорость их движения невелика. Примером ламинарного движения могут служить подземные воды, ледники. В турбулентном режиме движение частиц воды имеет хаотический характер, с относительно большой скоростью. Таким режимом отличаются движения вод в океанах, морях, реках, озерах. Характер движения определяется скоростью движения, гидродинамический режим потока характеризуется числом Рейнольдса (Rе): Rе = Vh/v, где V – средняя скорость, м/с , h – глубина водоема; ν – кинематический коэффициент вязкости, при температуре ≈15°С, ν = 1 • 10 -6 м 2/с. Если Rе < 300, то поток является ламинарным, если Rе > 3000 – турбулентным, 300< Rе <3000 соответствует переходному гидродинамическому режиму потока.
 По состоянию поверхности воды бывают спокойные и бурные (как обтекают препятствие). Число Фруда: Fr=V 2/gh, где V - скорость м/с, g - ускорение свободного падения, м 2/с, h – глубина, м Fr=1 критическое; Fr>1 поток бурный (горные реки); Fr<1 поток спокойный (равнинное течение в водоемах)
По состоянию поверхности воды бывают спокойные и бурные (как обтекают препятствие). Число Фруда: Fr=V 2/gh, где V - скорость м/с, g - ускорение свободного падения, м 2/с, h – глубина, м Fr=1 критическое; Fr>1 поток бурный (горные реки); Fr<1 поток спокойный (равнинное течение в водоемах)



