Тема - Биофизика воды.ppt
- Количество слайдов: 31
 ВОДА А. Структура и свойства молекулы воды. Молекула воды, Н 2= состоит из одного 0 атома кислорода O и двух атомов водорода. +. H Каждая водородная связь O-H+ представляет электрический диполь. По модулю эти два диполя равны. Если они расположились бы линейно, то результирующий элек. момент был бы равен нулю. (Рис. 1).
ВОДА А. Структура и свойства молекулы воды. Молекула воды, Н 2= состоит из одного 0 атома кислорода O и двух атомов водорода. +. H Каждая водородная связь O-H+ представляет электрический диполь. По модулю эти два диполя равны. Если они расположились бы линейно, то результирующий элек. момент был бы равен нулю. (Рис. 1).
 Но, аргументы полученые экспериментально подтверждают что молекула воды представляет постоянный диполь. Методом дифракции рентгеновских лучей было установлено, что молекула воды имеет треугольную форму. (рис. 2).
Но, аргументы полученые экспериментально подтверждают что молекула воды представляет постоянный диполь. Методом дифракции рентгеновских лучей было установлено, что молекула воды имеет треугольную форму. (рис. 2).
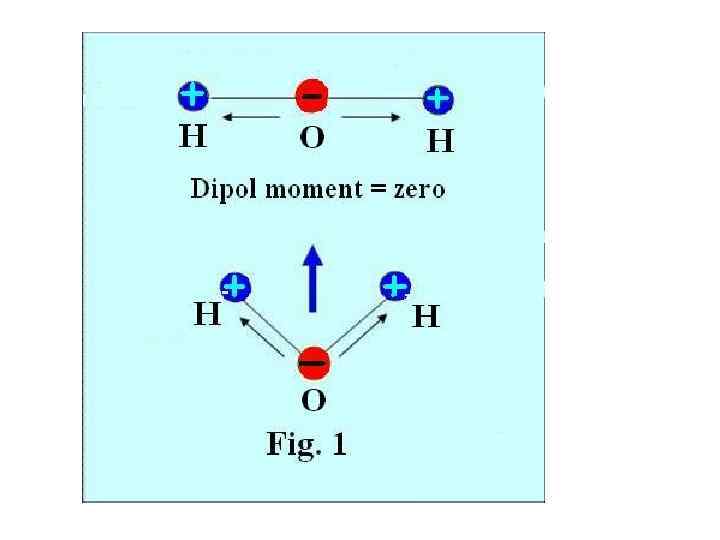
 Рис. 2. Структура молекулы воды Каждая ковалентная связь Å О-H, длиной 0, 96 , представляет электрический диполь (Рис. 1) Ковалентные связи О-H образуют между собой угол 104028´ Момент диполя молекулы воды. 1, 84 Дебай (D); 1 D = 3, 336 10 -30 Кл·м )
Рис. 2. Структура молекулы воды Каждая ковалентная связь Å О-H, длиной 0, 96 , представляет электрический диполь (Рис. 1) Ковалентные связи О-H образуют между собой угол 104028´ Момент диполя молекулы воды. 1, 84 Дебай (D); 1 D = 3, 336 10 -30 Кл·м )
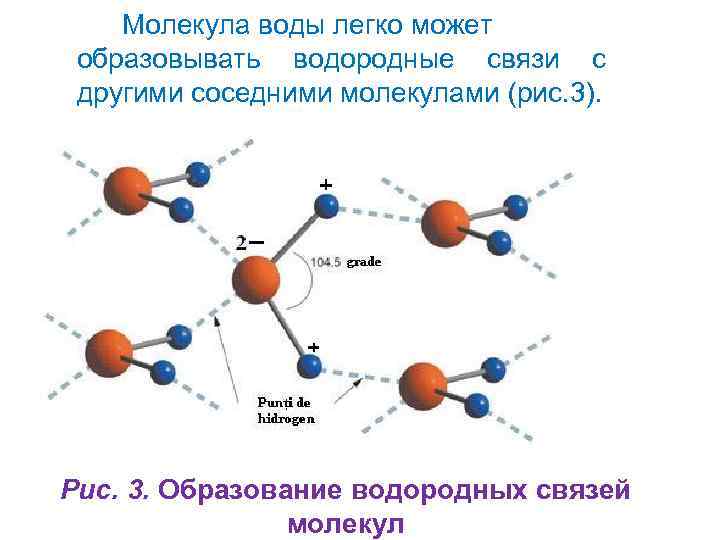 Молекула воды легко может образовывать водородные связи с другими соседними молекулами (рис. 3). Рис. 3. Образование водородных связей молекул
Молекула воды легко может образовывать водородные связи с другими соседними молекулами (рис. 3). Рис. 3. Образование водородных связей молекул
 В жидком состоянии вода состоит из смеси свободных молекул: мономеров (Н 2 О), димеров Н 2 О)2 , тетрамеров (Н 2 О)4 , и октомеров (Н 2 О)8. , причем процентное содержание каждого типа молекул зависит от температуры воды. В интервале температур 35 – 41 0 C (интервал температуры тела ), в воде преобладают димеры и вода имеет повышенную химическую активность. Этим объясняется тот факт, что у гомиотермых животных установилась нормальная температура в пределах указанного интервала.
В жидком состоянии вода состоит из смеси свободных молекул: мономеров (Н 2 О), димеров Н 2 О)2 , тетрамеров (Н 2 О)4 , и октомеров (Н 2 О)8. , причем процентное содержание каждого типа молекул зависит от температуры воды. В интервале температур 35 – 41 0 C (интервал температуры тела ), в воде преобладают димеры и вода имеет повышенную химическую активность. Этим объясняется тот факт, что у гомиотермых животных установилась нормальная температура в пределах указанного интервала.
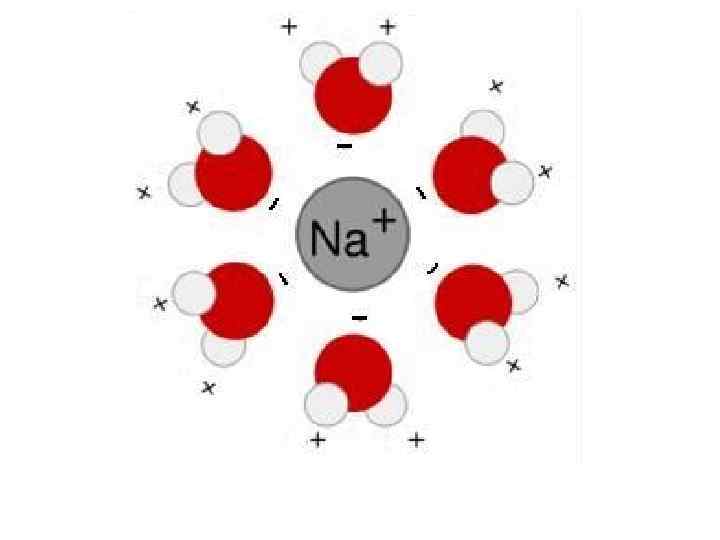
 В водных растворах ионы притягивают молекулы воды, повернутые к иону обратным знаком, образуя надмолекулярную сферическую структуру. Вода, связанная с ионами таким образом, называется гидратированной и ее свойства значительно отличаются от свойств свободной воды. Процесс связывания воды химическими веществами называется гидратацией ионов и существенно влияет на свойства раствора. Число молекул воды, связанных с ионом, зависит от природы иона (его заряда и размеры). Из рисунков видно, что Na+ связывает 6 молекул воды. К+ связывает- только 4 (Рис. 4).
В водных растворах ионы притягивают молекулы воды, повернутые к иону обратным знаком, образуя надмолекулярную сферическую структуру. Вода, связанная с ионами таким образом, называется гидратированной и ее свойства значительно отличаются от свойств свободной воды. Процесс связывания воды химическими веществами называется гидратацией ионов и существенно влияет на свойства раствора. Число молекул воды, связанных с ионом, зависит от природы иона (его заряда и размеры). Из рисунков видно, что Na+ связывает 6 молекул воды. К+ связывает- только 4 (Рис. 4).
![Физические свойства воды Б. Физические свойства и характеристики воды • Плотность воды [ ]СИ Физические свойства воды Б. Физические свойства и характеристики воды • Плотность воды [ ]СИ](https://present5.com/presentation/40418783_150192299/image-9.jpg) Физические свойства воды Б. Физические свойства и характеристики воды • Плотность воды [ ]СИ = кг/м 3. Плотность воды, в отличие от других веществ, в жидком состоянии больше, чем в твердом, и максимальное значение плотности достигается при 40 С (рис. 5). График зависимости плотности воды от температуры представлено на рис. 5.
Физические свойства воды Б. Физические свойства и характеристики воды • Плотность воды [ ]СИ = кг/м 3. Плотность воды, в отличие от других веществ, в жидком состоянии больше, чем в твердом, и максимальное значение плотности достигается при 40 С (рис. 5). График зависимости плотности воды от температуры представлено на рис. 5.
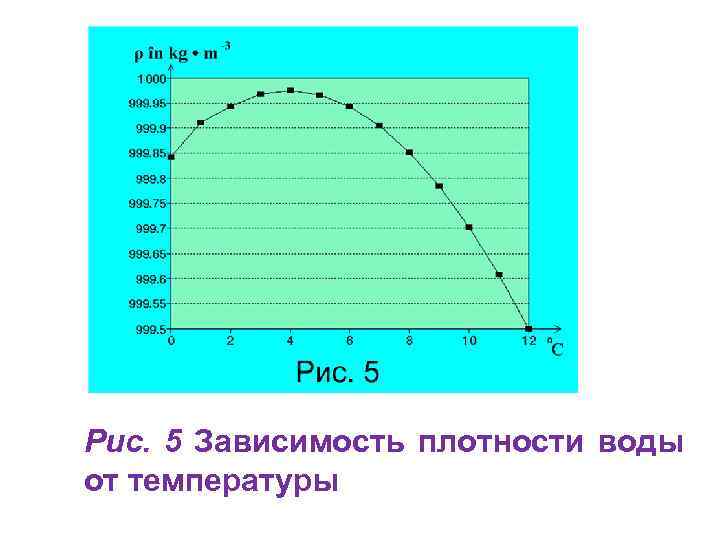 Рис. 5 Зависимость плотности воды от температуры
Рис. 5 Зависимость плотности воды от температуры
 • Удельная теплота парообразования (r) Представляет количество тепловой энергии необходимой для превращения в пар 1 кг вещества при температуре кипения. Для воды: r = 22, 6· 105 Дж·кг -1 Для железа: r = 58· 103 Дж·кг -1 Высокое значение удельной теплоты парообразования подчёркивает ту роль которую играет вода в термографических процессах.
• Удельная теплота парообразования (r) Представляет количество тепловой энергии необходимой для превращения в пар 1 кг вещества при температуре кипения. Для воды: r = 22, 6· 105 Дж·кг -1 Для железа: r = 58· 103 Дж·кг -1 Высокое значение удельной теплоты парообразования подчёркивает ту роль которую играет вода в термографических процессах.
 • Диэлектрическая постоянная (ε) ε есть постоянная среды, которая характеризует во сколько раз силы электростатического взаимодействия меньше в данной среде (в данном случае- в воде) чем в вакууме. Для воды: ε = 80. Этим объясняется что вода является хорошим растворителем для полярных молекул и ионных кристаллов.
• Диэлектрическая постоянная (ε) ε есть постоянная среды, которая характеризует во сколько раз силы электростатического взаимодействия меньше в данной среде (в данном случае- в воде) чем в вакууме. Для воды: ε = 80. Этим объясняется что вода является хорошим растворителем для полярных молекул и ионных кристаллов.
 Физические свойства воды В. Содержание воды в биосистемах и её биологические роли. В биосистемах вода составляет 65 -70% из общего веса тела человека. Можно выделить основные роли которые выполняет вода в организме:
Физические свойства воды В. Содержание воды в биосистемах и её биологические роли. В биосистемах вода составляет 65 -70% из общего веса тела человека. Можно выделить основные роли которые выполняет вода в организме:
 1. Создает и поддерживает осмотическое давление; 2. Участвует в организации различных структур; 3. Служит дисперсной средой многих коллоидных растворов; 4. Будучи хорошим растворителем, вода создаёт с рядом веществ растворы, и переносит их с наружи в клетку и обратно- из клетки вне.
1. Создает и поддерживает осмотическое давление; 2. Участвует в организации различных структур; 3. Служит дисперсной средой многих коллоидных растворов; 4. Будучи хорошим растворителем, вода создаёт с рядом веществ растворы, и переносит их с наружи в клетку и обратно- из клетки вне.
 5. Обеспечивает выделение токсических продуктов метаболизма через почки. 6. Играет важную роль в обеспечении механической защиты плода в утробе матери (вплоть до рождения). 7. Защищает организм от механических воздействий и от изменений температуры.
5. Обеспечивает выделение токсических продуктов метаболизма через почки. 6. Играет важную роль в обеспечении механической защиты плода в утробе матери (вплоть до рождения). 7. Защищает организм от механических воздействий и от изменений температуры.
 Г. Диссоциация молекулы воды Молекулы воды диссоциируют на ионы водорода Н+ и группу ОН– : H 2 O → H+ + OH- Ион водорода Н+ не имеет электронной оболочки и обладает большей способностью к гидратации. Имея также и большую подвижность протон (Н+) переходит от одной молекулы к другой. Он связывается с молекулой воды, образуя ион оксония Н 3 О: H+ + H 2 O → H 3 O+
Г. Диссоциация молекулы воды Молекулы воды диссоциируют на ионы водорода Н+ и группу ОН– : H 2 O → H+ + OH- Ион водорода Н+ не имеет электронной оболочки и обладает большей способностью к гидратации. Имея также и большую подвижность протон (Н+) переходит от одной молекулы к другой. Он связывается с молекулой воды, образуя ион оксония Н 3 О: H+ + H 2 O → H 3 O+
 При температуре 25 °C степень диссоциации молекул воды незначительна и концентрация ионов обоих знаков составляет [H+]=[OH-]=10 -7 mol/l
При температуре 25 °C степень диссоциации молекул воды незначительна и концентрация ионов обоих знаков составляет [H+]=[OH-]=10 -7 mol/l
 Логарифм концентрации ионов водорода с обратным знаком называется реакцией среды и обозначается р. Н: р. Н = – lg [H+] Для чистой воды при температуре 250 С р. Н = 7, 0. Раствор с p. H = 7, 0 является нейтральным. Если р. Н > 7, раствор является щелочным. Если p. H < 7, раствор кислотный. Среднее значение р. Н в тканях организма составляет 7, 4.
Логарифм концентрации ионов водорода с обратным знаком называется реакцией среды и обозначается р. Н: р. Н = – lg [H+] Для чистой воды при температуре 250 С р. Н = 7, 0. Раствор с p. H = 7, 0 является нейтральным. Если р. Н > 7, раствор является щелочным. Если p. H < 7, раствор кислотный. Среднее значение р. Н в тканях организма составляет 7, 4.
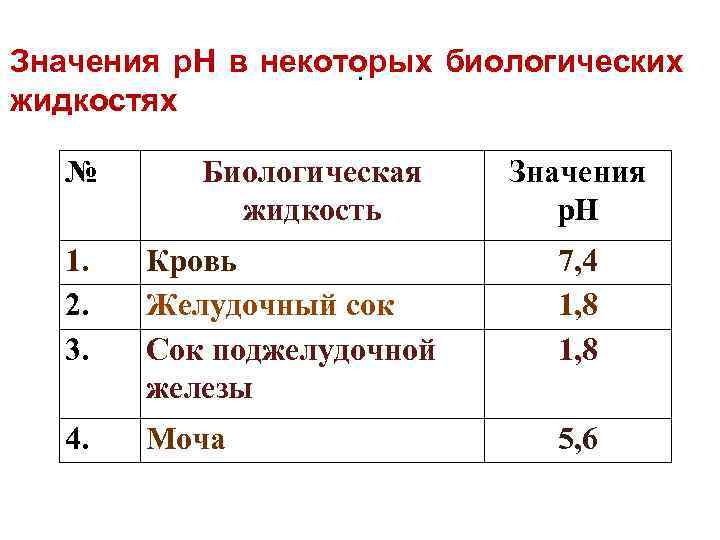 Значения р. Н в некоторых биологических . жидкостях № Биологическая жидкость Значения р. Н 1. 2. 3. Кровь Желудочный сок Сок поджелудочной железы 7, 4 1, 8 4. Моча 5, 6
Значения р. Н в некоторых биологических . жидкостях № Биологическая жидкость Значения р. Н 1. 2. 3. Кровь Желудочный сок Сок поджелудочной железы 7, 4 1, 8 4. Моча 5, 6
 Д. Тяжёлая вода В 1932 г. Юри открыл тяжелую воду, которая имеет плотность большую, чем обычная вода. Тяжелая вода содержится в морской воде в соотношении 1: 6000. Обогащение обычной воды тяжелой происходит при электролизе под высоким напряжением.
Д. Тяжёлая вода В 1932 г. Юри открыл тяжелую воду, которая имеет плотность большую, чем обычная вода. Тяжелая вода содержится в морской воде в соотношении 1: 6000. Обогащение обычной воды тяжелой происходит при электролизе под высоким напряжением.
 Тяжелая вода вместо атома обычного водорода содержит атом изотопа водорода дейтерия (D) и имеет формулу D 2 O или DOH. Физические свойства тяжелой воды отличаются от свойств обычной воды, что хорошо видно из Таблицы.
Тяжелая вода вместо атома обычного водорода содержит атом изотопа водорода дейтерия (D) и имеет формулу D 2 O или DOH. Физические свойства тяжелой воды отличаются от свойств обычной воды, что хорошо видно из Таблицы.
 Разные типымолекул воды. ТЯЖЁЛАЯ И ТРЕТИРОВАННАЯ ВОДА H – O – H : H 2 O обычная вода H – O – D D – O – D : D 2 O - тяжёлая вода D – O – T H – O – T T 2 O - третированая вода D – дейтерий 21 H T – тритии 31 H существуют 18 типов молекул воды
Разные типымолекул воды. ТЯЖЁЛАЯ И ТРЕТИРОВАННАЯ ВОДА H – O – H : H 2 O обычная вода H – O – D D – O – D : D 2 O - тяжёлая вода D – O – T H – O – T T 2 O - третированая вода D – дейтерий 21 H T – тритии 31 H существуют 18 типов молекул воды
 Какую роь играет тяжёлая вода в организме? Было отмечено, что, начиная с определенной концентрации, тяжелая вода замедляет метаболические процессы, приостанавливает деление клеток, замедляется активный транспорт и мышечное сокращение.
Какую роь играет тяжёлая вода в организме? Было отмечено, что, начиная с определенной концентрации, тяжелая вода замедляет метаболические процессы, приостанавливает деление клеток, замедляется активный транспорт и мышечное сокращение.
 Тяжелая вода отрицательно влияет на работу сердца, что четко наблюдается на электрокардиограмме. Все эти явления находят свое объяснение, если предположить, что в клеточных энергетических процессах, в синтезе макромолекул АТФ протон играет особенную роль, и эта роль не может быть выполнена дейтерием.
Тяжелая вода отрицательно влияет на работу сердца, что четко наблюдается на электрокардиограмме. Все эти явления находят свое объяснение, если предположить, что в клеточных энергетических процессах, в синтезе макромолекул АТФ протон играет особенную роль, и эта роль не может быть выполнена дейтерием.
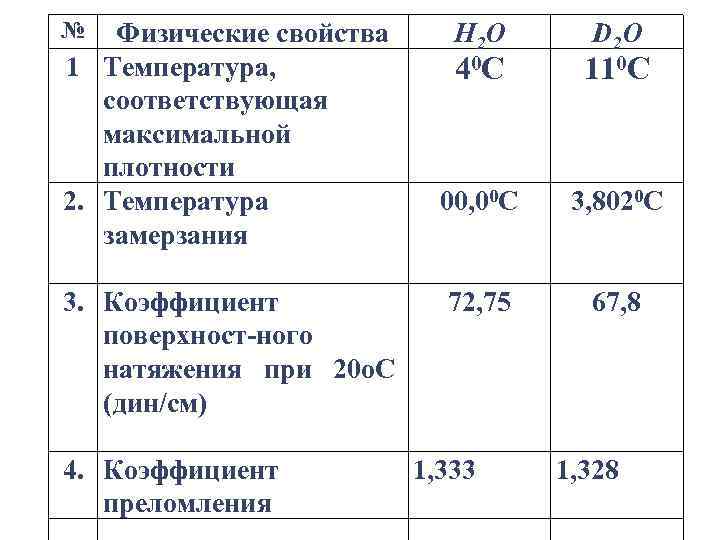 № Физические свойства 1 Температура, соответствующая максимальной плотности 2. Температура замерзания 3. Коэффициент поверхност-ного натяжения при 20 о. С (дин/см) 4. Коэффициент преломления Н 2 О D 2 O 40 С 110 С 00, 00 С 3, 8020 С 72, 75 67, 8 1, 333 1, 328
№ Физические свойства 1 Температура, соответствующая максимальной плотности 2. Температура замерзания 3. Коэффициент поверхност-ного натяжения при 20 о. С (дин/см) 4. Коэффициент преломления Н 2 О D 2 O 40 С 110 С 00, 00 С 3, 8020 С 72, 75 67, 8 1, 333 1, 328
 Е. Определение распределения объёма воды в различных частях организма Было установлено, что 70% воды в организме человека является внутриклеточной. Остальная часть является внеклеточной, которая, в свою очередь, делится на внутримышечную и содержащуюся в плазме.
Е. Определение распределения объёма воды в различных частях организма Было установлено, что 70% воды в организме человека является внутриклеточной. Остальная часть является внеклеточной, которая, в свою очередь, делится на внутримышечную и содержащуюся в плазме.
 В лабораториях при фармакологических и фармацевтических исследованиях часто необходимо определить распределение воды в различных частях человеческого организма. Для определения объема воды в различных частях используется простая формула, которая выражает связь между массой (m), объемом (V) и концентрацией (С) вещества
В лабораториях при фармакологических и фармацевтических исследованиях часто необходимо определить распределение воды в различных частях человеческого организма. Для определения объема воды в различных частях используется простая формула, которая выражает связь между массой (m), объемом (V) и концентрацией (С) вещества
 Для определения общего объема воды в организме (Vобщ. ) при помощи инъекции вводится определенная известная масса вещества m, которая хорошо растворяется и свободно диффундирует по всему организму. Таким веществом могут служить антипирин, изотоп водорода и д. в. Для определения объема плазмы (Vплаз) в кровеносных сосудах, используются макромолекулы, меченные радиоактивным йодом, которые не могут диффундировать через эндотелий сосудистой системы.
Для определения общего объема воды в организме (Vобщ. ) при помощи инъекции вводится определенная известная масса вещества m, которая хорошо растворяется и свободно диффундирует по всему организму. Таким веществом могут служить антипирин, изотоп водорода и д. в. Для определения объема плазмы (Vплаз) в кровеносных сосудах, используются макромолекулы, меченные радиоактивным йодом, которые не могут диффундировать через эндотелий сосудистой системы.
 В случае определения внеклеточного объема воды (Vвнекл) необходимо использовать такое вещество, которое диффундирует через эндотелий сосудистой системы, но для которого клеточная мембрана является непроницаемой, и тогда внутриклеточный (Vвнкл), внутрмышечный (Vвнмыш) и внеклеточный (Vвнекл) объемы определяются согласно формулам: Vвнкл = Vобщ – Vвнекл Vвнмыш = Vвнекл – Vплаз Vвнекл = Vвнкл – Vплаз
В случае определения внеклеточного объема воды (Vвнекл) необходимо использовать такое вещество, которое диффундирует через эндотелий сосудистой системы, но для которого клеточная мембрана является непроницаемой, и тогда внутриклеточный (Vвнкл), внутрмышечный (Vвнмыш) и внеклеточный (Vвнекл) объемы определяются согласно формулам: Vвнкл = Vобщ – Vвнекл Vвнмыш = Vвнекл – Vплаз Vвнекл = Vвнкл – Vплаз