Cell_cell_comm.ppt
- Количество слайдов: 83

Внутри и межклеточная сигнализация

Как клетки общаются и слушают мир, который их окружает
• Вначале было Слово, и Слово было у Бога, и Слово было Бог. Оно было в начале у Бога. Все чрез Него начало быть, и без Него ничто не начало быть, что начало быть. В Нем была жизнь, и жизнь была свет человеков. Caenorhabditis elegans.
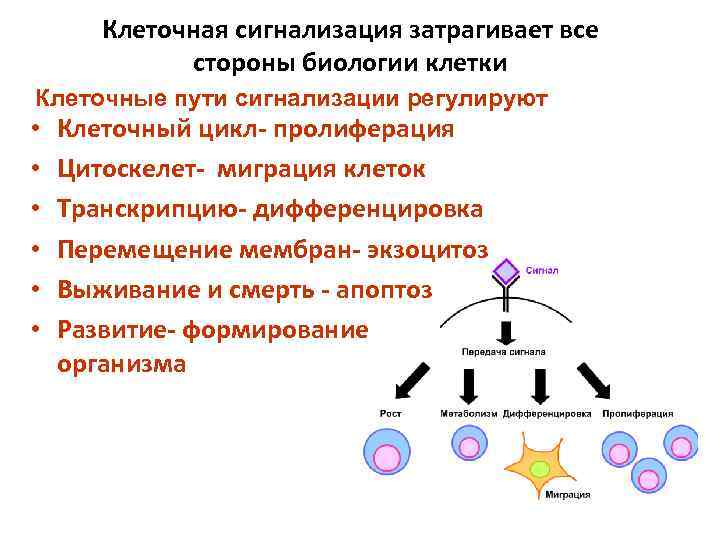
Клеточная сигнализация затрагивает все стороны биологии клетки Клеточные пути сигнализации регулируют • • • Клеточный цикл- пролиферация Цитоскелет- миграция клеток Транскрипцию- дифференцировка Перемещение мембран- экзоцитоз Выживание и смерть - апоптоз Развитие- формирование организма
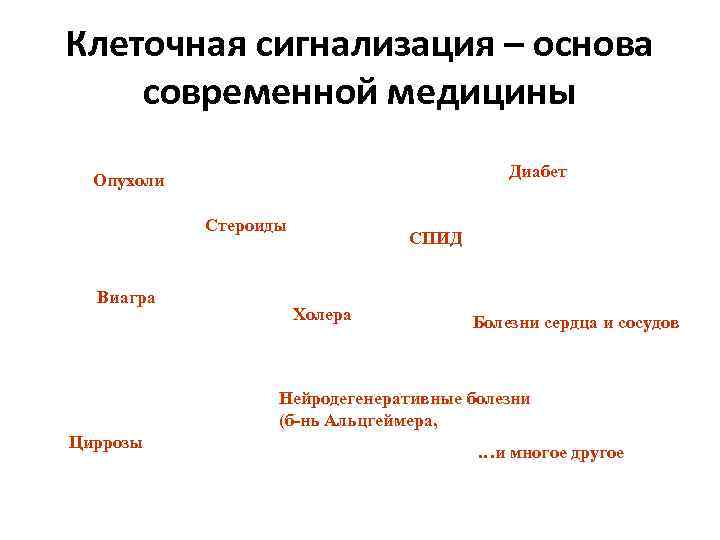
Клеточная сигнализация – основа современной медицины Диабет Опухоли Стероиды Виагра СПИД Холера Болезни сердца и сосудов Нейродегенеративные болезни (б-нь Альцгеймера, Циррозы …и многое другое

Откуда пошли и есть лиганды и рецепторы сигнальных путей? ? ? Лиганды – это побочные продукты метаболических путей , означавших избыток или недостаток источников питания Рецепторы и регуляторные белки были отобраны в процессе эволюции. В пользу этого говорит высокий консерватизм у разных видов живого в строении и функциях многих сигнальных путей Классическая концепция взаимодействия рецептора и лиганда –комплементарность • Лиганд взаимодействует с частью молекулярной структуры рецептора • Рецептор - макромолекула, которая связывает только специфический лиганд в присутствии обширного избытка других молекул • Выраженная стереоспецифичность
Что уже было в нашей программе?
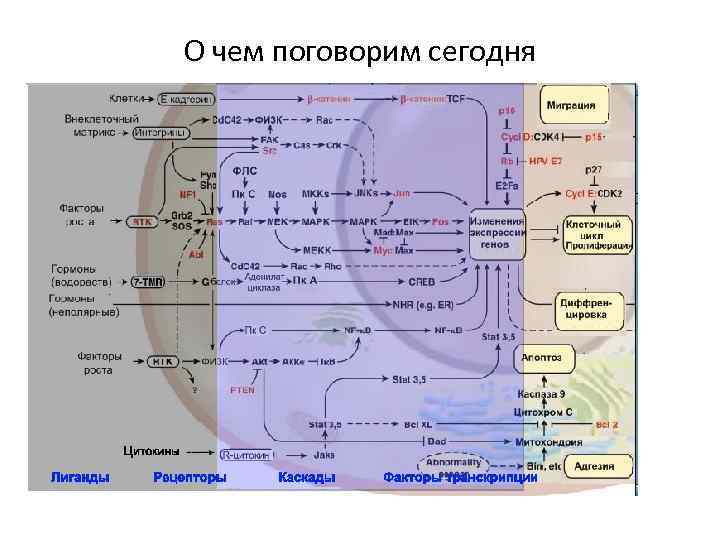
О чем поговорим сегодня
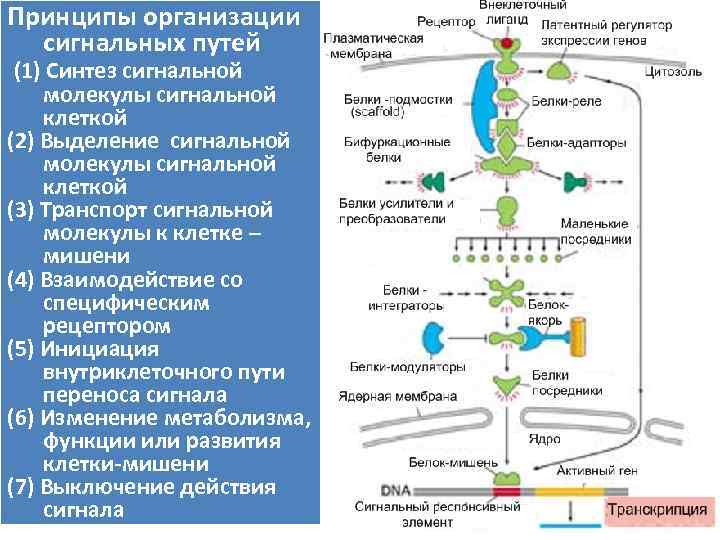
Принципы организации сигнальных путей (1) Синтез сигнальной молекулы сигнальной клеткой (2) Выделение сигнальной молекулы сигнальной клеткой (3) Транспорт сигнальной молекулы к клетке – мишени (4) Взаимодействие со специфическим рецептором (5) Инициация внутриклеточного пути переноса сигнала (6) Изменение метаболизма, функции или развития клетки-мишени (7) Выключение действия сигнала

Генерация сигнала • Некоторые гидрофильные сигналы синтезируются и хранятся в секреторных везикулах • Секреция часто регулируется ионами [Ca ] 2+ • Гидрофобные сигналы высвобождаются по мере их образования • Время полужизни гидрофобного сигнала определяет продолжительность хронического эндокринного ответа или преходящего паракринного ответа. Быстрая и продолжительная сигнализация • Изменение активности фермента в клетках-мишенях => быстрый ответ Это обычный первичный эффект лигандов, которые связываются с поверхностными рецепторами • Изменение характера экспрессии генов => хронический ответ Это обычный первичный эффект лигандов, которые связываются с внутриклеточными рецепторами (исключение : NO) и более поздний эффект лигандов, которые связываются с поверхностными рецепторами

Сигналы бывают разные • Липофильные молекулы, взаимодействующие с внутриклеточными рецепторами(стероиды, ретиноиды и др. ; NO) • Гидрофильные молекулы, взаимодействующие с поверхностными рецепторами (нейромедиаторы , пептидные гормоны, факторы роста, цитокины) • Липофильные молекулы, взаимодействующие с поверхностными рецепторами (простагландины, лейкотриены) • Факторы внешней среды, взаимодействующие с поверхностными рецепторами (свет, одоранты)
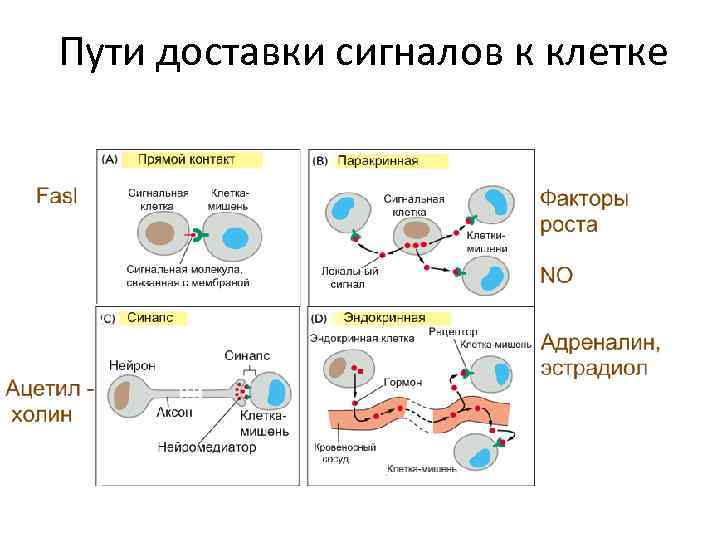
Пути доставки сигналов к клетке
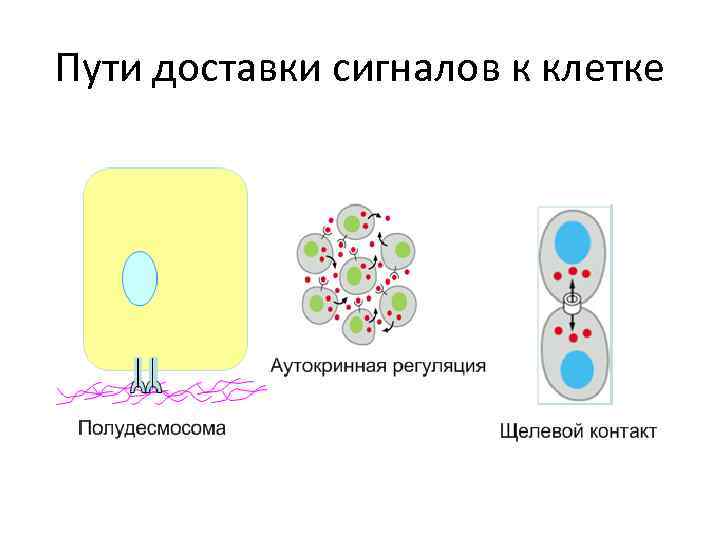
Пути доставки сигналов к клетке

Пути доставки сигналов в клетку • Сигнальный лиганд может быть гидрофильным и не проникает в клетку, а действует через мембранные рецепторы • Сигнальный лиганд может быть гидрофобным и проникает в клетку, действуя через цитозольные и ядерные рецепторы
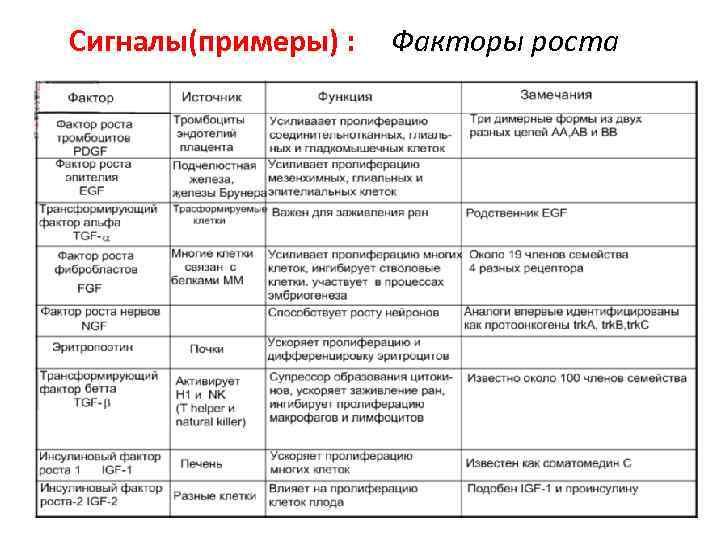
Сигналы(примеры) : Факторы роста

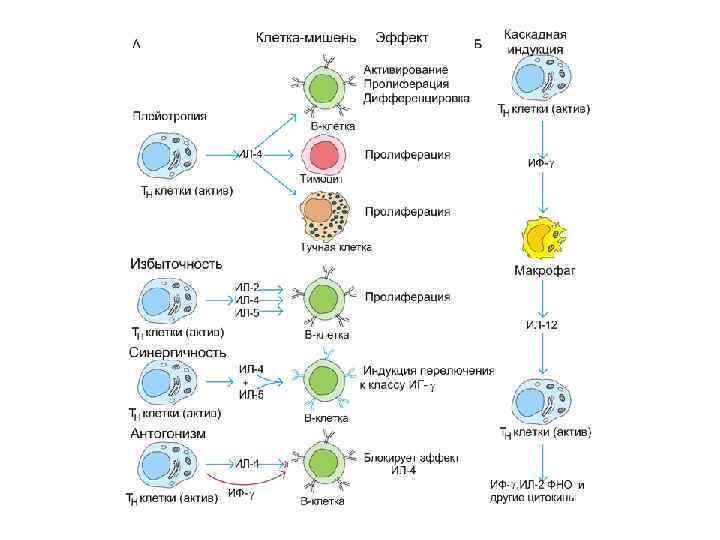
Сигналы(примеры): • Цитокины • Низкомолекулярные белки (30 к. Да) • Действуют аутокринно, паракринно и эндокринно. • Термин ЦИТОКИН общий для монокинов, интерлейкинов, лимфокинов, хемокинов. • Наиболее хорошо изучено их участие в иммунитете, воспалении
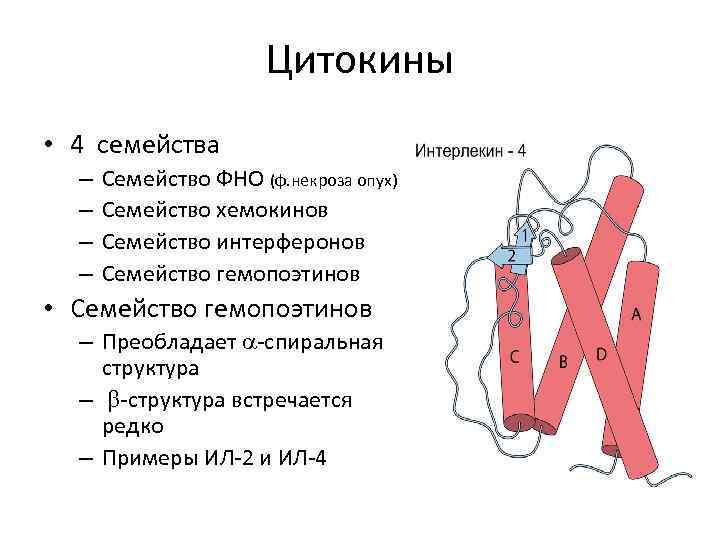
Цитокины • 4 семейства – – Семейство ФНО (ф. некроза опух) Семейство хемокинов Семейство интерферонов Семейство гемопоэтинов • Семейство гемопоэтинов – Преобладает -спиральная структура – -структура встречается редко – Примеры ИЛ-2 и ИЛ-4
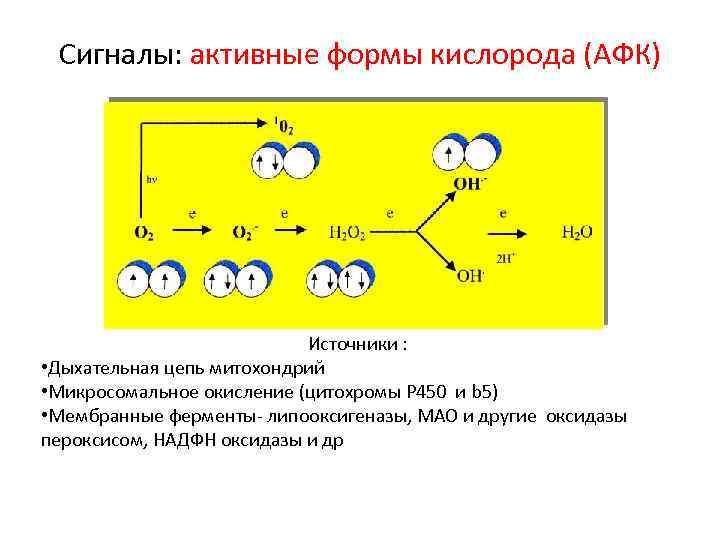
Сигналы: активные формы кислорода (АФК) Источники : • Дыхательная цепь митохондрий • Микросомальное окисление (цитохромы Р 450 и b 5) • Мембранные ферменты- липооксигеназы, МАО и другие оксидазы пероксисом, НАДФН оксидазы и др
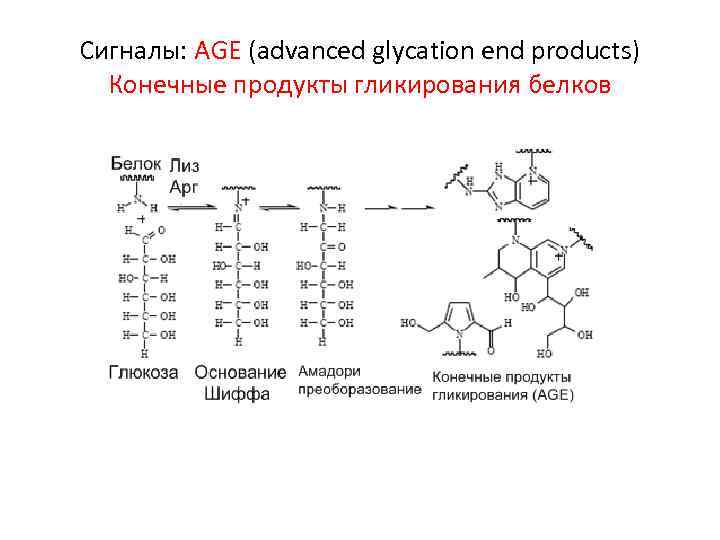
Сигналы: AGE (advanced glycation end products) Конечные продукты гликирования белков
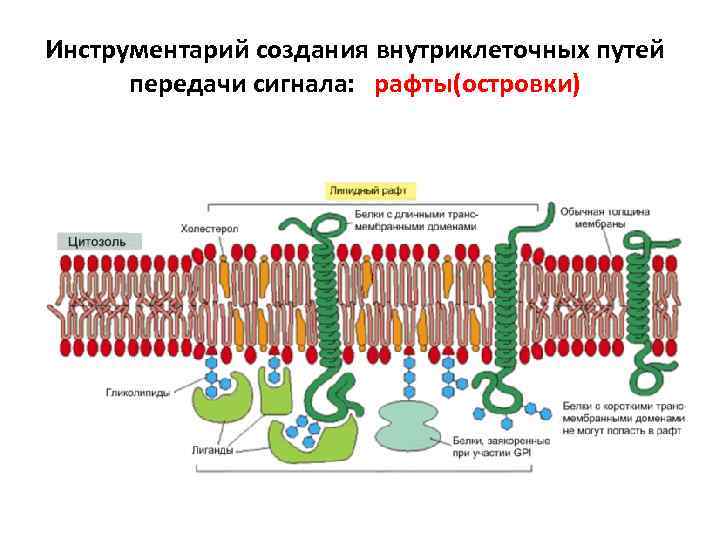
Инструментарий создания внутриклеточных путей передачи сигнала: рафты(островки)
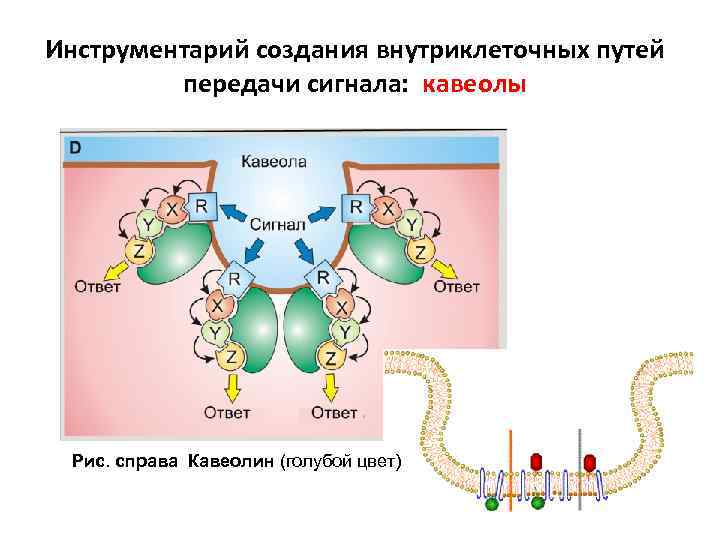
Инструментарий создания внутриклеточных путей передачи сигнала: кавеолы Рис. справа Кавеолин (голубой цвет)

Инструментарий создания внутриклеточных путей передачи сигнала: фосфорилирование • Фосфорилирование - самый распространенный способ посттрансляционной модификации белков: 30 -50% всех белков эукариот фосфорилируются • Фосфорилирование меняет функцию белков путем их аллостерической модуляции или изменяя их способность взаимодействовать с другими молекулами • Фосфатная группа (PO 4) присоединяется к одной или нескольким аминокислотам белка • Фосфорилирование обратимо – у каждой киназы – своя фосфатаза Примеры процессов сопряженных с фосфорилирования белков • Каскады передачи сигналов внутри клетки (рецепторные тирозинкиназы, сигнальный каскад рецепторов, сопряженных с Gбелками ) p Метаболизм гликогена. Цикл жизни вирусов Регуляция экспрессии генов (транскрипция)
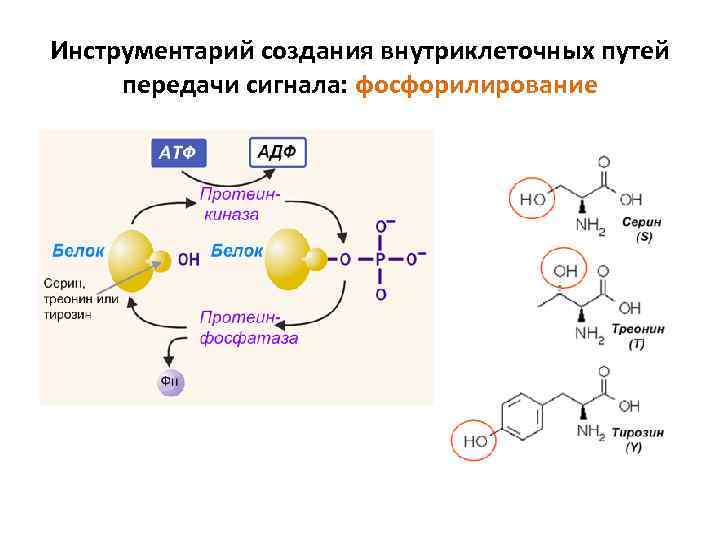
Инструментарий создания внутриклеточных путей передачи сигнала: фосфорилирование
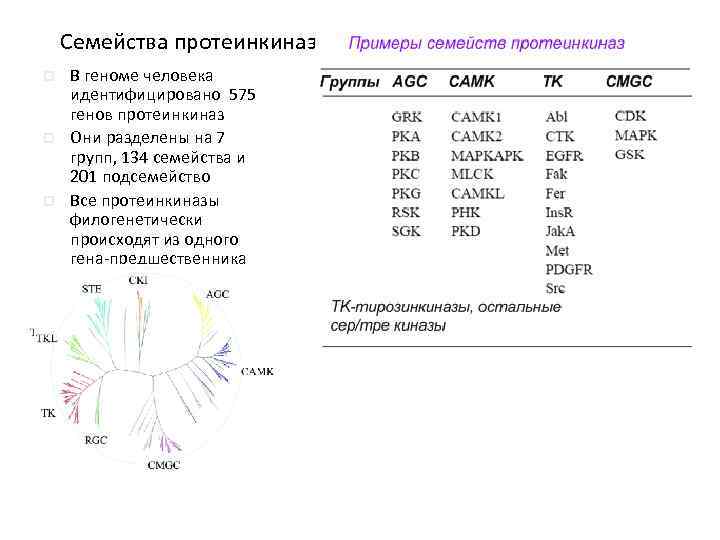
Семейства протеинкиназ p p p В геноме человека идентифицировано 575 генов протеинкиназ Они разделены на 7 групп, 134 семейства и 201 подсемейство Все протеинкиназы филогенетически происходят из одного гена-предшественника
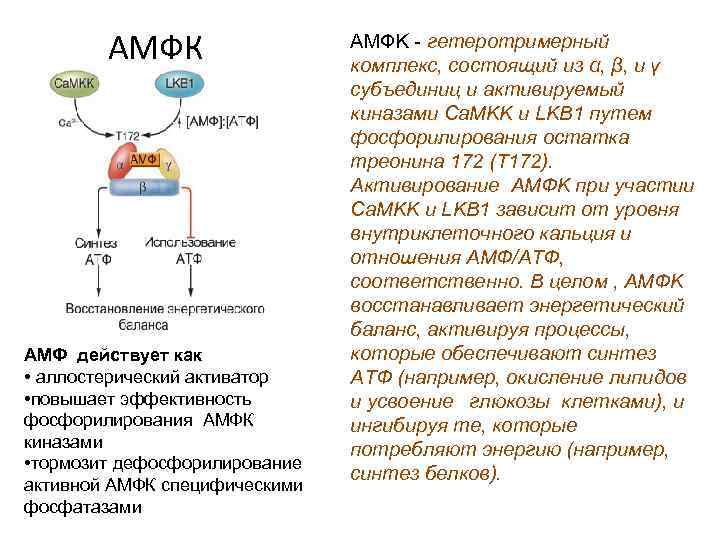
АМФК АМФ действует как • аллостерический активатор • повышает эффективность фосфорилирования АМФК киназами • тормозит дефосфорилирование активной АМФК специфическими фосфатазами AMФK - гетеротримерный комплекс, состоящий из α, β, и γ субъединиц и активируемый киназами Ca. MKK и LKB 1 путем фосфорилирования остатка треонина 172 (Т 172). Активирование AMФK при участии Ca. MKK и LKB 1 зависит от уровня внутриклеточного кальция и отношения АМФ/АТФ, соответственно. В целом , AMФK восстанавливает энергетический баланс, активируя процессы, которые обеспечивают синтез АТФ (например, окисление липидов и усвоение глюкозы клетками), и ингибируя те, которые потребляют энергию (например, синтез белков).
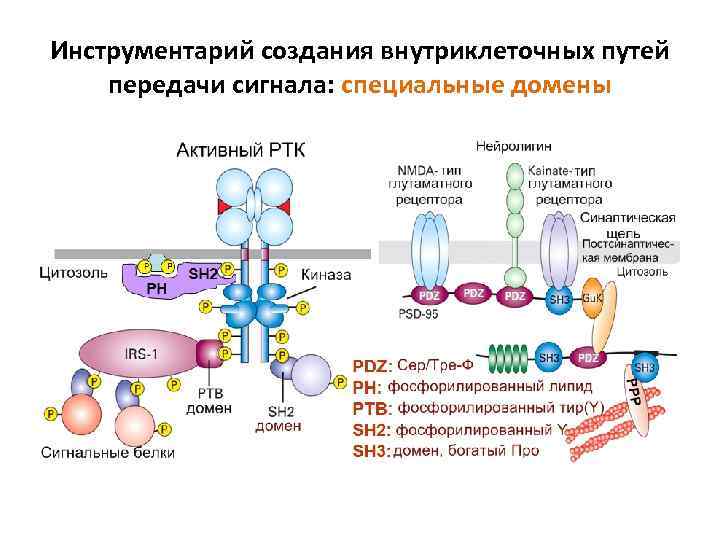
Инструментарий создания внутриклеточных путей передачи сигнала: специальные домены
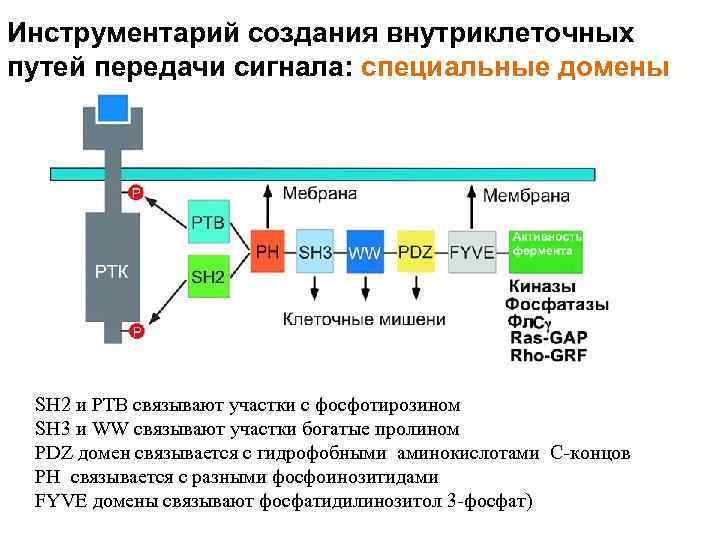
Инструментарий создания внутриклеточных путей передачи сигнала: специальные домены SH 2 и PTB связывают участки с фосфотирозином SH 3 и WW связывают участки богатые пролином PDZ домен связывается с гидрофобными аминокислотами C-концов PH связывается с разными фосфоинозитидами FYVE домены связывают фосфатидилинозитол 3 -фосфат)
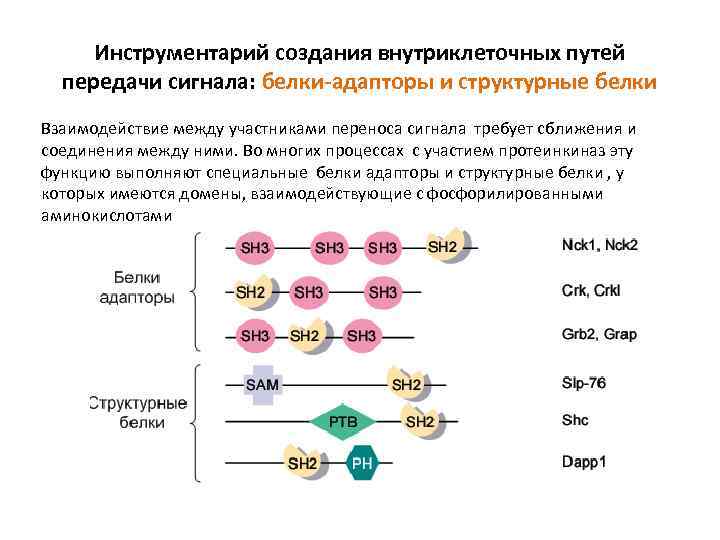
Инструментарий создания внутриклеточных путей передачи сигнала: белки-адапторы и структурные белки Взаимодействие между участниками переноса сигнала требует сближения и соединения между ними. Во многих процессах с участием протеинкиназ эту функцию выполняют специальные белки адапторы и структурные белки , у которых имеются домены, взаимодействующие с фосфорилированными аминокислотами
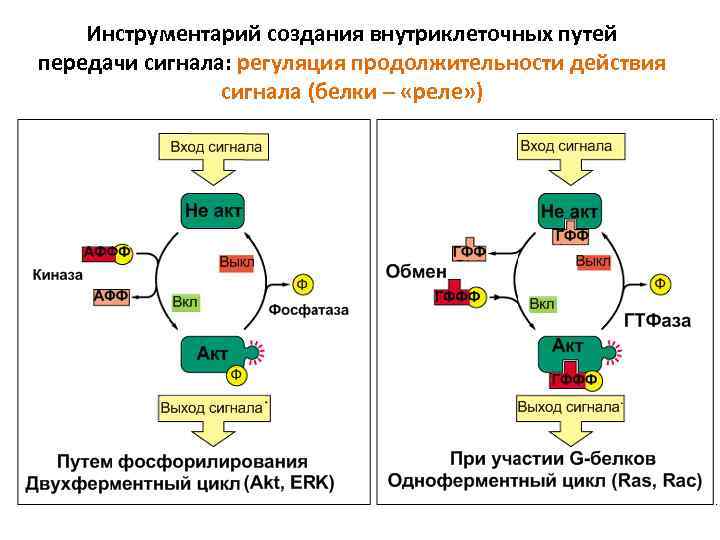
Инструментарий создания внутриклеточных путей передачи сигнала: регуляция продолжительности действия сигнала (белки – «реле» )
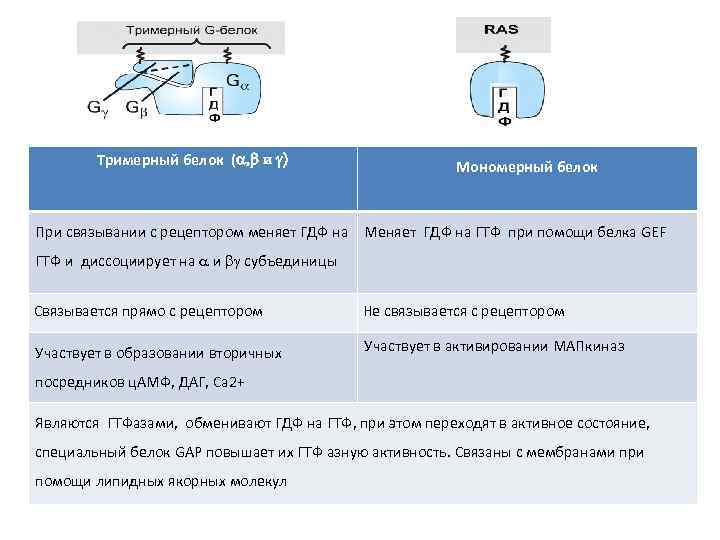
Тримерный белок (a, b и g) Мономерный белок При связывании с рецептором меняет ГДФ на Меняет ГДФ на ГТФ при помощи белка GEF ГТФ и диссоциирует на и g субъединицы Связывается прямо с рецептором Не связывается с рецептором Участвует в образовании вторичных Участвует в активировании МАПкиназ посредников ц. АМФ, ДАГ, Са 2+ Являются ГТФазами, обменивают ГДФ на ГТФ, при этом переходят в активное состояние, специальный белок GAP повышает их ГТФ азную активность. Связаны с мембранами при помощи липидных якорных молекул

Инструментарий создания внутриклеточных путей передачи сигнала: амплификация количества молекул, участвующих в передаче сигнала • Для реализации эффекта сигнала необходимо участие несоизмеримо большего по сравнению с числом сигнальных лигандов количества молекул – эффекторов. В организации внутриклеточного переноса сигналов важная роль принадлежит механизмам умножения (амплификации) сигнала. Это достигается несколькими механизмами, среди которых наиболее часто используются • Образование небольших молекул- вторичных посредников • Формирование ферментных каскадов амплификации • Увеличение концентрации ионов • Взаимодействие с компонентами цитоскелета Примеры такой амплификации далее
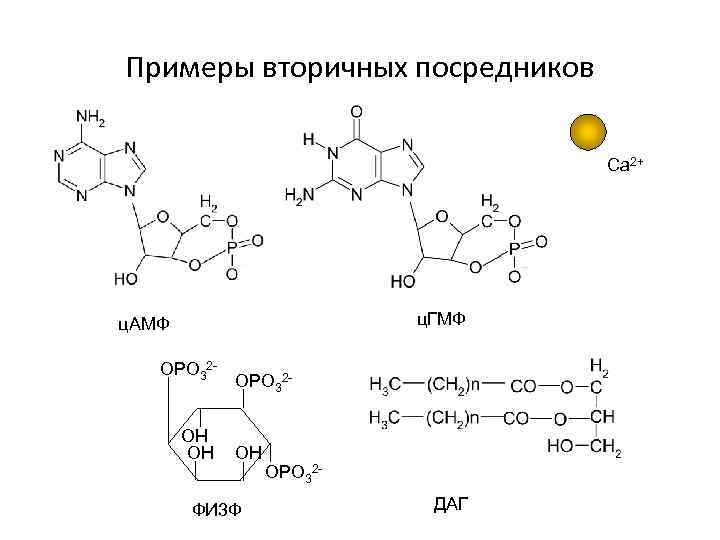
Примеры вторичных посредников Ca 2+ ц. ГМФ ц. АМФ OPO 32 HO OH OPO 32 - OH ФИ 3 Ф OPO 32 ДАГ
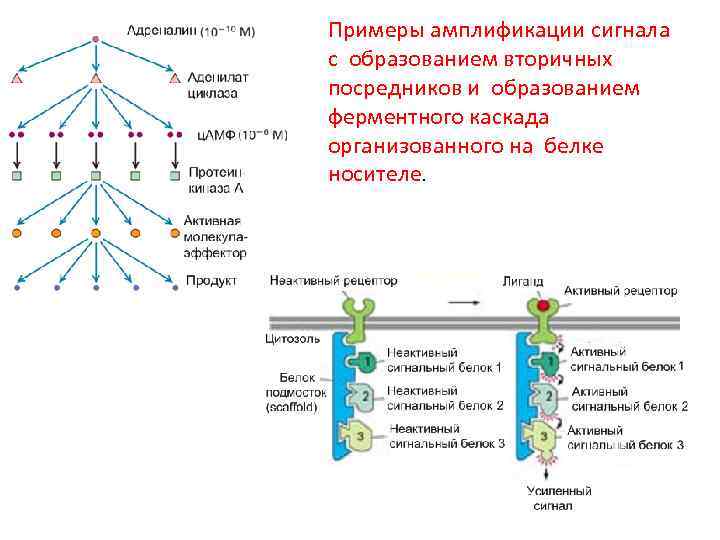
Примеры амплификации сигнала с образованием вторичных посредников и образованием ферментного каскада организованного на белке носителе.
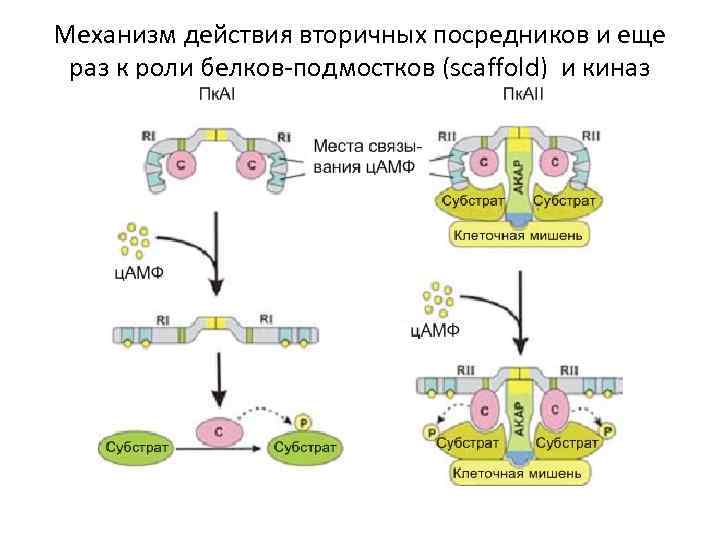
Механизм действия вторичных посредников и еще раз к роли белков-подмостков (scaffold) и киназ

PKA I. Тип 1 PKA связывается с изоформами RI. Как и для всех изоформ, субъединицы R формируют димеры, связываясь N-терминальными доменами димеризации/стыковки (желтый цвет). В дополнение к димеризации, эта Nтерминальная область также связывается с AKAPs (см. ниже). Однако, изоформы RI имеют очень низкое сродство к AKAPs и таким образом главным образом растворимы. ЦАМФ действует связываясь с тандемными связы вающими ц. АМФ доменам, освобождая активные субъединицы C, которые затем фосфорилируют специфические субстраты. Так как субъединицы RI имеют более высокое сродство к ц. АМФ , PKA I в состоянии ответить на более низкие концентрации ц. АМФ, найденные глобально в пределах общего цитозоля. PKAII. PKA II имеет димер регуляторных субъединиц RII. Так как эта субъединица RII имеет намного более высокое сродство к AKAPs, PKAII обычно связывается с этим белком подмостком и таким образом имеет намного более точную локализацию к специфическим клеточным целям. AKAPs. скэфолдовская Функция AKAPs выполнена различными доменами, типа консервативного PKA-связывающего домена (желтая область), который является гидрофобной поверхностью, которая связывается к N-терминальной области димеризации субъединиц R. В другом конце молекулы есть уникальные (синие) домены наведения, которые определяют способ, которым AKAPs идентифицирует и связывает специфические клеточные цели в отдельных областях клетки.
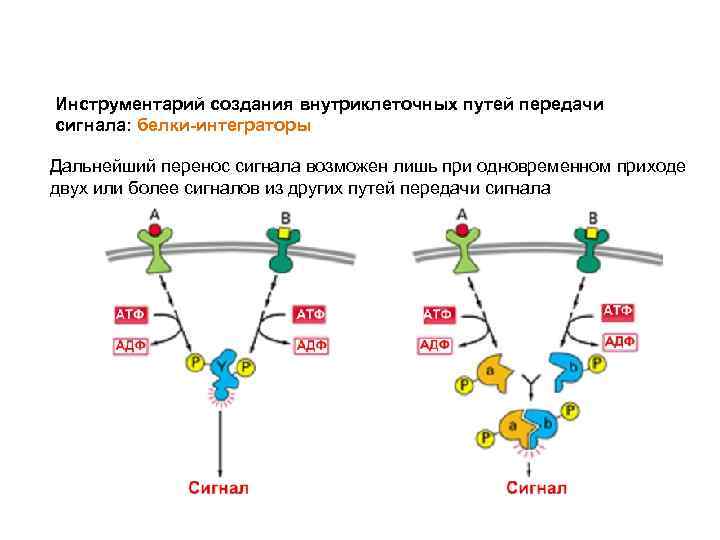
Инструментарий создания внутриклеточных путей передачи сигнала: белки-интеграторы Дальнейший перенос сигнала возможен лишь при одновременном приходе двух или более сигналов из других путей передачи сигнала

Молекулы - рецепторы • 1. Рецепторы, ассоциированные с тримерными G-белками ( рецепторы глюкагона, адреналина, серотонина и др. ) 7 -ТМС-рецепторы • 2. Рецепторы – лигандзависимые ионные каналы ( рецептор ацетилхолина, глутамата и др. ) • 3. Рецепторы, не обладающие каталитической активностью, но ассоциированные с цитозольными тирозинкиназами. • 4. Рецепторы, обладающие каталитической активностью (гуанилатциклазы, протеинфосфатазы, серин/треонин киназы, тирозинкиназы и др) • 5. Цитозольные и ядерные рецепторы. • 6. Рецепторы – молекулы клеточной адгезии • 7. Рецепторы ассоциированные с процессами протеолиза
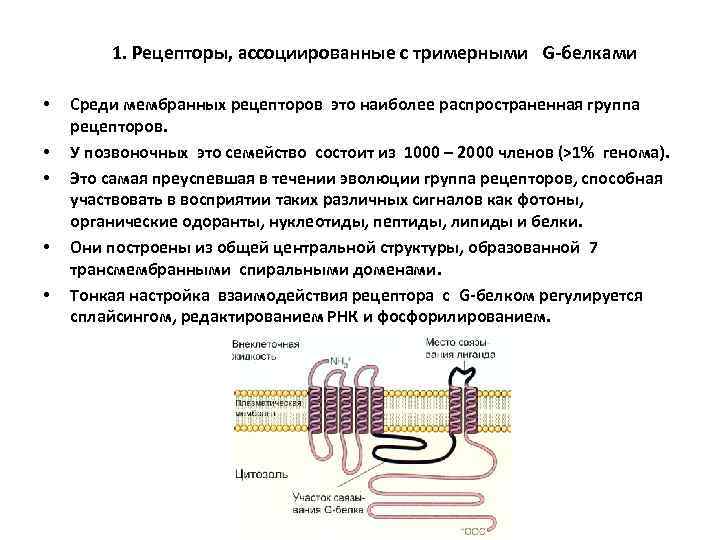
1. Рецепторы, ассоциированные с тримерными G-белками • • • Среди мембранных рецепторов это наиболее распространенная группа рецепторов. У позвоночных это семейство состоит из 1000 – 2000 членов (>1% генома). Это самая преуспевшая в течении эволюции группа рецепторов, способная участвовать в восприятии таких различных сигналов как фотоны, органические одоранты, нуклеотиды, пептиды, липиды и белки. Они построены из общей центральной структуры, образованной 7 трансмембранными спиральными доменами. Тонкая настройка взаимодействия рецептора с G-белком регулируется сплайсингом, редактированием РНК и фосфорилированием.
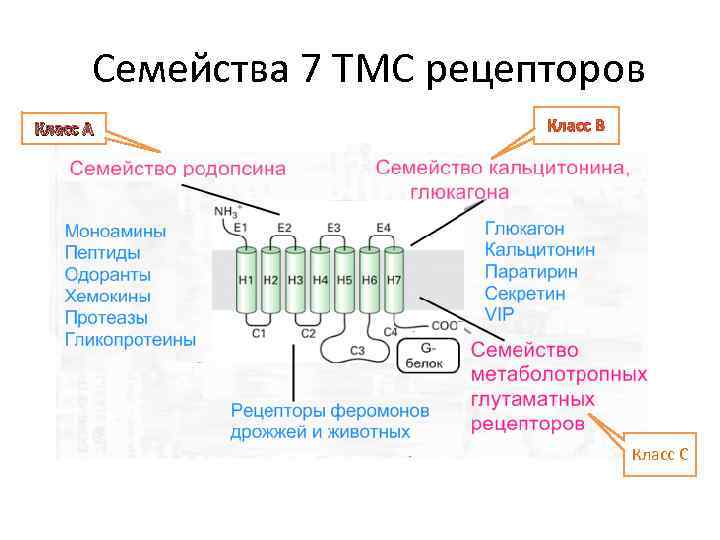
Семейства 7 ТМС рецепторов Класс А Класс B Класс C

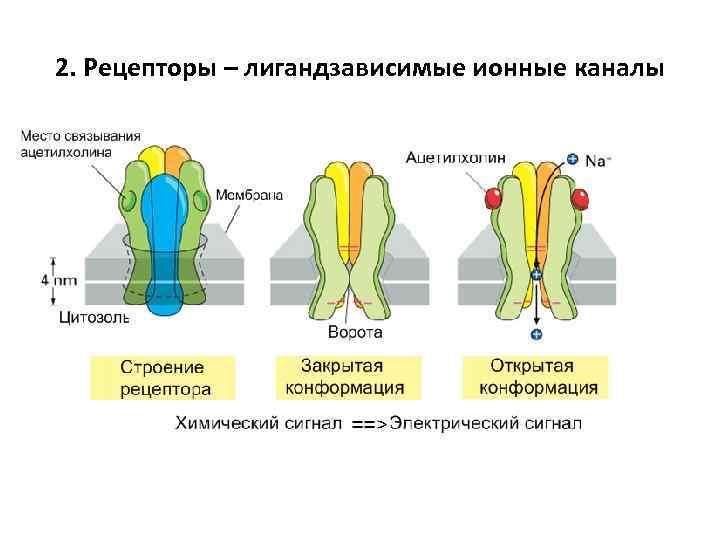
2. Рецепторы – лигандзависимые ионные каналы
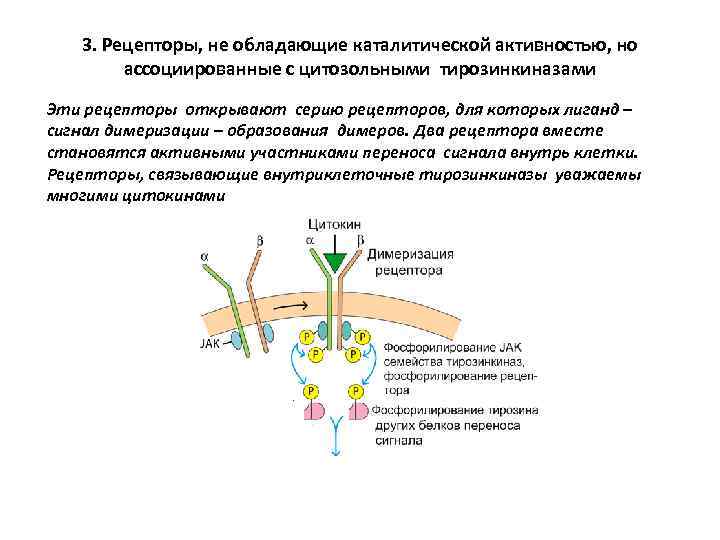
3. Рецепторы, не обладающие каталитической активностью, но ассоциированные с цитозольными тирозинкиназами Эти рецепторы открывают серию рецепторов, для которых лиганд – сигнал димеризации – образования димеров. Два рецептора вместе становятся активными участниками переноса сигнала внутрь клетки. Рецепторы, связывающие внутриклеточные тирозинкиназы уважаемы многими цитокинами

4. Рецепторы, обладающие каталитической активностью 1. Тирозинкиназы: рецепторы, фосфорилирующие тирозины молекул переноса сигнала. 2. Тирозинфосфатазы: рецепторы, удаляющие фосфатные группы, связанные с тирозином. Лиганд их неизвестен. 3. Серин/треонин киназы: рецепторы, фосфорилирующие Сер или Тре молекул переноса сигнала. 4. Гуанилатсинтазы : рецепторы, катализирующие образование ц. ГМФ 5. Рецепторы, асоциированные с гистидинкиназой: фофорилируют свой гистидин и затем быстро переносят фосфат на другие молекулы
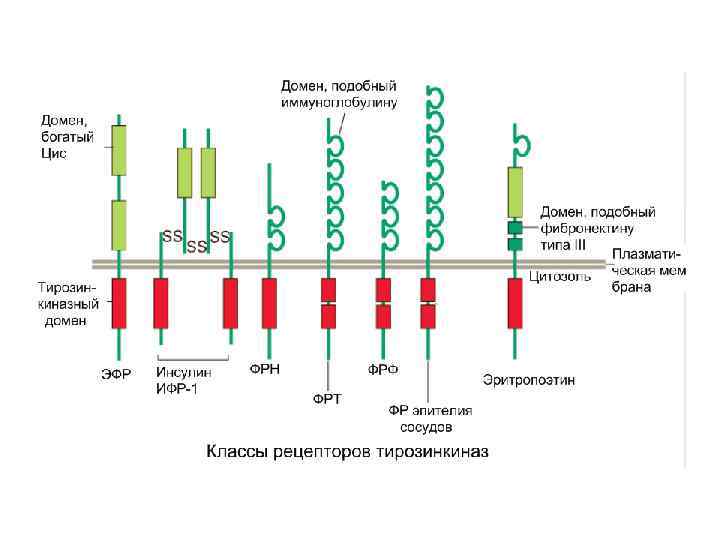
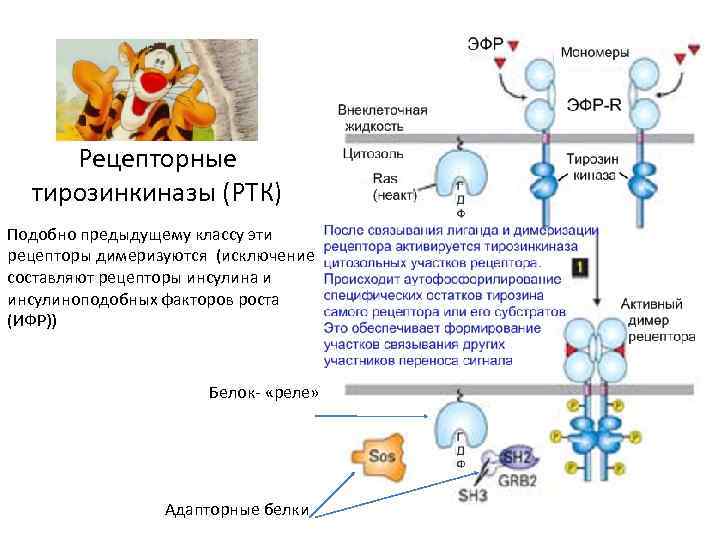
Рецепторные тирозинкиназы (РТК) Подобно предыдущему классу эти рецепторы димеризуются (исключение составляют рецепторы инсулина и инсулиноподобных факторов роста (ИФР)) Белок- «реле» Адапторные белки
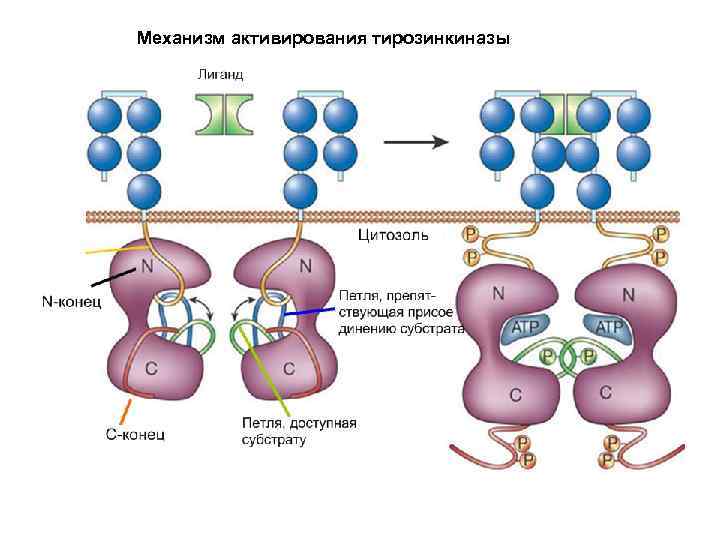
Механизм активирования тирозинкиназы
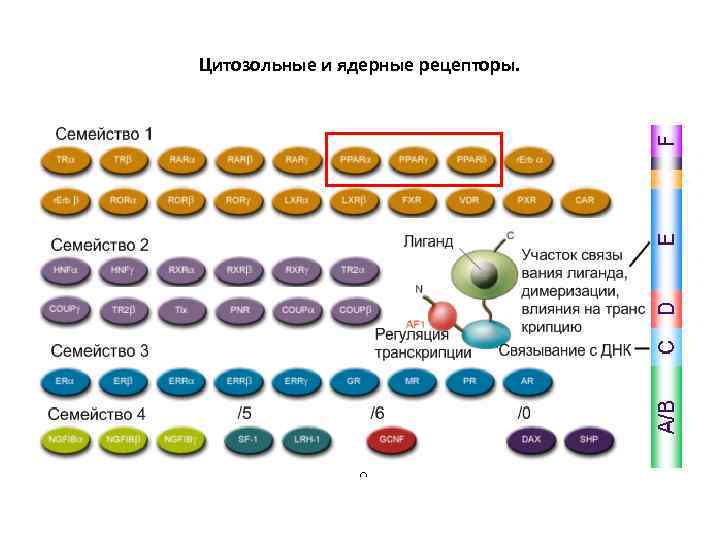
Цитозольные и ядерные рецепторы.

Лиганды • • • Стероидные гормоны Гормоны щитовидной железы Витамин D Ретиноиды Другие
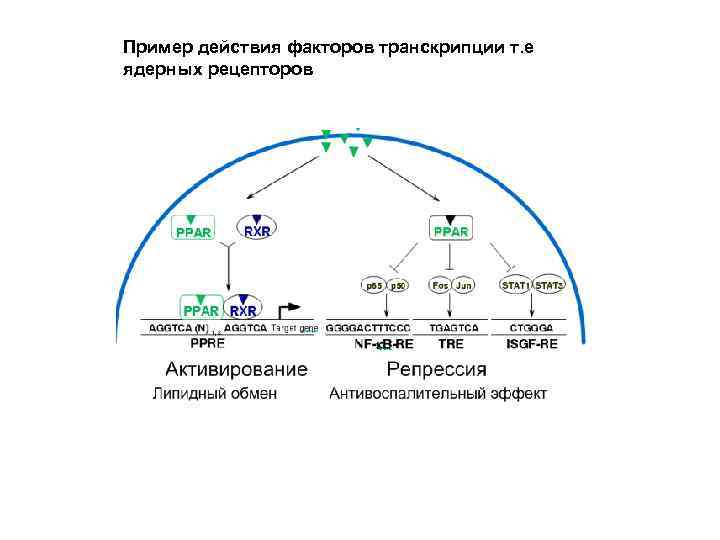
Пример действия факторов транскрипции т. е ядерных рецепторов
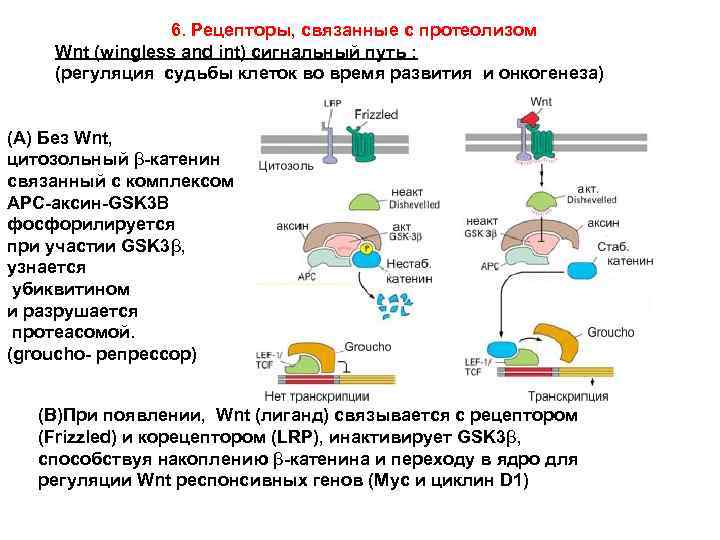
6. Рецепторы, связанные с протеолизом Wnt (wingless and int) сигнальный путь : (регуляция судьбы клеток во время развития и онкогенеза) (A) Без Wnt, цитозольный β-катенин связанный с комплексом APC-аксин-GSK 3Β фосфорилируется при участии GSK 3β, узнается убиквитином и разрушается протеасомой. (groucho- репрессор) (B)При появлении, Wnt (лиганд) связывается с рецептором (Frizzled) и корецептором (LRP), инактивирует GSK 3β, способствуя накоплению β-катенина и переходу в ядро для регуляции Wnt респонсивных генов (Мyc и циклин D 1)

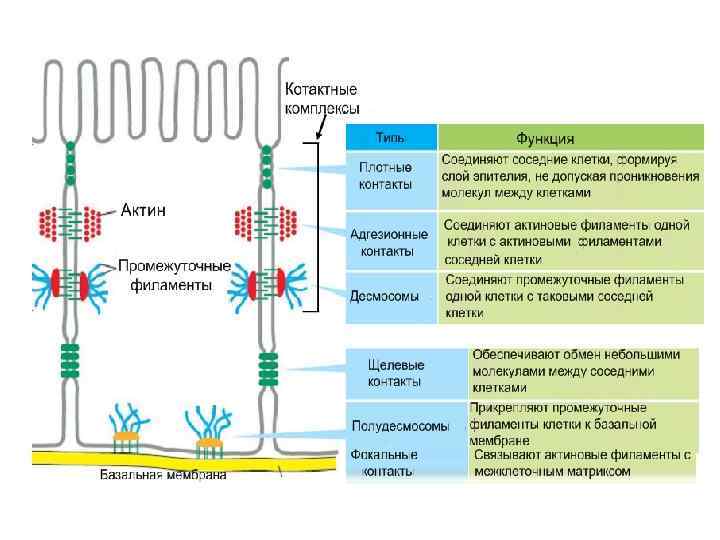
7. Рецепторы – молекулы клеточной адгезии Типы прямого взаимодействия между клетками • • • I. Замыкающие (плотные) контакты II. Прикрепительные соединения 1. Места прикрепления актиновых филаментов (адгезионные контакты) а) между клетками (например, адгезионные пояса) б) между клетками и матриксом (например, фокальные контакты) 2. Места прикрепления промежуточных филаментов а) между клетками (десмосомы) б) между клетками и матриксом (полудесмосомы) III. Коммуникационные соединения 1. Щелевые контакты 2. Химические синапсы
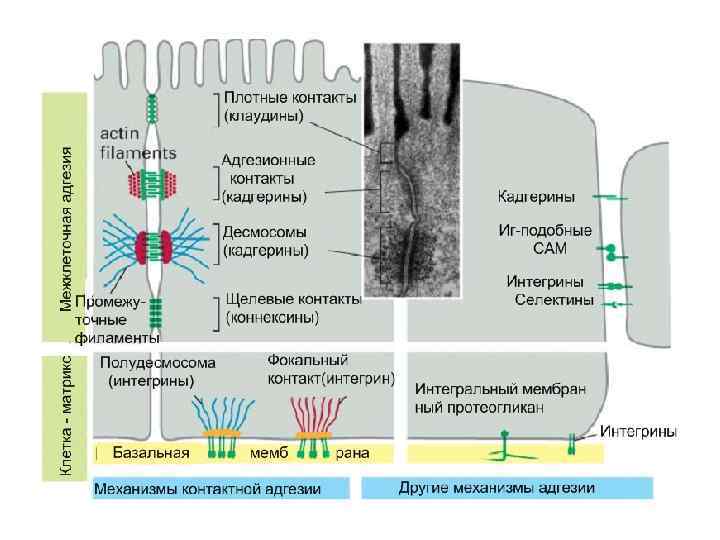
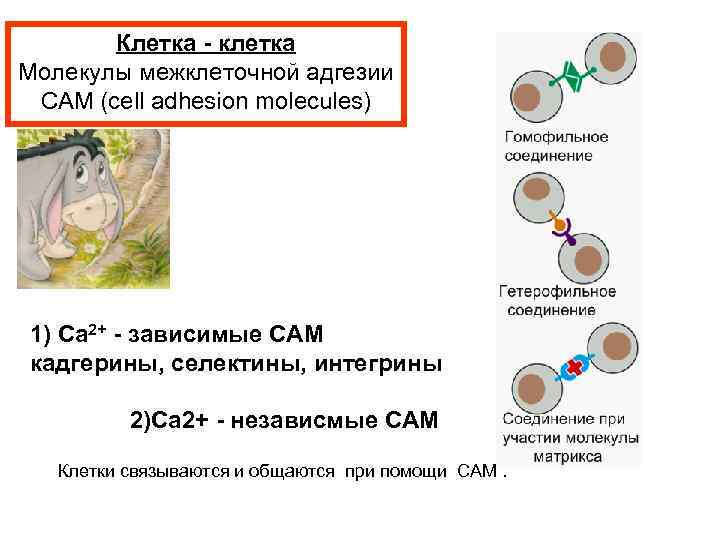
Клетка - клетка Молекулы межклеточной адгезии CAM (cell adhesion molecules) 1) Ca 2+ - зависимые CAM кадгерины, селектины, интегрины 2)Ca 2+ - независмые CAM Клетки связываются и общаются при помощи CAM.
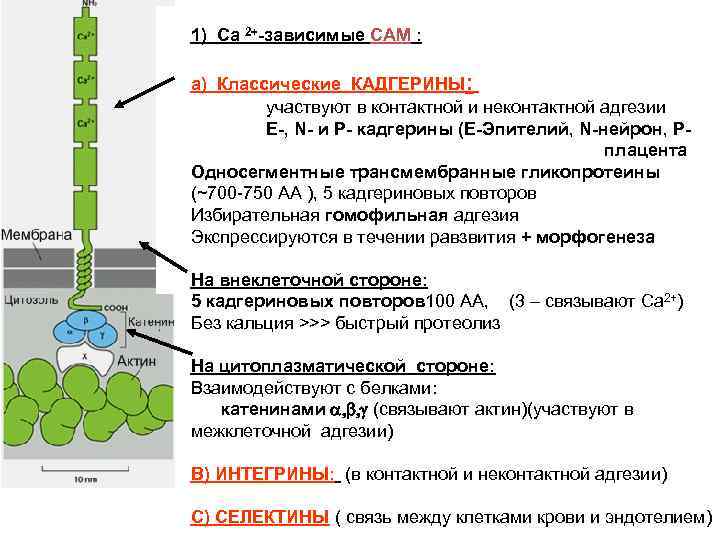
1) Cа 2+-зависимые СAM : a) Классические КАДГЕРИНЫ: участвуют в контактной и неконтактной адгезии E-, N- и P- кадгерины (E-Эпителий, N-нейрон, Pплацента Односегментные трансмембранные гликопротеины (~700 -750 AA ), 5 кадгериновых повторов Избирательная гомофильная адгезия Экспрессируются в течении равзвития + морфогенеза На внеклеточной стороне: 5 кадгериновых повторов 100 AA, (3 – связывают Ca 2+) Без кальция >>> быстрый протеолиз На цитоплазматической стороне: Взаимодействуют с белками: катенинами a, b, g (связывают актин)(участвуют в межклеточной адгезии) B) ИНТЕГРИНЫ: (в контактной и неконтактной адгезии) C) СЕЛЕКТИНЫ ( связь между клетками крови и эндотелием)
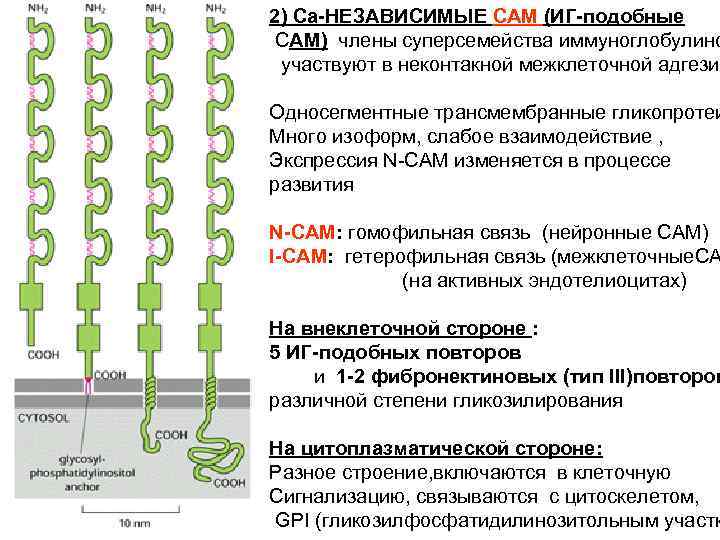
2) Ca-НЕЗАВИСИМЫЕ CAM (ИГ-подобные CAM) члены суперсемейства иммуноглобулино участвуют в неконтакной межклеточной адгезии Односегментные трансмембранные гликопротеи Много изоформ, слабое взаимодействие , Экспрессия N-CAM изменяется в процессе развития N-CAM: гомофильная связь (нейронные CAM) I-CAM: гетерофильная связь (межклеточные. CA (на активных эндотелиоцитах) На внеклеточной стороне : 5 ИГ-подобных повторов и 1 -2 фибронектиновых (тип III)повторов различной степени гликозилирования На цитоплазматической стороне: Разное строение, включаются в клеточную Сигнализацию, связываются с цитоскелетом, GPI (гликозилфосфатидилинозитольным участк
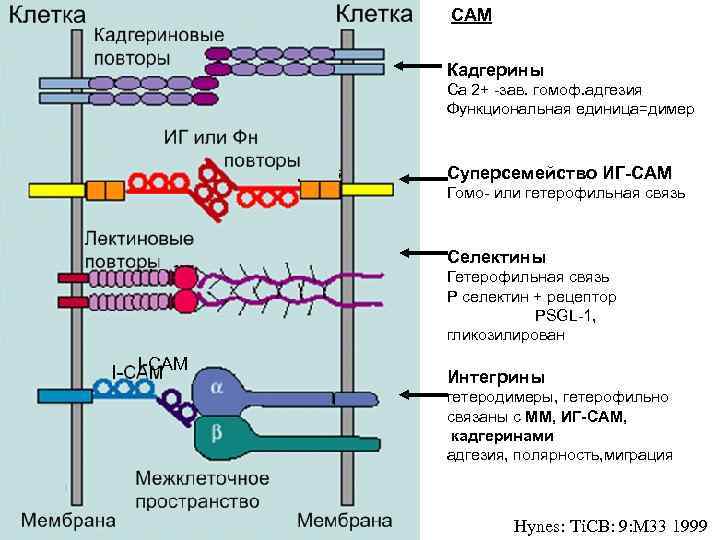
CAM Кадгерины Ca 2+ -зав. гомоф. адгезия Функциональная единица=димер Суперсемейство ИГ-CAM Гомо- или гетерофильная связь Селектины Гетерофильная связь P селектин + рецептор PSGL-1, гликозилирован I-CAM Интегрины гетеродимеры, гетерофильно связаны с МM, ИГ-CAM, кадгеринами адгезия, полярность, миграция Hynes: Ti. CB: 9: M 33 1999
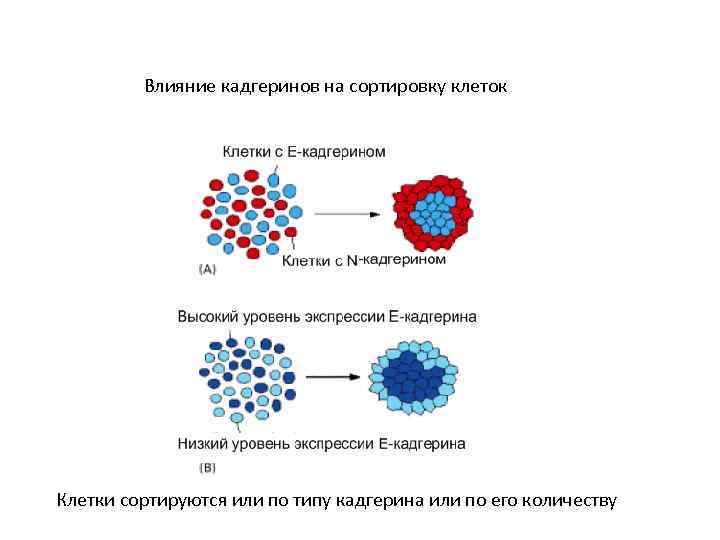
Влияние кадгеринов на сортировку клеток Клетки сортируются или по типу кадгерина или по его количеству
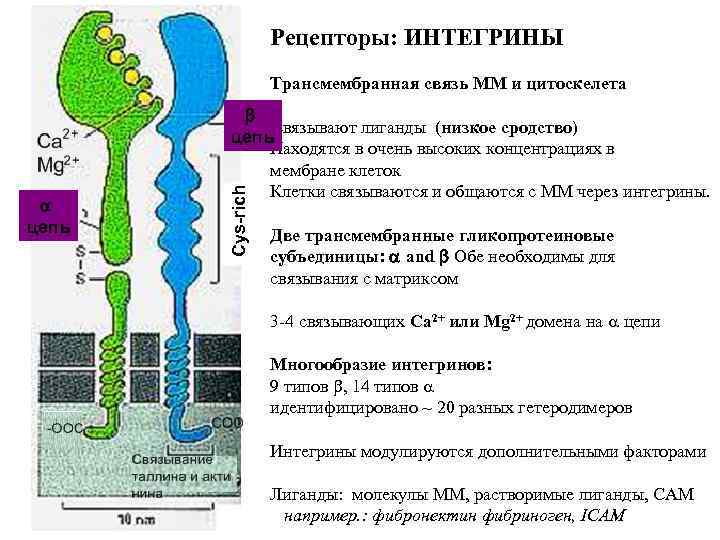
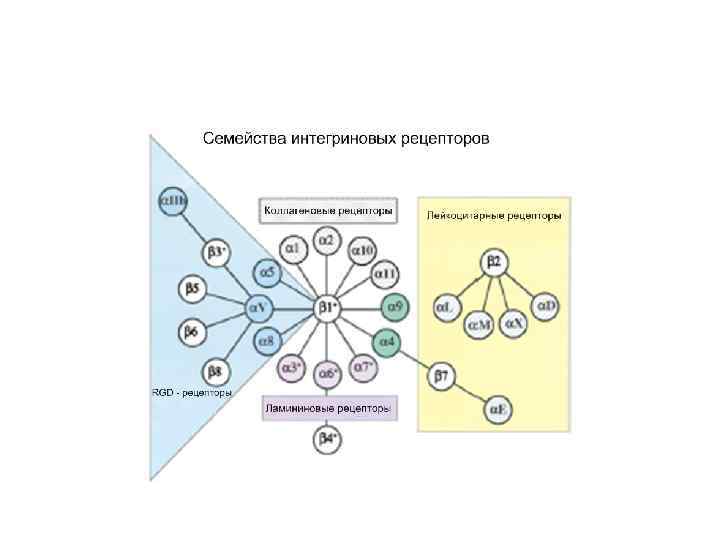
Рецепторы: ИНТЕГРИНЫ Трансмембранная связь ММ и цитоскелета Cys-rich a цепь b связывают лиганды (низкое сродство) цепь Находятся в очень высоких концентрациях в мембране клеток Клетки связываются и общаются с ММ через интегрины. Две трансмембранные гликопротеиновые субъединицы: a and b Обе необходимы для связывания с матриксом 3 -4 связывающих Ca 2+ или Mg 2+ домена на цепи Многообразие интегринов: 9 типов , 14 типов идентифицировано ~ 20 разных гетеродимеров Интегрины модулируются дополнительными факторами Лиганды: молекулы ММ, растворимые лиганды, CAM например. : фибронектин фибриноген, ICAM

Интегрины Цитозольный домен, трансмембранный домен, внеклеточный домен Внеклеточный домен связывает: Молекулы матрикса напр. фибронектин, коллаген, витронектин, Растворимые лиганды, напр. фибриноген “рецепторы-счетчики” напр. ICAM Цитозольный домен связывает: Актинсвязывабщие белки: винкулин, a-актинин, талин, зиксин ИЛИ белки, связывающие промежуточные филаменты: плакоглобин и многие сигнальные молекулы: . тирозинкиназы
Взаимодействия и процессы фокального контакта ОЧЕНЬ сложны! J. Cell Sci, 114: 35
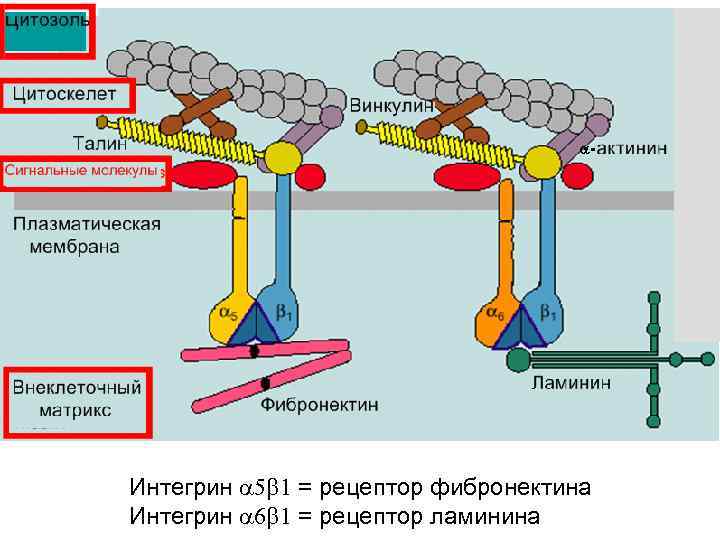
Интегрин 5 1 = рецептор фибронектина Интегрин 6 1 = рецептор ламинина
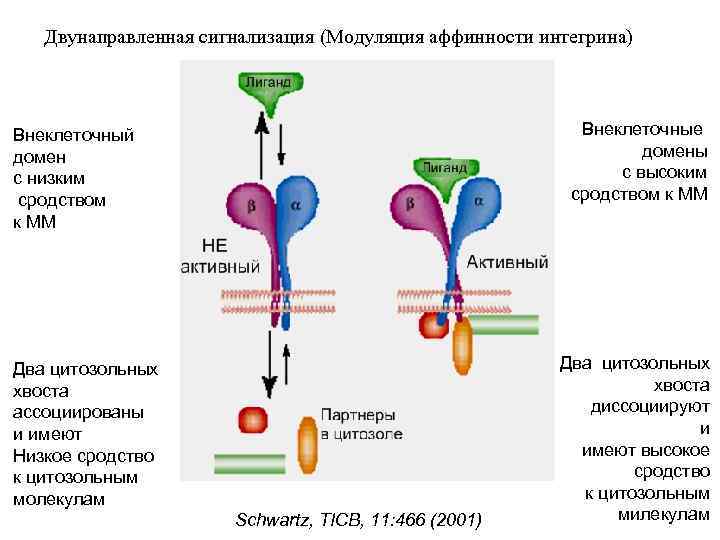
Двунаправленная сигнализация (Модуляция аффинности интегрина) Внеклеточные домены с высоким сродством к ММ Внеклеточный домен с низким сродством к ММ Два цитозольных хвоста ассоциированы и имеют Низкое сродство к цитозольным молекулам Schwartz, TICB, 11: 466 (2001) Два цитозольных хвоста диссоциируют и имеют высокое сродство к цитозольным милекулам

СИГНАЛИЗАЦИЯ ИЗ ВНЕКЛЕТОЧНОЙ СРЕДЫ: Внеклеточныый домен связывается с лигандом (ММ или CAM) Конформационные изменения цитозольного домена (хвост) Взаимодействие цитоскелета и сигнальных молекул. фосфорилирование, экспрессия генов СИГНАЛИЗАЦИЯ ИЗ КЛЕТКИ: Молекулярный сигнал Конформационные изменения цитозольного домена Конформационные изменения внеклеточного лигандсвязывающего участка Изменение сродства к лиганду
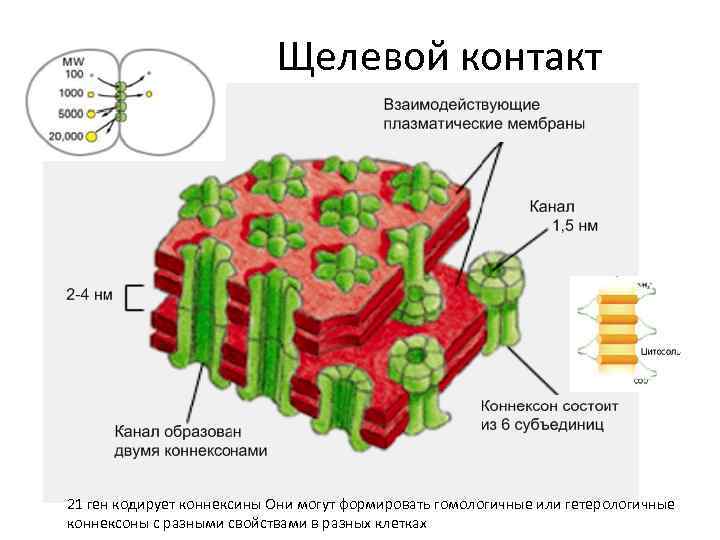
Щелевой контакт 21 ген кодирует коннексины Они могут формировать гомологичные или гетерологичные коннексоны с разными свойствами в разных клетках

Механизмы выключения переноса сигналов • Секвестрация рецепторов • Модификация рецепторов • Инактивация белков участвующих в переносе (фосфатазы) • Белки- «реле» • Изменение концентрации вторичных посредников • Образование белков ингибиторов • Взаимодействие между различными сигнальными путями Большая часть участников регулируются по принципу обратной связи
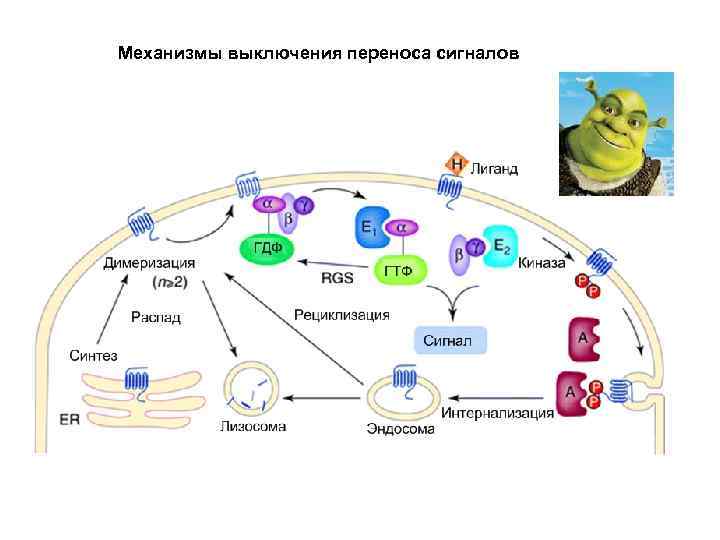
Механизмы выключения переноса сигналов
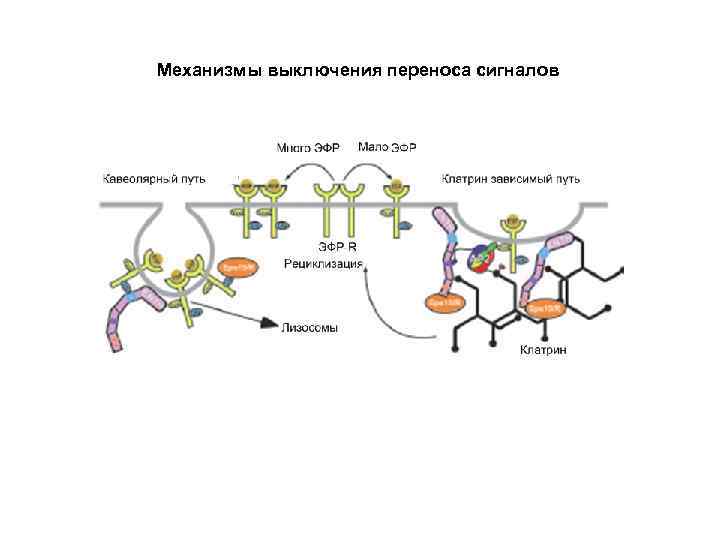
Механизмы выключения переноса сигналов
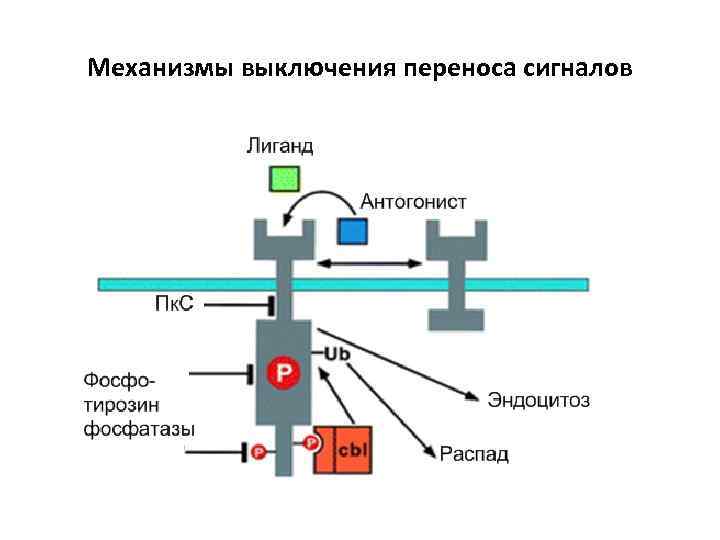
Механизмы выключения переноса сигналов
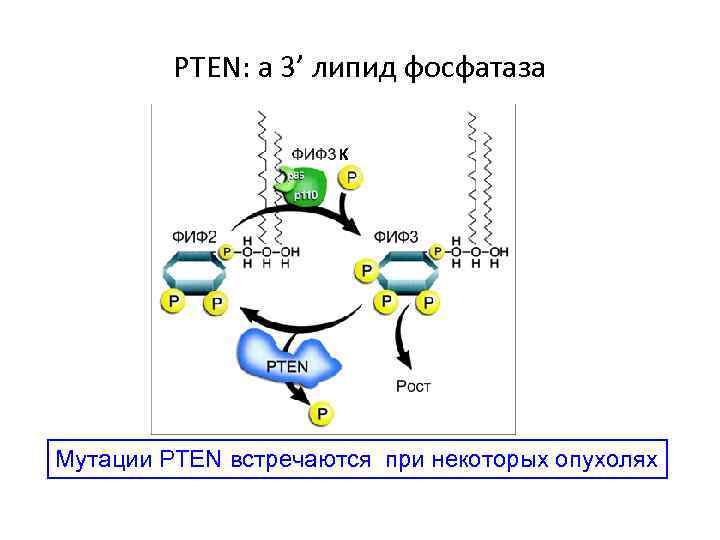
PTEN: a 3’ липид фосфатаза К Мутации PTEN встречаются при некоторых опухолях

Соберем несколько сигнальных путей

Семейство NF- B/Rel Семейство чувствительных к сигналам факторов транскрипции В случае если быстрый ответ требует синтеза белков Включается в провоспалительное реакции: первая линия защиты против инфекционных болезней и клеточного стресса Сигнал Активный NF- B активирование иммунной защиты Имммунный ответ, вопалительный ответ, острофазный ответ NFk. B также главный фактор против апоптоза Нарушение активирования NF- B = одна из первопричин широкого ряда болезней у человека типа воспаления, ревматоидного артрита , астмы, атеросклероза, Альцгеймера Постоянная активность при раке – помогает оставаться раку живым NFk. B поддерживает рост Активный NF- B повышение экспрессии циклина D рост Лекарства против NFk. B = лекарство против рака

Характерный признак: гомо и гетеродимеры фактора найдены в цитозоле неактивных клеток в неактивной форме [в комплексе с ингибитором I B]. Активная связывающая ДНК форма димер из различных членов семейства NF- B/Rel Неактивная цитоплазматичекая форма комплекс I B с NF- B После стимуляции активный NF- B быстро переходит в ядро, где связывается с B-сайтами и активирует гены-мишени. Быстрый эффект - минуты Сигнал активный NF- B активирование иммунной защиты
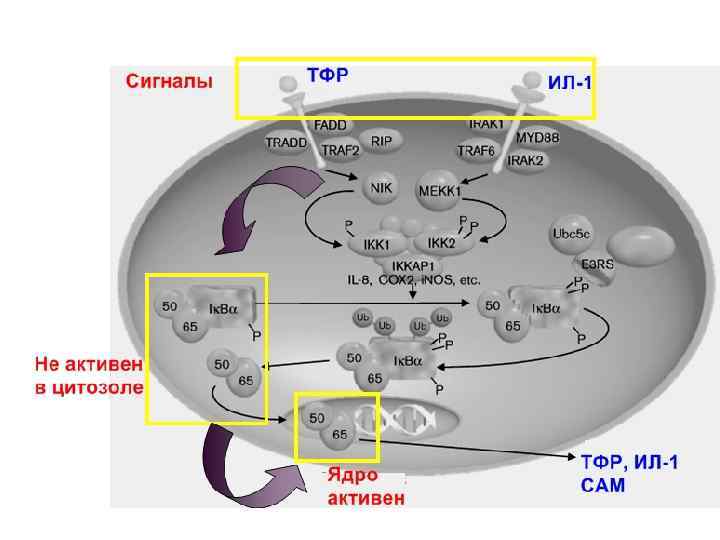

Семейства NF-k. B и Ik. B. Члены семейства NF-k. B содержат высококонсервативный в приблизительно 300 аминокислот, Nтерминальный домен гомологичный Rel (черный прямоугольник). Этот домен опосредует димеризацию членов семейства NFk. B, связывание с ДНК, и с ингибитором Ik. B и также содержит ядерный сигнал локализации. Члены семейства Ik. B содержат многочисленные анкириновые повторы. . Они способствуют специфическому связыванию с димеризированными иммуноглобулиноподоб ными участками доменов гомологичных Rel NF-k. B. GRR богатая глицином область p 100 и p 105; LZ - домен лейциновых застежек-молний домена Rel. B.
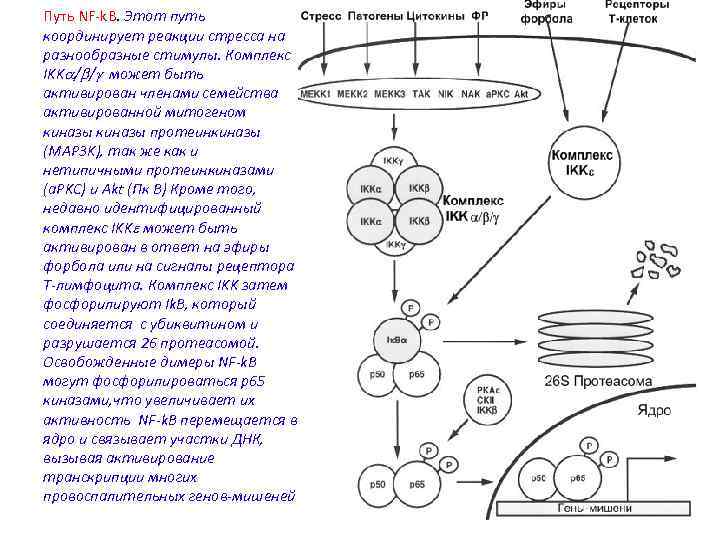
Путь NF-k. B. Этот путь координирует реакции стресса на разнообразные стимулы. Комплекс IKKa/b/g может быть активирован членами семейства активированной митогеном киназы протеинкиназы (MAP 3 K), так же как и нетипичными протеинкиназами (a. PKC) и Akt (Пк B) Кроме того, недавно идентифицированный комплекс IKKe может быть активирован в ответ на эфиры форбола или на сигналы рецептора Т-лимфоцита. Комплекс IKK затем фосфорилируют Ik. B, который соединяется с убиквитином и разрушается 26 протеасомой. Освобожденные димеры NF-k. B могут фосфорилироваться p 65 киназами, что увеличивает их активность NF-k. B перемещаетcя в ядро и связывает участки ДНК, вызывая активирование транскрипции многих провоспалительных генов-мишеней
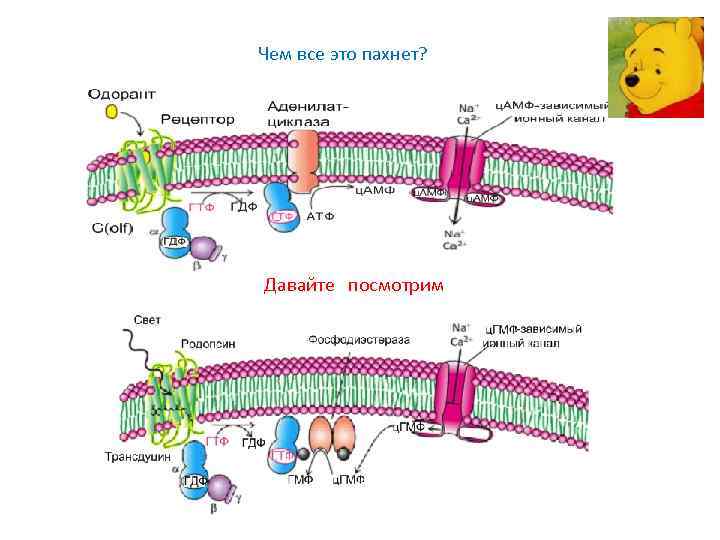
Чем все это пахнет? Давайте посмотрим
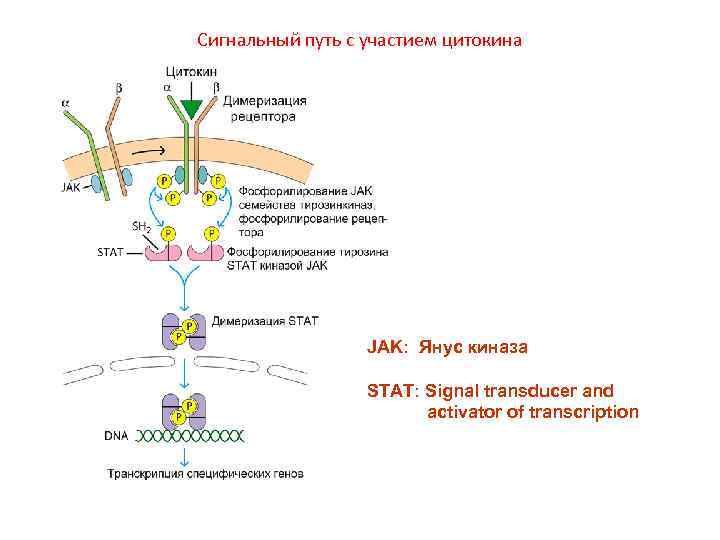
Сигнальный путь с участием цитокина JAK: Янус киназа STAT: Signal transducer and activator of transcription
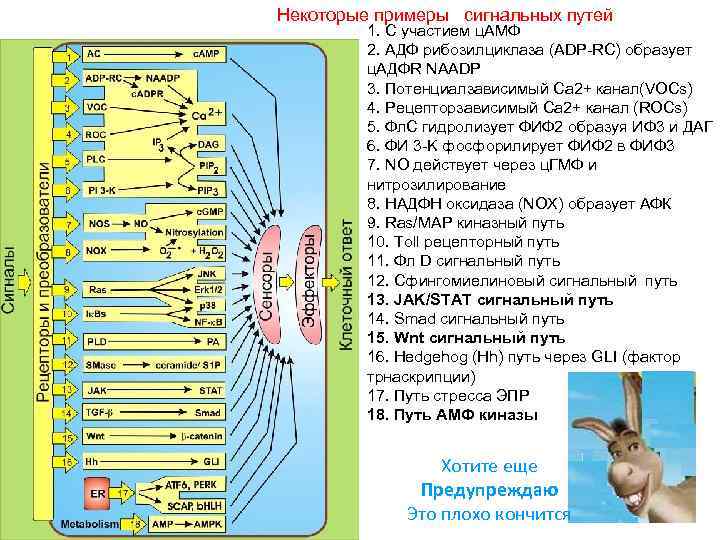
Некоторые примеры сигнальных путей 1. С участием ц. АМФ 2. AДФ рибозилциклаза (ADP-RC) образует ц. AДФR NAADP 3. Потенциалзависимый Ca 2+ канал(VOCs) 4. Рецепторзависимый Ca 2+ канал (ROCs) 5. Фл. С гидролизует ФИФ 2 образуя ИФ 3 и ДАГ 6. ФИ 3 -K фосфорилирует ФИФ 2 в ФИФ 3 7. NO действует через ц. ГМФ и нитрозилирование 8. НАДФH оксидаза (NOX) образует АФК 9. Ras/MAP киназный путь 10. Toll рецепторный путь 11. Фл D сигнальный путь 12. Сфингомиелиновый сигнальный путь 13. JAK/STAT сигнальный путь 14. Smad сигнальный путь 15. Wnt сигнальный путь 16. Hedgehog (Hh) путь через GLI (фактор трнаскрипции) 17. Путь стресса ЭПР 18. Путь AMФ киназы Хотите еще Предупреждаю Это плохо кончится


БЕРЕГИТЕ СЕБЯ СПАСИБО за ВНИМАНИЕ
Cell_cell_comm.ppt