Мин._ткани.ppt
- Количество слайдов: 51
 Внеклеточный матрикс – основа минерализованных тканей Автор – доцент кафедры биохимии Е. А. Рыскина
Внеклеточный матрикс – основа минерализованных тканей Автор – доцент кафедры биохимии Е. А. Рыскина
 Минерализованные ткани. • Минерализованные ткани представлены в организме костью, цементом, дентином и эмалью. • Как и другие виды соединительной ткани, минерализованные ткани содержат небольшое количество клеток (остеобластов, остеоцитов и остеокластов) и большое межклеточное пространство (внеклеточный матрикс - ВКМ).
Минерализованные ткани. • Минерализованные ткани представлены в организме костью, цементом, дентином и эмалью. • Как и другие виды соединительной ткани, минерализованные ткани содержат небольшое количество клеток (остеобластов, остеоцитов и остеокластов) и большое межклеточное пространство (внеклеточный матрикс - ВКМ).
 Все минеральные ткани различаются по содержанию воды, минеральных и органических компонентов (Т. П. Вавилова, 2008 г. ) Ткань Эмаль Минераль-е Органич-е вещества% 95 1, 2 Вода% 3, 8 Дентин 70 20 10 Цемент 65 25 10 Кость 45 30 25
Все минеральные ткани различаются по содержанию воды, минеральных и органических компонентов (Т. П. Вавилова, 2008 г. ) Ткань Эмаль Минераль-е Органич-е вещества% 95 1, 2 Вода% 3, 8 Дентин 70 20 10 Цемент 65 25 10 Кость 45 30 25
 Внеклеточный матрикс образуют макромолекулы двух основных классов – белки и полисахариды. • В состав внеклеточного матрикса входят белки двух типов: структурные и адгезивные. • Структурные белки представлены двумя видами белков - коллагеном и эластином. К адгезивным белкам относятся фибронектин, остеопонтин и др. • Полисахариды – гликозамингликаны (ГАГ), могут быть в свободном виде и в связанном с белками (протеогликаны)
Внеклеточный матрикс образуют макромолекулы двух основных классов – белки и полисахариды. • В состав внеклеточного матрикса входят белки двух типов: структурные и адгезивные. • Структурные белки представлены двумя видами белков - коллагеном и эластином. К адгезивным белкам относятся фибронектин, остеопонтин и др. • Полисахариды – гликозамингликаны (ГАГ), могут быть в свободном виде и в связанном с белками (протеогликаны)
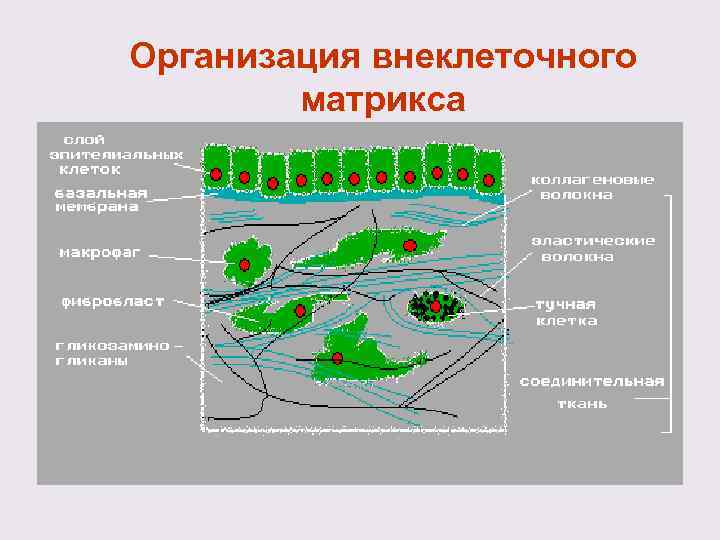 Организация внеклеточного матрикса
Организация внеклеточного матрикса
 Коллаген – основной структурный белок минерализованной ткани • Коллагены составляют приблизительно 30 % общего количества белка в организме, синтезируется клетками соединительной ткани. • Молекулы коллагенов имеют трехспиральную структуру, полученную при скручивании трех полипептидных цепей, названных α – цепями. Отдельные цепи связаны между собой водородными связями. Количество аминокислот в каждой из α – цепей около 1000.
Коллаген – основной структурный белок минерализованной ткани • Коллагены составляют приблизительно 30 % общего количества белка в организме, синтезируется клетками соединительной ткани. • Молекулы коллагенов имеют трехспиральную структуру, полученную при скручивании трех полипептидных цепей, названных α – цепями. Отдельные цепи связаны между собой водородными связями. Количество аминокислот в каждой из α – цепей около 1000.
![Особенности аминокислотного состава коллагена • Полипептидная цепь коллагена состоит из повторяющихся триплетов: [Гли-Х-Y], Где Особенности аминокислотного состава коллагена • Полипептидная цепь коллагена состоит из повторяющихся триплетов: [Гли-Х-Y], Где](https://present5.com/presentation/168068890_151065579/image-7.jpg) Особенности аминокислотного состава коллагена • Полипептидная цепь коллагена состоит из повторяющихся триплетов: [Гли-Х-Y], Где Гли – глицин, Х и Y могут быть любыми аминокислотами, но чаще всего: Х –пролин или аланин Y - гидроксипролин или гидроксилизин. Коллаген содержит 33% глицина. На рисунке аминокислотные остатки глицина окрашены в черный цвет, а других аминокислот – в белый.
Особенности аминокислотного состава коллагена • Полипептидная цепь коллагена состоит из повторяющихся триплетов: [Гли-Х-Y], Где Гли – глицин, Х и Y могут быть любыми аминокислотами, но чаще всего: Х –пролин или аланин Y - гидроксипролин или гидроксилизин. Коллаген содержит 33% глицина. На рисунке аминокислотные остатки глицина окрашены в черный цвет, а других аминокислот – в белый.
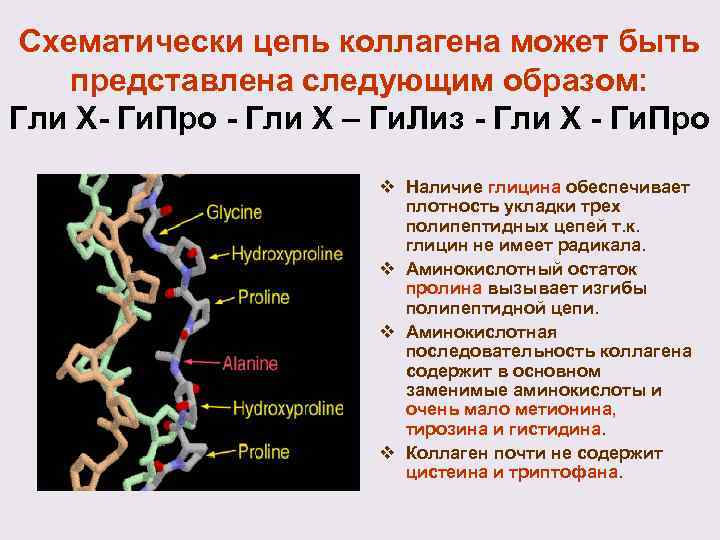 Схематически цепь коллагена может быть представлена следующим образом: Гли Х- Ги. Про - Гли X – Ги. Лиз - Гли X - Ги. Про v Наличие глицина обеспечивает плотность укладки трех полипептидных цепей т. к. глицин не имеет радикала. v Аминокислотный остаток пролина вызывает изгибы полипептидной цепи. v Аминокислотная последовательность коллагена содержит в основном заменимые аминокислоты и очень мало метионина, тирозина и гистидина. v Коллаген почти не содержит цистеина и триптофана.
Схематически цепь коллагена может быть представлена следующим образом: Гли Х- Ги. Про - Гли X – Ги. Лиз - Гли X - Ги. Про v Наличие глицина обеспечивает плотность укладки трех полипептидных цепей т. к. глицин не имеет радикала. v Аминокислотный остаток пролина вызывает изгибы полипептидной цепи. v Аминокислотная последовательность коллагена содержит в основном заменимые аминокислоты и очень мало метионина, тирозина и гистидина. v Коллаген почти не содержит цистеина и триптофана.
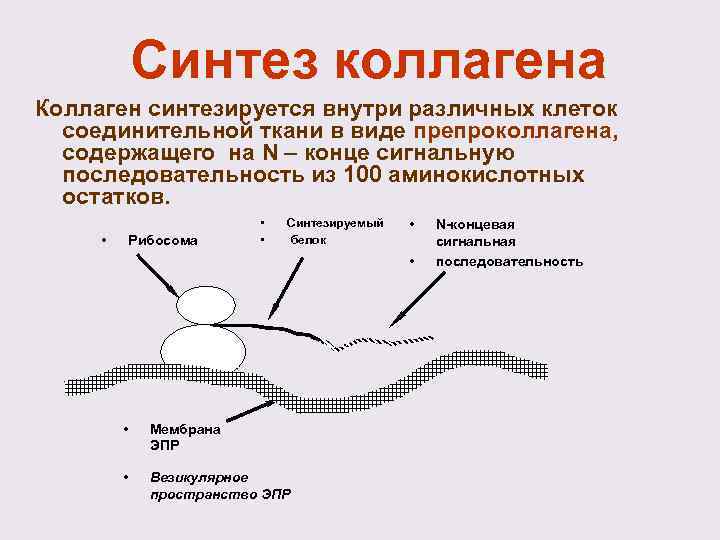 Синтез коллагена Коллаген синтезируется внутри различных клеток соединительной ткани в виде препроколлагена, содержащего на N – конце сигнальную последовательность из 100 аминокислотных остатков. • Рибосома • • Синтезируемый белок • • • Мембрана ЭПР • Везикулярное пространство ЭПР N-концевая сигнальная последовательность
Синтез коллагена Коллаген синтезируется внутри различных клеток соединительной ткани в виде препроколлагена, содержащего на N – конце сигнальную последовательность из 100 аминокислотных остатков. • Рибосома • • Синтезируемый белок • • • Мембрана ЭПР • Везикулярное пространство ЭПР N-концевая сигнальная последовательность
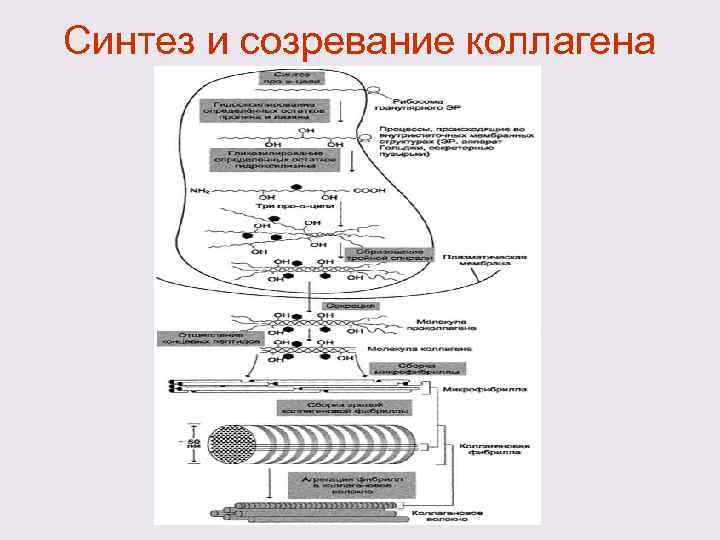
 Созревание коллагена После синтеза цепи коллагена следует сложный многоступенчатый процесс - созревания коллагена, который включает 2 этапа: - внутриклеточный - внеклеточный На первом этапе происходит пострансляционная модификация полипептидных цепей препроколлагена. Во втором этапе – образуются зрелые коллагеновые волокна.
Созревание коллагена После синтеза цепи коллагена следует сложный многоступенчатый процесс - созревания коллагена, который включает 2 этапа: - внутриклеточный - внеклеточный На первом этапе происходит пострансляционная модификация полипептидных цепей препроколлагена. Во втором этапе – образуются зрелые коллагеновые волокна.
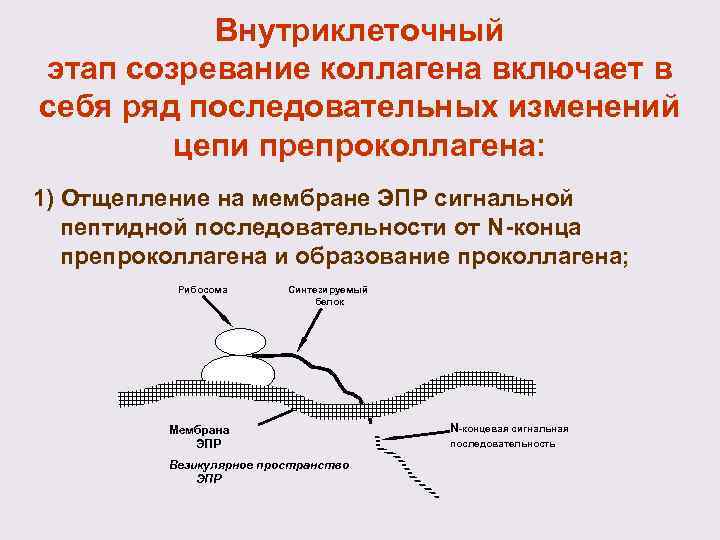 Внутриклеточный этап созревание коллагена включает в себя ряд последовательных изменений цепи препроколлагена: 1) Отщепление на мембране ЭПР сигнальной пептидной последовательности от N-конца препроколлагена и образование проколлагена; Рибосома Синтезируемый белок Мембрана ЭПР Везикулярное пространство ЭПР N-концевая сигнальная последовательность
Внутриклеточный этап созревание коллагена включает в себя ряд последовательных изменений цепи препроколлагена: 1) Отщепление на мембране ЭПР сигнальной пептидной последовательности от N-конца препроколлагена и образование проколлагена; Рибосома Синтезируемый белок Мембрана ЭПР Везикулярное пространство ЭПР N-концевая сигнальная последовательность
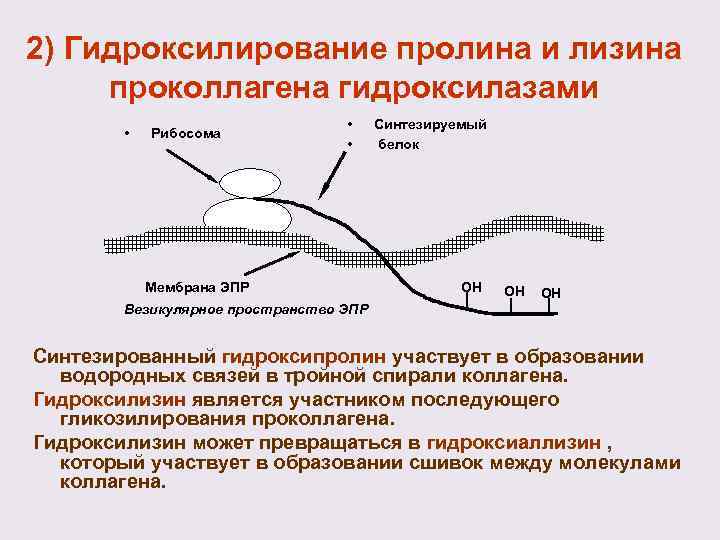 2) Гидроксилирование пролина и лизина проколлагена гидроксилазами • Рибосома • • Мембрана ЭПР Синтезируемый белок ОН ОН ОН Везикулярное пространство ЭПР Синтезированный гидроксипролин участвует в образовании водородных связей в тройной спирали коллагена. Гидроксилизин является участником последующего гликозилирования проколлагена. Гидроксилизин может превращаться в гидроксиаллизин , который участвует в образовании сшивок между молекулами коллагена.
2) Гидроксилирование пролина и лизина проколлагена гидроксилазами • Рибосома • • Мембрана ЭПР Синтезируемый белок ОН ОН ОН Везикулярное пространство ЭПР Синтезированный гидроксипролин участвует в образовании водородных связей в тройной спирали коллагена. Гидроксилизин является участником последующего гликозилирования проколлагена. Гидроксилизин может превращаться в гидроксиаллизин , который участвует в образовании сшивок между молекулами коллагена.
 Гидроксилазам необходим атом двухвалентного железа и его восстановитель - витамин С (аскорбат)
Гидроксилазам необходим атом двухвалентного железа и его восстановитель - витамин С (аскорбат)
 3) Гликозилирование аминокислотных остатков гидроксилизина • Под действием гликозилтрансфераз. Углеводные остатки связываются с ОНгруппами гидроксилина О-гликозидными связями. Чаще всего углеводными компонентами являются глюкоза или дисахарид галактозилглюкоза.
3) Гликозилирование аминокислотных остатков гидроксилизина • Под действием гликозилтрансфераз. Углеводные остатки связываются с ОНгруппами гидроксилина О-гликозидными связями. Чаще всего углеводными компонентами являются глюкоза или дисахарид галактозилглюкоза.
 4) Формирование тройной спирали проколлагена Каждая пептидная цепь проколлагена соединяется водородными связями с двумя другими. Образуются дисульфидные связи внутри- и между полипептидных цепей. Внутрицепочечные дисульфидные связи возникают между аминокислотными остатками цистеина на С- и N-концах молекулы проколлагена. Таким образом, формируется тройная спираль проколлагена, который секретируется из клетки.
4) Формирование тройной спирали проколлагена Каждая пептидная цепь проколлагена соединяется водородными связями с двумя другими. Образуются дисульфидные связи внутри- и между полипептидных цепей. Внутрицепочечные дисульфидные связи возникают между аминокислотными остатками цистеина на С- и N-концах молекулы проколлагена. Таким образом, формируется тройная спираль проколлагена, который секретируется из клетки.
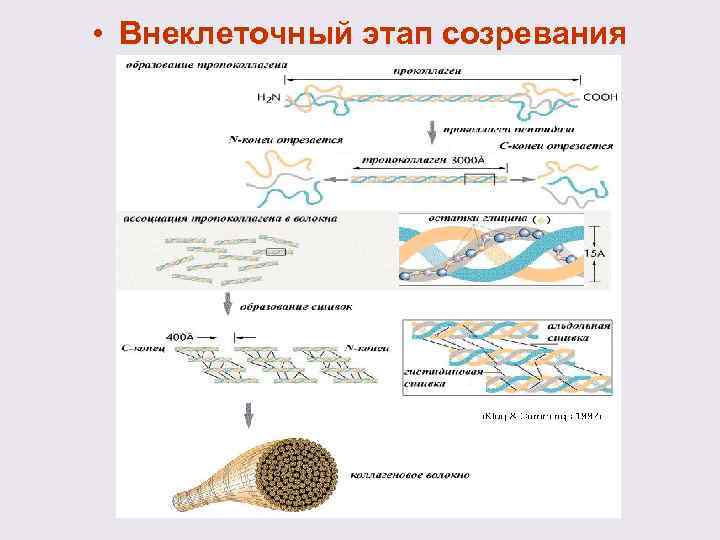
 Внеклеточный этап созревания включает в себя ряд последовательных изменений 1) Отщепление от проколлагена N – и С – концевых пептидов специфическими протеиназами. В результате образуется молекула тропоколлагена – палочкообразнаая молекула. Между цепями в тримерной молекуле тропоколлагена возникают дисульфидные связи.
Внеклеточный этап созревания включает в себя ряд последовательных изменений 1) Отщепление от проколлагена N – и С – концевых пептидов специфическими протеиназами. В результате образуется молекула тропоколлагена – палочкообразнаая молекула. Между цепями в тримерной молекуле тропоколлагена возникают дисульфидные связи.
 2) Формирование фибрилл незрелого коллагена Особенностью структурной организации фибрилл является параллельное расположение тройных спиралей тропоколлагена, причем на стыках молекулы тропоколлагена не примыкают другу вплотную, между ними остаются промежутки длиной в 35 -40 нм. Молекулы сдвинуты относительно друга на ¼ своей длины, что составляет приблизительно 67 нм. Такое расположение повышает прочность на растяжение.
2) Формирование фибрилл незрелого коллагена Особенностью структурной организации фибрилл является параллельное расположение тройных спиралей тропоколлагена, причем на стыках молекулы тропоколлагена не примыкают другу вплотную, между ними остаются промежутки длиной в 35 -40 нм. Молекулы сдвинуты относительно друга на ¼ своей длины, что составляет приблизительно 67 нм. Такое расположение повышает прочность на растяжение.
 3) Превращения незрелых фибрилл в зрелые путем формирования сшивок между полипептидными цепями • Чтобы обеспечить создание укрепляющих связей фермент лизилоксидаза катализирует реакцию превращения в коллагене аминогрупп отдельных лизильных и гидроксилизильных остатков в альдегидные группы и образование аллизина. • Остаток лизина Остаток аллизина
3) Превращения незрелых фибрилл в зрелые путем формирования сшивок между полипептидными цепями • Чтобы обеспечить создание укрепляющих связей фермент лизилоксидаза катализирует реакцию превращения в коллагене аминогрупп отдельных лизильных и гидроксилизильных остатков в альдегидные группы и образование аллизина. • Остаток лизина Остаток аллизина
 • Возникшие в результате реакции окислительного дезаминирования альдегидные группы участвуют в образовании внутри- и межмолекулярных связей, которые стабилизируют фибриллы коллагена. • Альдольная конденсация двух аллизиновых остатков приводит к формированию сшивки лизин-норлейцин (см. схему - а), а путем взаимодействия лизильного и альлизильного остатков образуются альдиминные связи, называемые также основаниями Шиффа (см. схему -б):
• Возникшие в результате реакции окислительного дезаминирования альдегидные группы участвуют в образовании внутри- и межмолекулярных связей, которые стабилизируют фибриллы коллагена. • Альдольная конденсация двух аллизиновых остатков приводит к формированию сшивки лизин-норлейцин (см. схему - а), а путем взаимодействия лизильного и альлизильного остатков образуются альдиминные связи, называемые также основаниями Шиффа (см. схему -б):
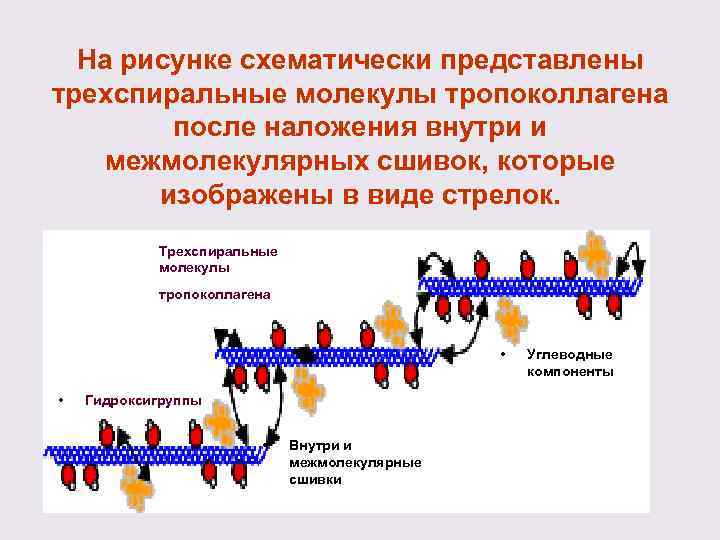 На рисунке схематически представлены трехспиральные молекулы тропоколлагена после наложения внутри и межмолекулярных сшивок, которые изображены в виде стрелок. Трехспиральные молекулы тропоколлагена • • Гидроксигруппы • Внутри и межмолекулярные сшивки Углеводные компоненты
На рисунке схематически представлены трехспиральные молекулы тропоколлагена после наложения внутри и межмолекулярных сшивок, которые изображены в виде стрелок. Трехспиральные молекулы тропоколлагена • • Гидроксигруппы • Внутри и межмолекулярные сшивки Углеводные компоненты
 После превращения незрелых фибрилл в зрелые путем формирования сшивок, фибриллы укладываются параллельно другу (на схеме слева), и далее они объединяются в коллагеновое волокно (на схеме справа).
После превращения незрелых фибрилл в зрелые путем формирования сшивок, фибриллы укладываются параллельно другу (на схеме слева), и далее они объединяются в коллагеновое волокно (на схеме справа).
 • Внеклеточный этап созревания
• Внеклеточный этап созревания
 Синтез и созревание коллагена
Синтез и созревание коллагена
 Уникальные свойства коллагенов • Коллагеновые волокна обладают огромной прочностью и практически нерастяжимы. Они могут выдерживать нагрузку, в 10 000 раз превышающую их собственный вес. • По прочности коллагеновые волокна превосходят прочность стальной проволоки того же сечения. Именно поэтому большое количество коллагеновых волокон, состоящих из коллагеновых фибрилл, входит в состав кожи, сухожилий, хрящей и костей.
Уникальные свойства коллагенов • Коллагеновые волокна обладают огромной прочностью и практически нерастяжимы. Они могут выдерживать нагрузку, в 10 000 раз превышающую их собственный вес. • По прочности коллагеновые волокна превосходят прочность стальной проволоки того же сечения. Именно поэтому большое количество коллагеновых волокон, состоящих из коллагеновых фибрилл, входит в состав кожи, сухожилий, хрящей и костей.
 Типы коллагена • В настоящее время известно около 20 различных типов коллагена, различающихся по первичной структуре, пространственной организации и по биологической роли. • Различают два основных типа цепей коллагена: α 1 и α 2, а также четыре разновидности цепи α 1: α 1(I), α 1(III), α 1(IV). Для обозначения каждого вида коллагена пользуются формулой, Например: коллаген I типа - [α 1(I)]2 α 2
Типы коллагена • В настоящее время известно около 20 различных типов коллагена, различающихся по первичной структуре, пространственной организации и по биологической роли. • Различают два основных типа цепей коллагена: α 1 и α 2, а также четыре разновидности цепи α 1: α 1(I), α 1(III), α 1(IV). Для обозначения каждого вида коллагена пользуются формулой, Например: коллаген I типа - [α 1(I)]2 α 2
![Наиболее распространенные типы коллагенов. Тип Формула Распределение в Характерные тканях особенности I [α 1(I)]2 Наиболее распространенные типы коллагенов. Тип Формула Распределение в Характерные тканях особенности I [α 1(I)]2](https://present5.com/presentation/168068890_151065579/image-26.jpg) Наиболее распространенные типы коллагенов. Тип Формула Распределение в Характерные тканях особенности I [α 1(I)]2 α 2 Кожа, сухожилия, кости, дентин 1%-гидроксипролина 33%-глицина 13%-пролина Мало гликозилирован II [α 1(II)]3 Хрящи >1% гидроксилизина Сильно гликозилирован III [α 1(III)]3 Кожа, матка, десна, кровеносные сосуды Много гидроксипролина, мало гидроксилизина; Мало гликозилирован IV [α 1(IV)]2 α 2(IV) Базальные мембраны Очень много гидроксилизина, мало аланина и почти полностью гликозилирован
Наиболее распространенные типы коллагенов. Тип Формула Распределение в Характерные тканях особенности I [α 1(I)]2 α 2 Кожа, сухожилия, кости, дентин 1%-гидроксипролина 33%-глицина 13%-пролина Мало гликозилирован II [α 1(II)]3 Хрящи >1% гидроксилизина Сильно гликозилирован III [α 1(III)]3 Кожа, матка, десна, кровеносные сосуды Много гидроксипролина, мало гидроксилизина; Мало гликозилирован IV [α 1(IV)]2 α 2(IV) Базальные мембраны Очень много гидроксилизина, мало аланина и почти полностью гликозилирован
 Белки межклеточного матрикса минерализованных тканей • Белки составляют основу для прикрепления минералов и определяют процессы минерализации. • К белкам межклеточного матрикса относят коллагены и группу неколлагеновых белков, синтезируемых в основном остебластами. • Особенностью этих белков является наличие остатков фосфосерина, глутамата и аспартата, которые способны связывать кальций и таким образом участвовать в минерализации. • Второй особенностью является присутствие углеводов и последовательности аминокислотных остатков арг-гли-асп (RGD) в структуре белков, что обеспечивает их связывание с клетками и белками, формирующими межклеточный матрикс.
Белки межклеточного матрикса минерализованных тканей • Белки составляют основу для прикрепления минералов и определяют процессы минерализации. • К белкам межклеточного матрикса относят коллагены и группу неколлагеновых белков, синтезируемых в основном остебластами. • Особенностью этих белков является наличие остатков фосфосерина, глутамата и аспартата, которые способны связывать кальций и таким образом участвовать в минерализации. • Второй особенностью является присутствие углеводов и последовательности аминокислотных остатков арг-гли-асп (RGD) в структуре белков, что обеспечивает их связывание с клетками и белками, формирующими межклеточный матрикс.
 Неколлагеновые белки межклеточного матрикса Секреторные белки остеобластов Фибронектин, остеопонтин Функции Адгезивные белки Остеонектин, сиалопротеин кости Са 2+ - связывающие белки Остеокальцин Участвует в минерализации Ферменты - кислая и щелочная фосфатаза, коллагеназа Дефосфорилирование белков Протеолиз коллагена Факторы роста – инсулиноподоб- Регуляторные белки и ный и трансформирующий. факторы роста Цитокины: интерлейкины - 1 и 6 (IL-1, IL-6)
Неколлагеновые белки межклеточного матрикса Секреторные белки остеобластов Фибронектин, остеопонтин Функции Адгезивные белки Остеонектин, сиалопротеин кости Са 2+ - связывающие белки Остеокальцин Участвует в минерализации Ферменты - кислая и щелочная фосфатаза, коллагеназа Дефосфорилирование белков Протеолиз коллагена Факторы роста – инсулиноподоб- Регуляторные белки и ный и трансформирующий. факторы роста Цитокины: интерлейкины - 1 и 6 (IL-1, IL-6)
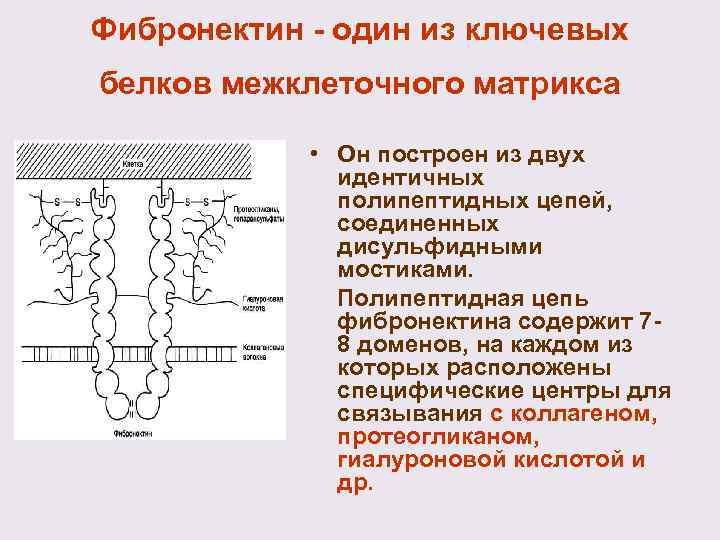 Фибронектин - один из ключевых белков межклеточного матрикса • Он построен из двух идентичных полипептидных цепей, соединенных дисульфидными мостиками. Полипептидная цепь фибронектина содержит 7 - 8 доменов, на каждом из которых расположены специфические центры для связывания с коллагеном, протеогликаном, гиалуроновой кислотой и др.
Фибронектин - один из ключевых белков межклеточного матрикса • Он построен из двух идентичных полипептидных цепей, соединенных дисульфидными мостиками. Полипептидная цепь фибронектина содержит 7 - 8 доменов, на каждом из которых расположены специфические центры для связывания с коллагеном, протеогликаном, гиалуроновой кислотой и др.
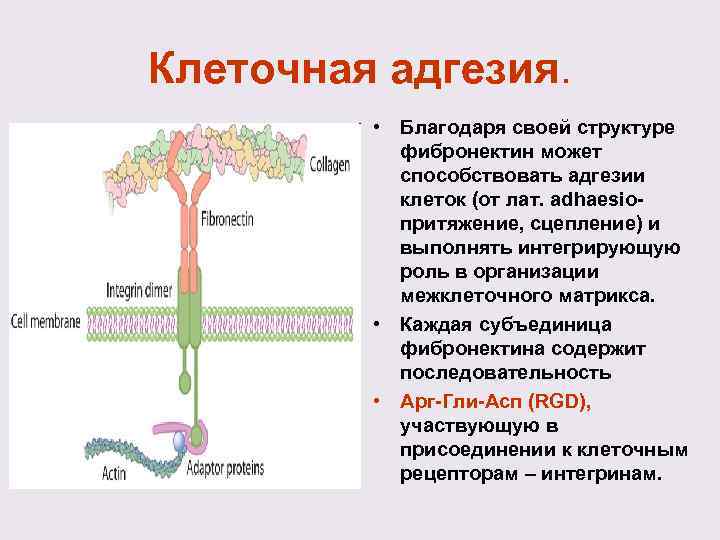 Клеточная адгезия. • Благодаря своей структуре фибронектин может способствовать адгезии клеток (от лат. adhaesioпритяжение, сцепление) и выполнять интегрирующую роль в организации межклеточного матрикса. • Каждая субъединица фибронектина содержит последовательность • Арг-Гли-Асп (RGD), участвующую в присоединении к клеточным рецепторам – интегринам.
Клеточная адгезия. • Благодаря своей структуре фибронектин может способствовать адгезии клеток (от лат. adhaesioпритяжение, сцепление) и выполнять интегрирующую роль в организации межклеточного матрикса. • Каждая субъединица фибронектина содержит последовательность • Арг-Гли-Асп (RGD), участвующую в присоединении к клеточным рецепторам – интегринам.
 Остеонектин • Остеонектин секретируется зрелыми остеобластами и остеоцитами, поэтому по количеству остеонектина в крови можно судить о степени дифференцировки костных клеток. Гликопротеин кости и дентина, содержит много аминокислотных остатков глутамата и аспартата. • Соединяется с коллагеном I типа через углеводный компонент. Может связываться с гидроксиапатитами. • Участки связывания молекулы остеонектина с гидроксиапатитами могут играть роль центров кристаллизации. • Остеонектин способствуют кальцификации, регулирует рост кристаллов гидроксиапатитов.
Остеонектин • Остеонектин секретируется зрелыми остеобластами и остеоцитами, поэтому по количеству остеонектина в крови можно судить о степени дифференцировки костных клеток. Гликопротеин кости и дентина, содержит много аминокислотных остатков глутамата и аспартата. • Соединяется с коллагеном I типа через углеводный компонент. Может связываться с гидроксиапатитами. • Участки связывания молекулы остеонектина с гидроксиапатитами могут играть роль центров кристаллизации. • Остеонектин способствуют кальцификации, регулирует рост кристаллов гидроксиапатитов.
 Gla-белки Белки содержащие остатки γ–карбоксиглутаминовой кислоты, образующиеся в результате посттрансляционной модификации глутамильных остатков полипептидной цепи называют Glaбелками. Аминокислотные остатки гамма-карбокси-глу, обладают повышенной способностью связывать ионы кальция (между карбоксильными группами). Коферментом в реакциях карбоксилирования глутамильных остатков является витамин К (поэтому недостаток витамина К приводит к нарушению минерализации).
Gla-белки Белки содержащие остатки γ–карбоксиглутаминовой кислоты, образующиеся в результате посттрансляционной модификации глутамильных остатков полипептидной цепи называют Glaбелками. Аминокислотные остатки гамма-карбокси-глу, обладают повышенной способностью связывать ионы кальция (между карбоксильными группами). Коферментом в реакциях карбоксилирования глутамильных остатков является витамин К (поэтому недостаток витамина К приводит к нарушению минерализации).
 Остеокальцин – представитель Gla-белков • Занимает второе место по содержанию в минерализованных тканях, низкомолекулярный белок, состоящий из 49 аминокислотных остатков, три из которых γ–карбоксиглутаминовая кислота (γ–Глу или Gla). • Остеокальцин предотвращает слишком быструю и избыточную минерализацию костной ткани, связывая иона кальция (уменьшается связывание кальция с остеонектином и замедляется образование центров кристаллизации). • На рисунке показана структура остеокальцина. Ионы кальция показаны в виде фиолетовых сфер.
Остеокальцин – представитель Gla-белков • Занимает второе место по содержанию в минерализованных тканях, низкомолекулярный белок, состоящий из 49 аминокислотных остатков, три из которых γ–карбоксиглутаминовая кислота (γ–Глу или Gla). • Остеокальцин предотвращает слишком быструю и избыточную минерализацию костной ткани, связывая иона кальция (уменьшается связывание кальция с остеонектином и замедляется образование центров кристаллизации). • На рисунке показана структура остеокальцина. Ионы кальция показаны в виде фиолетовых сфер.
 Gla – протеин матрикса В составе Gla – протеина присутствуют 5 остатков γ – карбоксиглутаминовой кислоты, с помощью которых он участвует в кальций – зависимом взаимодействии с полярными головками липидов мембран остеокластов. Gla – протеин, активирует остеокласты и снижает скорость минерализации.
Gla – протеин матрикса В составе Gla – протеина присутствуют 5 остатков γ – карбоксиглутаминовой кислоты, с помощью которых он участвует в кальций – зависимом взаимодействии с полярными головками липидов мембран остеокластов. Gla – протеин, активирует остеокласты и снижает скорость минерализации.
 Остеопонтин • Остеопонтин – адгезивный белок, содержит участки, богатые аспарагином, которые могут связываться с гидроксиапатитами. • В центре белковой молекулы находиться фрагмент • Арг-Глу-Асп (RGD-последовательность) для связи с интегринами остеокластов. • Взаимодействие с остеопонтином стимулирует прикрепление остеокластов к поверхности кости в участках физиологического и репаративного костеобразования.
Остеопонтин • Остеопонтин – адгезивный белок, содержит участки, богатые аспарагином, которые могут связываться с гидроксиапатитами. • В центре белковой молекулы находиться фрагмент • Арг-Глу-Асп (RGD-последовательность) для связи с интегринами остеокластов. • Взаимодействие с остеопонтином стимулирует прикрепление остеокластов к поверхности кости в участках физиологического и репаративного костеобразования.
 Сиалопротеин кости • Гликопротеин, содержит сиаловые кислоты и RGD-последовательность для связи с интегринами остеокластов. • Участвует в процессах резорбции кости, кальцификации воспаленных и поврежденных тканей, тормозит рост гидроксиапатитов.
Сиалопротеин кости • Гликопротеин, содержит сиаловые кислоты и RGD-последовательность для связи с интегринами остеокластов. • Участвует в процессах резорбции кости, кальцификации воспаленных и поврежденных тканей, тормозит рост гидроксиапатитов.
 Ферменты - щелочная и кислая фосфатазы • Щелочная фосфатаза – проявляет активность только на стадии минерализации т. к. на этой стадии создается оптимум р. Н (9, 6) для этого фермента. • ЩФ катализирует реакции дефосфорилирования, тем самым повышает концентрацию фосфатных остатков, которые способствуют образованию центров кристаллизации и формированию гидроксиапатитов. Кислая фосфатаза - катализирует реакции дефосфорилирования остеопонтина и сиалопротеин кости в кислой среде, тем самым нарушают прикрепления остеокластов к поверхности кости и замедляет скорость резорбции.
Ферменты - щелочная и кислая фосфатазы • Щелочная фосфатаза – проявляет активность только на стадии минерализации т. к. на этой стадии создается оптимум р. Н (9, 6) для этого фермента. • ЩФ катализирует реакции дефосфорилирования, тем самым повышает концентрацию фосфатных остатков, которые способствуют образованию центров кристаллизации и формированию гидроксиапатитов. Кислая фосфатаза - катализирует реакции дефосфорилирования остеопонтина и сиалопротеин кости в кислой среде, тем самым нарушают прикрепления остеокластов к поверхности кости и замедляет скорость резорбции.
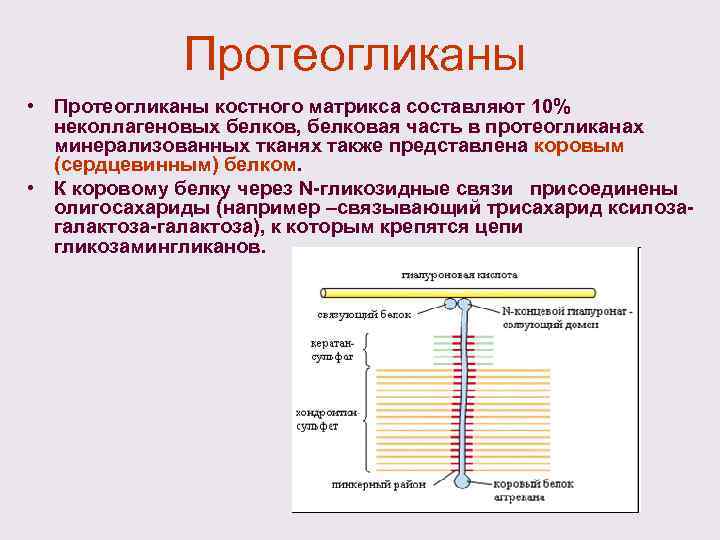 Протеогликаны • Протеогликаны костного матрикса составляют 10% неколлагеновых белков, белковая часть в протеогликанах минерализованных тканях также представлена коровым (сердцевинным) белком. • К коровому белку через N-гликозидные связи присоединены олигосахариды (например –связывающий трисахарид ксилозагалактоза-галактоза), к которым крепятся цепи гликозамингликанов.
Протеогликаны • Протеогликаны костного матрикса составляют 10% неколлагеновых белков, белковая часть в протеогликанах минерализованных тканях также представлена коровым (сердцевинным) белком. • К коровому белку через N-гликозидные связи присоединены олигосахариды (например –связывающий трисахарид ксилозагалактоза-галактоза), к которым крепятся цепи гликозамингликанов.
 Протеогликаны можно разделить на большие и малые. • К большим протеогликанам относят белки с большой молекулярной массой, содержащие свыше 100 цепей гликозамингликанов. • В эту группу входят агрекан, версикан и др. Они могут связываться с коллагенами и гиалуроновой кислотой и образовывать протеогликановые агрегаты. • В цементе зуба, костной ткани и коже присутствует – версикан, для матрикса хрящевой ткани характерен – агреган.
Протеогликаны можно разделить на большие и малые. • К большим протеогликанам относят белки с большой молекулярной массой, содержащие свыше 100 цепей гликозамингликанов. • В эту группу входят агрекан, версикан и др. Они могут связываться с коллагенами и гиалуроновой кислотой и образовывать протеогликановые агрегаты. • В цементе зуба, костной ткани и коже присутствует – версикан, для матрикса хрящевой ткани характерен – агреган.
 Схема агрегатов протеогликанов.
Схема агрегатов протеогликанов.
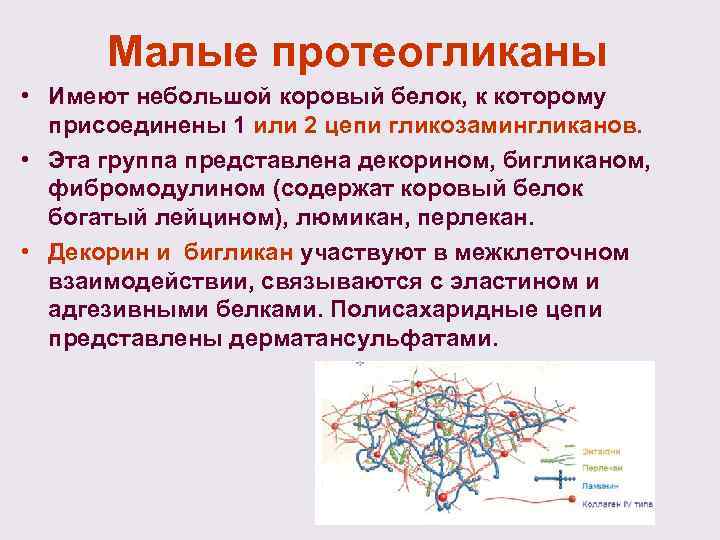 Малые протеогликаны • Имеют небольшой коровый белок, к которому присоединены 1 или 2 цепи гликозамингликанов. • Эта группа представлена декорином, бигликаном, фибромодулином (содержат коровый белок богатый лейцином), люмикан, перлекан. • Декорин и бигликан участвуют в межклеточном взаимодействии, связываются с эластином и адгезивными белками. Полисахаридные цепи представлены дерматансульфатами.
Малые протеогликаны • Имеют небольшой коровый белок, к которому присоединены 1 или 2 цепи гликозамингликанов. • Эта группа представлена декорином, бигликаном, фибромодулином (содержат коровый белок богатый лейцином), люмикан, перлекан. • Декорин и бигликан участвуют в межклеточном взаимодействии, связываются с эластином и адгезивными белками. Полисахаридные цепи представлены дерматансульфатами.
 Гликозаминогликаны (ГАГ) • Это линейные структуры, состоят из повторяющихся дисахаридных фрагментов. • Гликозамингликаны делят на 2 группы: сульфатированные и несульфатированные (глюкуроновая кислота). • Больше всего в межклеточном матриксе костной ткани содержится сульфатированных гликозамингликанов, таких как: • Хондроитинсульфаты, • Кератинсульфаты, • Дерматансульфаты.
Гликозаминогликаны (ГАГ) • Это линейные структуры, состоят из повторяющихся дисахаридных фрагментов. • Гликозамингликаны делят на 2 группы: сульфатированные и несульфатированные (глюкуроновая кислота). • Больше всего в межклеточном матриксе костной ткани содержится сульфатированных гликозамингликанов, таких как: • Хондроитинсульфаты, • Кератинсульфаты, • Дерматансульфаты.
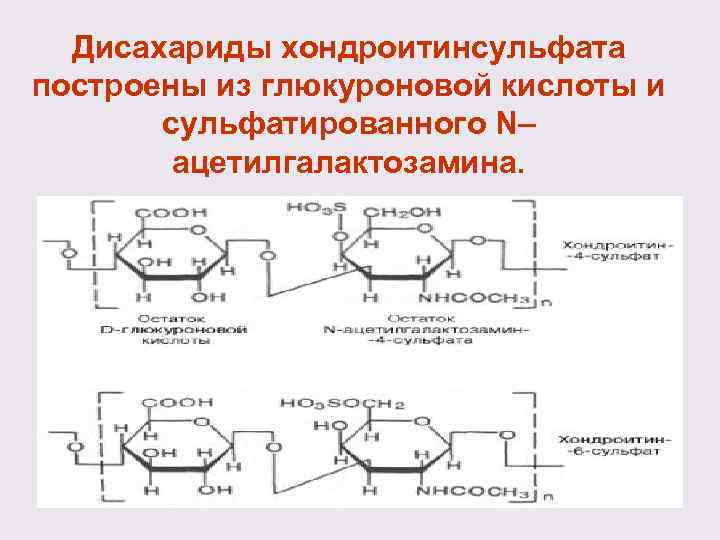 Дисахариды хондроитинсульфата построены из глюкуроновой кислоты и сульфатированного N– ацетилгалактозамина.
Дисахариды хондроитинсульфата построены из глюкуроновой кислоты и сульфатированного N– ацетилгалактозамина.
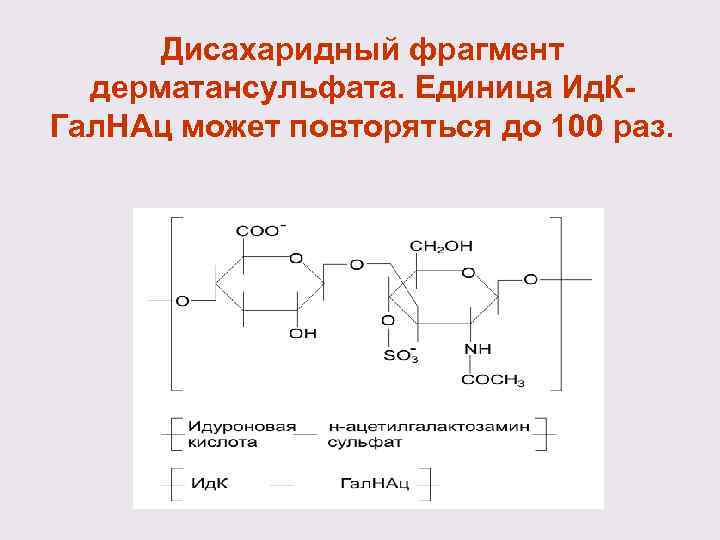 Дисахаридный фрагмент дерматансульфата. Единица Ид. К- Гал. НАц может повторяться до 100 раз.
Дисахаридный фрагмент дерматансульфата. Единица Ид. К- Гал. НАц может повторяться до 100 раз.
 Дисахариды кератинсульфата состоят из галактозы и сульфатированного N– ацетилглюкозамина.
Дисахариды кератинсульфата состоят из галактозы и сульфатированного N– ацетилглюкозамина.
 Функции гликоамингликанов • Молекулы ГАГ и протеингликанов образуют гидратированную гелеподобную среду, в которую погружены фибриллярные белки. • Гликозамингликаны могут связывать большое количество воды, сильно набухают, тем самым придают межклеточному матриксу высокую вязкость (желеобразные свойства). • Гиалуроновая кислота в суставной жидкости выполняет роль смазочного вещества, уменьшая трение между суставными поверхностями.
Функции гликоамингликанов • Молекулы ГАГ и протеингликанов образуют гидратированную гелеподобную среду, в которую погружены фибриллярные белки. • Гликозамингликаны могут связывать большое количество воды, сильно набухают, тем самым придают межклеточному матриксу высокую вязкость (желеобразные свойства). • Гиалуроновая кислота в суставной жидкости выполняет роль смазочного вещества, уменьшая трение между суставными поверхностями.
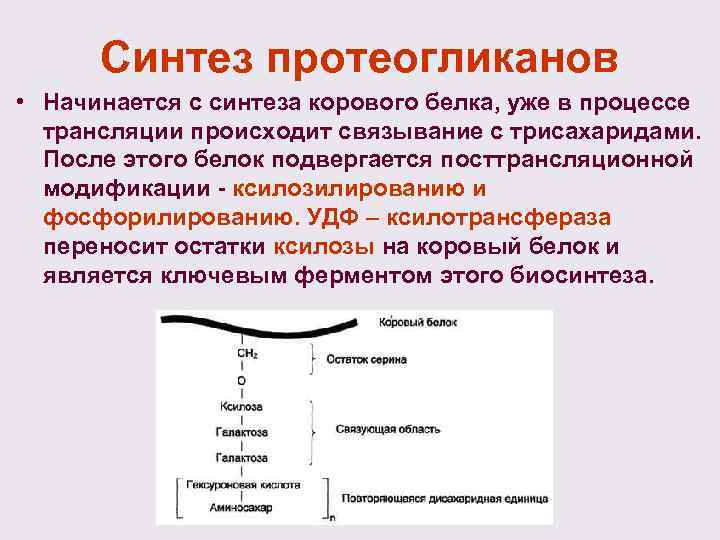 Синтез протеогликанов • Начинается с синтеза корового белка, уже в процессе трансляции происходит связывание с трисахаридами. После этого белок подвергается посттрансляционной модификации - ксилозилированию и фосфорилированию. УДФ – ксилотрансфераза переносит остатки ксилозы на коровый белок и является ключевым ферментом этого биосинтеза.
Синтез протеогликанов • Начинается с синтеза корового белка, уже в процессе трансляции происходит связывание с трисахаридами. После этого белок подвергается посттрансляционной модификации - ксилозилированию и фосфорилированию. УДФ – ксилотрансфераза переносит остатки ксилозы на коровый белок и является ключевым ферментом этого биосинтеза.
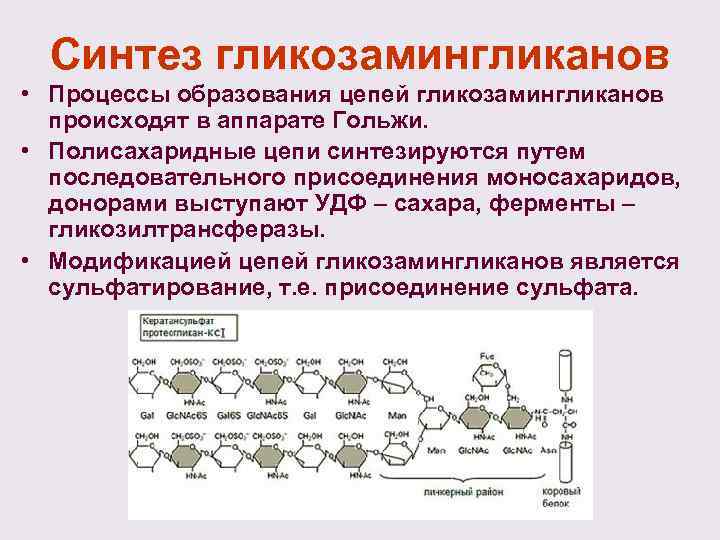 Синтез гликозамингликанов • Процессы образования цепей гликозамингликанов происходят в аппарате Гольжи. • Полисахаридные цепи синтезируются путем последовательного присоединения моносахаридов, донорами выступают УДФ – сахара, ферменты – гликозилтрансферазы. • Модификацией цепей гликозамингликанов является сульфатирование, т. е. присоединение сульфата.
Синтез гликозамингликанов • Процессы образования цепей гликозамингликанов происходят в аппарате Гольжи. • Полисахаридные цепи синтезируются путем последовательного присоединения моносахаридов, донорами выступают УДФ – сахара, ферменты – гликозилтрансферазы. • Модификацией цепей гликозамингликанов является сульфатирование, т. е. присоединение сульфата.
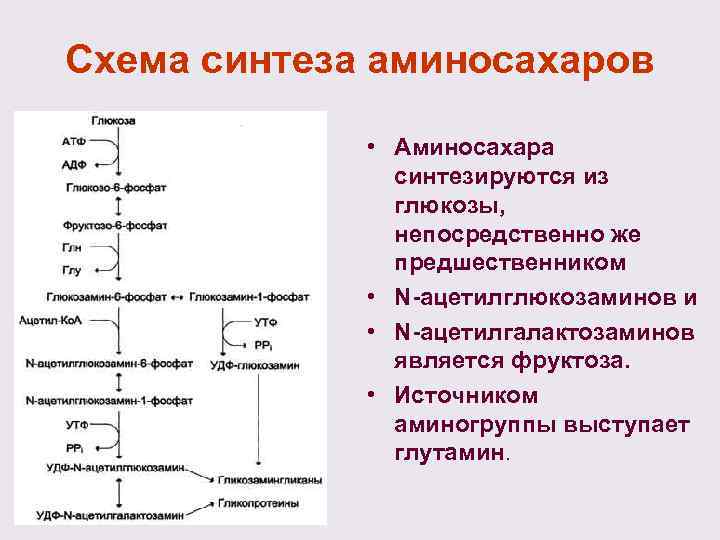 Схема синтеза аминосахаров • Аминосахара синтезируются из глюкозы, непосредственно же предшественником • N-ацетилглюкозаминов и • N-ацетилгалактозаминов является фруктоза. • Источником аминогруппы выступает глутамин.
Схема синтеза аминосахаров • Аминосахара синтезируются из глюкозы, непосредственно же предшественником • N-ацетилглюкозаминов и • N-ацетилгалактозаминов является фруктоза. • Источником аминогруппы выступает глутамин.
 Распад протеогликанов • Все высокополимерные протеингликаны расщепляются на фрагменты, а затем подвергаются внутриклеточной деградации. • В деградации протеогликанов участвуют протеиназы и гликозидазы. Сначала коровый и связывающий белки гидролизуются металлопротеиназами – коллагеназой, желатиназой и др. • Разрушение гликозамингликановых цепей происходит в лизосомах под действием гликозидаз (глюкуронидазы, Nацетилгалактозаминидазы и др. ). • В итоге образуются моносахариды.
Распад протеогликанов • Все высокополимерные протеингликаны расщепляются на фрагменты, а затем подвергаются внутриклеточной деградации. • В деградации протеогликанов участвуют протеиназы и гликозидазы. Сначала коровый и связывающий белки гидролизуются металлопротеиназами – коллагеназой, желатиназой и др. • Разрушение гликозамингликановых цепей происходит в лизосомах под действием гликозидаз (глюкуронидазы, Nацетилгалактозаминидазы и др. ). • В итоге образуются моносахариды.
 • Спасибо за внимание
• Спасибо за внимание


