вирусы итд.pptx
- Количество слайдов: 94
 Вирусы парагриппа и респираторносинцитиальный вирус Выполнили: Ковалевская И. Гераськина Е. 346 гр.
Вирусы парагриппа и респираторносинцитиальный вирус Выполнили: Ковалевская И. Гераськина Е. 346 гр.
 Вирусы парагриппа Парагрипп - антропонозная острая респираторная вирусная инфекция. Характеризуется умеренно выраженной общей интоксикацией и поражением верхних дыхательных путей, преимущественно гортани.
Вирусы парагриппа Парагрипп - антропонозная острая респираторная вирусная инфекция. Характеризуется умеренно выраженной общей интоксикацией и поражением верхних дыхательных путей, преимущественно гортани.
 Классификация Царство Вирусы Подцарство ДНК-содержащие семейство Paramyxoviridae подсемейство Paramyxovirinae род Paramyxovirus Известно 5 разновидностей вирусов парагриппа; первые 3 вызывают заболевание людей, ПГ-4 и ПГ-5 для человека неопасны
Классификация Царство Вирусы Подцарство ДНК-содержащие семейство Paramyxoviridae подсемейство Paramyxovirinae род Paramyxovirus Известно 5 разновидностей вирусов парагриппа; первые 3 вызывают заболевание людей, ПГ-4 и ПГ-5 для человека неопасны
 Строение вириона Парамиксовирусы — сферические «одетые» вирусы; средний размер вириона — 100 -800 нм. Геном образует линейная, несегментированная молекула -РНК. С ней связаны белок NP и полимеразные белки Р и L, образующие нуклеокапсид со спиральной симметрией. Нуклеокапсид окружён матриксным М-белком. Суперкапсид парамиксовирусов образован двухслойной липидной мембраной, пронизываемой глико-протеиновыми «шипами» HN (обладают гемагглютинирующей и нейраминидазной активностью) и F (ответственны за слияние с клеточной мембраной, образование симпластов и проявляющие гемолитическую и цитотоксическую активность). Репликация вирусов полностью реализуется в цитоплазме клеток хозяина.
Строение вириона Парамиксовирусы — сферические «одетые» вирусы; средний размер вириона — 100 -800 нм. Геном образует линейная, несегментированная молекула -РНК. С ней связаны белок NP и полимеразные белки Р и L, образующие нуклеокапсид со спиральной симметрией. Нуклеокапсид окружён матриксным М-белком. Суперкапсид парамиксовирусов образован двухслойной липидной мембраной, пронизываемой глико-протеиновыми «шипами» HN (обладают гемагглютинирующей и нейраминидазной активностью) и F (ответственны за слияние с клеточной мембраной, образование симпластов и проявляющие гемолитическую и цитотоксическую активность). Репликация вирусов полностью реализуется в цитоплазме клеток хозяина.
 Эпидемиология Истпочником инфекции является больной человек, особенно с выраженным катаральным синдромом. Выделение возбудителя продолжается в течение 7 -10 дней, при повторном инфицировании сокращается на 2 -3 дня. Вирусоносители не представляют большой эпидемической опасности из-за отсутствия катаральных явлений. Механизм передачи: капельный. Путь передачи - воздушнокапельный. Возрастная структура: восприимчивость наиболее высока у детей в возрасте 1 -5 лет. Дети до 4 мес. болеют редко, так как получают специфические антитела от матери. Сезонность и периодичность. Заболевания парагриппом встречаются круглогодично с подъемом в холодный период. Парагриппу свойственна определенная периодичность, равная 2 годам при заболеваниях, вызванных вирусами 1 -го и 2 -го типов, и 4 годам - при инфекции, обусловленной вирусом 3 -го типа. Заболевания регистрируют в виде спорадических случаев или групповых вспышек в детских коллективах. Вспышки характеризуются медленным подъемом заболеваемости в начале, интенсивным ростом в дальнейшем с вовлечением в эпидемический процесс от 70 до 100% детей.
Эпидемиология Истпочником инфекции является больной человек, особенно с выраженным катаральным синдромом. Выделение возбудителя продолжается в течение 7 -10 дней, при повторном инфицировании сокращается на 2 -3 дня. Вирусоносители не представляют большой эпидемической опасности из-за отсутствия катаральных явлений. Механизм передачи: капельный. Путь передачи - воздушнокапельный. Возрастная структура: восприимчивость наиболее высока у детей в возрасте 1 -5 лет. Дети до 4 мес. болеют редко, так как получают специфические антитела от матери. Сезонность и периодичность. Заболевания парагриппом встречаются круглогодично с подъемом в холодный период. Парагриппу свойственна определенная периодичность, равная 2 годам при заболеваниях, вызванных вирусами 1 -го и 2 -го типов, и 4 годам - при инфекции, обусловленной вирусом 3 -го типа. Заболевания регистрируют в виде спорадических случаев или групповых вспышек в детских коллективах. Вспышки характеризуются медленным подъемом заболеваемости в начале, интенсивным ростом в дальнейшем с вовлечением в эпидемический процесс от 70 до 100% детей.
 Патогенез Воротами инфекции являются слизистые оболочки респираторного тракта, особенно носа и гортани, где возникают выраженные воспалительные изменения. Глотка и трахея вовлекаются в процесс реже и в меньшей степени. Вирус с капельками слюны, пыли попадает на слизистые оболочки верхних дыхательных путей проникает в эпителиальные клетки цитопатическое действие на эпителиальные клетки Местно возникает воспалительный процесс и накапливается слизистый экссудат, появляется отечность (синдром крупа).
Патогенез Воротами инфекции являются слизистые оболочки респираторного тракта, особенно носа и гортани, где возникают выраженные воспалительные изменения. Глотка и трахея вовлекаются в процесс реже и в меньшей степени. Вирус с капельками слюны, пыли попадает на слизистые оболочки верхних дыхательных путей проникает в эпителиальные клетки цитопатическое действие на эпителиальные клетки Местно возникает воспалительный процесс и накапливается слизистый экссудат, появляется отечность (синдром крупа).
 Проникновение вируса в кровь общетоксическое действие, клинически проявляющееся повышением температуры тела, головной болью и др. сенсибилизация вирусными антигенами и продуктами полураспада эпителиальных клеток выработка вируснейтрализующих, комплементсвязывающих и гемагглютинирующих антител
Проникновение вируса в кровь общетоксическое действие, клинически проявляющееся повышением температуры тела, головной болью и др. сенсибилизация вирусными антигенами и продуктами полураспада эпителиальных клеток выработка вируснейтрализующих, комплементсвязывающих и гемагглютинирующих антител
 Клинические проявления Инкубационный период – 2– 7 дней. Заболевание чаще начинается постепенно, с умеренной интоксикации, субфебрильной температуры, после чего развивается катаральный синдром, являющийся ведущим при парагриппе. Типичным следует считать возникновение ларингита, что сопровождается сухим "лающим" кашлем, осиплым голосом, нередко афонией. Кашель сохраняется длительное время, иногда до 12– 21 -го дня болезни. Довольно часто парагриппозный ларингит протекает без лихорадки и начинается осиплостью голоса или афонией. При осмотре обнаруживают гиперемию зева, мягкого неба, задней стенки глотки. У детей парагрипп осложняется крупом. В этих случаях болезнь начинается остро с высокой температуры, грубого кашля, осиплости голоса. Стеноз гортани развивается внезапно, чаще ночью, и продолжается несколько часов. Другими осложнениями парагриппа являются вируснобактериальная пневмония, а также отит и поражение придаточных пазух носа.
Клинические проявления Инкубационный период – 2– 7 дней. Заболевание чаще начинается постепенно, с умеренной интоксикации, субфебрильной температуры, после чего развивается катаральный синдром, являющийся ведущим при парагриппе. Типичным следует считать возникновение ларингита, что сопровождается сухим "лающим" кашлем, осиплым голосом, нередко афонией. Кашель сохраняется длительное время, иногда до 12– 21 -го дня болезни. Довольно часто парагриппозный ларингит протекает без лихорадки и начинается осиплостью голоса или афонией. При осмотре обнаруживают гиперемию зева, мягкого неба, задней стенки глотки. У детей парагрипп осложняется крупом. В этих случаях болезнь начинается остро с высокой температуры, грубого кашля, осиплости голоса. Стеноз гортани развивается внезапно, чаще ночью, и продолжается несколько часов. Другими осложнениями парагриппа являются вируснобактериальная пневмония, а также отит и поражение придаточных пазух носа.
 Диагностика Исследуемвый материал: глоточный смыв или мазок, взятый с помощью ватного тампона с задней стенки глотки, сыворотка крови. 1. Экспресс-диагностика - Реакция прямой иммунофлюоресценции со стандартными типовыми антисыворотками. - Реже применяют риноцитоскопию при окраске по Романовскому 2. Вирусологический метод - Выделение вируса осуществляют в культурах клеток почек обезьян «МК-2» или эмбриона человека. ВПГЧ редко дают выраженный цитопатогенный эффект. - Индикацию чаще всего проводят с помощью реакции гемадсорбции. Для этого к заражённым культурам клеток прибавляют эритроциты морской свинки или человека. Если клетки инфицированы вирусом парагриппа, они адсорбируют эритроциты. - Идентификация осуществляется с помощью иммунных сывороток в РТГАдс или РСК.
Диагностика Исследуемвый материал: глоточный смыв или мазок, взятый с помощью ватного тампона с задней стенки глотки, сыворотка крови. 1. Экспресс-диагностика - Реакция прямой иммунофлюоресценции со стандартными типовыми антисыворотками. - Реже применяют риноцитоскопию при окраске по Романовскому 2. Вирусологический метод - Выделение вируса осуществляют в культурах клеток почек обезьян «МК-2» или эмбриона человека. ВПГЧ редко дают выраженный цитопатогенный эффект. - Индикацию чаще всего проводят с помощью реакции гемадсорбции. Для этого к заражённым культурам клеток прибавляют эритроциты морской свинки или человека. Если клетки инфицированы вирусом парагриппа, они адсорбируют эритроциты. - Идентификация осуществляется с помощью иммунных сывороток в РТГАдс или РСК.
 3. Серодиагностика: Исследование парных проб сыворотки крови больного (интервал 10 -14 дней) на наличие противовирусных антител в РТГА или РСК. Нарастание титра антител во второй сыворотке в 4 и более раз указывает на парагриппозную инфекцию. 4. В крови больных неосложнённым парагриппом – нормоцитоз или умеренная лейкопения. СОЭ не увеличена.
3. Серодиагностика: Исследование парных проб сыворотки крови больного (интервал 10 -14 дней) на наличие противовирусных антител в РТГА или РСК. Нарастание титра антител во второй сыворотке в 4 и более раз указывает на парагриппозную инфекцию. 4. В крови больных неосложнённым парагриппом – нормоцитоз или умеренная лейкопения. СОЭ не увеличена.
 Средства специфической профилактики и лечения Отсутствуют.
Средства специфической профилактики и лечения Отсутствуют.
 Респираторносинцитиальный вирус Респираторно-синцитиальная вирусная инфекция (РСВИ) занимает важное место в патологии органов дыхания, как у детей, так и у взрослых. Респираторно-синцитиальный вирус (РСВ) - наиболее частая причина поражения Нижних дыхательных путей (НДП) у детей раннего возраста, причем заболевание может привести к летальному исходу. У детей старшего возраста и взрослых РСВ вызывает более легкое поражение респираторного тракта, проявляющееся ринофарингитом, бронхитом, включая обострение хронического бронхита, пневмонией. РС вирус – был выделен в 1957 году в США Р. Чаноком от детей с ОРЗ
Респираторносинцитиальный вирус Респираторно-синцитиальная вирусная инфекция (РСВИ) занимает важное место в патологии органов дыхания, как у детей, так и у взрослых. Респираторно-синцитиальный вирус (РСВ) - наиболее частая причина поражения Нижних дыхательных путей (НДП) у детей раннего возраста, причем заболевание может привести к летальному исходу. У детей старшего возраста и взрослых РСВ вызывает более легкое поражение респираторного тракта, проявляющееся ринофарингитом, бронхитом, включая обострение хронического бронхита, пневмонией. РС вирус – был выделен в 1957 году в США Р. Чаноком от детей с ОРЗ
 Классификация Царство – Вирусы Подцарство – РНК содержащие Семейство – Paramyxoviridae Род – Metamyxovirus
Классификация Царство – Вирусы Подцарство – РНК содержащие Семейство – Paramyxoviridae Род – Metamyxovirus
 Строение вириона Вирионы РС-вируса сферической формы, диаметром 120 -200 нм. Геном образован несегментированной молекулой -РНК. С ним связаны нуклеокапсидиый белок N и белки Р и L полимеразного комплекса (содержащего транскриптазу). Белки М и N прилегают к внутренней поверхности суперкапсида. Суперкапсид респираторно-синцитиального вируса пронизывают шипы, образованные гликопротеинами G и F. Белок G обеспечивает взаимодействие с клеточными рецепторами. Белок F обеспечивает слияние оболочки вируса с клеточной мембраной и мембраной лизосом, а также слияние инфицированной клетки с прилегающими незаражёнными клетками. В результате слияния клеток образуется синцитий — структура из клеток, соединённых выростами цитоплазмы. У PCвируса отсутствует гемагглютинин; его отличает меньшая гемадсорбционная и гемолитическая активность.
Строение вириона Вирионы РС-вируса сферической формы, диаметром 120 -200 нм. Геном образован несегментированной молекулой -РНК. С ним связаны нуклеокапсидиый белок N и белки Р и L полимеразного комплекса (содержащего транскриптазу). Белки М и N прилегают к внутренней поверхности суперкапсида. Суперкапсид респираторно-синцитиального вируса пронизывают шипы, образованные гликопротеинами G и F. Белок G обеспечивает взаимодействие с клеточными рецепторами. Белок F обеспечивает слияние оболочки вируса с клеточной мембраной и мембраной лизосом, а также слияние инфицированной клетки с прилегающими незаражёнными клетками. В результате слияния клеток образуется синцитий — структура из клеток, соединённых выростами цитоплазмы. У PCвируса отсутствует гемагглютинин; его отличает меньшая гемадсорбционная и гемолитическая активность.
 Эпидемиология РСВИ является, по существу, эндемичной, и в отдельные периоды происходит подъем заболеваемости. Вспышки наблюдаются в различное время года, чаще осенью и зимой. Подъем заболеваемости РСВИ нередко совпадает с эпидемией гриппа, и тогда у детей можно диагностировать микст-инфекцию. Как и грипп, РСВИ увеличивает количество осложнений и летальность от гриппа и пневмонии. Продолжительность эпидемического подъема заболеваемости ограничивается 3 -5 месяцами. Такие вспышки, как правило, имеют место ежегодно в одной и той же местности. В это время РСВ вызывает не только бронхиолиты и пневмонии, но также и легкие заболевания верхних дыхательных путей (ВДП) у детей. Вспышки РСВИ могут протекать в виде ограниченных локальных эпидемий в учреждениях для детей раннего возраста. Источником инфекции являются больные и вирусоносители. Вирусы выделяются вместе с секретом слизистой оболочки ВДП во время разговора, кашля, чихания, и передача возбудителя здоровым осуществляется воздушно-капельным путем. Опасность заражения от больного человека сохраняется в течение 5 -7 дней. Восприимчивость к РСВ очень высока, особенно у детей раннего возраста. Заболевания, вызванные РСВ, наблюдаются и среди взрослых различного возраста, при этом у большинства из них имеет место реинфекция, так как болезнь возникает несмотря на наличие нейтрализующих и комплементсвязывающих антител.
Эпидемиология РСВИ является, по существу, эндемичной, и в отдельные периоды происходит подъем заболеваемости. Вспышки наблюдаются в различное время года, чаще осенью и зимой. Подъем заболеваемости РСВИ нередко совпадает с эпидемией гриппа, и тогда у детей можно диагностировать микст-инфекцию. Как и грипп, РСВИ увеличивает количество осложнений и летальность от гриппа и пневмонии. Продолжительность эпидемического подъема заболеваемости ограничивается 3 -5 месяцами. Такие вспышки, как правило, имеют место ежегодно в одной и той же местности. В это время РСВ вызывает не только бронхиолиты и пневмонии, но также и легкие заболевания верхних дыхательных путей (ВДП) у детей. Вспышки РСВИ могут протекать в виде ограниченных локальных эпидемий в учреждениях для детей раннего возраста. Источником инфекции являются больные и вирусоносители. Вирусы выделяются вместе с секретом слизистой оболочки ВДП во время разговора, кашля, чихания, и передача возбудителя здоровым осуществляется воздушно-капельным путем. Опасность заражения от больного человека сохраняется в течение 5 -7 дней. Восприимчивость к РСВ очень высока, особенно у детей раннего возраста. Заболевания, вызванные РСВ, наблюдаются и среди взрослых различного возраста, при этом у большинства из них имеет место реинфекция, так как болезнь возникает несмотря на наличие нейтрализующих и комплементсвязывающих антител.
 Патогенез Репродукция вирусов происходит, прежде всего, в клетках эпителия органов дыхания и складывается из нескольких основных этапов. Адсорбция вируса на оболочке восприимчивой клетки, видимо, за счет взаимодействия с рецепторами клетки. Проникновение вируса или его нуклеиновой кислоты в клетку. При гриппе это происходит благодаря ферменту вируса — нейраминидазе. Возможно и активное поглощение клеткой вируса ( «виропексия» или «пиноцитоз» ). Между проникновением вируса в клетку и появлением в ней потомства в виде многих сотен вирусных частиц может пройти всего лишь несколько десятков минут. Репродукция вируса производится клеткой хозяина на вирусных матрицах, поэтому ее скорость находится в зависимости от ритма исходного обмена в клетках хозяина. Вирусы можно обнаружить при электронной микроскопии, хотя это удается лишь в тех случаях, когда частицы вируса сформированы в полной мере. Легче обнаружить их антиген при иммунофлюоресцентном исследовании. Большие скопления вирусов выявляются и при световой микроскопии в виде базофильных гранул. Под воздействием размножающегося вируса происходит повреждение клетки. В первую очередь возникают альтеративные изменения, доходящие до частичного некроза или приводящие к гибели всю клетку. Такие участки повреждения, интенсивно окрашивающиеся основным фуксином, обозначаются термином фуксинофильные включения. Возможно их частичное отторжение вместе с апикальной частью цитоплазмы.
Патогенез Репродукция вирусов происходит, прежде всего, в клетках эпителия органов дыхания и складывается из нескольких основных этапов. Адсорбция вируса на оболочке восприимчивой клетки, видимо, за счет взаимодействия с рецепторами клетки. Проникновение вируса или его нуклеиновой кислоты в клетку. При гриппе это происходит благодаря ферменту вируса — нейраминидазе. Возможно и активное поглощение клеткой вируса ( «виропексия» или «пиноцитоз» ). Между проникновением вируса в клетку и появлением в ней потомства в виде многих сотен вирусных частиц может пройти всего лишь несколько десятков минут. Репродукция вируса производится клеткой хозяина на вирусных матрицах, поэтому ее скорость находится в зависимости от ритма исходного обмена в клетках хозяина. Вирусы можно обнаружить при электронной микроскопии, хотя это удается лишь в тех случаях, когда частицы вируса сформированы в полной мере. Легче обнаружить их антиген при иммунофлюоресцентном исследовании. Большие скопления вирусов выявляются и при световой микроскопии в виде базофильных гранул. Под воздействием размножающегося вируса происходит повреждение клетки. В первую очередь возникают альтеративные изменения, доходящие до частичного некроза или приводящие к гибели всю клетку. Такие участки повреждения, интенсивно окрашивающиеся основным фуксином, обозначаются термином фуксинофильные включения. Возможно их частичное отторжение вместе с апикальной частью цитоплазмы.
 Наряду с этим происходит изменение формы пораженной клетки — гигантоклеточный метаморфоз. Такие клетки существенно увеличиваются в размерах, как за счет цитоплазмы, так и ядра. Ядро при РНК-вирусных инфекциях остается светлым. При инфекциях, вызванных вирусами парагриппа и респираторно-синцитиальным, пораженные клетки оказываются тесно соединенными друг с другом. В связи с этим они образуют выросты или утолщения, аналогичные тем симпластам, которые возникают в культурах тканей. Возникают также нарушения кровообращения, проявляющиеся, прежде всего повышенной проницаемостью стенок кровеносных сосудов. В результате этого развивается умеренный отек, сочетающийся иногда с образованием гиалиновых мембран — плотных белковых масс, образовавшихся из белков плазмы крови и располагающихся по стенкам альвеол, а также кровоизлияний, обычно небольших. Закономерно наблюдается также очаговое спадение легких, чаще при вирусных инфекциях с более длительным течением. Эти очаговые спадения легких (частичный ателектаз или дистелектаз) связаны с нарушением образования сурфактанта. На поздних стадиях заболевания происходит регенерация эпителия, нарастающего из ростковых зон на обнаженную поверхность. Регенерация чаще бывает полной. Но иногда, особенно при повторных ОРВИ развивается многорядность эпителия и даже истинная метаплазия эпителия.
Наряду с этим происходит изменение формы пораженной клетки — гигантоклеточный метаморфоз. Такие клетки существенно увеличиваются в размерах, как за счет цитоплазмы, так и ядра. Ядро при РНК-вирусных инфекциях остается светлым. При инфекциях, вызванных вирусами парагриппа и респираторно-синцитиальным, пораженные клетки оказываются тесно соединенными друг с другом. В связи с этим они образуют выросты или утолщения, аналогичные тем симпластам, которые возникают в культурах тканей. Возникают также нарушения кровообращения, проявляющиеся, прежде всего повышенной проницаемостью стенок кровеносных сосудов. В результате этого развивается умеренный отек, сочетающийся иногда с образованием гиалиновых мембран — плотных белковых масс, образовавшихся из белков плазмы крови и располагающихся по стенкам альвеол, а также кровоизлияний, обычно небольших. Закономерно наблюдается также очаговое спадение легких, чаще при вирусных инфекциях с более длительным течением. Эти очаговые спадения легких (частичный ателектаз или дистелектаз) связаны с нарушением образования сурфактанта. На поздних стадиях заболевания происходит регенерация эпителия, нарастающего из ростковых зон на обнаженную поверхность. Регенерация чаще бывает полной. Но иногда, особенно при повторных ОРВИ развивается многорядность эпителия и даже истинная метаплазия эпителия.
 Клиника Инкубационный период - 3 -6 дней. Заболевание может начаться как остро, так и постепенно. Лихорадка непостоянная, температура тела может оставаться нормальной или повышаться до субфебрильной, а при остром начале болезни - и до фебрильной. У маленьких детей на высоте лихорадки могут быть судороги, потеря сознания, синдром менингизма. Катаральные явления разнообразны - небольшая сухость, першение в горле, заложенность носа, ринорея. Постоянный и ведущий симптом РСинфекции - сухой кашель, который через 3 -5 дней становится влажным и может продолжаться в течение 2 -3 нед. Иногда кашель сопровождается болью в области грудной клетки, у маленьких детей приобретает характер астматического. У взрослых появляются учащенное дыхание, ощущение удушья.
Клиника Инкубационный период - 3 -6 дней. Заболевание может начаться как остро, так и постепенно. Лихорадка непостоянная, температура тела может оставаться нормальной или повышаться до субфебрильной, а при остром начале болезни - и до фебрильной. У маленьких детей на высоте лихорадки могут быть судороги, потеря сознания, синдром менингизма. Катаральные явления разнообразны - небольшая сухость, першение в горле, заложенность носа, ринорея. Постоянный и ведущий симптом РСинфекции - сухой кашель, который через 3 -5 дней становится влажным и может продолжаться в течение 2 -3 нед. Иногда кашель сопровождается болью в области грудной клетки, у маленьких детей приобретает характер астматического. У взрослых появляются учащенное дыхание, ощущение удушья.
 Одной из особенностей РС-инфекции является вовлечение в процесс печени. Больные жалуются на боли и неприятные ощущения в эпигастрии, правом подреберье, отрыжку. Отмечается увеличение печени, незначительное кратковременное повышение активности Ал. АТ и уровня билирубина в сыворотке крови. У части больных РС-инфекция имеет длительное, вялое течение с периодами ухудшения и улучшения самочувствия. Следует иметь в виду, что развивающаяся при РС-инфекции иммуносупрессия приводит к обострению сопутствующих заболеваний. Осложнения у взрослых наблюдаются значительно реже, чем у детей. У последних нередко возникают вируснобактериальная пневмония, отиты, синуситы. При развитии иммунопатологии заболевание может приобрести хроническое течение по типу обструктивного бронхита.
Одной из особенностей РС-инфекции является вовлечение в процесс печени. Больные жалуются на боли и неприятные ощущения в эпигастрии, правом подреберье, отрыжку. Отмечается увеличение печени, незначительное кратковременное повышение активности Ал. АТ и уровня билирубина в сыворотке крови. У части больных РС-инфекция имеет длительное, вялое течение с периодами ухудшения и улучшения самочувствия. Следует иметь в виду, что развивающаяся при РС-инфекции иммуносупрессия приводит к обострению сопутствующих заболеваний. Осложнения у взрослых наблюдаются значительно реже, чем у детей. У последних нередко возникают вируснобактериальная пневмония, отиты, синуситы. При развитии иммунопатологии заболевание может приобрести хроническое течение по типу обструктивного бронхита.
 Диагностика Исследуемый материал: смыв из носоглотки, сыворотка крови. 1. Экспресс-диагностика - Реакция прямой флюоресценции 2. Вирусологический метод - Выделение вируса осуществляют в культурах клеток почек обезьян «МК-2» , He. La, Hep-2 или почки эмбриона человека - Индикацию осуществляют по цитопатическому действию вируса – образованию синцития - Идентификация осуществляется с помощью иммунных сывороток в РИФ, РН и РСК. 3. Серодиагностика(основной метод) - Исследуют парные сыворотки, взятые с интервалом 10 -14 дней, при помощи РН, РСК и РПГА. Диагностическим является нарастание титра антител в 4 раза и более.
Диагностика Исследуемый материал: смыв из носоглотки, сыворотка крови. 1. Экспресс-диагностика - Реакция прямой флюоресценции 2. Вирусологический метод - Выделение вируса осуществляют в культурах клеток почек обезьян «МК-2» , He. La, Hep-2 или почки эмбриона человека - Индикацию осуществляют по цитопатическому действию вируса – образованию синцития - Идентификация осуществляется с помощью иммунных сывороток в РИФ, РН и РСК. 3. Серодиагностика(основной метод) - Исследуют парные сыворотки, взятые с интервалом 10 -14 дней, при помощи РН, РСК и РПГА. Диагностическим является нарастание титра антител в 4 раза и более.
 Специфическая профилактика и терапия Отсутствуют
Специфическая профилактика и терапия Отсутствуют
 КРАСНУХА (RUBEOLA)
КРАСНУХА (RUBEOLA)
 КЛАССИФИКАЦИЯ ВИРУСА ЦАРСТВО - ВИРУСЫ (VIRA) ПОДЦАРСТВО – РНК- СОДЕРЖАЩИЕ ВИРУСЫ СЕМЕЙСТВО – TOGAVIRIDAE РОД - RUBIVIRUS
КЛАССИФИКАЦИЯ ВИРУСА ЦАРСТВО - ВИРУСЫ (VIRA) ПОДЦАРСТВО – РНК- СОДЕРЖАЩИЕ ВИРУСЫ СЕМЕЙСТВО – TOGAVIRIDAE РОД - RUBIVIRUS
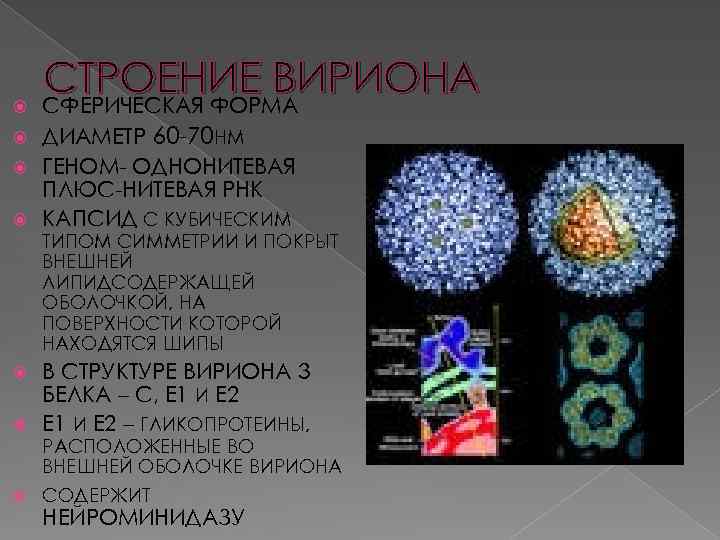 СТРОЕНИЕ ВИРИОНА СФЕРИЧЕСКАЯ ФОРМА ДИАМЕТР 60 -70 НМ ГЕНОМ- ОДНОНИТЕВАЯ ПЛЮС-НИТЕВАЯ РНК КАПСИД С КУБИЧЕСКИМ ТИПОМ СИММЕТРИИ И ПОКРЫТ ВНЕШНЕЙ ЛИПИДСОДЕРЖАЩЕЙ ОБОЛОЧКОЙ, НА ПОВЕРХНОСТИ КОТОРОЙ НАХОДЯТСЯ ШИПЫ В СТРУКТУРЕ ВИРИОНА 3 БЕЛКА – С, Е 1 И Е 2 – ГЛИКОПРОТЕИНЫ, РАСПОЛОЖЕННЫЕ ВО ВНЕШНЕЙ ОБОЛОЧКЕ ВИРИОНА СОДЕРЖИТ НЕЙРОМИНИДАЗУ
СТРОЕНИЕ ВИРИОНА СФЕРИЧЕСКАЯ ФОРМА ДИАМЕТР 60 -70 НМ ГЕНОМ- ОДНОНИТЕВАЯ ПЛЮС-НИТЕВАЯ РНК КАПСИД С КУБИЧЕСКИМ ТИПОМ СИММЕТРИИ И ПОКРЫТ ВНЕШНЕЙ ЛИПИДСОДЕРЖАЩЕЙ ОБОЛОЧКОЙ, НА ПОВЕРХНОСТИ КОТОРОЙ НАХОДЯТСЯ ШИПЫ В СТРУКТУРЕ ВИРИОНА 3 БЕЛКА – С, Е 1 И Е 2 – ГЛИКОПРОТЕИНЫ, РАСПОЛОЖЕННЫЕ ВО ВНЕШНЕЙ ОБОЛОЧКЕ ВИРИОНА СОДЕРЖИТ НЕЙРОМИНИДАЗУ
 АНТИГЕННЫЕ СВОЙСТВА ВНУТРЕННИЙ НУКЛЕОКАПСИДНЫЙ АНТИГЕН – С ПРОТЕКТИВНЫЙ АНТИГЕН - Е 2, К КОТОРОМУ ВЫРАБАТЫВАЮТСЯ ВИРУСНЕЙТРАЛИЗУЮЩИЕ АНТИТЕЛА Е 2 ТАКЖЕ ЯВЛЯЕТСЯ ГЕМАГГЛЮТИНИНОМ, АГГЛЮТИНИРУЯ ЭРИТРОЦИТЫ ГОЛУБЕЙ, ГУСЕЙ И -3 ДНЕВНЫХ ЦЫПЛЯТ 1
АНТИГЕННЫЕ СВОЙСТВА ВНУТРЕННИЙ НУКЛЕОКАПСИДНЫЙ АНТИГЕН – С ПРОТЕКТИВНЫЙ АНТИГЕН - Е 2, К КОТОРОМУ ВЫРАБАТЫВАЮТСЯ ВИРУСНЕЙТРАЛИЗУЮЩИЕ АНТИТЕЛА Е 2 ТАКЖЕ ЯВЛЯЕТСЯ ГЕМАГГЛЮТИНИНОМ, АГГЛЮТИНИРУЯ ЭРИТРОЦИТЫ ГОЛУБЕЙ, ГУСЕЙ И -3 ДНЕВНЫХ ЦЫПЛЯТ 1
 КУЛЬТИВИРОВАНИЕ КУЛЬТУРЫ КЛЕТОК (ВНК-21(ХОМЯЧКОВЫЕ)ЦИТОПАТИЧЕСКОЕ ДЕЙСТВИЕ И ОБРАЗОВАНИЕ БЛЯШЕК и ПЕРВИЧНЫЕ КУЛЬТУРЫ КЛЕТОК ИЗ ТКАНЕЙ ЧЕЛОВЕЧЕСКОГО ПЛОДА – ОБРАЗОВАНИЕ ЭОЗИНОФИЛЬНЫХ ВКЛЮЧЕНИЙ) КУРИНЫЕ И УТИНЫЕ ЭМБРИОНЫ
КУЛЬТИВИРОВАНИЕ КУЛЬТУРЫ КЛЕТОК (ВНК-21(ХОМЯЧКОВЫЕ)ЦИТОПАТИЧЕСКОЕ ДЕЙСТВИЕ И ОБРАЗОВАНИЕ БЛЯШЕК и ПЕРВИЧНЫЕ КУЛЬТУРЫ КЛЕТОК ИЗ ТКАНЕЙ ЧЕЛОВЕЧЕСКОГО ПЛОДА – ОБРАЗОВАНИЕ ЭОЗИНОФИЛЬНЫХ ВКЛЮЧЕНИЙ) КУРИНЫЕ И УТИНЫЕ ЭМБРИОНЫ
 РЕЗИСТЕНТНОСТЬ. Во внешней среде не устойчив. Быстро погибает при высушивании. При изменениях р. Н (ниже 6, 8 и выше 8, 0) Погибает под влиянием УФ-лучей, эфира, формалина и других дез. растворов. При кипячении погибает за 2 минуты. При низких температурах, в замороженном состоянии сохраняет свою активность годами
РЕЗИСТЕНТНОСТЬ. Во внешней среде не устойчив. Быстро погибает при высушивании. При изменениях р. Н (ниже 6, 8 и выше 8, 0) Погибает под влиянием УФ-лучей, эфира, формалина и других дез. растворов. При кипячении погибает за 2 минуты. При низких температурах, в замороженном состоянии сохраняет свою активность годами
 Патогенность для животных. Вирус патогенен для некоторых видов обезьян.
Патогенность для животных. Вирус патогенен для некоторых видов обезьян.
 Эпидемиология. - Антропонозное заболевание (источник – человек). Пути передачи: воздушнокапельный и трансплацентарный (от матери к плоду). Восприимчивый коллектив – любой человек.
Эпидемиология. - Антропонозное заболевание (источник – человек). Пути передачи: воздушнокапельный и трансплацентарный (от матери к плоду). Восприимчивый коллектив – любой человек.
 Патогенез. Проникновение вируса через слизистые оболочки верхних дыхательных путей Регионарные лимфатические узлы. Размножение. Поступление в кровь. (Вирусемия). С током крови разносится по органам и оседает в лимфатических узлах и эпителиальных клетках кожи, где развивается иммунная воспалительная реакция. Появление пятнистой папулёзной сыпи.
Патогенез. Проникновение вируса через слизистые оболочки верхних дыхательных путей Регионарные лимфатические узлы. Размножение. Поступление в кровь. (Вирусемия). С током крови разносится по органам и оседает в лимфатических узлах и эпителиальных клетках кожи, где развивается иммунная воспалительная реакция. Появление пятнистой папулёзной сыпи.
 Клиника Инкубационный период 11 -24 дня(в срелнем 16 -21 день. ) Заболевание начинается с незначительного повышения температуры и лёгких катаральных симптомов, конъюктивита, а также увеличения заднешейных и затылочных лимфатических узлов. На 1 -4 день болезни появляется пятнистопапулёзная сыпь , расположенная по всему(сначала появляется на лице, затем распространяется по всему телу и конечностям)
Клиника Инкубационный период 11 -24 дня(в срелнем 16 -21 день. ) Заболевание начинается с незначительного повышения температуры и лёгких катаральных симптомов, конъюктивита, а также увеличения заднешейных и затылочных лимфатических узлов. На 1 -4 день болезни появляется пятнистопапулёзная сыпь , расположенная по всему(сначала появляется на лице, затем распространяется по всему телу и конечностям)

 Сыпь более обильна на разгибательных поверхностях конечностей, на спине, пояснице, ягодицах. На лице сыпь менее выражена, чем на туловище, и отсутствует этапность высыпания(при кори наоборот). В отличие от скарлатины элементы сыпи расположены на фоне нормальной (негиперемированной) кожи.
Сыпь более обильна на разгибательных поверхностях конечностей, на спине, пояснице, ягодицах. На лице сыпь менее выражена, чем на туловище, и отсутствует этапность высыпания(при кори наоборот). В отличие от скарлатины элементы сыпи расположены на фоне нормальной (негиперемированной) кожи.
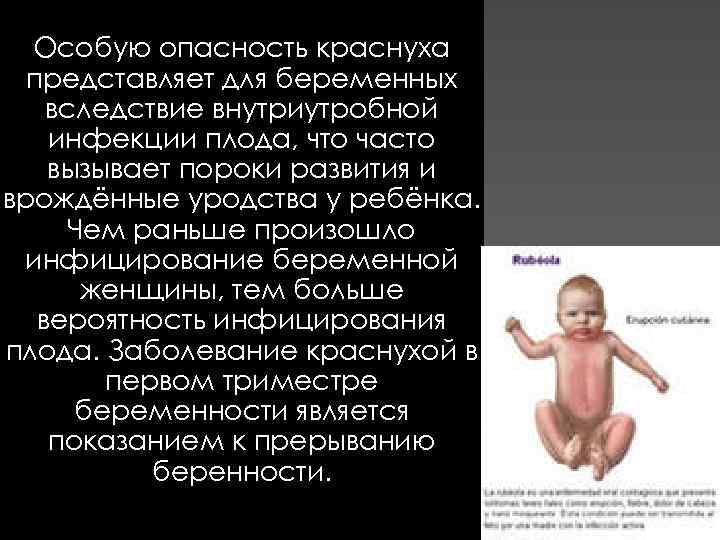 Особую опасность краснуха представляет для беременных вследствие внутриутробной инфекции плода, что часто вызывает пороки развития и врождённые уродства у ребёнка. Чем раньше произошло инфицирование беременной женщины, тем больше вероятность инфицирования плода. Заболевание краснухой в первом триместре беременности является показанием к прерыванию беренности.
Особую опасность краснуха представляет для беременных вследствие внутриутробной инфекции плода, что часто вызывает пороки развития и врождённые уродства у ребёнка. Чем раньше произошло инфицирование беременной женщины, тем больше вероятность инфицирования плода. Заболевание краснухой в первом триместре беременности является показанием к прерыванию беренности.
 Иммунитет. У переболевших и вакцинированных людей формируется стойкий, напряжённый иммунитет.
Иммунитет. У переболевших и вакцинированных людей формируется стойкий, напряжённый иммунитет.
 Лабораторная диагностика. Исследуемый материал: смывы со слизистой оболочки носа и зева, кровь, моча, реже испражнения. I. Экспресс-диагностика – обнаружение вируса или его антигенов в исслед. материале. ПЦР – обнаружение нуклеиновой кислоты вируса. ИФА ЭМ РИА ИЭМ(иммунная электронная микроскопия)
Лабораторная диагностика. Исследуемый материал: смывы со слизистой оболочки носа и зева, кровь, моча, реже испражнения. I. Экспресс-диагностика – обнаружение вируса или его антигенов в исслед. материале. ПЦР – обнаружение нуклеиновой кислоты вируса. ИФА ЭМ РИА ИЭМ(иммунная электронная микроскопия)
 II. Вирусологический метод – метод выделения вируса из исследуемого материала и его идентификация. 1 Этап - Накопление вирусов - накопление в культуре клеток и тканей: перевиваемые КУЛЬТУРЫ КЛЕТОК (ВНК-21(ХОМЯЧКОВЫЕ)-и ПЕРВИЧНЫЕ КУЛЬТУРЫ КЛЕТОК ИЗ ТКАНЕЙ ЧЕЛОВЕЧЕСКОГО ПЛОДА. - КУРИНЫЕ И УТИНЫЕ ЭМБРИОНЫ. 2 Этап. Обнаружение (индикация) вирусов: -ОБНАРУЖЕНИЕ В ПЕРЕВИВАЕМОЙ КУЛЬТУРЕ КЛЕТОК (ВНК 21(ХОМЯЧКОВЫЕ)- ОБРАЗОВАНИЕ БЛЯШЕК и В ПЕРВИЧНЫХ КУЛЬТУРАХ КЛЕТОК ИЗ ТКАНЕЙ ЧЕЛОВЕЧЕСКОГО ПЛОДА – ЭОЗИНОФИЛЬНЫХ ВКЛЮЧЕНИЙ). - ОБНАРУШЕНИЕ ЦИТОПАТИЧЕСКОГО ДЕЙСТВИЯ - РГАдс – РЕАКЦИЯ ГЕМАДСОРБЦИИ. КОМПОНЕНТЫ: КУЛЬТУРА КЛЕТОК, ЭРИТРОЦИТЫ. УЧЁТ С ПОМОЩЬЮ СВЕТОВОЙ МИКРОСКОПИИ. РЕАКЦИЯ «+» , ЕСЛИ НА ПОВЕРХНОСТИ КЛЕТОК ВИДНЫ ЭРИТРОЦИТЫ. -РГА – РЕАКЦИЯ ГЕМАГГЛЮТИНАЦИИ. КОМПОНЕНТЫ: ЖИДКАЯ ПИТАТЕЛЬНАЯ СРЕДА В КОТОРОЙ КУЛЬТИВИРОВАЛИСЬ КЛЕТКИ, ВЗВЕСЬ ЭРИТРОЦИТОВ. СТАВИТСЯ В ЛУНКАХ ПЛАНШЕТА. УЧЁТ ПО ХАРАКТЕРУ ОСАДКА: «ЗОНТИК» - «+» РЕАКЦИЯ, «ПУГОВКА» - «-» РЕАКЦИЯ. - ЦВЕТНАЯ ПРОБА СОЛКА.
II. Вирусологический метод – метод выделения вируса из исследуемого материала и его идентификация. 1 Этап - Накопление вирусов - накопление в культуре клеток и тканей: перевиваемые КУЛЬТУРЫ КЛЕТОК (ВНК-21(ХОМЯЧКОВЫЕ)-и ПЕРВИЧНЫЕ КУЛЬТУРЫ КЛЕТОК ИЗ ТКАНЕЙ ЧЕЛОВЕЧЕСКОГО ПЛОДА. - КУРИНЫЕ И УТИНЫЕ ЭМБРИОНЫ. 2 Этап. Обнаружение (индикация) вирусов: -ОБНАРУЖЕНИЕ В ПЕРЕВИВАЕМОЙ КУЛЬТУРЕ КЛЕТОК (ВНК 21(ХОМЯЧКОВЫЕ)- ОБРАЗОВАНИЕ БЛЯШЕК и В ПЕРВИЧНЫХ КУЛЬТУРАХ КЛЕТОК ИЗ ТКАНЕЙ ЧЕЛОВЕЧЕСКОГО ПЛОДА – ЭОЗИНОФИЛЬНЫХ ВКЛЮЧЕНИЙ). - ОБНАРУШЕНИЕ ЦИТОПАТИЧЕСКОГО ДЕЙСТВИЯ - РГАдс – РЕАКЦИЯ ГЕМАДСОРБЦИИ. КОМПОНЕНТЫ: КУЛЬТУРА КЛЕТОК, ЭРИТРОЦИТЫ. УЧЁТ С ПОМОЩЬЮ СВЕТОВОЙ МИКРОСКОПИИ. РЕАКЦИЯ «+» , ЕСЛИ НА ПОВЕРХНОСТИ КЛЕТОК ВИДНЫ ЭРИТРОЦИТЫ. -РГА – РЕАКЦИЯ ГЕМАГГЛЮТИНАЦИИ. КОМПОНЕНТЫ: ЖИДКАЯ ПИТАТЕЛЬНАЯ СРЕДА В КОТОРОЙ КУЛЬТИВИРОВАЛИСЬ КЛЕТКИ, ВЗВЕСЬ ЭРИТРОЦИТОВ. СТАВИТСЯ В ЛУНКАХ ПЛАНШЕТА. УЧЁТ ПО ХАРАКТЕРУ ОСАДКА: «ЗОНТИК» - «+» РЕАКЦИЯ, «ПУГОВКА» - «-» РЕАКЦИЯ. - ЦВЕТНАЯ ПРОБА СОЛКА.
 3 Этап. ИДЕНТИФИКАЦИЯ. - РТГА – РЕАКЦИЯ ТОРМОЖЕНИЯ ГЕМАГГЛЮТИНАЦИИ. КОМПОНЕНТЫ: ВСЖ, ПРОТИВОВИРУСНАЯ СЫВОРОТКА, ВЗВЕСЬ ЭРИТРОЦИТОВ, СТАВИТСЯ В ЛУНКАХ ПЛАНШЕТА. УЧЁТ: «ПУГОВКА» - «+» РЕАКЦИЯ, «ЗОНТИК» - «-» РЕАКЦИЯ. - РСК. КОМПОНЕНТЫ: ВСЖ, ПРОТИВОВИРУСНАЯ СЫВОРОТКА, КОМПЛЕМЕНТ, ИНДИКАТОРНАЯ СИСТЕМА. СТАВИТСЯ В ПРОБИРКАХ. УЧЁТ ПО ГЕМОЛИЗУ. ГЕМОЛИЗ ЭРИТРОЦИТОВ – РЕАКЦИЯ «-» . НЕТ ГЕМОЛИЗА – РЕАКЦИЯ «+» . - ИФА. «СЭНДВИЧ» . КОМПОНЕНТЫ: 1 -ЫЕ АНТИТЕЛА НА ДНЕ ЛУНКИ, ВСЖ, АНТИТЕЛА МЕЧЕНЫЕ ФЕРМЕНТОМ, СУБСТРАТ ДЛЯ ФЕРМЕНТА, ХРОМОГЕН. СТАВИТСЯ В ЛУНКАХ ПЛАНШЕТА. УЧЁТ ПО ИЗМЕНЕНИЮ ЦВЕТА. «+» РЕАКЦИЯ- ЕСТЬ ИЗМЕНЕНИЯ. - РЕАКЦИЯ НЕЙТРАЛИЗАЦИИ. КОМПОНЕНТЫ: ВСЖ, ПРОТИВОВИРУСНАЯ СЫВОРОТКА. УЧЁТ: 1) ЦВЕТНАЯ ПРОБА СОЛКА- ИЗМЕНЕНИЕ ЦВЕТА – РЕАКЦИЯ «+» . 2) НЕЙТРАЛИЗАЦИЯ ЦПД – «+» РЕАКЦИЯ, КЛЕТКИ НЕ ИЗМЕНЕНЫ. 3) РТГАдс. РЕАКЦИЯ ПОЛОЖИТЕЛЬНАЯ, АДСОРБЦИИ ЭРИТРОЦИТОВ НА ПОВЕРХНОСТИ КУЛЬТУРЫ КЛЕТОК НЕТ. - РИФ. КОМПОНЕНТЫ: КУЛЬТУРЫ КЛЕТОК, ЛЮМИНИСЦИРУЮЩАЯ ПРОТИВОВИРУСНАЯ СЫВОРОТКА, МЕЧЕНАЯ ФИТЦ. УЧЁТ В ЛЮМИНИСЦЕНТНОМ МИКРОСКОПЕ ПО СВЕЧЕНИЮ КЛЕТОК.
3 Этап. ИДЕНТИФИКАЦИЯ. - РТГА – РЕАКЦИЯ ТОРМОЖЕНИЯ ГЕМАГГЛЮТИНАЦИИ. КОМПОНЕНТЫ: ВСЖ, ПРОТИВОВИРУСНАЯ СЫВОРОТКА, ВЗВЕСЬ ЭРИТРОЦИТОВ, СТАВИТСЯ В ЛУНКАХ ПЛАНШЕТА. УЧЁТ: «ПУГОВКА» - «+» РЕАКЦИЯ, «ЗОНТИК» - «-» РЕАКЦИЯ. - РСК. КОМПОНЕНТЫ: ВСЖ, ПРОТИВОВИРУСНАЯ СЫВОРОТКА, КОМПЛЕМЕНТ, ИНДИКАТОРНАЯ СИСТЕМА. СТАВИТСЯ В ПРОБИРКАХ. УЧЁТ ПО ГЕМОЛИЗУ. ГЕМОЛИЗ ЭРИТРОЦИТОВ – РЕАКЦИЯ «-» . НЕТ ГЕМОЛИЗА – РЕАКЦИЯ «+» . - ИФА. «СЭНДВИЧ» . КОМПОНЕНТЫ: 1 -ЫЕ АНТИТЕЛА НА ДНЕ ЛУНКИ, ВСЖ, АНТИТЕЛА МЕЧЕНЫЕ ФЕРМЕНТОМ, СУБСТРАТ ДЛЯ ФЕРМЕНТА, ХРОМОГЕН. СТАВИТСЯ В ЛУНКАХ ПЛАНШЕТА. УЧЁТ ПО ИЗМЕНЕНИЮ ЦВЕТА. «+» РЕАКЦИЯ- ЕСТЬ ИЗМЕНЕНИЯ. - РЕАКЦИЯ НЕЙТРАЛИЗАЦИИ. КОМПОНЕНТЫ: ВСЖ, ПРОТИВОВИРУСНАЯ СЫВОРОТКА. УЧЁТ: 1) ЦВЕТНАЯ ПРОБА СОЛКА- ИЗМЕНЕНИЕ ЦВЕТА – РЕАКЦИЯ «+» . 2) НЕЙТРАЛИЗАЦИЯ ЦПД – «+» РЕАКЦИЯ, КЛЕТКИ НЕ ИЗМЕНЕНЫ. 3) РТГАдс. РЕАКЦИЯ ПОЛОЖИТЕЛЬНАЯ, АДСОРБЦИИ ЭРИТРОЦИТОВ НА ПОВЕРХНОСТИ КУЛЬТУРЫ КЛЕТОК НЕТ. - РИФ. КОМПОНЕНТЫ: КУЛЬТУРЫ КЛЕТОК, ЛЮМИНИСЦИРУЮЩАЯ ПРОТИВОВИРУСНАЯ СЫВОРОТКА, МЕЧЕНАЯ ФИТЦ. УЧЁТ В ЛЮМИНИСЦЕНТНОМ МИКРОСКОПЕ ПО СВЕЧЕНИЮ КЛЕТОК.
 III. СЕРОЛОГИЧЕСКИЙ МЕТОД (СЕРОДИАГНОСТИКАОБНАРУЖЕНИЕ АНТИТЕЛ К АНТИГЕНАМ ВИРУСОВ В СЫВОРОТКЕ КРОВИ ПАЦИЕНТОВ). ИСПОЛЬЗУЮТ ПАРНЫЕ СЫВОРОТКИ, ВЗЯТЫЕ С ИНТЕРВАЛОМ С УЧЁТОМ ДИАГНОСТИЧЕСКОГО ТИТРА. 1) РТГА, РСК, ИФА, н. РИФ с антиглобулиновой (люминесцирующей) сывороткой, РИА С АНТИГЕНАМИ ВИРУСОВ ИЛИ ИНАКТИВИРОВАННЫМИ ВИРУСНЫМИ ЧАСТИЦАМИ. 2)РН С ЖИВЫМИ ЛАБОРАТОРНЫМИ ШТАММАМИ ВИРУСА С УЧЁТОМ ПО: ЦВЕТНОЙ ПРОБЕ СОЛКА, РТГАдс, НЕЙТРАЛИЗАЦИЯ ЦПД.
III. СЕРОЛОГИЧЕСКИЙ МЕТОД (СЕРОДИАГНОСТИКАОБНАРУЖЕНИЕ АНТИТЕЛ К АНТИГЕНАМ ВИРУСОВ В СЫВОРОТКЕ КРОВИ ПАЦИЕНТОВ). ИСПОЛЬЗУЮТ ПАРНЫЕ СЫВОРОТКИ, ВЗЯТЫЕ С ИНТЕРВАЛОМ С УЧЁТОМ ДИАГНОСТИЧЕСКОГО ТИТРА. 1) РТГА, РСК, ИФА, н. РИФ с антиглобулиновой (люминесцирующей) сывороткой, РИА С АНТИГЕНАМИ ВИРУСОВ ИЛИ ИНАКТИВИРОВАННЫМИ ВИРУСНЫМИ ЧАСТИЦАМИ. 2)РН С ЖИВЫМИ ЛАБОРАТОРНЫМИ ШТАММАМИ ВИРУСА С УЧЁТОМ ПО: ЦВЕТНОЙ ПРОБЕ СОЛКА, РТГАдс, НЕЙТРАЛИЗАЦИЯ ЦПД.
 Препараты для профилактики краснухи. -краснушная живая моновакцина «Рудивакс» . -Живая вакцина против кори, краснухи и паротита. Содержат живой, аттенуированный и лиофилизированный штамм вируса краснухи. Получают путём культивирования вируса на диплоидных клетках человека. Вводят однократно подкожно или внутримышечно. Иммунитет развивается в среднем через 15 -20 дней и сохраняется до 20 лет. ПРИМЕНЯЮТ В ПЛАНОВОМ ПОРЯДКЕ ВАКЦИНАЦИЯ У ДЕТЕЙ В 12 -15 МЕСЯЦЕВ, РЕВАКЦИНАЦИЯ В 6 ЛЕТ. Выборочная вакцинопрофилактика у серонегативных женщин детородного возраста.
Препараты для профилактики краснухи. -краснушная живая моновакцина «Рудивакс» . -Живая вакцина против кори, краснухи и паротита. Содержат живой, аттенуированный и лиофилизированный штамм вируса краснухи. Получают путём культивирования вируса на диплоидных клетках человека. Вводят однократно подкожно или внутримышечно. Иммунитет развивается в среднем через 15 -20 дней и сохраняется до 20 лет. ПРИМЕНЯЮТ В ПЛАНОВОМ ПОРЯДКЕ ВАКЦИНАЦИЯ У ДЕТЕЙ В 12 -15 МЕСЯЦЕВ, РЕВАКЦИНАЦИЯ В 6 ЛЕТ. Выборочная вакцинопрофилактика у серонегативных женщин детородного возраста.
 Корь
Корь
 Царство: Вирусы Семейство: Paramyxovirid ae Подсемейство: Paramyxovi rinae Род: Morbillivirus Вид: Measles virus Корь – острая вирусная болезнь, характеризующаяся лихорадкой, общей интоксикацией, энантемой, макулопапулёзной сыпью, поражением коньюктивы и верхних отделов респираторного тракта.
Царство: Вирусы Семейство: Paramyxovirid ae Подсемейство: Paramyxovi rinae Род: Morbillivirus Вид: Measles virus Корь – острая вирусная болезнь, характеризующаяся лихорадкой, общей интоксикацией, энантемой, макулопапулёзной сыпью, поражением коньюктивы и верхних отделов респираторного тракта.
 Морфология и ультраструктура вириона Морфология вируса типична для парамиксовирусов. Диаметр вириона 150— 250 нм. Вирион имеет округлую форму, снаружи покрыт липопротеиновым суперкапсидом. Изнутри к суперкапсиду прилегает слой матриксного белка. В центральной части вириона имеется тяж нуклеокапсида со спиральным типом симметрии, свернутый в клубок. Геном вируса — одноцепочечная нефрагментированная (-)РНК. Основные белки: нуклеокапсидный протеин NP, матриксный белок M, а также поверхностные гликозилированные белки липопротеиновой оболочки — гемагглютинин H, белок слияния F и гемолизин. В отличие от других парамиковирусов, у вируса кори отсутствует нейраминидаза.
Морфология и ультраструктура вириона Морфология вируса типична для парамиксовирусов. Диаметр вириона 150— 250 нм. Вирион имеет округлую форму, снаружи покрыт липопротеиновым суперкапсидом. Изнутри к суперкапсиду прилегает слой матриксного белка. В центральной части вириона имеется тяж нуклеокапсида со спиральным типом симметрии, свернутый в клубок. Геном вируса — одноцепочечная нефрагментированная (-)РНК. Основные белки: нуклеокапсидный протеин NP, матриксный белок M, а также поверхностные гликозилированные белки липопротеиновой оболочки — гемагглютинин H, белок слияния F и гемолизин. В отличие от других парамиковирусов, у вируса кори отсутствует нейраминидаза.
 Эпидемиология. Корь является эндемичной инфекцией. До введения обязательной вакцинации была самой распространённой детской болезнью с относительно высокой летальностью. Источник инфекции – больной человек. Определяющим фактором, обусловливающим распространение инфекции, является состояние коллективного иммунитета населения. Вспышки кори возникают при появлении прослойки восприимчивых детей. При попадании вируса в изолированные коллективы, где циркуляции вируса не было, корью заболевают люди всех возрастов. Классическим примером является занос кори на Фарерские острова в 1846 г. , когда корью переболело все население, кроме лиц пожилого возраста, заставших последнюю эпидемию кори. В подобных обстоятельствах корь протекает тяжело и смертность достигает 25%. В основном вспышки кори регистрируются в конце зимы и весной. Вирус выделяется главным образом в продромальном периоде при дыхании и кашле с каплями слизи. Инкубационный период около 10 дней.
Эпидемиология. Корь является эндемичной инфекцией. До введения обязательной вакцинации была самой распространённой детской болезнью с относительно высокой летальностью. Источник инфекции – больной человек. Определяющим фактором, обусловливающим распространение инфекции, является состояние коллективного иммунитета населения. Вспышки кори возникают при появлении прослойки восприимчивых детей. При попадании вируса в изолированные коллективы, где циркуляции вируса не было, корью заболевают люди всех возрастов. Классическим примером является занос кори на Фарерские острова в 1846 г. , когда корью переболело все население, кроме лиц пожилого возраста, заставших последнюю эпидемию кори. В подобных обстоятельствах корь протекает тяжело и смертность достигает 25%. В основном вспышки кори регистрируются в конце зимы и весной. Вирус выделяется главным образом в продромальном периоде при дыхании и кашле с каплями слизи. Инкубационный период около 10 дней.
 Патогенез. Вирус проникает в верхние дыхательные пути и размножается в клетках эпителия слизистой оболочки, носоглотки, трахеи, конъюнктиве глаза и бронхов уже на первой недели инкубации. Лимфогенным путём попадает в кровь (вирусэмия) и вызывает поражения эндотелия сосудов. Экссудация сыворотки в эндотелий капилляров эпидермиса, локальный некроз клеток эндотелия. Сыпь.
Патогенез. Вирус проникает в верхние дыхательные пути и размножается в клетках эпителия слизистой оболочки, носоглотки, трахеи, конъюнктиве глаза и бронхов уже на первой недели инкубации. Лимфогенным путём попадает в кровь (вирусэмия) и вызывает поражения эндотелия сосудов. Экссудация сыворотки в эндотелий капилляров эпидермиса, локальный некроз клеток эндотелия. Сыпь.
 Клиника. Инкубационный период составляет около 10 дней до момента повышения температуры и 14 дней до появления сыпи. В продромальном периоде инфекция напоминает острое респираторное заболевание и протекает с симптомами поражения верхних дыхательных путей (ринит, фарингит, конъюнктивит). Диагностическим признаком являются пятна Коплика — Филатова (везикулы, образовавшиеся в результате некроза эндотелиальных клеток) на слизистой оболочке щек. Сыпь папулезного характера сначала появляется на коже головы (в области лба и за ушами), затем распространяется по всему туловищу и конечностям. Температура держится 7— 8 дней, может сопровождаться судорогами, помутнением сознания. Кашель, резь в глазах, фотофобия, конъюнктивит утяжеляют состояние больного. Осложнением кори является пневмония, в раннем периоде заболевания отек гортани, круп. Редким осложнением (примерно 1 из 2000 случаев) является энцефаломиелит, который обычно возникает у детей старше 8 — 10 лет.
Клиника. Инкубационный период составляет около 10 дней до момента повышения температуры и 14 дней до появления сыпи. В продромальном периоде инфекция напоминает острое респираторное заболевание и протекает с симптомами поражения верхних дыхательных путей (ринит, фарингит, конъюнктивит). Диагностическим признаком являются пятна Коплика — Филатова (везикулы, образовавшиеся в результате некроза эндотелиальных клеток) на слизистой оболочке щек. Сыпь папулезного характера сначала появляется на коже головы (в области лба и за ушами), затем распространяется по всему туловищу и конечностям. Температура держится 7— 8 дней, может сопровождаться судорогами, помутнением сознания. Кашель, резь в глазах, фотофобия, конъюнктивит утяжеляют состояние больного. Осложнением кори является пневмония, в раннем периоде заболевания отек гортани, круп. Редким осложнением (примерно 1 из 2000 случаев) является энцефаломиелит, который обычно возникает у детей старше 8 — 10 лет.
 Лабораторная диагностика. Исследуемый материал: смыв из носоглотки, моча, сыворотка крови. 1. Экспресс-диагностика. *Реакция прямой иммунофлюорисценции. *Цитоскопия (окраска по Романовскому). Видны многоядерные симпласты. 2. Вирусологический метод. * Выделение вируса осуществляют в культурах фибробластов японских перепелок, культурах Не. Lа, Нер2, А-1, почек обезьян. * Индикацию осуществляют по цитопатическому действию вируса - образование гигантских многоядерных клеток. * Идентификация осуществляется с помощью иммунных сывороток в РТГАдс. 3. Серодиагностика (основной метод). * Исследование сыворотки крови больного на наличие противовирусных антител в РТГА, РСК и РПГА.
Лабораторная диагностика. Исследуемый материал: смыв из носоглотки, моча, сыворотка крови. 1. Экспресс-диагностика. *Реакция прямой иммунофлюорисценции. *Цитоскопия (окраска по Романовскому). Видны многоядерные симпласты. 2. Вирусологический метод. * Выделение вируса осуществляют в культурах фибробластов японских перепелок, культурах Не. Lа, Нер2, А-1, почек обезьян. * Индикацию осуществляют по цитопатическому действию вируса - образование гигантских многоядерных клеток. * Идентификация осуществляется с помощью иммунных сывороток в РТГАдс. 3. Серодиагностика (основной метод). * Исследование сыворотки крови больного на наличие противовирусных антител в РТГА, РСК и РПГА.
 Специфическая профилактика Осуществляется путем иммунизации детей в возрасте от 3 месяцев до 1 года живой ослабленной вакциной (вакцинный штамм Ленинград-16, культивируемый на клетках почек морских свинок или фибробластах японских перепелок). Плановая ревакцинация проводится в 9 лет. Кроме того, как средство экстренной профилактики применим иммуноглобулин нормальный донорский (противокоревой). Специфического лечения нет.
Специфическая профилактика Осуществляется путем иммунизации детей в возрасте от 3 месяцев до 1 года живой ослабленной вакциной (вакцинный штамм Ленинград-16, культивируемый на клетках почек морских свинок или фибробластах японских перепелок). Плановая ревакцинация проводится в 9 лет. Кроме того, как средство экстренной профилактики применим иммуноглобулин нормальный донорский (противокоревой). Специфического лечения нет.
 Вирус эпидемического паротита (свинки)
Вирус эпидемического паротита (свинки)
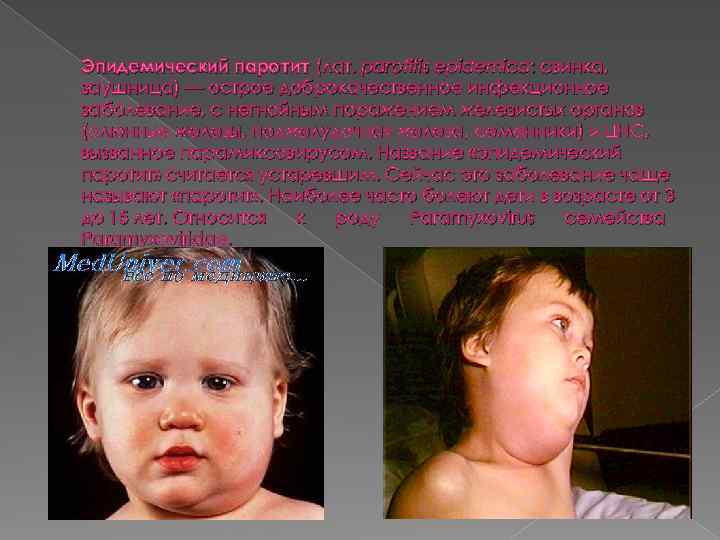 Эпидемический паротит (лат. parotitis epidemica: свинка, заушница) — острое доброкачественное инфекционное заболевание, с негнойным поражением железистых органов (слюнные железы, поджелудочная железа, семенники) и ЦНС, вызванное парамиксовирусом. Название «эпидемический паротит» считается устаревшим. Сейчас это заболевание чаще называют «паротит» . Наиболее часто болеют дети в возрасте от 3 до 15 лет. Относится к роду Paramyxovirus семейства Paramyxoviridae.
Эпидемический паротит (лат. parotitis epidemica: свинка, заушница) — острое доброкачественное инфекционное заболевание, с негнойным поражением железистых органов (слюнные железы, поджелудочная железа, семенники) и ЦНС, вызванное парамиксовирусом. Название «эпидемический паротит» считается устаревшим. Сейчас это заболевание чаще называют «паротит» . Наиболее часто болеют дети в возрасте от 3 до 15 лет. Относится к роду Paramyxovirus семейства Paramyxoviridae.
 Вирионы полиморфны, округлые вирионы имеют диаметр 120— 300 нм. Однонитевая и нефрагментированная «минус» РНК кодирует 8 белков, в том числе Н-, N- и F-белки суперкапсидной оболочки. Вирус обладает гемагглютинирующей, нейраминидазной и гемолитической активностью. Вирус агглютинирует эритроциты кур, уток, морских свинок, собак и др. В лабораторных условиях вирус культивируется на 7 — 8 -дневных куриных эмбрионах и клеточных культурах. К вирусу чувствительны первично трипсинизированные культуры клеток почки морской свинки, обезьян, сирийского хомяка, фибробласты куриных эмбрионов. Лабораторные животные малочувствительны к вирусу паротита, только у обезьян удается воспроизвести заболевание, сходное с паротитом человека. Вирус нестоек, инактивируется при нагревании, при ультрафиолетовом облучении, при контакте с жирорастворителями, 2 % раствором формалина, 1 % раствором лизола. Антигенная структура вируса стабильна. Он содержит антигены, способные вызвать образование нейтрализующих и комплементсвязывающих антител.
Вирионы полиморфны, округлые вирионы имеют диаметр 120— 300 нм. Однонитевая и нефрагментированная «минус» РНК кодирует 8 белков, в том числе Н-, N- и F-белки суперкапсидной оболочки. Вирус обладает гемагглютинирующей, нейраминидазной и гемолитической активностью. Вирус агглютинирует эритроциты кур, уток, морских свинок, собак и др. В лабораторных условиях вирус культивируется на 7 — 8 -дневных куриных эмбрионах и клеточных культурах. К вирусу чувствительны первично трипсинизированные культуры клеток почки морской свинки, обезьян, сирийского хомяка, фибробласты куриных эмбрионов. Лабораторные животные малочувствительны к вирусу паротита, только у обезьян удается воспроизвести заболевание, сходное с паротитом человека. Вирус нестоек, инактивируется при нагревании, при ультрафиолетовом облучении, при контакте с жирорастворителями, 2 % раствором формалина, 1 % раствором лизола. Антигенная структура вируса стабильна. Он содержит антигены, способные вызвать образование нейтрализующих и комплементсвязывающих антител.

 Эпидемиология Эпидемический паротит или свинка наиболее часто поражает детей в возрасте от 5 до 15 лет. Заражение происходит воздушно-капельным путём (при кашле, чихании, разговоре) от больного человека, который заражен до 9 -х суток. Также существует несколько мутаций вируса, передающихся половым путём (из-за этого болезнь иногда классифицируют как венерическую). В 30 -40% наблюдается бессимптомная инфекция с развитием прочного иммунитета. Лица с бессимптомной формой инфекции столь же опасны для окружающих. Больной заразен за два дня до начала болезни. Инкубационный период 11 — 23 дней, чаще 13 — 19 дней.
Эпидемиология Эпидемический паротит или свинка наиболее часто поражает детей в возрасте от 5 до 15 лет. Заражение происходит воздушно-капельным путём (при кашле, чихании, разговоре) от больного человека, который заражен до 9 -х суток. Также существует несколько мутаций вируса, передающихся половым путём (из-за этого болезнь иногда классифицируют как венерическую). В 30 -40% наблюдается бессимптомная инфекция с развитием прочного иммунитета. Лица с бессимптомной формой инфекции столь же опасны для окружающих. Больной заразен за два дня до начала болезни. Инкубационный период 11 — 23 дней, чаще 13 — 19 дней.
 Патогенез Местом первичной репродукции вируса является эпителий слизистых оболочек носоглотки и полости рта. Затем по стенонову протоку вирус проникает в околоушную слюнную железу. Лимфогенным путем вирус может попадать в кровеносное русло (вирусемия). Вирус паротита способен поражать внутренние органы: яички, яичники, поджелудочную и щитовидную железы, почки, головной мозг, вызывая серьезные осложнения (орхит, оофорит, менингоэнцефалит, тиреоидит, панкреатит, нефрит). Орхит наблюдается почти в 20% случаев свинки у лиц мужского пола. Последствием перенесенного двустороннего орхита является половая стерильность. Постинфекционный иммунитет пожизненный.
Патогенез Местом первичной репродукции вируса является эпителий слизистых оболочек носоглотки и полости рта. Затем по стенонову протоку вирус проникает в околоушную слюнную железу. Лимфогенным путем вирус может попадать в кровеносное русло (вирусемия). Вирус паротита способен поражать внутренние органы: яички, яичники, поджелудочную и щитовидную железы, почки, головной мозг, вызывая серьезные осложнения (орхит, оофорит, менингоэнцефалит, тиреоидит, панкреатит, нефрит). Орхит наблюдается почти в 20% случаев свинки у лиц мужского пола. Последствием перенесенного двустороннего орхита является половая стерильность. Постинфекционный иммунитет пожизненный.
 Лабораторная диагностика Исследуемый материал: слюна или спинномозговая жидкость, сыворотка крови. 1. Вирусологический метод. • Выделение вируса осуществляют в 7 -9 -дневных куриных эмбрионах или клеточных культурах. Материал вводят в амниотическую полость. Вирус обычно не вызывает видимых изменений в тканях эмбриона. • Индикацию чаще всего проводят в реакции гемагглютинации (эмбрион) или РГАдс с эритроцитами морской свинки (культуры клеток). • Идентификация осуществляется помощью стандартной антисыворотки в РТГА и РТГАдс. 2. Серодиагностика. Исследование парных проб сыворотки крови больного (интервал 10 -14 дней) на наличие противовирусных антител в РТГА. Нарастание титра во второй сыворотке в 4 и более раз указывает на парагриппозную инфекцию.
Лабораторная диагностика Исследуемый материал: слюна или спинномозговая жидкость, сыворотка крови. 1. Вирусологический метод. • Выделение вируса осуществляют в 7 -9 -дневных куриных эмбрионах или клеточных культурах. Материал вводят в амниотическую полость. Вирус обычно не вызывает видимых изменений в тканях эмбриона. • Индикацию чаще всего проводят в реакции гемагглютинации (эмбрион) или РГАдс с эритроцитами морской свинки (культуры клеток). • Идентификация осуществляется помощью стандартной антисыворотки в РТГА и РТГАдс. 2. Серодиагностика. Исследование парных проб сыворотки крови больного (интервал 10 -14 дней) на наличие противовирусных антител в РТГА. Нарастание титра во второй сыворотке в 4 и более раз указывает на парагриппозную инфекцию.
 Специфическая профилактика Иммунизация проводится однократно на первом году жизни с помощью живой ослабленной вакцины , полученной на куриных эмбрионах. Специфического лечения нет.
Специфическая профилактика Иммунизация проводится однократно на первом году жизни с помощью живой ослабленной вакцины , полученной на куриных эмбрионах. Специфического лечения нет.
 Аденовирусы
Аденовирусы
 Классификация вируса Царство – Vira Подцарство – ДНК-содержащие Семейство – Adenoviridae Роды: › › › Atadenovirus Aviadenovirus Ichtadenovirus Mastadenovirus Siadenovirus В настоящее время известно более 90 серотипов аденовирусов млекопитающих. Из них 49 серотипов являются патогенными для человека.
Классификация вируса Царство – Vira Подцарство – ДНК-содержащие Семейство – Adenoviridae Роды: › › › Atadenovirus Aviadenovirus Ichtadenovirus Mastadenovirus Siadenovirus В настоящее время известно более 90 серотипов аденовирусов млекопитающих. Из них 49 серотипов являются патогенными для человека.
 Строение вирионов вируса Нуклеокапсид покрыт белковой мембраной. Капсид построен из 252 капсомеров по кубическому типу симметрии в форме икосаэдра. Диаметр вириона – 70 -90 нм. От 12 вершин икосаэдра Микрофотография аденовируса на отходят отростки фибры (нити). Внешняя просвечивающем электронном микроскопе. оболочка отсутствует.
Строение вирионов вируса Нуклеокапсид покрыт белковой мембраной. Капсид построен из 252 капсомеров по кубическому типу симметрии в форме икосаэдра. Диаметр вириона – 70 -90 нм. От 12 вершин икосаэдра Микрофотография аденовируса на отходят отростки фибры (нити). Внешняя просвечивающем электронном микроскопе. оболочка отсутствует.
 Строение вирионов вируса Геном аденовирусов состоит из двунитевой линейной ДНК с молекулярной массой 2025 м. Д. С молекулой ДНК ковалентно связан внутренний белок, инициирующий репликацию ДНК. Внутренние белки в комплексе с ДНК формируют сердцевину вириона, расположенную под вершинами капсида.
Строение вирионов вируса Геном аденовирусов состоит из двунитевой линейной ДНК с молекулярной массой 2025 м. Д. С молекулой ДНК ковалентно связан внутренний белок, инициирующий репликацию ДНК. Внутренние белки в комплексе с ДНК формируют сердцевину вириона, расположенную под вершинами капсида.
 Эпидемиология заболевания Источник инфекции – больные с клинически выраженными или стертыми формами заболевания. Пути передачи – воздушно-капельный, реже алиментарный. Повышение заболеваемости отмечается в холодное время года. Восприимчивый коллектив – дети, военнослужащие. «Кишечные» аденовирусы выделяются с фекалиями и распространяются фекально-оральным путем. Аденовирусные инфекции чаще поражают детей в возрасте от 6 мес. до 2 лет. Аденовирусы обладают сравнительно высокой устойчивостью к действию физических и химических факторов. Они способны длительное время сохранять инфекционность во внешней среде, особенно при пониженных температурах. Аденовирусы инактивируются через несколько минут при температуре выше 56°С и при УФ-облучении.
Эпидемиология заболевания Источник инфекции – больные с клинически выраженными или стертыми формами заболевания. Пути передачи – воздушно-капельный, реже алиментарный. Повышение заболеваемости отмечается в холодное время года. Восприимчивый коллектив – дети, военнослужащие. «Кишечные» аденовирусы выделяются с фекалиями и распространяются фекально-оральным путем. Аденовирусные инфекции чаще поражают детей в возрасте от 6 мес. до 2 лет. Аденовирусы обладают сравнительно высокой устойчивостью к действию физических и химических факторов. Они способны длительное время сохранять инфекционность во внешней среде, особенно при пониженных температурах. Аденовирусы инактивируются через несколько минут при температуре выше 56°С и при УФ-облучении.
 Патогенез Ворота инфекции – слизистые оболочки верхних дыхательных путей, кишечника, реже конъюктива глаза. Первичная репродукция аденовирусов в эпителиальных клетках слизистой оболочки дыхательных путей и кишечника, в конъюнктиве глаза и в лимфоидной ткани (миндалины, мезентериальные лимфатические узлы). Развитие генерализованной лимфаденопатии. Общее токсическое действие на организм в виде лихорадки и симптомов общей интоксикации. Циркуляция аденовирусов в крови поражение эндотелия сосудов. Это приводит к экссудативному воспалению слизистых оболочек, к образованию фибринозных пленок и некрозу. Аденовирусы могут проникать через плаценту, вызывая внутриутробные заболевания, аномалии развития плода, смертельные пневмонии новорожденных.
Патогенез Ворота инфекции – слизистые оболочки верхних дыхательных путей, кишечника, реже конъюктива глаза. Первичная репродукция аденовирусов в эпителиальных клетках слизистой оболочки дыхательных путей и кишечника, в конъюнктиве глаза и в лимфоидной ткани (миндалины, мезентериальные лимфатические узлы). Развитие генерализованной лимфаденопатии. Общее токсическое действие на организм в виде лихорадки и симптомов общей интоксикации. Циркуляция аденовирусов в крови поражение эндотелия сосудов. Это приводит к экссудативному воспалению слизистых оболочек, к образованию фибринозных пленок и некрозу. Аденовирусы могут проникать через плаценту, вызывая внутриутробные заболевания, аномалии развития плода, смертельные пневмонии новорожденных.
 Клиника Инкубационный период – от 4 до 14 дней. (чаще 5 -7 дней) Чаще всего аденовирусы вызывают острые респираторные заболевания (фарингиты, ларингиты, трахеобронхиты). У детей и у пожилых людей могут развиться затяжные формы мелкоочаговой или интерстициальной аденовирусной пневмонии (серотипы 3, 4, 7, 14). Для аденовирусной инфекции характерно сочетанное поражение слизистой оболочки и лимфоидных тканей миндалин, аденоидов и конъюнктивы глаза (фаринго-конъюнктивальная лихорадка). Нередки случаи эпидемических вспышек конъюнктивитов одного или обоих глаз (серотипы 3, 4, 8, 19).
Клиника Инкубационный период – от 4 до 14 дней. (чаще 5 -7 дней) Чаще всего аденовирусы вызывают острые респираторные заболевания (фарингиты, ларингиты, трахеобронхиты). У детей и у пожилых людей могут развиться затяжные формы мелкоочаговой или интерстициальной аденовирусной пневмонии (серотипы 3, 4, 7, 14). Для аденовирусной инфекции характерно сочетанное поражение слизистой оболочки и лимфоидных тканей миндалин, аденоидов и конъюнктивы глаза (фаринго-конъюнктивальная лихорадка). Нередки случаи эпидемических вспышек конъюнктивитов одного или обоих глаз (серотипы 3, 4, 8, 19).
 Клиника Аденовирусные конъюнктивиты и кератоконъюнктивиты нередко являются госпитальными инфекциями. Кишечные аденовирусы (серотипы 40, 41) вызывают у детей младшего возраста вспышки гастроэнтерита. В некоторых случаях наблюдаются длительная персистенция аденовирусов в организме человека и переход в хроническую форму инфекции (хронические тонзиллиты, гаймориты, ангины и др. ). У детей возможна аллергизация организма, сопровождающаяся развитием астматического бронхита и ларинготрахеита. Ряд серотипов аденовирусов индуцирует опухоли у животных.
Клиника Аденовирусные конъюнктивиты и кератоконъюнктивиты нередко являются госпитальными инфекциями. Кишечные аденовирусы (серотипы 40, 41) вызывают у детей младшего возраста вспышки гастроэнтерита. В некоторых случаях наблюдаются длительная персистенция аденовирусов в организме человека и переход в хроническую форму инфекции (хронические тонзиллиты, гаймориты, ангины и др. ). У детей возможна аллергизация организма, сопровождающаяся развитием астматического бронхита и ларинготрахеита. Ряд серотипов аденовирусов индуцирует опухоли у животных.
 Иммунитет После перенесения заболевания формируется типоспецифический гуморальный иммунитет, связанный с синтезом антител класса Ig. M и Ig. G, в носовом секрете выявляются SIg. A. Иммунитет не длительный. Повторные заболевания наблюдаются у детей через 8 -12 мес. после перенесения первичной инфекции.
Иммунитет После перенесения заболевания формируется типоспецифический гуморальный иммунитет, связанный с синтезом антител класса Ig. M и Ig. G, в носовом секрете выявляются SIg. A. Иммунитет не длительный. Повторные заболевания наблюдаются у детей через 8 -12 мес. после перенесения первичной инфекции.
 Лабораторная диагностика Исследуемый материал: смывы из носоглотки, сыворотка крови. 1. Экспресс-диагностика. › Реакция прямой иммунофлюоресценции. 2. Вирусологический метод. › Выделение вируса в культурах Hep-2, Hela, клеток почек эмбриона человека. › Индикация по цитопатическому действию вируса. › Идентификация с помощью иммунных сывороток в РИФ и РСК. 3. Серодиагностика. › Исследуют парные сыворотки, взятые с интервалом 10 -14 дней, при помощи РСК и РТГА. Диагностическим является нарастание титра антител в 4 раза и более.
Лабораторная диагностика Исследуемый материал: смывы из носоглотки, сыворотка крови. 1. Экспресс-диагностика. › Реакция прямой иммунофлюоресценции. 2. Вирусологический метод. › Выделение вируса в культурах Hep-2, Hela, клеток почек эмбриона человека. › Индикация по цитопатическому действию вируса. › Идентификация с помощью иммунных сывороток в РИФ и РСК. 3. Серодиагностика. › Исследуют парные сыворотки, взятые с интервалом 10 -14 дней, при помощи РСК и РТГА. Диагностическим является нарастание титра антител в 4 раза и более.
 Профилактика и лечение. Для профилактики и раннего лечения аденовирусных инфекций применяют лейкоцитарный интерферон, а также фермент дезоксирибонуклеазу. Инактивированная (формалином) аденовирусная вакцина серотипов 3, 4, 7. Специфическая терапия отсутствует.
Профилактика и лечение. Для профилактики и раннего лечения аденовирусных инфекций применяют лейкоцитарный интерферон, а также фермент дезоксирибонуклеазу. Инактивированная (формалином) аденовирусная вакцина серотипов 3, 4, 7. Специфическая терапия отсутствует.
 Натуральная оспа
Натуральная оспа
 Вирус натуральной оспы. Возбудитель оспы относится к вирусам семейства Poxviridae, подсемейства Chordopoxviridae, рода Orthopoxvirus; Poxviridae – семейство крупных ДНК-содержащих вирусов, вызывающих у человека, животных (коров, овец, коз, верблюдов, лошадей, свиней, кроликов) и птиц заболевания с выраженным поражением кожи - пустулезного дерматита, папулезного стоматита, миксомы и конгиозного моллюска человека, т. е. натуральную оспу. Внутриклеточные (точнее околоядерные) включения в клетках роговицы заражённого кролика впервые обнаружил итальянский патолог Д. Гварнери (1892). Dирусные корпускулы в отделяемом везикул открыл немецкий бактериолог Э. Пашен (1906). Позднее было установлено наличие двух штаммов вируса натуральной оспы. Первый вызывает классическую оспу (variola major) с летальностью, превышающей 50%, второй — алястрим (variola minor) с более лёгким течением и летальностью, не превышающей 1%. Возбудители идентичны по основным свойствам. Отличительные особенности — способность вируса алястрима размножаться в куриных эмбрионах при более низкой температуре (37, 5 °С), образовывать бляшки и проявлять цитопатичес-кий эффект в культуре куриных фибробластов при температуре 37 °С.
Вирус натуральной оспы. Возбудитель оспы относится к вирусам семейства Poxviridae, подсемейства Chordopoxviridae, рода Orthopoxvirus; Poxviridae – семейство крупных ДНК-содержащих вирусов, вызывающих у человека, животных (коров, овец, коз, верблюдов, лошадей, свиней, кроликов) и птиц заболевания с выраженным поражением кожи - пустулезного дерматита, папулезного стоматита, миксомы и конгиозного моллюска человека, т. е. натуральную оспу. Внутриклеточные (точнее околоядерные) включения в клетках роговицы заражённого кролика впервые обнаружил итальянский патолог Д. Гварнери (1892). Dирусные корпускулы в отделяемом везикул открыл немецкий бактериолог Э. Пашен (1906). Позднее было установлено наличие двух штаммов вируса натуральной оспы. Первый вызывает классическую оспу (variola major) с летальностью, превышающей 50%, второй — алястрим (variola minor) с более лёгким течением и летальностью, не превышающей 1%. Возбудители идентичны по основным свойствам. Отличительные особенности — способность вируса алястрима размножаться в куриных эмбрионах при более низкой температуре (37, 5 °С), образовывать бляшки и проявлять цитопатичес-кий эффект в культуре куриных фибробластов при температуре 37 °С.
 Вирус натуральной оспы
Вирус натуральной оспы
 Морфология Вирус оспы отличается сложностью строения, он имеет форму параллелепипеда с закругленными углами. Размер его 200— 250 нм. Он состоит из нуклеотида, покрытого трехслойной оболочкой. От наружного осмиофильного слоя отходят ворсинки. На противоположных сторонах вириона под оболочкой расположены два боковых тела, похожие на линзы.
Морфология Вирус оспы отличается сложностью строения, он имеет форму параллелепипеда с закругленными углами. Размер его 200— 250 нм. Он состоит из нуклеотида, покрытого трехслойной оболочкой. От наружного осмиофильного слоя отходят ворсинки. На противоположных сторонах вириона под оболочкой расположены два боковых тела, похожие на линзы.
 Культивирование Вирус натуральной оспы хорошо развивается в куриных эмбрионах, спустя 48— 72 часа после заражения. На хорион – аллантоисной оболочке вызывает образование белых мелких, плотных, резко отграниченных от окружающей ткани точечных поражений. Вирус хорошо культивируется на первичных и перевиваемых клеточных культурах человека, обезьяны, овцы и других животных, в которых обнаруживаются через 24— 72 часа после заражения выраженное цитопатическое действие, проявляющихся округлением и увеличением клеток с последующим их отторжением их от стекла.
Культивирование Вирус натуральной оспы хорошо развивается в куриных эмбрионах, спустя 48— 72 часа после заражения. На хорион – аллантоисной оболочке вызывает образование белых мелких, плотных, резко отграниченных от окружающей ткани точечных поражений. Вирус хорошо культивируется на первичных и перевиваемых клеточных культурах человека, обезьяны, овцы и других животных, в которых обнаруживаются через 24— 72 часа после заражения выраженное цитопатическое действие, проявляющихся округлением и увеличением клеток с последующим их отторжением их от стекла.
 Антигенная структура У вируса натуральной оспы не обнаружено антигенных разновидностей или вариантов, он имеет общие антигены с вирусом вакцины. Различают четыре антигена: растворимые L и S, нуклеопротеидный (NP), антигены и Х –гемагллютиин. Вирус оспы имеет общие антигены с эритроцитами человека
Антигенная структура У вируса натуральной оспы не обнаружено антигенных разновидностей или вариантов, он имеет общие антигены с вирусом вакцины. Различают четыре антигена: растворимые L и S, нуклеопротеидный (NP), антигены и Х –гемагллютиин. Вирус оспы имеет общие антигены с эритроцитами человека
 Резистентность Возбудитель оспы устойчив к действию фенола, высыханию, в высушенных оспенных корочках и в 50% глицерине сохраняется месяцами, легко переносят низкую температуру. Вирус чувствителен к действию света, при температуре 1000 С погибает моментально. При 600 С в течение 1 часа; 3% раствор хлорамина, фенола, лизола инактивирую вирус через 30 минут, а 1% раствор хлорной извести – через 1 час; при действии перманганата калия погибает через 70 минут.
Резистентность Возбудитель оспы устойчив к действию фенола, высыханию, в высушенных оспенных корочках и в 50% глицерине сохраняется месяцами, легко переносят низкую температуру. Вирус чувствителен к действию света, при температуре 1000 С погибает моментально. При 600 С в течение 1 часа; 3% раствор хлорамина, фенола, лизола инактивирую вирус через 30 минут, а 1% раствор хлорной извести – через 1 час; при действии перманганата калия погибает через 70 минут.
 Патогенность для животных К вирусу натуральной оспы чувствительны обезьяны; при введении им вируса в кожу или тестикулы появляется специфические высыпания на коже, развивается архит, а иногда генерализация процесса. У кроликов и морских свинок наблюдаются незначительные местные поражения, а у новорожденных белых мышей при заражении в мозг развивается оспенный энцефалит.
Патогенность для животных К вирусу натуральной оспы чувствительны обезьяны; при введении им вируса в кожу или тестикулы появляется специфические высыпания на коже, развивается архит, а иногда генерализация процесса. У кроликов и морских свинок наблюдаются незначительные местные поражения, а у новорожденных белых мышей при заражении в мозг развивается оспенный энцефалит.
 Натуральная оспа относится к антропонозам и представляет собой высококонтагиозную, особо опасную инфекцию. К оспе восприимчивы все люди, если у них нет иммунитета, полученного в результате перенесенного ранее заболевания или вакцинации. Натуральная оспа была широко распространена в Азии и Африке. Является воздушно-капельной инфекцией, однако возможна инокуляция вируса при непосредственном соприкосновении с пораженной кожей больного или инфицированными им предметами. Заразность больного наблюдается на протяжении всего заболевания — от последних дней инкубации до отторжения корочек. Трупы умерших от оспы также сохраняют высокую заразность.
Натуральная оспа относится к антропонозам и представляет собой высококонтагиозную, особо опасную инфекцию. К оспе восприимчивы все люди, если у них нет иммунитета, полученного в результате перенесенного ранее заболевания или вакцинации. Натуральная оспа была широко распространена в Азии и Африке. Является воздушно-капельной инфекцией, однако возможна инокуляция вируса при непосредственном соприкосновении с пораженной кожей больного или инфицированными им предметами. Заразность больного наблюдается на протяжении всего заболевания — от последних дней инкубации до отторжения корочек. Трупы умерших от оспы также сохраняют высокую заразность.
 Патогенез При вдыхании зараженного воздуха вирусы попадают в респираторный тракт. Возможно заражение через кожу при вариоляции и трансплацентарно. Вирус поступает в ближайшие лимфатические узлы и далее в кровь, что приводит к виремии. Гематогенно инфицируется эпителий, здесь происходит размножение вируса, с чем связано появление энантемы и экзантемы. Ослабление иммунитета ведет к активации вторичной флоры и превращению везикул в пустулы. Вследствие гибели росткового слоя эпидермиса, глубоких нагноительных и деструктивных процессов формируются рубцы. Может развиться инфекционно-токсический шок. Для тяжелых форм характерно развитие геморрагического синдрома.
Патогенез При вдыхании зараженного воздуха вирусы попадают в респираторный тракт. Возможно заражение через кожу при вариоляции и трансплацентарно. Вирус поступает в ближайшие лимфатические узлы и далее в кровь, что приводит к виремии. Гематогенно инфицируется эпителий, здесь происходит размножение вируса, с чем связано появление энантемы и экзантемы. Ослабление иммунитета ведет к активации вторичной флоры и превращению везикул в пустулы. Вследствие гибели росткового слоя эпидермиса, глубоких нагноительных и деструктивных процессов формируются рубцы. Может развиться инфекционно-токсический шок. Для тяжелых форм характерно развитие геморрагического синдрома.
 Клиника При типичном течении оспы инкубационный период длится 8— 12 дней. Начальный период характеризуется ознобом, повышением температуры тела, сильными рвущими болями в пояснице, крестце и конечностях, сильной жаждой, головокружением, головной болью, рвотой. Иногда начало болезни мягкое. На 2— 4 -й день на фоне лихорадки появляется инициальная сыпь на коже либо в виде участков гиперемии (кореподобная, розеолезная, эритематозная), либо геморрагическая сыпь по обеим сторонам грудной клетки в области грудных мышц до подмышечных впадин, а также ниже пупка в области паховых складок и внутренних поверхностей бедер ( «треугольник Симона» ); кровоизлияния выглядят как пурпура и даже как экхимозы. Пятнистая сыпь держится несколько часов, геморрагическая — более продолжительное время. На 4 -й день наблюдается снижение температуры тела, ослабляются клинические симптомы начального периода, но появляются типичные оспины на коже головы, лица, туловища и конечностей, которые проходят стадии пятна, папулы, пузырька, пустулы, образования корочек, отторжения последних и образования рубца. Одновременно появляются оспины на слизистой оболочке носа, ротоглотки, гортани, трахеи, бронхах, конъюнктивах, прямой кишке, женских половых органов, мочеиспускательного канала. Они вскоре превращаются в эрозии. На 8— 9 -й дни болезни в стадии нагноения пузырьков вновь ухудшается самочувствие больных, возникают признаки токсической энцефалопатии (нарушение сознания, бред, возбуждение, у детей — судороги). Период подсыхания и отпадения корок занимает около 1— 2 недель. На лице и волосистой части головы образуются многочисленные рубцы
Клиника При типичном течении оспы инкубационный период длится 8— 12 дней. Начальный период характеризуется ознобом, повышением температуры тела, сильными рвущими болями в пояснице, крестце и конечностях, сильной жаждой, головокружением, головной болью, рвотой. Иногда начало болезни мягкое. На 2— 4 -й день на фоне лихорадки появляется инициальная сыпь на коже либо в виде участков гиперемии (кореподобная, розеолезная, эритематозная), либо геморрагическая сыпь по обеим сторонам грудной клетки в области грудных мышц до подмышечных впадин, а также ниже пупка в области паховых складок и внутренних поверхностей бедер ( «треугольник Симона» ); кровоизлияния выглядят как пурпура и даже как экхимозы. Пятнистая сыпь держится несколько часов, геморрагическая — более продолжительное время. На 4 -й день наблюдается снижение температуры тела, ослабляются клинические симптомы начального периода, но появляются типичные оспины на коже головы, лица, туловища и конечностей, которые проходят стадии пятна, папулы, пузырька, пустулы, образования корочек, отторжения последних и образования рубца. Одновременно появляются оспины на слизистой оболочке носа, ротоглотки, гортани, трахеи, бронхах, конъюнктивах, прямой кишке, женских половых органов, мочеиспускательного канала. Они вскоре превращаются в эрозии. На 8— 9 -й дни болезни в стадии нагноения пузырьков вновь ухудшается самочувствие больных, возникают признаки токсической энцефалопатии (нарушение сознания, бред, возбуждение, у детей — судороги). Период подсыхания и отпадения корок занимает около 1— 2 недель. На лице и волосистой части головы образуются многочисленные рубцы


 Диагностика вируса натуральной оспы включает вирусоскопические, вирусологические и серологические методы. Материал для исследований — содержимое пузырьков и отделяемое пустул. • Наиболее эффективный метод диагностики вируса натуральной оспы — электронная микроскопия материала. При отсутствии соответствующего оборудования можно проводить световую микроскопию окрашенных мазков для выявления телец Пашена-Гварнери (ацидофильные овальные структуры, располагающиеся около ядра). Для экспрессдиагностики проводят определение вирусных Аг в мазках-отпечатках с помощью РНИФ. В отделяемом пузырьков и пустул вирусные Аг определяют в реакциях иммунодиффузии, РСК или ИФА.
Диагностика вируса натуральной оспы включает вирусоскопические, вирусологические и серологические методы. Материал для исследований — содержимое пузырьков и отделяемое пустул. • Наиболее эффективный метод диагностики вируса натуральной оспы — электронная микроскопия материала. При отсутствии соответствующего оборудования можно проводить световую микроскопию окрашенных мазков для выявления телец Пашена-Гварнери (ацидофильные овальные структуры, располагающиеся около ядра). Для экспрессдиагностики проводят определение вирусных Аг в мазках-отпечатках с помощью РНИФ. В отделяемом пузырьков и пустул вирусные Аг определяют в реакциях иммунодиффузии, РСК или ИФА.

 • Выделение возбудителя натуральной оспы проводят заражением хорионаллантоисной оболочки куриных эмбрионов, где вирус образует белёсые бляшки. Также можно использовать культуры фибробластов эмбриона человека или клеток почек обезьян и оценивать цитопатический эффект (изменение морфологии и гибель клеток). Характер повреждений, а также предельная температура размножения вируса помогают дифференцировать возбудителя натуральной оспы от вирусов оспы животных (обезьян, верблюдов, коров и т. д. ).
• Выделение возбудителя натуральной оспы проводят заражением хорионаллантоисной оболочки куриных эмбрионов, где вирус образует белёсые бляшки. Также можно использовать культуры фибробластов эмбриона человека или клеток почек обезьян и оценивать цитопатический эффект (изменение морфологии и гибель клеток). Характер повреждений, а также предельная температура размножения вируса помогают дифференцировать возбудителя натуральной оспы от вирусов оспы животных (обезьян, верблюдов, коров и т. д. ).
 Идентификацию возбудителя натуральной оспы проводят в РН, РТГА и РПГА.
Идентификацию возбудителя натуральной оспы проводят в РН, РТГА и РПГА.
 В дифференциации натуральной оспы от ветряной оспы генирализованной вакцины аластрима учитываются характер высыпаний, очередность их появлений и исчезновения, полиморфизм, особенности, свойственные их возбудителям при культивировании культуры клеток и культурных эмбрионах, лабораторные данные.
В дифференциации натуральной оспы от ветряной оспы генирализованной вакцины аластрима учитываются характер высыпаний, очередность их появлений и исчезновения, полиморфизм, особенности, свойственные их возбудителям при культивировании культуры клеток и культурных эмбрионах, лабораторные данные.
 Электронная микроскопия (ЭМ). С помощью этого метода можно обнаружить собственно вирус. Для успешного определения вируса его концентрация в пробе должна быть примерно 1· 106 частиц в 1 мл. Но поскольку концентрация возбудителя, как правило, в материале от больных незначительна, то поиск вируса затруднен и требует предварительного его осаждения с помощью высокоскоростного центрифугирования с последующим негативным контрастированием. Кроме того, ЭМ не позволяет типировать вирусы, так как у многих из них нет морфологических различий внутри семейства. Например, вирусы простого герпеса, цитомегалии или опоясывающего герпеса морфологически практически неотличимы. Одним из вариантов ЭМ, используемым в диагностических целях, является иммунная электронная микроскопия (ИЭМ), при которой применяются специфические антитела к вирусам. В результате взаимодействия антител с вирусами образуются комплексы, которые после негативного контрастирования легче обнаруживаются. ИЭМ несколько более чувствительна, чем ЭМ, и используется в тех случаях, когда вирус не удается культивировать in vitro, например при поиске возбудителей вирусных гепатитов.
Электронная микроскопия (ЭМ). С помощью этого метода можно обнаружить собственно вирус. Для успешного определения вируса его концентрация в пробе должна быть примерно 1· 106 частиц в 1 мл. Но поскольку концентрация возбудителя, как правило, в материале от больных незначительна, то поиск вируса затруднен и требует предварительного его осаждения с помощью высокоскоростного центрифугирования с последующим негативным контрастированием. Кроме того, ЭМ не позволяет типировать вирусы, так как у многих из них нет морфологических различий внутри семейства. Например, вирусы простого герпеса, цитомегалии или опоясывающего герпеса морфологически практически неотличимы. Одним из вариантов ЭМ, используемым в диагностических целях, является иммунная электронная микроскопия (ИЭМ), при которой применяются специфические антитела к вирусам. В результате взаимодействия антител с вирусами образуются комплексы, которые после негативного контрастирования легче обнаруживаются. ИЭМ несколько более чувствительна, чем ЭМ, и используется в тех случаях, когда вирус не удается культивировать in vitro, например при поиске возбудителей вирусных гепатитов.
 Реакция иммунофлюоресценции (РИФ). Метод основан на использовании антител, связанных с красителем, например флюоресцеинизотиоцианатом. РИФ широко применяется для выявления вирусных антигенов в материале больных и для быстрой диагностики. В практике применяются два варианта РИФ: прямой и непрямой. В первом случае применяются меченные красителем антитела к вирусам, которые наносятся на инфицированные клетки (мазок, культура клеток). Таким образом, реакция протекает одноэтапно. Неудобством метода является необходимость иметь большой набор конъюгированных специфических сывороток ко многим вирусам. При непрямом варианте РИФ на исследуемый материал наносится специфическая сыворотка, антитела которой связываются с вирусным антигеном, находящимся в материале, а затем наслаивается антивидовая сыворотка к гаммаглобулинам животного, в котором готовилась специфическая иммунная сыворотка, например антикроличья, антилошадиная и т. п. Преимущество непрямого варианта РИФ состоит в потребности лишь одного вида меченых антител. Метод РИФ широко применяется для быстрой расшифровки этиологии острых респираторных вирусных инфекций при анализе мазков-отпечатков со слизистой оболочки верхних дыхательных путей. Успешное применение РИФ для прямой детекции вируса в клиническом материале возможно лишь в случае содержания в нем достаточно большого числа инфицированных клеток и незначительной контаминации микроорганизмами, которые могут давать неспецифическое свечение.
Реакция иммунофлюоресценции (РИФ). Метод основан на использовании антител, связанных с красителем, например флюоресцеинизотиоцианатом. РИФ широко применяется для выявления вирусных антигенов в материале больных и для быстрой диагностики. В практике применяются два варианта РИФ: прямой и непрямой. В первом случае применяются меченные красителем антитела к вирусам, которые наносятся на инфицированные клетки (мазок, культура клеток). Таким образом, реакция протекает одноэтапно. Неудобством метода является необходимость иметь большой набор конъюгированных специфических сывороток ко многим вирусам. При непрямом варианте РИФ на исследуемый материал наносится специфическая сыворотка, антитела которой связываются с вирусным антигеном, находящимся в материале, а затем наслаивается антивидовая сыворотка к гаммаглобулинам животного, в котором готовилась специфическая иммунная сыворотка, например антикроличья, антилошадиная и т. п. Преимущество непрямого варианта РИФ состоит в потребности лишь одного вида меченых антител. Метод РИФ широко применяется для быстрой расшифровки этиологии острых респираторных вирусных инфекций при анализе мазков-отпечатков со слизистой оболочки верхних дыхательных путей. Успешное применение РИФ для прямой детекции вируса в клиническом материале возможно лишь в случае содержания в нем достаточно большого числа инфицированных клеток и незначительной контаминации микроорганизмами, которые могут давать неспецифическое свечение.
 Иммуноферментный анализ (ИФА). Иммуноферментные методы определения вирусных антигенов в принципе сходны с РИФ, но основываются на мечении антител ферментами, а не красителями. Наиболее широко используется пероксидаза хрена и щелочная фосфатаза, применяют также а-галактозидазу и в-лактамазы. Меченые антитела связываются с антигеном, и такой комплекс обнаруживается при добавлении субстрата для фермента, с которым конъюгированы антитела. Конечный продукт реакции может быть в виде нерастворимого осадка, и тогда учет проводится с помощью обычного светового микроскопа, или в виде растворимого продукта, который обычно окрашен (или может флюоресцировать или люминесцировать) и регистрируется инструментально. Поскольку с помощью ИФА можно измерять растворимые антигены, то не требуется наличия интактных клеток в образце, и таким образом могут использоваться различные виды клинического материала. Другое важное преимущество метода ИФА – возможность количественного определения антигенов, что позволяет применять его для оценки клинического течения болезни и эффективности химиотерапии. ИФА, как и РИФ, может применяться как в прямом, так и в непрямом варианте. Твердофазный ИФА, дающий растворимый окрашеный продукт реакции, нашел наибольшее распространение. ИФА может быть использован как для определения антигена (тогда на твердую фазу – дно лунки полистиролового планшета – наносятся антитела), так и для определения антител (тогда на твердую фазу наносятся антигены).
Иммуноферментный анализ (ИФА). Иммуноферментные методы определения вирусных антигенов в принципе сходны с РИФ, но основываются на мечении антител ферментами, а не красителями. Наиболее широко используется пероксидаза хрена и щелочная фосфатаза, применяют также а-галактозидазу и в-лактамазы. Меченые антитела связываются с антигеном, и такой комплекс обнаруживается при добавлении субстрата для фермента, с которым конъюгированы антитела. Конечный продукт реакции может быть в виде нерастворимого осадка, и тогда учет проводится с помощью обычного светового микроскопа, или в виде растворимого продукта, который обычно окрашен (или может флюоресцировать или люминесцировать) и регистрируется инструментально. Поскольку с помощью ИФА можно измерять растворимые антигены, то не требуется наличия интактных клеток в образце, и таким образом могут использоваться различные виды клинического материала. Другое важное преимущество метода ИФА – возможность количественного определения антигенов, что позволяет применять его для оценки клинического течения болезни и эффективности химиотерапии. ИФА, как и РИФ, может применяться как в прямом, так и в непрямом варианте. Твердофазный ИФА, дающий растворимый окрашеный продукт реакции, нашел наибольшее распространение. ИФА может быть использован как для определения антигена (тогда на твердую фазу – дно лунки полистиролового планшета – наносятся антитела), так и для определения антител (тогда на твердую фазу наносятся антигены).
 Радиоиммунный анализ (РИА). Метод основан на метке антител радиоизотопами, что обеспечивало высокую чувствительность в определении вирусного антигена. Широкое распространение метод получил в 80 -е годы, особенно для определения маркеров HBV и других некультивируемых вирусов. К недостаткам метода относится необходимость работать с радиоактивными веществами и использования дорогостоящего оборудования (гамма-счетчиков).
Радиоиммунный анализ (РИА). Метод основан на метке антител радиоизотопами, что обеспечивало высокую чувствительность в определении вирусного антигена. Широкое распространение метод получил в 80 -е годы, особенно для определения маркеров HBV и других некультивируемых вирусов. К недостаткам метода относится необходимость работать с радиоактивными веществами и использования дорогостоящего оборудования (гамма-счетчиков).
 Молекулярные методы Первоначально классическим методом выявления вирусного генома считался высокоспецифичный метод гибридизации НК, но в настоящее время все шире используется выделение геномов вируса с помощью полимеразной цепной реакции (ПЦР). Молекулярная гибридизация нуклеиновых кислот. Метод основан на гибридизации комплементарных нитей ДНК или РНК с образованием двунитевых структур и на выявлении их с помощью метки. Для этой цели используются специальные ДНК - или РНК-зонды, меченные изотопом (32 Р) или биотином, обнаруживающие комплементарные нити ДНК или РНК. Существуют несколько вариантов метода: – точечная гибридизация – выделенную и денатурированную НК наносят на фильтры и затем добавляют меченый зонд; индикация результатов – авторадиография при использовании 32 Р или окраска – при авидин-биотине; – блот-гибридизация – метод выделения фрагментов НК, нарезанных рестрикционными эндонуклеазами из суммарной ДНК и перенесенных на нитроцеллюлозные фильтры и тестируемые мечеными зондами; используется как подтверждающий тест при ВИЧ инфекции; – гибридизация in situ – позволяет определять НК в инфицированных клетках. ПЦР основана на принципе естественной репликации ДНК. Суть метода заключается в многократном повторении циклов синтеза (амплификации) вирусоспецифической последовательности ДНК с помощью термостабильной Taq ДНК-полимеразы и двух специфических затравок – так называемых праймеров. Каждый цикл состоит из трех стадий с различным температурным режимом. В каждом цикле удваивается число копий синтезируемого участка. Вновь синтезированные фрагменты ДНК служат в качестве матрицы для синтеза новых нитей в следующем цикле амплификации, что позволяет за 25– 35 циклов наработать достаточное число копий выбранного участка ДНК для ее определения, как правило, с помощью электрофореза в агарозном геле. Метод высокоспецифичен и очень чувствителен. Он позволяет обнаружить несколько копий вирусной ДНК в исследуемом материале. В последние годы ПЦР находит все более широкое применение для диагностики и мониторинга вирусных инфекций (вирусы гепатитов, герпеса, цитомегалии, папилломы и др. ). Разработан вариант количественной ПЦР, позволяющий определять число копий амплифицированного сайта ДНК. Методика проведения сложна, дорогостояща и пока недостаточно унифицирована для рутинного применения. Цитологические методы в настоящее время имеют ограниченное диагностическое значение, но при ряде инфекций по-прежнему должны применяться. Исследуются материалы аутопсии, биопсии, мазки, которые после соответствующей обработки окрашиваются и анализируются под микроскопом. При цитомегаловирусной инфекции, например, в срезах ткани или в моче обнаруживаются характерные гигантские клетки– "совиный глаз", при бешенстве – включения в цитоплазме клеток (тельца Бабеша–Негри). В некоторых случаях, например при дифференциальной диагностике хронических гепатитов, имеет значение оценка состояния ткани печени.
Молекулярные методы Первоначально классическим методом выявления вирусного генома считался высокоспецифичный метод гибридизации НК, но в настоящее время все шире используется выделение геномов вируса с помощью полимеразной цепной реакции (ПЦР). Молекулярная гибридизация нуклеиновых кислот. Метод основан на гибридизации комплементарных нитей ДНК или РНК с образованием двунитевых структур и на выявлении их с помощью метки. Для этой цели используются специальные ДНК - или РНК-зонды, меченные изотопом (32 Р) или биотином, обнаруживающие комплементарные нити ДНК или РНК. Существуют несколько вариантов метода: – точечная гибридизация – выделенную и денатурированную НК наносят на фильтры и затем добавляют меченый зонд; индикация результатов – авторадиография при использовании 32 Р или окраска – при авидин-биотине; – блот-гибридизация – метод выделения фрагментов НК, нарезанных рестрикционными эндонуклеазами из суммарной ДНК и перенесенных на нитроцеллюлозные фильтры и тестируемые мечеными зондами; используется как подтверждающий тест при ВИЧ инфекции; – гибридизация in situ – позволяет определять НК в инфицированных клетках. ПЦР основана на принципе естественной репликации ДНК. Суть метода заключается в многократном повторении циклов синтеза (амплификации) вирусоспецифической последовательности ДНК с помощью термостабильной Taq ДНК-полимеразы и двух специфических затравок – так называемых праймеров. Каждый цикл состоит из трех стадий с различным температурным режимом. В каждом цикле удваивается число копий синтезируемого участка. Вновь синтезированные фрагменты ДНК служат в качестве матрицы для синтеза новых нитей в следующем цикле амплификации, что позволяет за 25– 35 циклов наработать достаточное число копий выбранного участка ДНК для ее определения, как правило, с помощью электрофореза в агарозном геле. Метод высокоспецифичен и очень чувствителен. Он позволяет обнаружить несколько копий вирусной ДНК в исследуемом материале. В последние годы ПЦР находит все более широкое применение для диагностики и мониторинга вирусных инфекций (вирусы гепатитов, герпеса, цитомегалии, папилломы и др. ). Разработан вариант количественной ПЦР, позволяющий определять число копий амплифицированного сайта ДНК. Методика проведения сложна, дорогостояща и пока недостаточно унифицирована для рутинного применения. Цитологические методы в настоящее время имеют ограниченное диагностическое значение, но при ряде инфекций по-прежнему должны применяться. Исследуются материалы аутопсии, биопсии, мазки, которые после соответствующей обработки окрашиваются и анализируются под микроскопом. При цитомегаловирусной инфекции, например, в срезах ткани или в моче обнаруживаются характерные гигантские клетки– "совиный глаз", при бешенстве – включения в цитоплазме клеток (тельца Бабеша–Негри). В некоторых случаях, например при дифференциальной диагностике хронических гепатитов, имеет значение оценка состояния ткани печени.
 Непрямые методы диагностики Выделение вирусов – один из самых старых и трудоемких методов диагностики. Однако и сегодня выделение вируса с последующей идентификацией с помощью одного из современных методов (ИФА с моноклональными антителами или ПЦР) является наиболее достоверным методом диагностики – так называемый "золотой стандарт". Для успешного выделения вирусов клинический материал должен быть взят в соответствии с патогенезом предполагаемого заболевания и в наиболее ранние сроки. Как правило, берутся: – при респираторных инфекциях – носоглоточный смыв; – при энтеровирусных инфекциях – смыв и фекалии (рео-, энтеровирусы); – при поражениях кожи и слизистых оболочек – соскобы, содержимое пузырьков (герпес, ветряная оспа); – при экзантемных инфекциях – смывы (корь, краснуха); – при арбовирусных инфекциях – кровь, спинномозговая жидкость. Для выделения вирусов используют культуры клеток, лабораторных животных, эмбрионы кур. Процесс длительный, иногда требующий проведения нескольких пассажей, прежде чем вирус будет обнаружен и идентифицирован с помощью одного или нескольких методов – в реакции нейтрализации (РН), РИФ, ИФА или ПЦР. В настоящее время в большинстве случаев выделение вирусов заменено обнаружением вирусоспецифических антигенов в инфицированных клеточных культурах с помощью указанных методов. Для этих целей широко применяются моноклональные антитела, особенно к ранним белкам возбудителя в РИФ или ИФА. Такой подход позволяет получить ответ уже через 24– 72 ч после инфицирования клеток культуры тканей.
Непрямые методы диагностики Выделение вирусов – один из самых старых и трудоемких методов диагностики. Однако и сегодня выделение вируса с последующей идентификацией с помощью одного из современных методов (ИФА с моноклональными антителами или ПЦР) является наиболее достоверным методом диагностики – так называемый "золотой стандарт". Для успешного выделения вирусов клинический материал должен быть взят в соответствии с патогенезом предполагаемого заболевания и в наиболее ранние сроки. Как правило, берутся: – при респираторных инфекциях – носоглоточный смыв; – при энтеровирусных инфекциях – смыв и фекалии (рео-, энтеровирусы); – при поражениях кожи и слизистых оболочек – соскобы, содержимое пузырьков (герпес, ветряная оспа); – при экзантемных инфекциях – смывы (корь, краснуха); – при арбовирусных инфекциях – кровь, спинномозговая жидкость. Для выделения вирусов используют культуры клеток, лабораторных животных, эмбрионы кур. Процесс длительный, иногда требующий проведения нескольких пассажей, прежде чем вирус будет обнаружен и идентифицирован с помощью одного или нескольких методов – в реакции нейтрализации (РН), РИФ, ИФА или ПЦР. В настоящее время в большинстве случаев выделение вирусов заменено обнаружением вирусоспецифических антигенов в инфицированных клеточных культурах с помощью указанных методов. Для этих целей широко применяются моноклональные антитела, особенно к ранним белкам возбудителя в РИФ или ИФА. Такой подход позволяет получить ответ уже через 24– 72 ч после инфицирования клеток культуры тканей.
 Серодиагностика Серологическая диагностика, основанная на реакции антиген – антитело, может быть использована для определения, как тех, так и других, и играет роль в определении этиологии вирусной инфекции даже при отрицательных результатах выделения вируса. Успех серологической диагностики зависит от специфичности реакции и соблюдения временных условий взятия крови, необходимых для синтеза организмом антител. В большинстве случаев используют парные сыворотки крови, взятые с интервалом в 2– 3 нед. Положительной реакция считается, по крайней мере, при 4 -кратном нарастании титра антител. Известно, что большинство специфических антител относятся к классам Ig. G и Ig. M, которые синтезируются в различное время инфекционного процесса. При этом Ig. M антитела относятся к ранним, и тесты, используемые для их определения, применяются для ранней диагностики (достаточно исследовать одну сыворотку). Антитела класса Ig. G синтезируются позже и длительно сохраняются.
Серодиагностика Серологическая диагностика, основанная на реакции антиген – антитело, может быть использована для определения, как тех, так и других, и играет роль в определении этиологии вирусной инфекции даже при отрицательных результатах выделения вируса. Успех серологической диагностики зависит от специфичности реакции и соблюдения временных условий взятия крови, необходимых для синтеза организмом антител. В большинстве случаев используют парные сыворотки крови, взятые с интервалом в 2– 3 нед. Положительной реакция считается, по крайней мере, при 4 -кратном нарастании титра антител. Известно, что большинство специфических антител относятся к классам Ig. G и Ig. M, которые синтезируются в различное время инфекционного процесса. При этом Ig. M антитела относятся к ранним, и тесты, используемые для их определения, применяются для ранней диагностики (достаточно исследовать одну сыворотку). Антитела класса Ig. G синтезируются позже и длительно сохраняются.
 Для типирования вирусов применяется РН, при группоспецифической диагностике, например аденовирусной инфекции, используют реакцию связывания комплемента (РСК). Наиболее употребительными являются реакция торможения гемагглютинации (РТГА), РСК, РИФ, реакции пассивной и обратной пассивной гемагглютинации (РПГА, РОПГА), различные варианты ИФА, практически повсеместно заменившего равный ему по чувствительности РИА. РТГА используется для диагностики заболеваний, вызванных гемагглютинирующими вирусами. Она основана на связывании антителами сыворотки больного добавленного стандартного вируса. Индикатором реакции являются эритроциты, агглютинирующиеся вирусом (формирование характерного "зонтика") при отсутствии специфических антител и оседающие на дно неагглютинированными при их наличии. РСК является одной из традиционных серологических реакций и используется для диагностики многих вирусных инфекций. В реакции принимают участие две системы: антитела сыворотки больного + стандартный вирус и эритроциты барана + антитела к ним, а также оттитрованный комплемент. При соответствии антител и вируса этот комплекс связывает комплемент и лизиса бараньих эритроцитов не происходит (положительная реакция). При отрицательной РСК комплемент способствует лизису эритроцитов. Недостатком метода являет его недостаточно высокая чувствительность и трудность стандартизации реагентов. Для учета значимости РСК также, как и РТГА, необходимо титрование парных сывороток, то есть взятых в начале заболевания и в период реконвалесценции. РПГА – агглютинация сенсибилизированных вирусными антигенами эритроцитов (или полистироловых шариков) в присутствии антител. На эритроцитах могут быть сорбированы любые вирусы, независимо от наличия или отсутствия у них гемагглютинирующей активности. В связи с наличием неспецифических реакций сыворотки исследуются в разведении 1: 10 и более. РНГА – агглютинация эритроцитов, сенсибилизированных специфическими антителами в присутствии вирусных антигенов. Наибольшее распространение РОПГА получила при выявлении HBs-антигена как у больных, так и у доноров крови. ИФ метод так же, как ИФА, применяется для определения антител в сыворотке. Все большее значение и распространение получает ИФА для диагностических целей. На твердую фазу (дно лунок полистироловых планшет или полистироловые шарики) сорбируется вирусный антиген. При добавлении соответствующих антител, находящихся в сыворотке, происходит их связывание с сорбированными антигенами. Наличие искомых антител обнаруживается с помощью анти-антител (например, человеческих), конъюгированных с ферментом (пероксидазой). Добавление субстрата и реакция субстрат – фермент дают окраску. ИФА может быть использована и для определения антигенов. В этом случае на твердую фазу сорбируются антитела. Моноклональные антитела. Большой прогресс в диагностике вирусных инфекций достигнут в последнее десятилетие, когда с развитием генно-инженерных исследований была разработана система получения моноклональных антител. Тем самым были резко повышены специфичность и чувствительность диагностических методов определения вирусных антигенов. Узкая специфичность моноклонов, представляющих небольшую долю вирусных белков, которые могут не присутствовать в клиническом материале, успешно преодолевается использованием нескольких моноклональных антител к различным вирусных детерминантам.
Для типирования вирусов применяется РН, при группоспецифической диагностике, например аденовирусной инфекции, используют реакцию связывания комплемента (РСК). Наиболее употребительными являются реакция торможения гемагглютинации (РТГА), РСК, РИФ, реакции пассивной и обратной пассивной гемагглютинации (РПГА, РОПГА), различные варианты ИФА, практически повсеместно заменившего равный ему по чувствительности РИА. РТГА используется для диагностики заболеваний, вызванных гемагглютинирующими вирусами. Она основана на связывании антителами сыворотки больного добавленного стандартного вируса. Индикатором реакции являются эритроциты, агглютинирующиеся вирусом (формирование характерного "зонтика") при отсутствии специфических антител и оседающие на дно неагглютинированными при их наличии. РСК является одной из традиционных серологических реакций и используется для диагностики многих вирусных инфекций. В реакции принимают участие две системы: антитела сыворотки больного + стандартный вирус и эритроциты барана + антитела к ним, а также оттитрованный комплемент. При соответствии антител и вируса этот комплекс связывает комплемент и лизиса бараньих эритроцитов не происходит (положительная реакция). При отрицательной РСК комплемент способствует лизису эритроцитов. Недостатком метода являет его недостаточно высокая чувствительность и трудность стандартизации реагентов. Для учета значимости РСК также, как и РТГА, необходимо титрование парных сывороток, то есть взятых в начале заболевания и в период реконвалесценции. РПГА – агглютинация сенсибилизированных вирусными антигенами эритроцитов (или полистироловых шариков) в присутствии антител. На эритроцитах могут быть сорбированы любые вирусы, независимо от наличия или отсутствия у них гемагглютинирующей активности. В связи с наличием неспецифических реакций сыворотки исследуются в разведении 1: 10 и более. РНГА – агглютинация эритроцитов, сенсибилизированных специфическими антителами в присутствии вирусных антигенов. Наибольшее распространение РОПГА получила при выявлении HBs-антигена как у больных, так и у доноров крови. ИФ метод так же, как ИФА, применяется для определения антител в сыворотке. Все большее значение и распространение получает ИФА для диагностических целей. На твердую фазу (дно лунок полистироловых планшет или полистироловые шарики) сорбируется вирусный антиген. При добавлении соответствующих антител, находящихся в сыворотке, происходит их связывание с сорбированными антигенами. Наличие искомых антител обнаруживается с помощью анти-антител (например, человеческих), конъюгированных с ферментом (пероксидазой). Добавление субстрата и реакция субстрат – фермент дают окраску. ИФА может быть использована и для определения антигенов. В этом случае на твердую фазу сорбируются антитела. Моноклональные антитела. Большой прогресс в диагностике вирусных инфекций достигнут в последнее десятилетие, когда с развитием генно-инженерных исследований была разработана система получения моноклональных антител. Тем самым были резко повышены специфичность и чувствительность диагностических методов определения вирусных антигенов. Узкая специфичность моноклонов, представляющих небольшую долю вирусных белков, которые могут не присутствовать в клиническом материале, успешно преодолевается использованием нескольких моноклональных антител к различным вирусных детерминантам.
 Профилактика и лечение Оспа известна более 10 тысяч лет. По оценкам, за это время она унесла около 500 миллионов человеческих жизней. В качестве профилактических мер борьбы с оспой с конца 18 века применяли вакцинацию. Декрет об обязательном оспопрививании в России был принят в 1919 году, и с 1936 году на территории СССР не регистрировалось вспышек болезни, были только случаи завоза болезни из-за рубежа. В 1960 -1970 -х годах усилиями ведущих мировых держав была проведена иммунизация всего населения Земли и в 1980 году объявлено о победе над оспой. После этого вакцинация была прекращена, и к началу 21 века уже 60 процентов населения Земли не имеют прививки от оспы. Для иммунопрофилактики натуральной оспы использовали живые вакцины. Невосприимчивость развивается через 7 -10 дней после вакцинации. Вакцинопрофилактика натуральной оспы обеспечивает невосприимчивость к заболеванию в течение 3 -5 лет. На эффективность вакцинации указывает факт ликвидации заболевания во всём мире. В связи с декларацией ВОЗ в настоящее время вакцинацию не проводят.
Профилактика и лечение Оспа известна более 10 тысяч лет. По оценкам, за это время она унесла около 500 миллионов человеческих жизней. В качестве профилактических мер борьбы с оспой с конца 18 века применяли вакцинацию. Декрет об обязательном оспопрививании в России был принят в 1919 году, и с 1936 году на территории СССР не регистрировалось вспышек болезни, были только случаи завоза болезни из-за рубежа. В 1960 -1970 -х годах усилиями ведущих мировых держав была проведена иммунизация всего населения Земли и в 1980 году объявлено о победе над оспой. После этого вакцинация была прекращена, и к началу 21 века уже 60 процентов населения Земли не имеют прививки от оспы. Для иммунопрофилактики натуральной оспы использовали живые вакцины. Невосприимчивость развивается через 7 -10 дней после вакцинации. Вакцинопрофилактика натуральной оспы обеспечивает невосприимчивость к заболеванию в течение 3 -5 лет. На эффективность вакцинации указывает факт ликвидации заболевания во всём мире. В связи с декларацией ВОЗ в настоящее время вакцинацию не проводят.


