комплемент.pptx
- Количество слайдов: 15

Виконала студентка 1 го курсу магістратури Кафедри біохімії, філії біотехнології Мазанова Анна Київ 2013

- одна з основних систем вродженого імунітету. її функціонування полягає у тому, щоб відрізняти “ своє ” від “ не свого ”. Така ідентифікація відбувається через присутність на клітинах власного організму регуляторних молекул, що пригнічують активацію системи комплементу.

Термін «комплемент» спочатку застосував Ерліх для опису «додаткової» , присутньої в сироватці активності, без якої специфічні антитіла не можуть лізувати бактерії. Відкриття цієї термолабільної активності в сироватці крові зазвичай приписують Борде (1895), хоча щось подібне кількома роками раніше описав Наттолл. У 1907 р. Феррата, проводячи діаліз сироватки проти підкисленої води, встановив, що пртеїни комплементу можна розділити на дві фракції: випадаючі в осад еуглобуліни і водорозчинну альбуміновоу фракцію (псевдоглобуліни). Активність комплементу виявлялася тільки в присутності обох фракцій, названих тоді середньою і кінцевою частинами, а пізніше – С’ 1 і С’ 2 компонентами. В подальшому Сакс і Омороков виявили, що отрута кобри інактивує інший компонент комплемента (С’З), а Гордон встановив, що наступний компонент (С’ 4) руйнується аміаком. Послідовність відкриття перерахованих компонентів комплементу не відповідає черзі їх вступу в реакцію активації системи, і цим пояснюється нелогічнийність її сучасної номенклатури. Пауль Ерліх Жюль Борде

Протеїни класичного шляху активації та комплексу, що лізуює мембрану, позначені кожен своїм номером і вступають в реакцію активації в наступному порядку: C 1 q, C 1 r, С 1 s, С 4, С 2, СЗ, С 5, С 6, С 7, С 8, С 9. Серед них багато попередників ензимів - проензимів, які набувають активнотсі тільки після розщеплення. Позначення активного ензимуу відрізняється від позначення його неактивного передника надбуквенной рискою. Продукти розщеплення позначаються так само, як вихідні компоненти комплементу, але з додаванням рядкових букв, зазвичай для меншого фрагмента «а» , а для більшого- «b» , наприклад СЗа і СЗb. З цього правила є один виняток: С 2 b означає менший, а С 2 а - більший фрагмент С 2. Протеїни альтернативного шляху активації називають факторами і позначають однобукненими символами. Регуляторні протеїни найчастіше позначають абревіатурами назв їх функціональної активності: наприклад, протеїн, який прискорює дисоціацію СЗ-конвертази класичного шляху, має символ DAF (decay accelcrating factor), або ФПД (фактор прискорення дисоціації) Клітинні рецептори, що зв'язують компоненти комплементу, названі згідно з абревіатурами своїх лігандів (наприклад. С 5 а-рецептор) або як маркерні молекули в номенклатурі CD-системи. Окремо пронумеровані рецептори для головних фрагментів СЗ як рецептори комплементу типів 1, 2, 3 і 4 (CRI, CR 2. CR 3 і CR 4).

Опсонізація. Це стимуляція фагоцитозу в результаті прикріплення протеїнів комлемента до поверхні мішеней (мікробів, імунних комплексів та ін. ) Володіючи рецепторами до опсонізуючих протеїнів, фагоцитарні клітини зв'язують мішені, що викликає активацію фагоцитів і ендоцитоз або фагоцитоз мішеней. Активація лейкоцитів. Поліморфноядерні гранулоцити і макрофаги володіють специфічними рецепторами до дрібних фрагментів протеїнів комплементу, що утворюються на поверхні мішеней в результаті каскаду протеолітичнихх реакцій. Дифундуючи в навколишнє середовище, ці фрагменти залучають фагоцити (спрямований рух клітин, або хемотаксис) і зв’язуючись з ними, викликають їх активацію. Лізис клітин-мішеней. Протеолітичний каскад комплементу завершується зануренням гідрофобного «зонду» в ліпідний бішар мембрани клітини - мішені і її подальшим осмотичним розривом і лізисом.
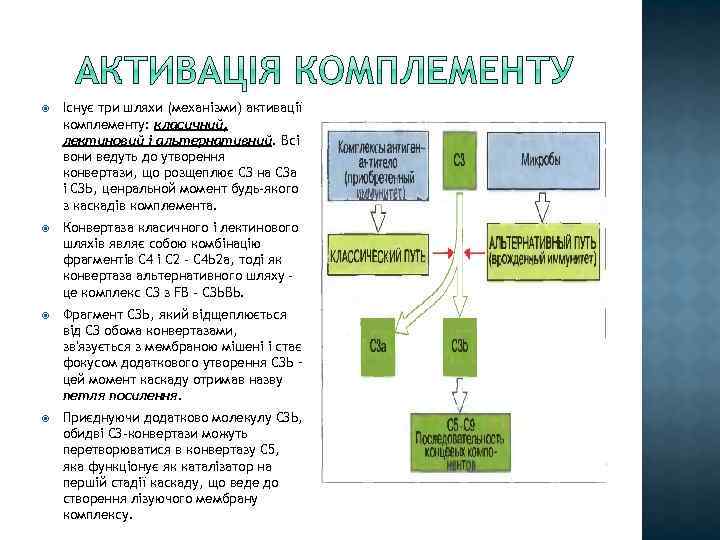
Існує три шляхи (механізми) активації комплементу: класичний, лектиновий і альтернативний. Всі вони ведуть до утворення конвертази, що розщеплює СЗ на СЗа і СЗЬ, ценральной момент будь-якого з каскадів комплемента. Конвертаза класичного і лектинового шляхів являє собою комбінацію фрагментів С 4 і С 2 - С 4 Ь 2 а, тоді як конвертаза альтернативного шляху це комплекс СЗ з FВ - СЗЬВЬ. Фрагмент СЗЬ, який відщеплюється від СЗ обома конвертазами, зв'язується з мембраною мішені і стає фокусом додаткового утворення СЗЬ – цей момент каскаду отримав назву петля посилення. Приєднуючи додатково молекулу СЗЬ, обидві СЗ-конвертази можуть перетворюватися в конвертазу С 5, яка функціонує як каталізатор на першій стадії каскаду, що веде до створення лізуючого мембрану комплексу.

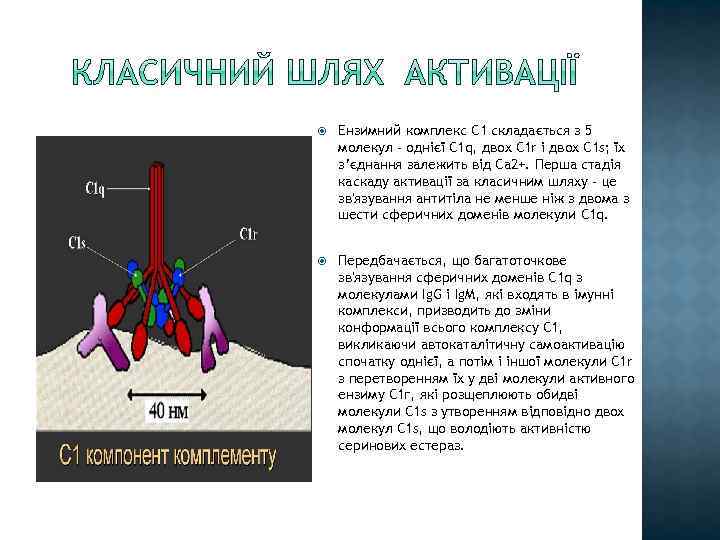
Ензимний комплекс С 1 складається з 5 молекул - однієї С 1 q, двох С 1 r і двох С 1 s; їх з’єднання залежить від Са 2+. Перша стадія каскаду активації за класичним шляху - це зв'язування антитіла не менше ніж з двома з шести сферичних доменів молекули С 1 q. Передбачається, що багатоточкове зв'язування сферичних доменів C 1 q з молекулами Ig. G і Ig. M, які входять в імунні комплекси, призводить до зміни конформації всього комплексу С 1, викликаючи автокаталітичну самоактивацію спочатку однієї, а потім і іншої молекули С 1 r з перетворенням їх у дві молекули активного ензиму С 1 г, які розщеплюють обидві молекули С 1 s з утворенням відповідно двох молекул С 1 s, що володіють активністю серинових естераз.
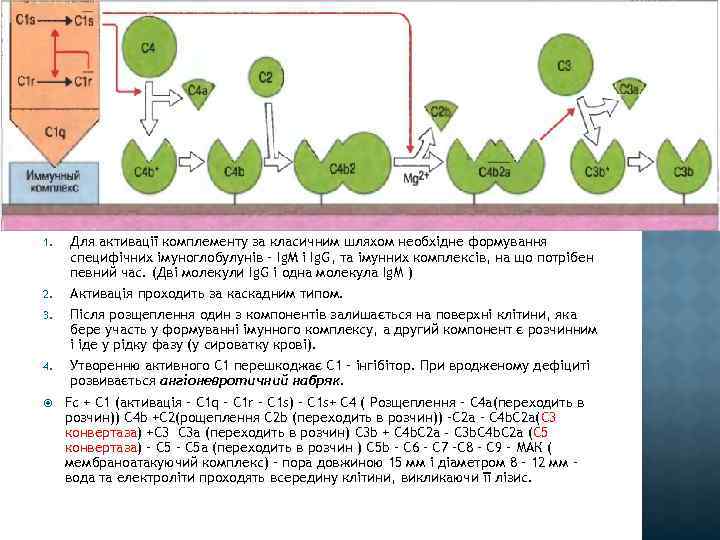
1. Для активації комплементу за класичним шляхом необхідне формування специфічних імуноглобулунів – Ig. M і Ig. G, та імунних комплексів, на що потрібен певний час. (Дві молекули Ig. G і одна молекула Ig. М ) 2. Активація проходить за каскадним типом. 3. Після розщеплення один з компонентів залишається на поверхні клітини, яка бере участь у формуванні імунного комплексу, а другий компонент є розчинним і іде у рідку фазу (у сироватку крові). 4. Утворенню активного С 1 перешкоджає С 1 – інгібітор. При вродженому дефіциті розвивається ангіоневротичний набряк. Fc + С 1 (активація – C 1 q – C 1 r – C 1 s) – C 1 s+ C 4 ( Розщеплення – C 4 a(переходить в розчин)) C 4 b +C 2(рощеплення C 2 b (переходить в розчин)) –C 2 a – С 4 b. C 2 a(C 3 конвертаза) +С 3 С 3 а (переходить в розчин) С 3 b + С 4 b. С 2 а - С 3 b. С 4 b. С 2 а (C 5 конвертаза) – С 5 а (переходить в розчин ) C 5 b – С 6 – С 7 –С 8 – С 9 – МАК ( мембраноатакуючий комплекс) – пора довжиною 15 мм і діаметром 8 – 12 мм – вода та електроліти проходять всередину клітини, викликаючи її лізис.
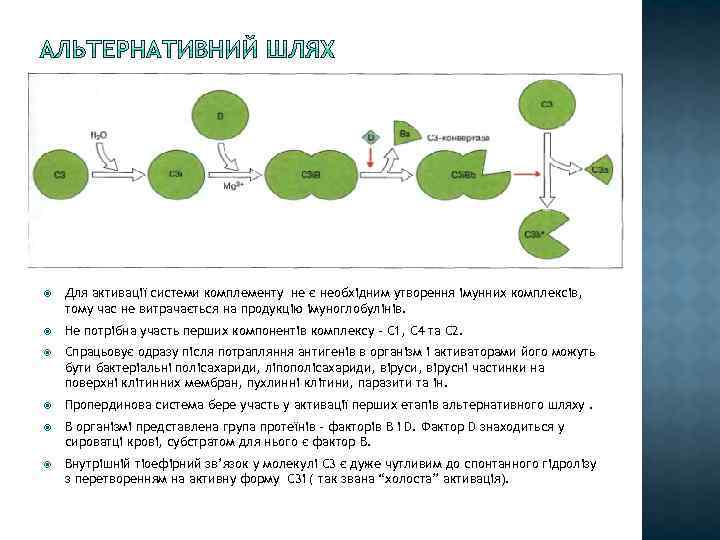
Для активації системи комплементу не є необхідним утворення імунних комплексів, тому час не витрачається на продукцію імуноглобулінів. Не потрібна участь перших компонентів комплексу – С 1, С 4 та С 2. Спрацьовує одразу після потрапляння антигенів в організм і активаторами його можуть бути бактеріальні полісахариди, ліпополісахариди, вірусні частинки на поверхні клітинних мембран, пухлинні клітини, паразити та ін. Пропердинова система бере участь у активації перших етапів альтернативного шляху. В організмі представлена група протеїнів – факторів B і D. Фактор D знаходиться у сироватці крові, субстратом для нього є фактор В. Внутрішній тіоефірний зв’язок у молекулі С 3 є дуже чутливим до спонтанного гідролізу з перетворенням на активну форму С 3і ( так звана “холоста” активація).

С 3і+ фактор В – С 3іВ – фактор В розщеплюється за допомогою фактора D – Ва ( переходить у розчин) – С 3іВb (С 3 конвертаза альтернативного шляху)- + С 3 – С 3 а+С 3 b – Р (пропердин) + С 3 b. Bb – PC 3 b. Bb – збірка МАК 1. Пропердин потрібний для того, щоб стабілізувати комплекс С 3 b. Bb , який є нестабільним у розчині. 2. Оскільки С 3 – конвертза діє у рідкій фазі, більшість утвореного С 3 b гідролізуються та інактивується водою. Однак у випадку контакут з чужорідною поверхнею бактеріальної клітини C 3 b ковалентно зв’язується та індукує утворення “петлі посилення” альтернативного шляху”.
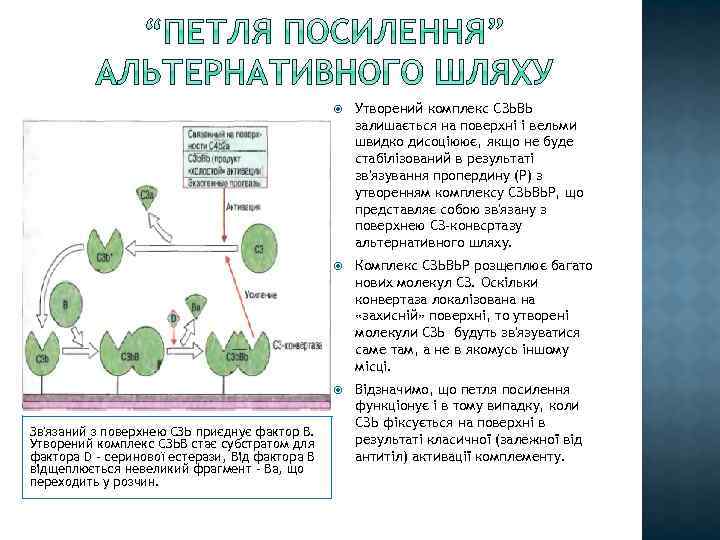
Комплекс СЗЬВЬР розщеплює багато нових молекул СЗ. Оскільки конвертаза локалізована на «захисній» поверхні, то утворені молекули СЗЬ будуть зв'язуватися саме там, а не в якомусь іншому місці. Зв'язаний з поверхнею СЗЬ приєднує фактор В. Утворений комплекс СЗЬВ стає субстратом для фактора D - серинової естерази, Від фактора В відщеплюється невеликий фрагмент – Ва, що переходить у розчин. Утворений комплекс СЗЬВЬ залишається на поверхні і вельми швидко дисоціюює, якщо не буде стабілізований в результаті зв'язування пропердину (Р) з утворенням комплексу СЗЬВЬР, що представляє собою зв'язану з поверхнею СЗ-конвсртазу альтернативного шляху. Відзначимо, що петля посилення функціонує і в тому випадку, коли СЗЬ фіксується на поверхні в результаті класичної (залежної від антитіл) активації комплементу.

Протеїн C 1 q відноситься до сімейства кальцій-залежних лектинів, названих коллектинами (колагенові лектнни). В цей же сімейство протеїнів входять манан-зв'язуючий лектин (МЗЛ), названий інакше манан-зв'язуючим протеїном (МЗП), конглютинін і протеїни легеневої поверхні А і D. Сироватковий МЗЛ може зв'язуватися з кінцевими маннановими групами на поверхні клітин бактерії, набуваючичи за рахунок цього здатності до взаімодії з двома манан-зв'язуючими лектин асоційованими сериновими протеїназами, МАСП 1 і МАСП 2, що є гомологічними по структурі до С 1 r і С 1 s. Його взаємодія подібно до взаємодії С 1 q з С 1 r і С 1 s, призводячи до незалежної від антитіл активації комплементу по класичному шляху. Крім того, С 1 q зв'язується безпосередньо, без участі антитіл, з деякими мікробами, зокрема з мікоплазмами а також ретровірусами (але не ВІЛ).

1. 2. 3. 4. С 1 – інгібітор – плазмовий α 2 – глобулін. Пригнічує ензиматичну активність С 1. Недостатність – вроджений ангіоневротичний набряк. С 3 b інактиватор. Розщеплює C 3 b на C 3 c C 3 d неактивні частини. Фактор Н. β 1 – глобулін. Відщеплення α ланцюга від С 3 b. Інактиватори анафілотоксинів. Ензиматичне руйнування біологічної активності С 3 а, С 4 а, С 5 а.

комплемент.pptx