Поглотительная способность.pptx
- Количество слайдов: 33


Виды поглотительной способности в почве 1. 2. 3. 4. Механическая Физико-химическая Химическая 5. Биологическая

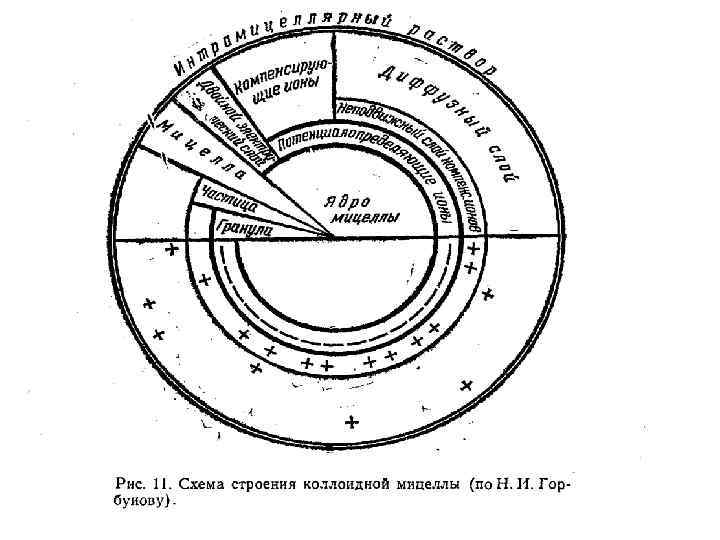
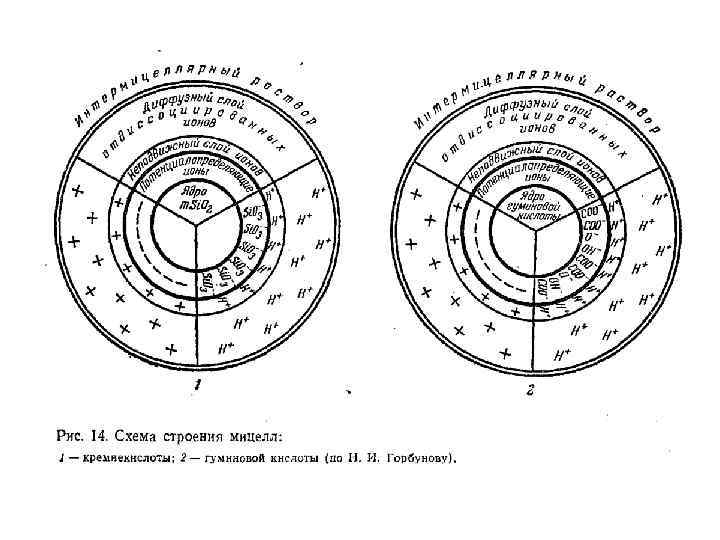

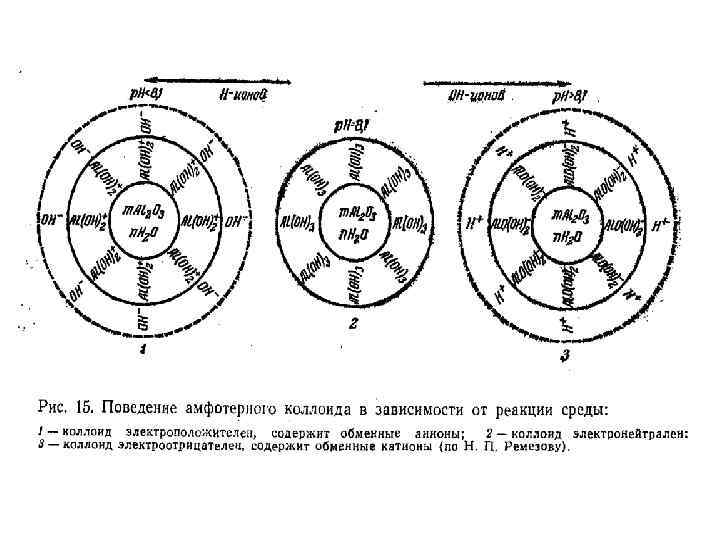
Коллоиды с двойственной природой называются амфолитоидами. В условиях кислой реакции в растворе находится много ионов водорода и мало гидроксил-ионов, отчего подавляется диссоциация водорода Например, гидроокись алюминия ведет себя как основание и диссоциация идет по уравнению: В условиях щелочной реакции в растворе проявляется высокая концентрация гидроксил-ионов, что приводит к подавлению диссоциации ОН-ионов. В этих условиях амфолитоид ведет себя как кислота и диссоциация идет по уравнению:

Основные закономерности обменной сорбции катионов






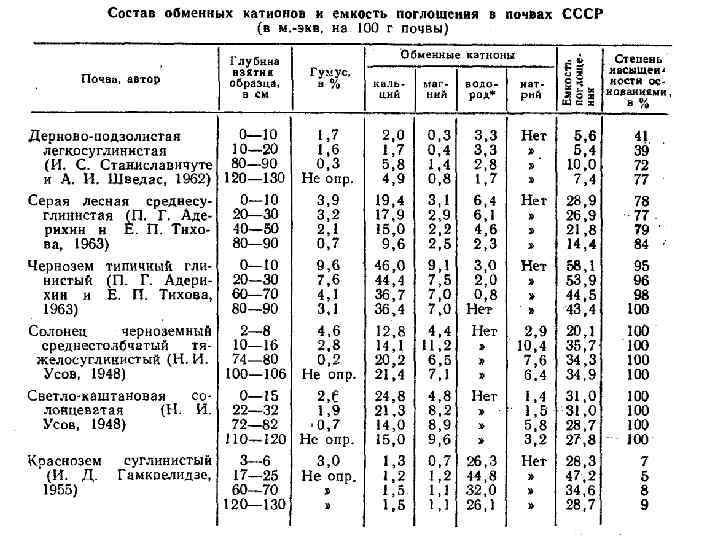

Потенциальная кислотность имеет сложную природу, объясняемую разными учеными поразному. К. К. Гедройц считал причиной потенциальной кислотности присутствие в ППК поглощенного водорода. При взаимодействии почвы, содержащей поглощенный водород, с растворами нейтральных солей происходит обмен катиона соли на поглощенный Н-ион: [


В зависимости от характера вытеснения различают две формы потенциальной кислотности — обменную и гидролитическую. Обменная кислотность проявляется при обработке почвы раствором нейтральной соли:

При обработке почвы раствором гидролитически щелочной соли, например CH 3 COONa, вследствие щелочной реакции среды, происходит более полное вытеснение поглощенного водорода. Суммарно эту реакцию можно представить так: Количество образующейся в результате обменной реакции уксусной кислоты, определяемое титрованием, характеризует величину гидролитической кислотности.




Расчет дозы извести рассчитывается по следующей формуле: PCa. CO т/га = Hz *5 *h *d, где P – доза извести, т/га Hz - гидролитическая кислотность, мгэкв/100 г почвы h – мощность почвенного слоя, м d – плотность почвенного слоя г/м 3 3


Щелочность почв Различают актуальную и потенциальную щелочность. Актуальная щелочность обусловливается наличием в почвенном растворе гидролитически щелочных солей (Na 2 C 03, ' Na. HC 03, Са. СОз и др. ), которые при диссоциации определяют преобладающую концентрацию гидроксил-ионов. Например,




Расчет дозы гипса, необходимой для мелиорации солонцов, проводится по следующей формуле: Р т/га = 0, 086*(Na – 0, 05 ЕКО)h*d Р –доза извести т/га 0, 086 – перевод мг/экв Ca. SO 4 в г ЕКО – емкость катионного обмена h – мощность почвенного слоя, см d – плотность солонцового горизонта



Поглотительная способность.pptx