3. Строение вещества. Молекулы. Связь..pptx
- Количество слайдов: 14
 Вещество Энергия Структура и превращения Часть III Молекулы. Связь.
Вещество Энергия Структура и превращения Часть III Молекулы. Связь.
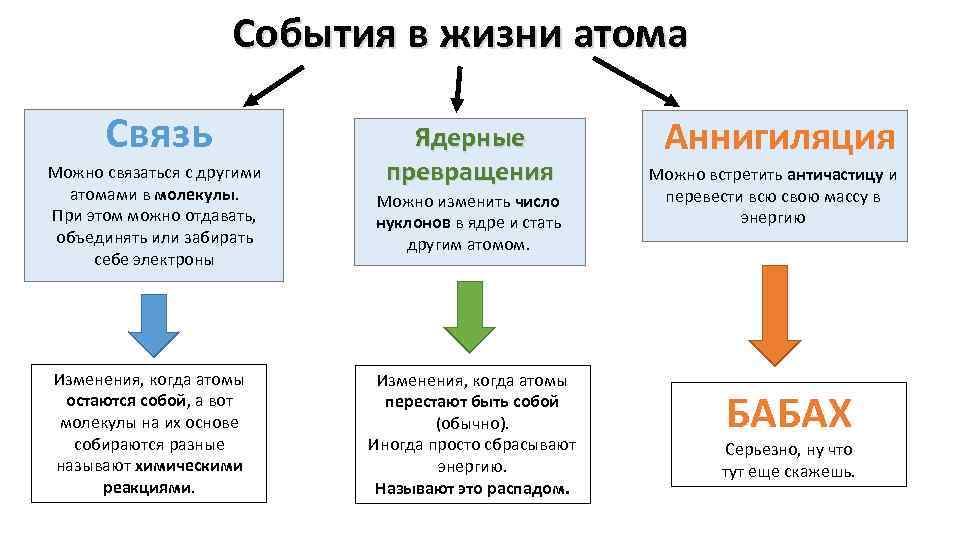 События в жизни атома Связь Ядерные превращения Можно связаться с другими атомами в молекулы. При этом можно отдавать, объединять или забирать себе электроны Можно изменить число нуклонов в ядре и стать другим атомом. Изменения, когда атомы остаются собой, а вот молекулы на их основе собираются разные называют химическими реакциями. Изменения, когда атомы перестают быть собой (обычно). Иногда просто сбрасывают энергию. Называют это распадом. Аннигиляция Можно встретить античастицу и перевести всю свою массу в энергию БАБАХ Серьезно, ну что тут еще скажешь.
События в жизни атома Связь Ядерные превращения Можно связаться с другими атомами в молекулы. При этом можно отдавать, объединять или забирать себе электроны Можно изменить число нуклонов в ядре и стать другим атомом. Изменения, когда атомы остаются собой, а вот молекулы на их основе собираются разные называют химическими реакциями. Изменения, когда атомы перестают быть собой (обычно). Иногда просто сбрасывают энергию. Называют это распадом. Аннигиляция Можно встретить античастицу и перевести всю свою массу в энергию БАБАХ Серьезно, ну что тут еще скажешь.
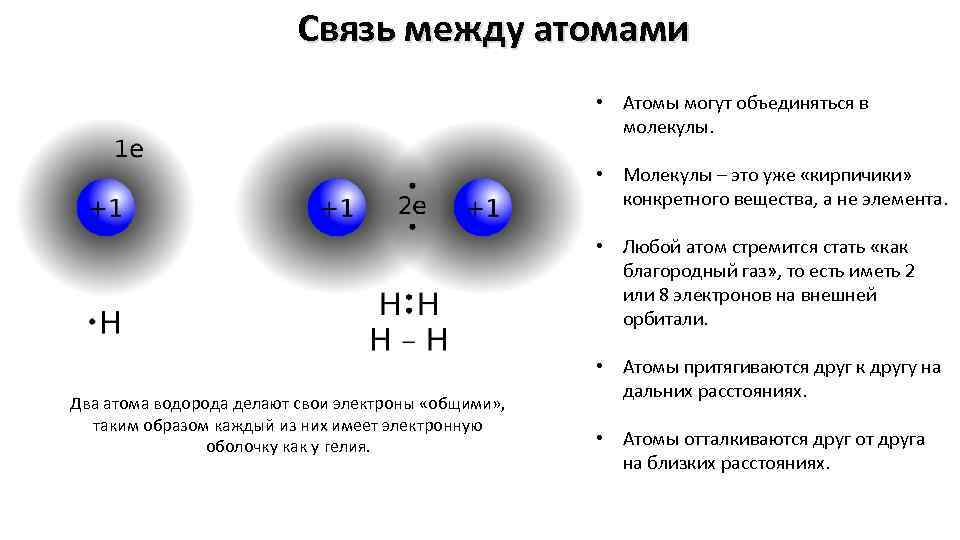 Связь между атомами • Атомы могут объединяться в молекулы. • Молекулы – это уже «кирпичики» конкретного вещества, а не элемента. • Любой атом стремится стать «как благородный газ» , то есть иметь 2 или 8 электронов на внешней орбитали. Два атома водорода делают свои электроны «общими» , таким образом каждый из них имеет электронную оболочку как у гелия. • Атомы притягиваются друг к другу на дальних расстояниях. • Атомы отталкиваются друг от друга на близких расстояниях.
Связь между атомами • Атомы могут объединяться в молекулы. • Молекулы – это уже «кирпичики» конкретного вещества, а не элемента. • Любой атом стремится стать «как благородный газ» , то есть иметь 2 или 8 электронов на внешней орбитали. Два атома водорода делают свои электроны «общими» , таким образом каждый из них имеет электронную оболочку как у гелия. • Атомы притягиваются друг к другу на дальних расстояниях. • Атомы отталкиваются друг от друга на близких расстояниях.
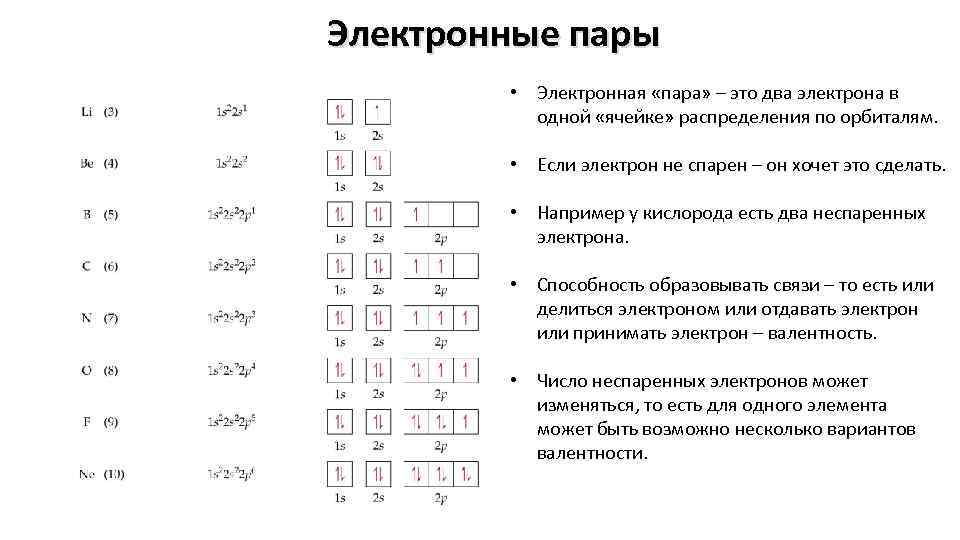 Электронные пары • Электронная «пара» – это два электрона в одной «ячейке» распределения по орбиталям. • Если электрон не спарен – он хочет это сделать. • Например у кислорода есть два неспаренных электрона. • Способность образовывать связи – то есть или делиться электроном или отдавать электрон или принимать электрон – валентность. • Число неспаренных электронов может изменяться, то есть для одного элемента может быть возможно несколько вариантов валентности.
Электронные пары • Электронная «пара» – это два электрона в одной «ячейке» распределения по орбиталям. • Если электрон не спарен – он хочет это сделать. • Например у кислорода есть два неспаренных электрона. • Способность образовывать связи – то есть или делиться электроном или отдавать электрон или принимать электрон – валентность. • Число неспаренных электронов может изменяться, то есть для одного элемента может быть возможно несколько вариантов валентности.
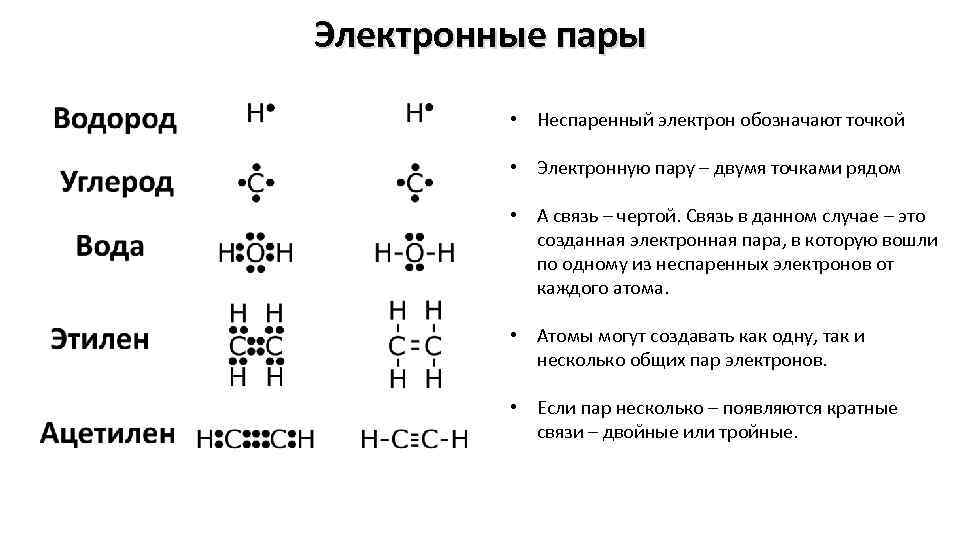 Электронные пары • Неспаренный электрон обозначают точкой • Электронную пару – двумя точками рядом • А связь – чертой. Связь в данном случае – это созданная электронная пара, в которую вошли по одному из неспаренных электронов от каждого атома. • Атомы могут создавать как одну, так и несколько общих пар электронов. • Если пар несколько – появляются кратные связи – двойные или тройные.
Электронные пары • Неспаренный электрон обозначают точкой • Электронную пару – двумя точками рядом • А связь – чертой. Связь в данном случае – это созданная электронная пара, в которую вошли по одному из неспаренных электронов от каждого атома. • Атомы могут создавать как одну, так и несколько общих пар электронов. • Если пар несколько – появляются кратные связи – двойные или тройные.
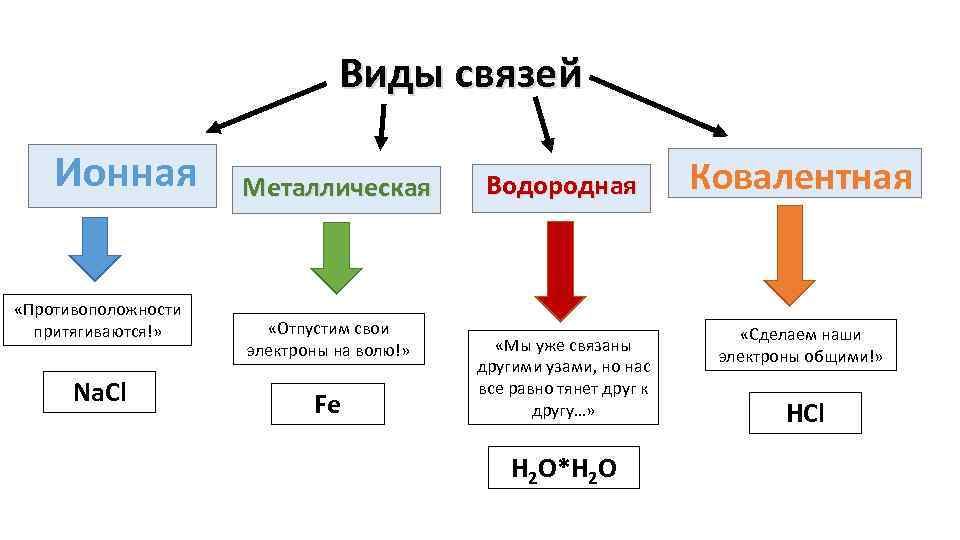 Виды связей Ионная «Противоположности притягиваются!» Na. Cl Металлическая «Отпустим свои электроны на волю!» Fe Водородная «Мы уже связаны другими узами, но нас все равно тянет друг к другу…» H 2 O*H 2 O Ковалентная «Сделаем наши электроны общими!» HCl
Виды связей Ионная «Противоположности притягиваются!» Na. Cl Металлическая «Отпустим свои электроны на волю!» Fe Водородная «Мы уже связаны другими узами, но нас все равно тянет друг к другу…» H 2 O*H 2 O Ковалентная «Сделаем наши электроны общими!» HCl
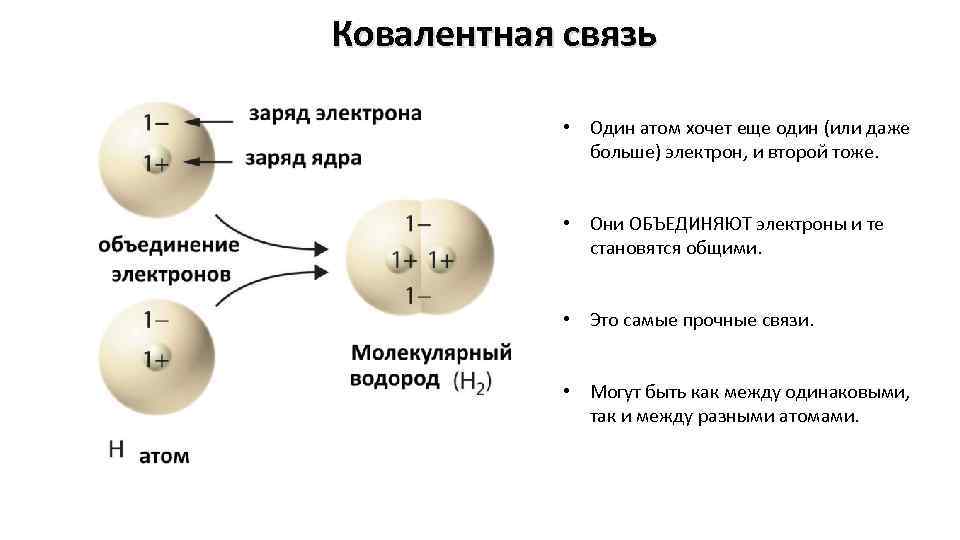 Ковалентная связь • Один атом хочет еще один (или даже больше) электрон, и второй тоже. • Они ОБЪЕДИНЯЮТ электроны и те становятся общими. • Это самые прочные связи. • Могут быть как между одинаковыми, так и между разными атомами.
Ковалентная связь • Один атом хочет еще один (или даже больше) электрон, и второй тоже. • Они ОБЪЕДИНЯЮТ электроны и те становятся общими. • Это самые прочные связи. • Могут быть как между одинаковыми, так и между разными атомами.
 Сближение атомов Образуя связь, атомы сближаются, пока это дает выигрыш в энергии. Почему? Потому что положительно заряженное ядро одного атома и отрицательно заряженное электронное облако другого притягиваются. Но если атомы СЛИШКОМ близко – начинает преобладать отталкивание двух ядер и двух электронных оболочек. Для каждой молекулы характерна определенная длина связи и определенная энергия. Энергия, которую надо приложить, чтобы связь разорвать.
Сближение атомов Образуя связь, атомы сближаются, пока это дает выигрыш в энергии. Почему? Потому что положительно заряженное ядро одного атома и отрицательно заряженное электронное облако другого притягиваются. Но если атомы СЛИШКОМ близко – начинает преобладать отталкивание двух ядер и двух электронных оболочек. Для каждой молекулы характерна определенная длина связи и определенная энергия. Энергия, которую надо приложить, чтобы связь разорвать.
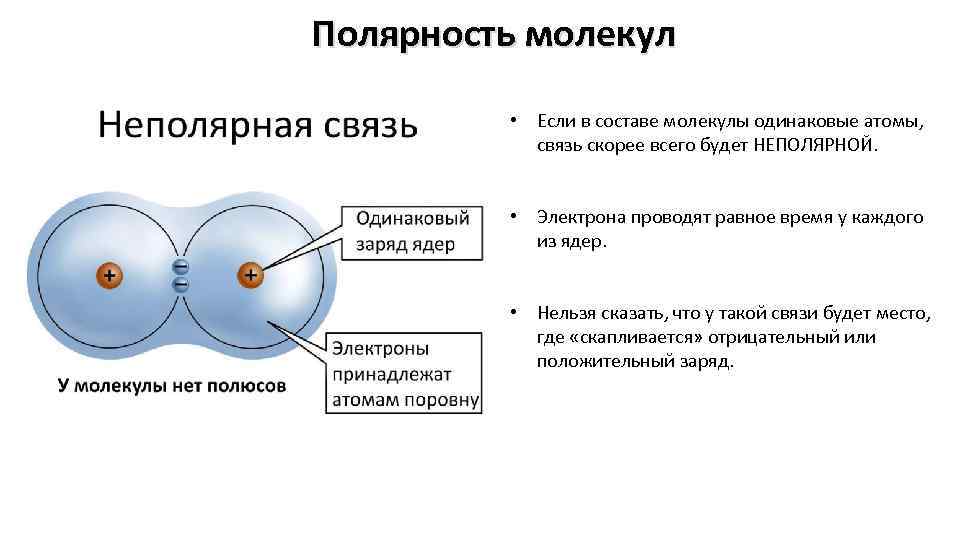 Полярность молекул • Если в составе молекулы одинаковые атомы, связь скорее всего будет НЕПОЛЯРНОЙ. • Электрона проводят равное время у каждого из ядер. • Нельзя сказать, что у такой связи будет место, где «скапливается» отрицательный или положительный заряд.
Полярность молекул • Если в составе молекулы одинаковые атомы, связь скорее всего будет НЕПОЛЯРНОЙ. • Электрона проводят равное время у каждого из ядер. • Нельзя сказать, что у такой связи будет место, где «скапливается» отрицательный или положительный заряд.
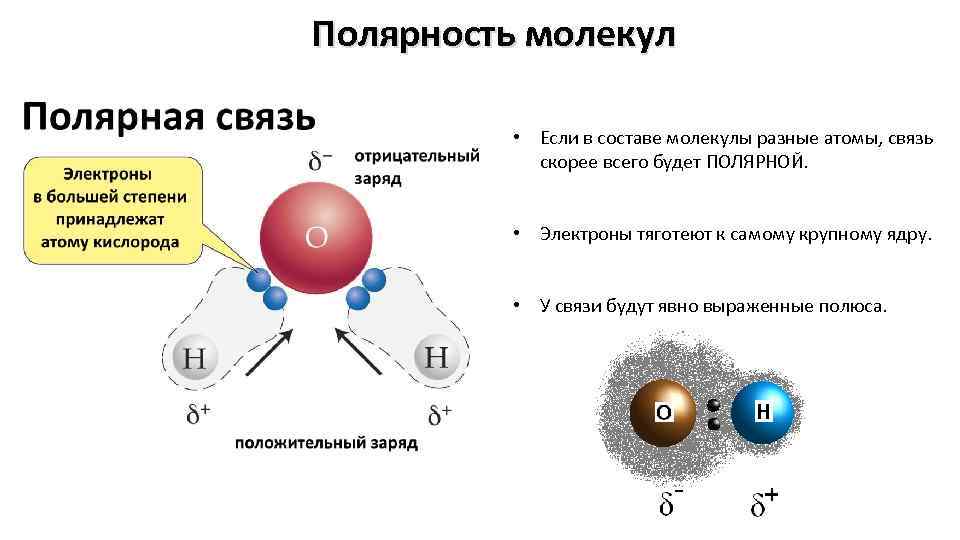 Полярность молекул • Если в составе молекулы разные атомы, связь скорее всего будет ПОЛЯРНОЙ. • Электроны тяготеют к самому крупному ядру. • У связи будут явно выраженные полюса.
Полярность молекул • Если в составе молекулы разные атомы, связь скорее всего будет ПОЛЯРНОЙ. • Электроны тяготеют к самому крупному ядру. • У связи будут явно выраженные полюса.
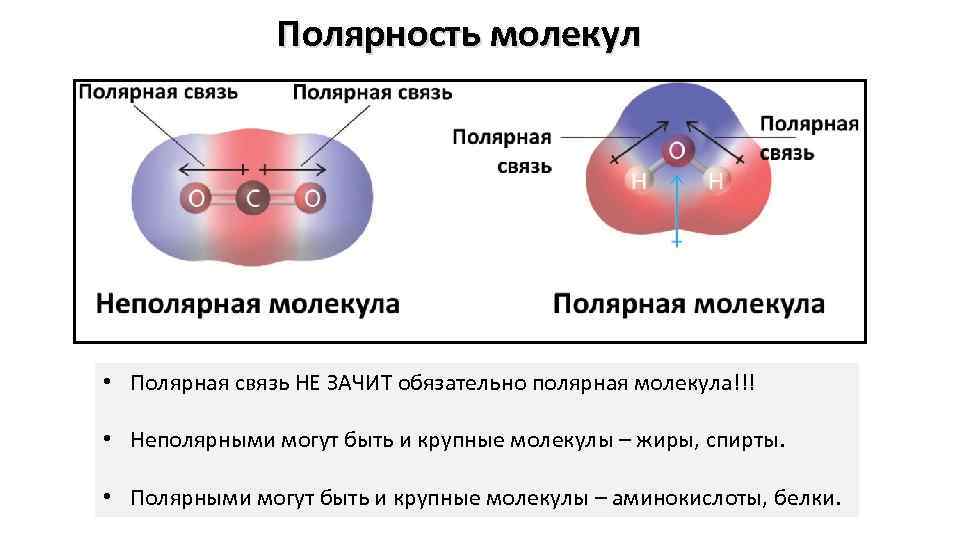 Полярность молекул • Полярная связь НЕ ЗАЧИТ обязательно полярная молекула!!! • Неполярными могут быть и крупные молекулы – жиры, спирты. • Полярными могут быть и крупные молекулы – аминокислоты, белки.
Полярность молекул • Полярная связь НЕ ЗАЧИТ обязательно полярная молекула!!! • Неполярными могут быть и крупные молекулы – жиры, спирты. • Полярными могут быть и крупные молекулы – аминокислоты, белки.
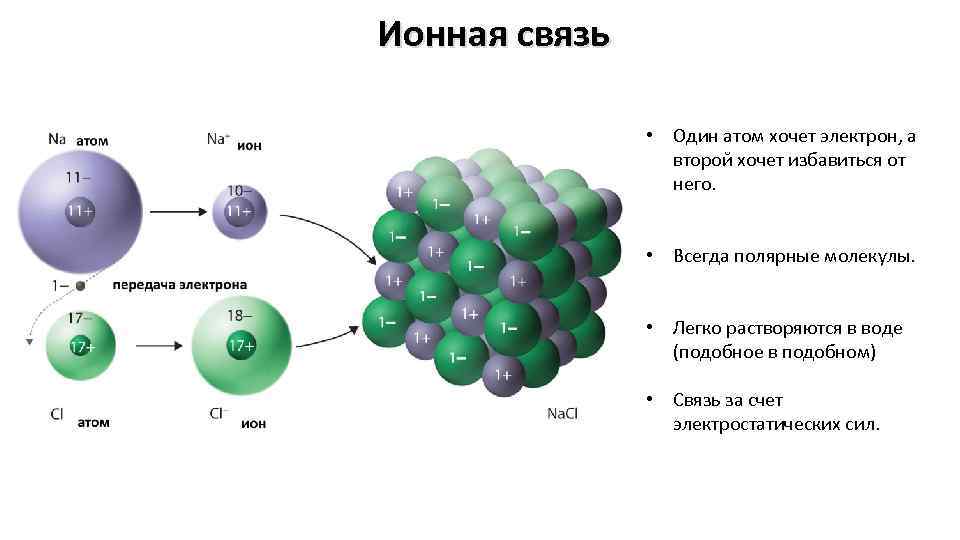 Ионная связь • Один атом хочет электрон, а второй хочет избавиться от него. • Всегда полярные молекулы. • Легко растворяются в воде (подобное в подобном) • Связь за счет электростатических сил.
Ионная связь • Один атом хочет электрон, а второй хочет избавиться от него. • Всегда полярные молекулы. • Легко растворяются в воде (подобное в подобном) • Связь за счет электростатических сил.
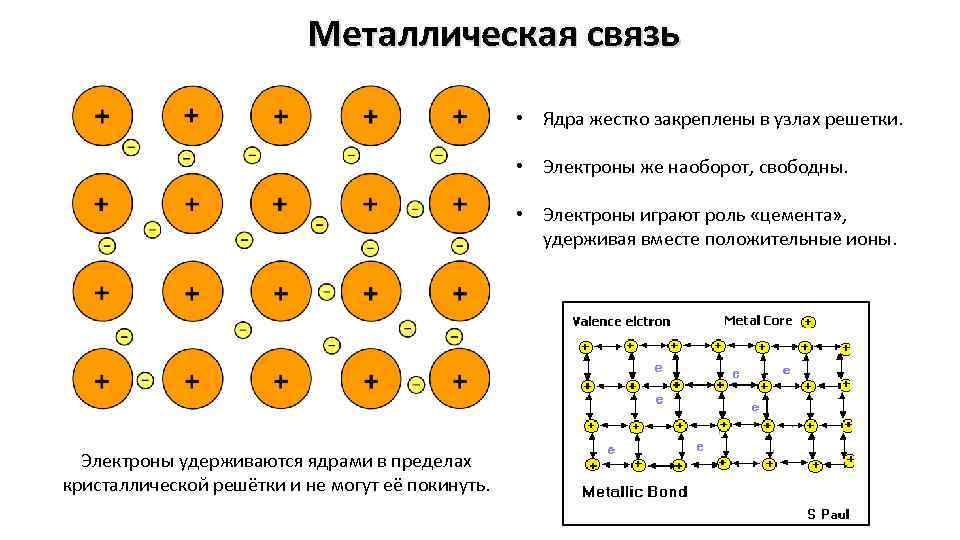 Металлическая связь • Ядра жестко закреплены в узлах решетки. • Электроны же наоборот, свободны. • Электроны играют роль «цемента» , удерживая вместе положительные ионы. Электроны удерживаются ядрами в пределах кристаллической решётки и не могут её покинуть.
Металлическая связь • Ядра жестко закреплены в узлах решетки. • Электроны же наоборот, свободны. • Электроны играют роль «цемента» , удерживая вместе положительные ионы. Электроны удерживаются ядрами в пределах кристаллической решётки и не могут её покинуть.
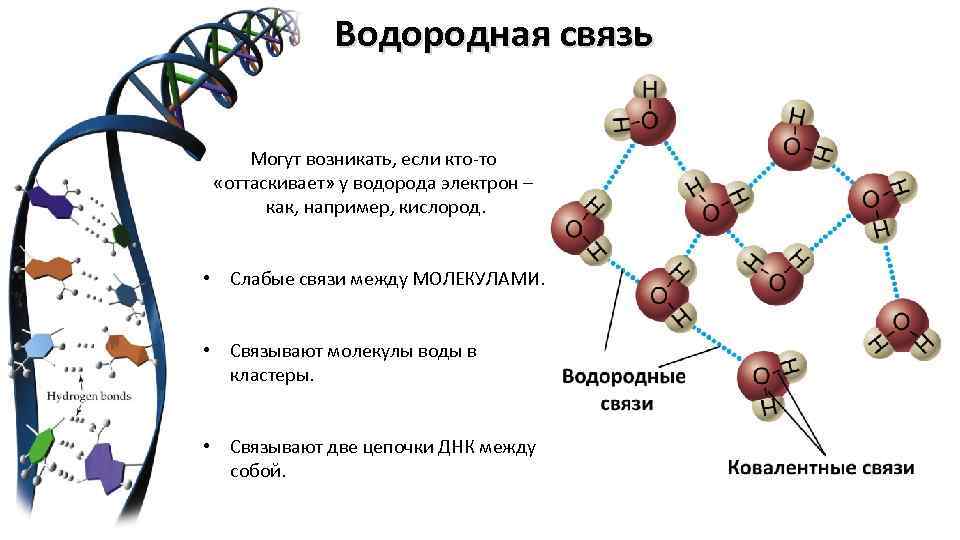 Водородная связь Могут возникать, если кто-то «оттаскивает» у водорода электрон – как, например, кислород. • Слабые связи между МОЛЕКУЛАМИ. • Связывают молекулы воды в кластеры. • Связывают две цепочки ДНК между собой.
Водородная связь Могут возникать, если кто-то «оттаскивает» у водорода электрон – как, например, кислород. • Слабые связи между МОЛЕКУЛАМИ. • Связывают молекулы воды в кластеры. • Связывают две цепочки ДНК между собой.


