Казахстан-2015-металлы.PPT
- Количество слайдов: 61

 ВАС ВІТАЄ НФа. У!
ВАС ВІТАЄ НФа. У!
 Фармация – святое ремесло, которое каждый день спасает чьи-то жизни….
Фармация – святое ремесло, которое каждый день спасает чьи-то жизни….
 НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ СОЕДИНЕНИЙ МЕТАЛЛОВ, СУРЬМЫ И МЫШЬЯКА доктор химических наук, профессор Журавель Ирина Александровна
НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ СОЕДИНЕНИЙ МЕТАЛЛОВ, СУРЬМЫ И МЫШЬЯКА доктор химических наук, профессор Журавель Ирина Александровна
 НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ СОЕДИНЕНИЙ МЕТАЛЛОВ, СУРЬМЫ И МЫШЬЯКА Часть 1: 1. Элементы организма человека, их распределение во внешней среде и основные источники. 2. Закономерности токсического действия и поведения элементов в организме. 3. Особенности химико-токсикологического анализа металлов.
НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ СОЕДИНЕНИЙ МЕТАЛЛОВ, СУРЬМЫ И МЫШЬЯКА Часть 1: 1. Элементы организма человека, их распределение во внешней среде и основные источники. 2. Закономерности токсического действия и поведения элементов в организме. 3. Особенности химико-токсикологического анализа металлов.
 Элементы организма Макроэлементы Элементы-органогены С, H, N, P, S (97, 4 %) Ca, Mg, Na, K (> 10 -2 %) Микроэлементы Необходимые (ессенциальные) Fe, Co, Mn, Cu, Zn (10 -5– 10 -2 %) Условно необходимые V, Ni, Cr (< 10 -5 %) Примесные Pb, Ag, Bi, Ba, Hg, Tl, Cd, As, Sb 6
Элементы организма Макроэлементы Элементы-органогены С, H, N, P, S (97, 4 %) Ca, Mg, Na, K (> 10 -2 %) Микроэлементы Необходимые (ессенциальные) Fe, Co, Mn, Cu, Zn (10 -5– 10 -2 %) Условно необходимые V, Ni, Cr (< 10 -5 %) Примесные Pb, Ag, Bi, Ba, Hg, Tl, Cd, As, Sb 6
 Распределение элементов во внешней среде Атмосфера Горные породы Морские аэрозоли Осадки Почва Реки, озера Моря, океаны Донные осадки 7
Распределение элементов во внешней среде Атмосфера Горные породы Морские аэрозоли Осадки Почва Реки, озера Моря, океаны Донные осадки 7
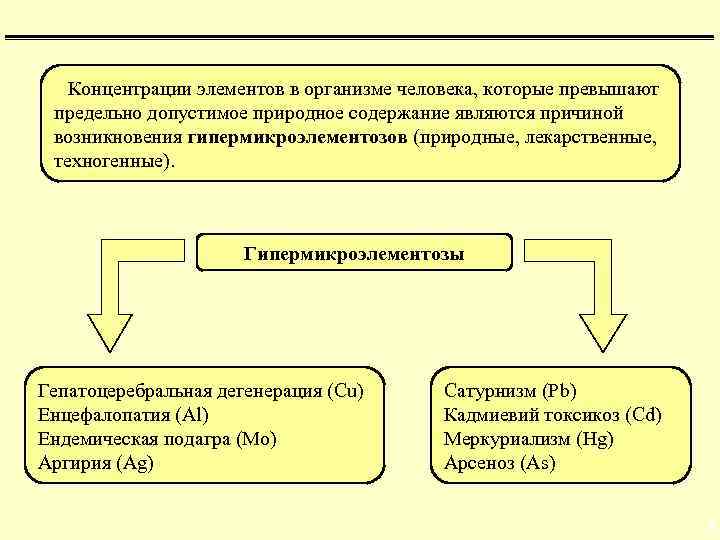 Концентрации элементов в организме человека, которые превышают предельно допустимое природное содержание являются причиной возникновения гипермикроэлементозов (природные, лекарственные, техногенные). Гипермикроэлементозы Гепатоцеребральная дегенерация (Cu) Енцефалопатия (Al) Ендемическая подагра (Mo) Аргирия (Ag) Сатурнизм (Pb) Кадмиевий токсикоз (Cd) Меркуриализм (Hg) Арсеноз (As) 8
Концентрации элементов в организме человека, которые превышают предельно допустимое природное содержание являются причиной возникновения гипермикроэлементозов (природные, лекарственные, техногенные). Гипермикроэлементозы Гепатоцеребральная дегенерация (Cu) Енцефалопатия (Al) Ендемическая подагра (Mo) Аргирия (Ag) Сатурнизм (Pb) Кадмиевий токсикоз (Cd) Меркуриализм (Hg) Арсеноз (As) 8
 Основные антропогенные источники элементов Вода (10 % поступлений) Воздух (20 % поступлений) Пищевые продукты (70 % поступлений) Лекарственные средства Факторы загрязнения: Транспортные средства, предприятия (горной промышленности, металургические, цементные, текстильные, химические и др. ), ядохимикаты (пестициды), техногенные та экологические катастрофы (Hg, Pb, Cd, As, Cu, Fe, Zn, Sb, Ba) Содержат микроэлементы: • Ессенциальные (Co, Mn, Fe, Cu, Zn, Si, Se, F, Br, I); • Токсикологически значимые (Ba, Li, Cr, Pt, Au, Ag, Al, Hg). 9
Основные антропогенные источники элементов Вода (10 % поступлений) Воздух (20 % поступлений) Пищевые продукты (70 % поступлений) Лекарственные средства Факторы загрязнения: Транспортные средства, предприятия (горной промышленности, металургические, цементные, текстильные, химические и др. ), ядохимикаты (пестициды), техногенные та экологические катастрофы (Hg, Pb, Cd, As, Cu, Fe, Zn, Sb, Ba) Содержат микроэлементы: • Ессенциальные (Co, Mn, Fe, Cu, Zn, Si, Se, F, Br, I); • Токсикологически значимые (Ba, Li, Cr, Pt, Au, Ag, Al, Hg). 9
 Основные направления токсического действия металлов при отравлении Ингибирование основных функций белка Связывание с SH-группой белка (для всех металлов) Ингибирование деяльности ферментных систем Замещение нативного металлического кофактора фермента другим металлом Поражение центральной нервной системы Для всех металлов (особенно для металорганических веществ) Способность к канцерогенезу (взаємодействие металла с ДНК клетки) As, Cr (VI), Ni (II), Cd Негативное влияние на репродуктивную функцию Pb, Cd, Tl 10
Основные направления токсического действия металлов при отравлении Ингибирование основных функций белка Связывание с SH-группой белка (для всех металлов) Ингибирование деяльности ферментных систем Замещение нативного металлического кофактора фермента другим металлом Поражение центральной нервной системы Для всех металлов (особенно для металорганических веществ) Способность к канцерогенезу (взаємодействие металла с ДНК клетки) As, Cr (VI), Ni (II), Cd Негативное влияние на репродуктивную функцию Pb, Cd, Tl 10
 Пути поступления в организм ЖКТ Все металлы Органы дыхания Пары Hg, органические соединения Pb, Zn, летучие соединения Sb, другие металлы в виде аерозолей Кожа Соединения Hg, Tl, Cd, Аg, Zn, Cr, As Слизистые оболочки и плацента Соединения As и Hg 11
Пути поступления в организм ЖКТ Все металлы Органы дыхания Пары Hg, органические соединения Pb, Zn, летучие соединения Sb, другие металлы в виде аерозолей Кожа Соединения Hg, Tl, Cd, Аg, Zn, Cr, As Слизистые оболочки и плацента Соединения As и Hg 11
 Поведение в организме Распределение Активно связываются с белками, распределяются в печени, почках, селезенке, волосах, ногтях, плоских костях Биотрансформация В основном не подвержены биотрансформации Экскреция ЖКТ и почки (все металлы), потовые (Cu, Cd, Zn, Pb) и молочные железы (As) 12
Поведение в организме Распределение Активно связываются с белками, распределяются в печени, почках, селезенке, волосах, ногтях, плоских костях Биотрансформация В основном не подвержены биотрансформации Экскреция ЖКТ и почки (все металлы), потовые (Cu, Cd, Zn, Pb) и молочные железы (As) 12
 Основные этапы химико-токсикологического анализа на металлы Выбор и отбор образцов От направленности ХТА Пробоподготовка биоматериала Общие или специальные методы минерализации Обнаружение металлов в минерализате Реакции осаджения, цветные и микрокристаллоскопические реакции, методы атомно-абсорбционной и атомно-эмиссионной спектрометрии Количественное определение Методы комплексонометрии, титриметрии, атомно-абсорбционной спектрометрии, екстракционной фотометрии, гравиметрии и др. Интерпретация результатов исследования Высокая степень вероятности получения ложноположительного результата 13
Основные этапы химико-токсикологического анализа на металлы Выбор и отбор образцов От направленности ХТА Пробоподготовка биоматериала Общие или специальные методы минерализации Обнаружение металлов в минерализате Реакции осаджения, цветные и микрокристаллоскопические реакции, методы атомно-абсорбционной и атомно-эмиссионной спектрометрии Количественное определение Методы комплексонометрии, титриметрии, атомно-абсорбционной спектрометрии, екстракционной фотометрии, гравиметрии и др. Интерпретация результатов исследования Высокая степень вероятности получения ложноположительного результата 13
 Основные и дополнительные объекты при анализе на металлы При ненаправленном (общем) химико-токсикологическом анализе в качестве объекта исследования для всех металлов – желудок с содержимым, печень, почка, селезёнка, кровь, моча. При направленном химико-токсикологическом анализе для соединений Hg – дополнительно прямая кишка, волосы; соединений Pb – дополнительно плоские кости (Pb(C 2 H 5)4 – мозг, лёгкие); соединений Tl – дополнительно плоские кости, волосы; соединений As – дополнительно плоские кости, волосы, ногти. 14
Основные и дополнительные объекты при анализе на металлы При ненаправленном (общем) химико-токсикологическом анализе в качестве объекта исследования для всех металлов – желудок с содержимым, печень, почка, селезёнка, кровь, моча. При направленном химико-токсикологическом анализе для соединений Hg – дополнительно прямая кишка, волосы; соединений Pb – дополнительно плоские кости (Pb(C 2 H 5)4 – мозг, лёгкие); соединений Tl – дополнительно плоские кости, волосы; соединений As – дополнительно плоские кости, волосы, ногти. 14
 НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ СОЕДИНЕНИЙ МЕТАЛЛОВ, СУРЬМЫ И МЫШЬЯКА Часть 2: 1. Пробоподготовка в анализе биоматериала на металлы. 2. Дробный метод анализа на элементы.
НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ СОЕДИНЕНИЙ МЕТАЛЛОВ, СУРЬМЫ И МЫШЬЯКА Часть 2: 1. Пробоподготовка в анализе биоматериала на металлы. 2. Дробный метод анализа на элементы.
 Пробоподготовка биоматериала для анализа на металлы Минерализация – процесс окисления (сжигания) органической составляющей биоматериала. Общие методы минерализации (“влажная” или “мокрая” минерализация) • Минерализация конц. H 2 SO 4 + конц. HNO 3 + конц. HCl. O 4 Специальные (частные) методы минерализации ØДеструктивный метод выделения Hg (минерализация конц. H 2 SO 4 + HNO 3) ØМетоды “сухого озоления” (при условии малой навески биоматериала): • сжигание биоматериала (300 -500°С) - анализ на содержание Cu, Mn, Bi, Zn, фториды; • сплавление с Na 2 CO 3 и Na. NO 3 - анализ на содержание As, Sb или разделение Pb, Ba, Ag. 16
Пробоподготовка биоматериала для анализа на металлы Минерализация – процесс окисления (сжигания) органической составляющей биоматериала. Общие методы минерализации (“влажная” или “мокрая” минерализация) • Минерализация конц. H 2 SO 4 + конц. HNO 3 + конц. HCl. O 4 Специальные (частные) методы минерализации ØДеструктивный метод выделения Hg (минерализация конц. H 2 SO 4 + HNO 3) ØМетоды “сухого озоления” (при условии малой навески биоматериала): • сжигание биоматериала (300 -500°С) - анализ на содержание Cu, Mn, Bi, Zn, фториды; • сплавление с Na 2 CO 3 и Na. NO 3 - анализ на содержание As, Sb или разделение Pb, Ba, Ag. 16
 МЕТОДЫ ИЗОЛИРОВАНИЯ СОЕДИНЕНИЙ МЕТАЛЛОВ ИЗ БИОМАТЕРИАЛА Объекты исследования Общие методы минерализации Частные методы минерализации Деструктивный метод на ртуть (минерализация конц. серной и азотной кислотами) Методы влажной минерализации Минерализация смесью конц. серной и азотной кислот Методы «сухой» минерализации Cплавление с содой и селитрой Сжигание Минерализация смесью конц. серной, азотной и хлорной кислот
МЕТОДЫ ИЗОЛИРОВАНИЯ СОЕДИНЕНИЙ МЕТАЛЛОВ ИЗ БИОМАТЕРИАЛА Объекты исследования Общие методы минерализации Частные методы минерализации Деструктивный метод на ртуть (минерализация конц. серной и азотной кислотами) Методы влажной минерализации Минерализация смесью конц. серной и азотной кислот Методы «сухой» минерализации Cплавление с содой и селитрой Сжигание Минерализация смесью конц. серной, азотной и хлорной кислот
 Схема общего метода минерализации (конц. H 2 SO 4 + HNO 3) Основные стадии минерализации Стадия 1 (конц. H 2 SO 4 + HNO 3 + H 2 O (1: 1: 1)): • разрушение структуры биоматериала; • разрушение комплекса белок/токсикант. Стадия 2 (избыток конц. HNO 3): • разрушение структуры жиров; • окисление органических веществ. Денитрация Процесс удаления (гидролиз и восстановление) окислителей ON(HSО 4), HNO 3, HNO 2, NO: • гидролизный метод (вода + кипячение); • химический метод (восстановители – CH 2 O, (NH 2)2 CO). Минерализат Осадок: белого цвета (Ba 2+, Pb 2+), грязно-зелёного – дополнительно избыток (Cr 3+, Fe 3+) Фильтрат: Mn 2+, Cr 3+, Zn 2+, Tl+, Ag+, Bi 3+, Cd 2+, Sb 3+, As 3+ 18
Схема общего метода минерализации (конц. H 2 SO 4 + HNO 3) Основные стадии минерализации Стадия 1 (конц. H 2 SO 4 + HNO 3 + H 2 O (1: 1: 1)): • разрушение структуры биоматериала; • разрушение комплекса белок/токсикант. Стадия 2 (избыток конц. HNO 3): • разрушение структуры жиров; • окисление органических веществ. Денитрация Процесс удаления (гидролиз и восстановление) окислителей ON(HSО 4), HNO 3, HNO 2, NO: • гидролизный метод (вода + кипячение); • химический метод (восстановители – CH 2 O, (NH 2)2 CO). Минерализат Осадок: белого цвета (Ba 2+, Pb 2+), грязно-зелёного – дополнительно избыток (Cr 3+, Fe 3+) Фильтрат: Mn 2+, Cr 3+, Zn 2+, Tl+, Ag+, Bi 3+, Cd 2+, Sb 3+, As 3+ 18
 Дробные методы анализа элементов Дробный метод анализа предусматривает определение ионов металлов в присутствии других подобных ионов без предварительного их разделения на группы. Дробный метод анализ в аналитической химии (H. А. Тананаев) Одно из положений метода – применение правила рядов, согласно которому выделение ионов металлов из раствора в осадок проводится действием другого аналогичного по составу осадка. При этом каждый следующий осадок имеет большую величину произведения растворимости. Ряд сульфидов по H. А. Тананаеву: Mn. S > Fe. S > Zn. S > Ni. S > Co. S > Pb. S > Cd. S > Bi 2 S 3 > Cu. S > Ag 2 S > Hg. S Дробный метод анализа в токсикологической химии (по А. H. Крыловой) В основе метода – использование реакций, с помощью которых в определенной последовательности можно определить ионы металлов в отдельных небольших порциях исследуемого раствора (минерализата) в присутствии других металлов. 19
Дробные методы анализа элементов Дробный метод анализа предусматривает определение ионов металлов в присутствии других подобных ионов без предварительного их разделения на группы. Дробный метод анализ в аналитической химии (H. А. Тананаев) Одно из положений метода – применение правила рядов, согласно которому выделение ионов металлов из раствора в осадок проводится действием другого аналогичного по составу осадка. При этом каждый следующий осадок имеет большую величину произведения растворимости. Ряд сульфидов по H. А. Тананаеву: Mn. S > Fe. S > Zn. S > Ni. S > Co. S > Pb. S > Cd. S > Bi 2 S 3 > Cu. S > Ag 2 S > Hg. S Дробный метод анализа в токсикологической химии (по А. H. Крыловой) В основе метода – использование реакций, с помощью которых в определенной последовательности можно определить ионы металлов в отдельных небольших порциях исследуемого раствора (минерализата) в присутствии других металлов. 19
 Основные положения дробного метода анализа по А. М. Крыловой Использование высокочувствительных и специфических реакций. Чувствительность дробного метода граничит с природным содержанием некоторых токсикологически значимых элементов (Mn, Cu и Hg). Замена реакций осаждения жидкофазными реакциями (в осадке минерализата только Ba 2+ и Pb 2+). Это позволяет исключить процессы фильтрования, промывания, упаривания и т. д. Выполнение не менее двух реакций – основной (предварительной, специфической) и дополнительной (подтверждающей). Использование микрокристаллоскопических реакций, как наиболее специфических и доказательных (перекристаллизация Ba. SO 4). “Маскировка” ионов, которые мешают анализу. Метод позволяет исключить влияние посторонних ионов при условии невозможности применения специфических реактивов. 20
Основные положения дробного метода анализа по А. М. Крыловой Использование высокочувствительных и специфических реакций. Чувствительность дробного метода граничит с природным содержанием некоторых токсикологически значимых элементов (Mn, Cu и Hg). Замена реакций осаждения жидкофазными реакциями (в осадке минерализата только Ba 2+ и Pb 2+). Это позволяет исключить процессы фильтрования, промывания, упаривания и т. д. Выполнение не менее двух реакций – основной (предварительной, специфической) и дополнительной (подтверждающей). Использование микрокристаллоскопических реакций, как наиболее специфических и доказательных (перекристаллизация Ba. SO 4). “Маскировка” ионов, которые мешают анализу. Метод позволяет исключить влияние посторонних ионов при условии невозможности применения специфических реактивов. 20
 Способы «маскировки» мешающих ионов Применение реакций комплексообразования Посторонние ионы связывают в бесцветные прочные комплексы, которые не способны реагировать со специфическими реактивами на исследуемые ионы. Для маскировки применяют такие реактивы: цианиды (Co 2+, Zn 2+, Fe 3+, Cd 2+, Hg 2+, Ag+), тиосульфаты (Ag+, Pb 2+, Fe 2+, Bi 3+, Fe 3+, Sb 3+, Cd 2+, Hg 2+), тиомочевину, трилон Б, фториды, фосфаты и др. Например: реакции на Co 2+ с роданид-ионом мешают ионы Fe 3+, поэтому к пробе добавляют раствор фторидов или фосфатов для образования неокрашенных комплексов [Fe. F 6]3 - или [Fe(PO 4)2]3 Разбавление минерализата Для исключения возможности определения эндогенных ионов металлов в природных концентрациях минерализат разводят водой до 180 мл, а потом используют небольшие порции минерализата для определения отдельных ионов: Mn 2+ – 1 мл, Cu 2+ – 3 мл, Bi 3+ – 10 мл и т. д. Применение реакций окисления–восстановления Реакция окисления Mn 2+ до перманганат иона (Mn. O 4 -) калий перйодатом или Cr 3+ до Сr 6+ аммоний персульфатом (образование надхромовых кислот). 21
Способы «маскировки» мешающих ионов Применение реакций комплексообразования Посторонние ионы связывают в бесцветные прочные комплексы, которые не способны реагировать со специфическими реактивами на исследуемые ионы. Для маскировки применяют такие реактивы: цианиды (Co 2+, Zn 2+, Fe 3+, Cd 2+, Hg 2+, Ag+), тиосульфаты (Ag+, Pb 2+, Fe 2+, Bi 3+, Fe 3+, Sb 3+, Cd 2+, Hg 2+), тиомочевину, трилон Б, фториды, фосфаты и др. Например: реакции на Co 2+ с роданид-ионом мешают ионы Fe 3+, поэтому к пробе добавляют раствор фторидов или фосфатов для образования неокрашенных комплексов [Fe. F 6]3 - или [Fe(PO 4)2]3 Разбавление минерализата Для исключения возможности определения эндогенных ионов металлов в природных концентрациях минерализат разводят водой до 180 мл, а потом используют небольшие порции минерализата для определения отдельных ионов: Mn 2+ – 1 мл, Cu 2+ – 3 мл, Bi 3+ – 10 мл и т. д. Применение реакций окисления–восстановления Реакция окисления Mn 2+ до перманганат иона (Mn. O 4 -) калий перйодатом или Cr 3+ до Сr 6+ аммоний персульфатом (образование надхромовых кислот). 21
 Селективная экстракция в виде комплексов с дитизоном (H 2 Dz) Применяют для определения Pb 2+, Ag+, Hg 2+, Tl 2+, Zn 2+, которые при определённом значении р. Н среды образуют окрашенные дитизонаты. Дитизонаты серебра и ртути имеют золотисто-желтый цвет (при р. Н 1), цинка - пурпурно-красный (р. Н 4 - 4, 5), свинца - карминно-красный (р. Н 7 10), таллия - красно-фиолетовый (р. Н 11 - 12). При р. Н < 2 дитизонат серебра, в отличие от дитизоната ртути, разрушается. Дитизон – дифенилтиокарбазон тионовая форма (р. Н ≤ 5) тиольная форма (р. Н > 7) В кето-форме H 2 Dz растворим в органических растворителях (зеленый цвет). В енольной форме H 2 Dz растворим в растворах щелочей (оранжевый цвет). 22
Селективная экстракция в виде комплексов с дитизоном (H 2 Dz) Применяют для определения Pb 2+, Ag+, Hg 2+, Tl 2+, Zn 2+, которые при определённом значении р. Н среды образуют окрашенные дитизонаты. Дитизонаты серебра и ртути имеют золотисто-желтый цвет (при р. Н 1), цинка - пурпурно-красный (р. Н 4 - 4, 5), свинца - карминно-красный (р. Н 7 10), таллия - красно-фиолетовый (р. Н 11 - 12). При р. Н < 2 дитизонат серебра, в отличие от дитизоната ртути, разрушается. Дитизон – дифенилтиокарбазон тионовая форма (р. Н ≤ 5) тиольная форма (р. Н > 7) В кето-форме H 2 Dz растворим в органических растворителях (зеленый цвет). В енольной форме H 2 Dz растворим в растворах щелочей (оранжевый цвет). 22
 Использование ряда активности ДДТК (диэтилдитиокарбаминатов) Для выделения Cu 2+, Bi 3+, Cd 2+ и Zn 2+ в органическую фазу, которая является свободной от посторонних ионов, используют выборочную экстракцию элементов в виде ДДТК. Специфичность экстракционных методик достигается за счёт использования правила ряда ДДТК металлов, согласно которому каждый предыдущий металл вытесняет последующий из его соли с ДДТК: Hg 2+ > Ag+ > Cu 2+ > Ni 2+ > Co 2+ > Bi 3+ > Sb 3+ > Cd 2+ > Pb 3+ > Zn 2+ > Mn 2+ Катионы Cu 2+, Bi 3+, Cd 2+, Zn 2+ называют экстракционными
Использование ряда активности ДДТК (диэтилдитиокарбаминатов) Для выделения Cu 2+, Bi 3+, Cd 2+ и Zn 2+ в органическую фазу, которая является свободной от посторонних ионов, используют выборочную экстракцию элементов в виде ДДТК. Специфичность экстракционных методик достигается за счёт использования правила ряда ДДТК металлов, согласно которому каждый предыдущий металл вытесняет последующий из его соли с ДДТК: Hg 2+ > Ag+ > Cu 2+ > Ni 2+ > Co 2+ > Bi 3+ > Sb 3+ > Cd 2+ > Pb 3+ > Zn 2+ > Mn 2+ Катионы Cu 2+, Bi 3+, Cd 2+, Zn 2+ называют экстракционными
 Особенности проведения некоторых реакций дробного анализа Реакции перекристаллизации Ba. SO 4 из H 2 SO 4 конц. мешает Pb. SO 4, поэтому сначала проводят реакцию на Pb 2+. При положительном результате Pb 2+ отделяют (обработка осадка ацетатом аммония), а потом проводят реакции на Ba 2+. Чувствительность реакций на Mn 2+ и Cr 3+ снижается при значительном количестве хлоридов, поэтому определение указанных катионов металлов необходимо проводить до проведения реакций на Ag+, в частности его осаждения в виде Ag. Cl под действием раствора HCl. Определение Cu 2+ в минерализате необходимо проводить до определения Sb 3+, поскольку оранжевий цвет Sb 2 S 3 (подтверждающая реакция на Sb 3+) будет маскироваться чёрным цветом Cu. S. Исследование минерализата на As 2+ необходимо проводить до обнаружения Sb 2+, поскольку последний элемент также образует летучий гидрид сурьмы Sb. H 3 и будет мешать обнаружению As. H 3. 24
Особенности проведения некоторых реакций дробного анализа Реакции перекристаллизации Ba. SO 4 из H 2 SO 4 конц. мешает Pb. SO 4, поэтому сначала проводят реакцию на Pb 2+. При положительном результате Pb 2+ отделяют (обработка осадка ацетатом аммония), а потом проводят реакции на Ba 2+. Чувствительность реакций на Mn 2+ и Cr 3+ снижается при значительном количестве хлоридов, поэтому определение указанных катионов металлов необходимо проводить до проведения реакций на Ag+, в частности его осаждения в виде Ag. Cl под действием раствора HCl. Определение Cu 2+ в минерализате необходимо проводить до определения Sb 3+, поскольку оранжевий цвет Sb 2 S 3 (подтверждающая реакция на Sb 3+) будет маскироваться чёрным цветом Cu. S. Исследование минерализата на As 2+ необходимо проводить до обнаружения Sb 2+, поскольку последний элемент также образует летучий гидрид сурьмы Sb. H 3 и будет мешать обнаружению As. H 3. 24
 Дробный анализ осадка на металлы Осадок грязнозеленого цвета (Ba 2+, Pb 2+, Cr 3+) Обработка осадка (NH 4)2 S 2 O 8 + 1% H 2 SO 4 Осадок (Ba 2+, Pb 2+) Осадок белого цвета (Ba 2+, Pb 2+) Фильтрат (Cr 6+) Обработка осадка горячим раствором NH 4 OCOCH 3 Осадок Ba. SO 4 Фильтрат Pb(OCOCH 3)2 25
Дробный анализ осадка на металлы Осадок грязнозеленого цвета (Ba 2+, Pb 2+, Cr 3+) Обработка осадка (NH 4)2 S 2 O 8 + 1% H 2 SO 4 Осадок (Ba 2+, Pb 2+) Осадок белого цвета (Ba 2+, Pb 2+) Фильтрат (Cr 6+) Обработка осадка горячим раствором NH 4 OCOCH 3 Осадок Ba. SO 4 Фильтрат Pb(OCOCH 3)2 25
 Исследование на Pb 2+ Предварительная реакция с дитизоном в хлороформе (специфическая) Образуется пурпурно-красное окрашивание хлороформного слоя (Cr 3+ образует бесцветные соединения с H 2 Dz). Отрицательный результат имеет судебно-токсикологическое значение. Выделение Pb 2+ из дитизоната в водную фазу водная фаза органическая фаза Подтверждающие реакции с Pb(NO 3)2 - микрокристаллоскопические • Реакция образования двойной соли Cs[Pb. I 3] Жёлто-зеленые кристаллы – сфероиды. Чувствительность 0, 01 мкг. • Реакция образования K 2 Cu. Pb(NO 2)6↓ в 30 % СН 3 СООН Чёрно-коричневые кристаллы в виде куба. Чувствительность 0, 03 мкг. 26
Исследование на Pb 2+ Предварительная реакция с дитизоном в хлороформе (специфическая) Образуется пурпурно-красное окрашивание хлороформного слоя (Cr 3+ образует бесцветные соединения с H 2 Dz). Отрицательный результат имеет судебно-токсикологическое значение. Выделение Pb 2+ из дитизоната в водную фазу водная фаза органическая фаза Подтверждающие реакции с Pb(NO 3)2 - микрокристаллоскопические • Реакция образования двойной соли Cs[Pb. I 3] Жёлто-зеленые кристаллы – сфероиды. Чувствительность 0, 01 мкг. • Реакция образования K 2 Cu. Pb(NO 2)6↓ в 30 % СН 3 СООН Чёрно-коричневые кристаллы в виде куба. Чувствительность 0, 03 мкг. 26
 Подтверждающие реакции с Pb(NO 3)2 - макрохимические Реакция с КІ Pb(NO 3)2 + 2 KI→Pb. I 2↓ + 2 KNO 3 Pb. I 2 + 2 KI→K 2[Pb. I 4] Образуется осадок жёлтого цвета, растворимый в избытке реактива. Реакция з K 2 Cr 2 O 7 2 Pb(NO 3)2 + K 2 Cr 2 O 7 + H 2 O→ 2 Pb. Cr. O 4↓ + 2 KNO 3 + 2 HNO 3 Образуется осадок жёлтого цвета. Реакция с H 2 SO 4 Pb(NO 3)2 + H 2 SO 4→Pb. SO 4↓ + 2 HNO 3 Образуется осадок белого цвета. Чувствительность 0, 2 мг. Реакция с H 2 S Pb(NO 3)2 + H 2 S→Pb. S↓ + 2 HNO 3 Образуется осадок чёрного цвета. 27
Подтверждающие реакции с Pb(NO 3)2 - макрохимические Реакция с КІ Pb(NO 3)2 + 2 KI→Pb. I 2↓ + 2 KNO 3 Pb. I 2 + 2 KI→K 2[Pb. I 4] Образуется осадок жёлтого цвета, растворимый в избытке реактива. Реакция з K 2 Cr 2 O 7 2 Pb(NO 3)2 + K 2 Cr 2 O 7 + H 2 O→ 2 Pb. Cr. O 4↓ + 2 KNO 3 + 2 HNO 3 Образуется осадок жёлтого цвета. Реакция с H 2 SO 4 Pb(NO 3)2 + H 2 SO 4→Pb. SO 4↓ + 2 HNO 3 Образуется осадок белого цвета. Чувствительность 0, 2 мг. Реакция с H 2 S Pb(NO 3)2 + H 2 S→Pb. S↓ + 2 HNO 3 Образуется осадок чёрного цвета. 27
 Исследование на Ba 2+ • Реакция перекристализации Ba. SO 4 Образуются беcцветные кристаллы в виде прямоугольных пластин Реакция специфическая, предел обнаружения 0, 05 мкг. • Реакция восстановления Ba. SO 4 до Ba. S в восстановительной части пламени (окрашивание пламени в зеленый цвет) Ba. SO 4 + 4 CO→Ba. S + 4 CO 2 • Образование призматических кристаллов Ba(IO 3)2, собранных в сфероиды. Реакция подтверждающая. Предел обнаружения 0, 03 мкг. Ba. S + 2 HCl→Ba. Cl 2 + H 2 S Ba. Cl 2 + 2 KIO 3→Ba(IO 3)2↓ + 2 KCl 28
Исследование на Ba 2+ • Реакция перекристализации Ba. SO 4 Образуются беcцветные кристаллы в виде прямоугольных пластин Реакция специфическая, предел обнаружения 0, 05 мкг. • Реакция восстановления Ba. SO 4 до Ba. S в восстановительной части пламени (окрашивание пламени в зеленый цвет) Ba. SO 4 + 4 CO→Ba. S + 4 CO 2 • Образование призматических кристаллов Ba(IO 3)2, собранных в сфероиды. Реакция подтверждающая. Предел обнаружения 0, 03 мкг. Ba. S + 2 HCl→Ba. Cl 2 + H 2 S Ba. Cl 2 + 2 KIO 3→Ba(IO 3)2↓ + 2 KCl 28
 Дробный анализ фильтрата минерализата на металлы Исследование на Mn 2+ • Предварительная реакция окисления Mn 2+ до Mn. O 4 - калий перйодатом 2 Mn. SO 4 + 5 KIO 4 + 3 H 2 O→ 2 HMn. O 4 + 5 KIO 3 + 2 H 2 SO 4 Образуется розовое или красно-фиолетовое окрашивание. Положительный результат ориентирует на содержание Mn в природной концентрации. • Подтверждающая реакция окисления Mn 2+ до Mn. O 4 - аммоний персульфатом ((NH 4)2 S 2 O 4): 2 Mn. SO 4 + 5(NH 4)2 S 2 O 8 + 8 H 2 O→ 2 HMn. O 4 + 5(NH 4)2 SO 4 + 7 H 2 SO 4 Образуется розовое или красно-фиолетовое окрашивание. Положительный результат ориентирует на проведение исследований по количественному содержанию Mn. Для маскировки мешающих ионов Fe 3+ и Sb 3+ используют Na. H 2 PO 4. 29
Дробный анализ фильтрата минерализата на металлы Исследование на Mn 2+ • Предварительная реакция окисления Mn 2+ до Mn. O 4 - калий перйодатом 2 Mn. SO 4 + 5 KIO 4 + 3 H 2 O→ 2 HMn. O 4 + 5 KIO 3 + 2 H 2 SO 4 Образуется розовое или красно-фиолетовое окрашивание. Положительный результат ориентирует на содержание Mn в природной концентрации. • Подтверждающая реакция окисления Mn 2+ до Mn. O 4 - аммоний персульфатом ((NH 4)2 S 2 O 4): 2 Mn. SO 4 + 5(NH 4)2 S 2 O 8 + 8 H 2 O→ 2 HMn. O 4 + 5(NH 4)2 SO 4 + 7 H 2 SO 4 Образуется розовое или красно-фиолетовое окрашивание. Положительный результат ориентирует на проведение исследований по количественному содержанию Mn. Для маскировки мешающих ионов Fe 3+ и Sb 3+ используют Na. H 2 PO 4. 29
 Исследования на Cr 3+ Реакция окисления Cr 3+ до Cr 6+ Cr 2(SO 4)4 + 3(NH 4)2 S 2 O 8 + 7 H 2 O → H 2 Cr 2 O 7 + 3(NH 4)2 SO 4 + 6 H 2 SO 4 • Предварительная реакция Cr 6+ с дифенилкарбазидом (ДФК) → Cr 6+ восстанавливается до Cr 2+: Cr 2 O 72+ + дифенилкарбазид → Cr 2++ дифенилкарбозон → комплекс Образуется розовое или красно-фиолетовое окрашивание. Реакция специфическая. Предел обнаружения 0, 2 мкг. • Подтверждающая реакция на Cr 6+ образование надхромовых кислот H 2 C 2 O 7 + 4 H 2 O 2→ 2 Cr. O 5 + 5 H 2 O Органический слой (диэтиловий эфир) окрашивается в синий цвет. Реакция специфическая. Предел обнаружения 2 мкг. 30
Исследования на Cr 3+ Реакция окисления Cr 3+ до Cr 6+ Cr 2(SO 4)4 + 3(NH 4)2 S 2 O 8 + 7 H 2 O → H 2 Cr 2 O 7 + 3(NH 4)2 SO 4 + 6 H 2 SO 4 • Предварительная реакция Cr 6+ с дифенилкарбазидом (ДФК) → Cr 6+ восстанавливается до Cr 2+: Cr 2 O 72+ + дифенилкарбазид → Cr 2++ дифенилкарбозон → комплекс Образуется розовое или красно-фиолетовое окрашивание. Реакция специфическая. Предел обнаружения 0, 2 мкг. • Подтверждающая реакция на Cr 6+ образование надхромовых кислот H 2 C 2 O 7 + 4 H 2 O 2→ 2 Cr. O 5 + 5 H 2 O Органический слой (диэтиловий эфир) окрашивается в синий цвет. Реакция специфическая. Предел обнаружения 2 мкг. 30
 Исследование на Ag+ Предварительная реакция с дитизоном в хлороформе Жёлтое окрашивание органического слоя. Предел обнаружения 0, 04 мкг. Отрицательный результат имеет судебно-токсикологическое значение. Выделение Ag+ из минерализата (90 мл минерализата + 0, 5 г Na. Cl): Ag+ + Na. Cl→Ag. Cl↓ + Na+ Фильтрат исследуют на другие катионы, а осадок растворяют в 20 % NH 4 OH: Ag. Cl + 2 NH 4 OH→[Ag(NH 3)2]Cl + 2 H 2 O Подтверждающие реакции с аммиачным раствором Ag. Cl: v реакция с K 2 Cr 2 O 7 (кристаллы оранжево-красного цвета): 2 Ag. NO 3 + K 2 Cr 2 O 7 → Ag 2 Cr 2 O 7↓ + 2 KNO 3 Предел обнаружения 0, 15 мкг; v реакция образования кристаллов Ag(NH 3)2 Cl (бесцветные кристаллы в виде иголок), предел обнаружения 0, 05 мкг; v реакция с тиомочевиной и пикратом калия (кристаллы жёлтого цвета), предел обнаружения 0, 03 мкг. 31
Исследование на Ag+ Предварительная реакция с дитизоном в хлороформе Жёлтое окрашивание органического слоя. Предел обнаружения 0, 04 мкг. Отрицательный результат имеет судебно-токсикологическое значение. Выделение Ag+ из минерализата (90 мл минерализата + 0, 5 г Na. Cl): Ag+ + Na. Cl→Ag. Cl↓ + Na+ Фильтрат исследуют на другие катионы, а осадок растворяют в 20 % NH 4 OH: Ag. Cl + 2 NH 4 OH→[Ag(NH 3)2]Cl + 2 H 2 O Подтверждающие реакции с аммиачным раствором Ag. Cl: v реакция с K 2 Cr 2 O 7 (кристаллы оранжево-красного цвета): 2 Ag. NO 3 + K 2 Cr 2 O 7 → Ag 2 Cr 2 O 7↓ + 2 KNO 3 Предел обнаружения 0, 15 мкг; v реакция образования кристаллов Ag(NH 3)2 Cl (бесцветные кристаллы в виде иголок), предел обнаружения 0, 05 мкг; v реакция с тиомочевиной и пикратом калия (кристаллы жёлтого цвета), предел обнаружения 0, 03 мкг. 31
 Исследование на Cu 2+ Предварительная реакция выделения Cu 2+ из минерализата Жёлто-коричневое окрашивание органического слоя. Отрицательный результат имеет судебно-токсикологическое значение. Реакция реэкстракции Cu 2+ в водную фазу Подтверждающие реакции с раствором Cu. Cl 2: v реакция с аммоний тетрароданомеркуроатом (NH 4)2[Hg(NCS)4] и Zn. SO 4 (специфическая) – образуется осадок розового цвета; v реакция с K 4[Fe(CN)6] и Cd. Cl 2 – образуется осадок сиреневого цвета; v реакция с пиридин-родановым реактивом в CHCl 3 – окрашивание органического слоя в зеленый цвет. 32
Исследование на Cu 2+ Предварительная реакция выделения Cu 2+ из минерализата Жёлто-коричневое окрашивание органического слоя. Отрицательный результат имеет судебно-токсикологическое значение. Реакция реэкстракции Cu 2+ в водную фазу Подтверждающие реакции с раствором Cu. Cl 2: v реакция с аммоний тетрароданомеркуроатом (NH 4)2[Hg(NCS)4] и Zn. SO 4 (специфическая) – образуется осадок розового цвета; v реакция с K 4[Fe(CN)6] и Cd. Cl 2 – образуется осадок сиреневого цвета; v реакция с пиридин-родановым реактивом в CHCl 3 – окрашивание органического слоя в зеленый цвет. 32
 Исследование на Sb 3+ • Предварительная реакция с малахитовым (бриллиантовым) зеленым в толуоле Реакция основана на окислении Sb 3+ до Sb 5+ азотистой кислотой с последующим выделением продукта реакции в органическую фазу (водная фаза сохраняет оранжевое окрашивание, а органическая фаза – окрашивается в синий цвет). После обработки органической фазы 25% H 2 SO 4 окрашивание сохраняется. Комплексы Fe 3+ и Tl+ с малахитовым зелёным легко разрушаются при данных условиях. Реакция неспецифическая. • Подтверждающая реакция с Na 2 S 2 O 3 Sb 2(SO 4)3 + 3 Na 2 S 2 O 3→Sb 2(S 2 O 3)3 + 3 Na 2 SO 4 Sb 2(S 2 O 3)3 + 3 H 2 O→Sb 2 S 3↓ + 3 H 2 SO 4 Образуется осадок оранжевого цвета. Данная реакция является отличительной при исследовании на Tl+. 33
Исследование на Sb 3+ • Предварительная реакция с малахитовым (бриллиантовым) зеленым в толуоле Реакция основана на окислении Sb 3+ до Sb 5+ азотистой кислотой с последующим выделением продукта реакции в органическую фазу (водная фаза сохраняет оранжевое окрашивание, а органическая фаза – окрашивается в синий цвет). После обработки органической фазы 25% H 2 SO 4 окрашивание сохраняется. Комплексы Fe 3+ и Tl+ с малахитовым зелёным легко разрушаются при данных условиях. Реакция неспецифическая. • Подтверждающая реакция с Na 2 S 2 O 3 Sb 2(SO 4)3 + 3 Na 2 S 2 O 3→Sb 2(S 2 O 3)3 + 3 Na 2 SO 4 Sb 2(S 2 O 3)3 + 3 H 2 O→Sb 2 S 3↓ + 3 H 2 SO 4 Образуется осадок оранжевого цвета. Данная реакция является отличительной при исследовании на Tl+. 33
 Исследование на Tl+ • Предварительная реакция с малахитовым (бриллиантовым) зелёным в толуоле. Реакция основана на окислении Tl+ до Tl 3+ с последующим выделением продукта реакции в органическую фазу. Органический слой окрашивается в синий цвет подобно исследованиям на Sb 3+, реакция неспецифическая. • Подтверждающая реакция исследовании на Sb 3+) с дитизоном (отличительная при (зелёный) (красный) Окрашивание органического слоя в красный цвет. 34
Исследование на Tl+ • Предварительная реакция с малахитовым (бриллиантовым) зелёным в толуоле. Реакция основана на окислении Tl+ до Tl 3+ с последующим выделением продукта реакции в органическую фазу. Органический слой окрашивается в синий цвет подобно исследованиям на Sb 3+, реакция неспецифическая. • Подтверждающая реакция исследовании на Sb 3+) с дитизоном (отличительная при (зелёный) (красный) Окрашивание органического слоя в красный цвет. 34
 Исследование на As 3+ • Предварительная реакция Зангер-Блэка Основана на восстановлении H 3 As. O 4 купрированным Zn до As. H 3↑ в присутствии H 2 SO 4. В дальнейшем As. H 3 реагирует с Hg. Cl 2 As. H 3 + 3 Hg. Cl 2→As(Hg. Cl)3 + 3 HCl Жёлтое окрашивание реактивной бумаги. Для устранения влияния H 2 S, который также реагирует с Hg. Cl 2, под реактивную бумагу помещают кусочек ваты, пропитанной Pb(CH 3 COO)2 + H 2 S→Pb. S + 2 CH 3 COOH Реакция неспецифическая, характерная также для Sb 3+. Отрицательный результат имеет судебно-токсикологическое значение. • Определение в аппарате Марша (метод предложен в 1836 г. ) H 3 As. O 4 + 8 H→As. H 3↑ + 4 H 2 O; As. H 3→As↓ + 3 H 4 As + 3 O 2 → 2 As 2 O 3 Восстановительная трубка аппарата Марша и микрофотографии налёта As 2 O 3, который имеет характерную форму кристаллов в виде октаэдров, прилагаются к акту судебно-токсикологических исследований, что является доказательством наличия As в минерализате. Налёт Sb 2 О 3 в трубке аппарата имеет аморфную структуру. 35
Исследование на As 3+ • Предварительная реакция Зангер-Блэка Основана на восстановлении H 3 As. O 4 купрированным Zn до As. H 3↑ в присутствии H 2 SO 4. В дальнейшем As. H 3 реагирует с Hg. Cl 2 As. H 3 + 3 Hg. Cl 2→As(Hg. Cl)3 + 3 HCl Жёлтое окрашивание реактивной бумаги. Для устранения влияния H 2 S, который также реагирует с Hg. Cl 2, под реактивную бумагу помещают кусочек ваты, пропитанной Pb(CH 3 COO)2 + H 2 S→Pb. S + 2 CH 3 COOH Реакция неспецифическая, характерная также для Sb 3+. Отрицательный результат имеет судебно-токсикологическое значение. • Определение в аппарате Марша (метод предложен в 1836 г. ) H 3 As. O 4 + 8 H→As. H 3↑ + 4 H 2 O; As. H 3→As↓ + 3 H 4 As + 3 O 2 → 2 As 2 O 3 Восстановительная трубка аппарата Марша и микрофотографии налёта As 2 O 3, который имеет характерную форму кристаллов в виде октаэдров, прилагаются к акту судебно-токсикологических исследований, что является доказательством наличия As в минерализате. Налёт Sb 2 О 3 в трубке аппарата имеет аморфную структуру. 35
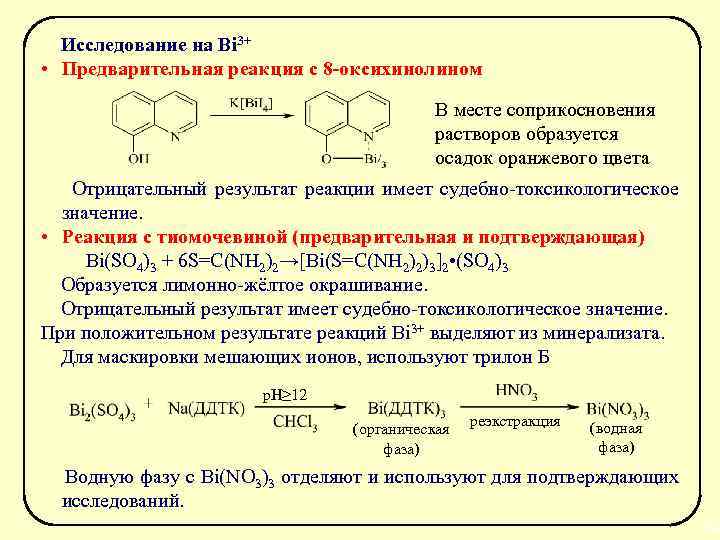 Исследование на Bi 3+ • Предварительная реакция с 8 -оксихинолином В месте соприкосновения растворов образуется осадок оранжевого цвета Отрицательный результат реакции имеет судебно-токсикологическое значение. • Реакция с тиомочевиной (предварительная и подтверждающая) Bi(SO 4)3 + 6 S=C(NH 2)2→[Bi(S=C(NH 2)2)3]2 • (SO 4)3 Образуется лимонно-жёлтое окрашивание. Отрицательный результат имеет судебно-токсикологическое значение. При положительном результате реакций Bi 3+ выделяют из минерализата. Для маскировки мешающих ионов, используют трилон Б р. Н≥ 12 (органическая фаза) реэкстракция (водная фаза) Водную фазу с Bi(NO 3)3 отделяют и используют для подтверждающих исследований. 36
Исследование на Bi 3+ • Предварительная реакция с 8 -оксихинолином В месте соприкосновения растворов образуется осадок оранжевого цвета Отрицательный результат реакции имеет судебно-токсикологическое значение. • Реакция с тиомочевиной (предварительная и подтверждающая) Bi(SO 4)3 + 6 S=C(NH 2)2→[Bi(S=C(NH 2)2)3]2 • (SO 4)3 Образуется лимонно-жёлтое окрашивание. Отрицательный результат имеет судебно-токсикологическое значение. При положительном результате реакций Bi 3+ выделяют из минерализата. Для маскировки мешающих ионов, используют трилон Б р. Н≥ 12 (органическая фаза) реэкстракция (водная фаза) Водную фазу с Bi(NO 3)3 отделяют и используют для подтверждающих исследований. 36
 Подтверждающие реакции на Bi 3+ Реакция с бруцином и KBr Образуются жёлто-зелёные кристаллы-сфероиды. При добавлении KI цвет кристаллов меняется на красный, в отличие от кристаллов Cd 2+. Реакция неспецифическая. Реакция с хлоридом цезия и KI Bi(NO 3)3 + 2 Cs. Cl + 5 KI→Cs[Bi. I 4]↓ + 3 KNO 3 + 2 KCl Образуются оранжево-красные кристаллы-шестиугольники. Реакция неспецифическая. Реакция с тиомочевиной Bi(NO 3)3 + 3 S=C(NH 2)2→[Bi(S=C(NH 2)2)3] • (NO 3)3 Образуется лимонно-жёлтое окрашивание. Реакция неспецифическая. 37
Подтверждающие реакции на Bi 3+ Реакция с бруцином и KBr Образуются жёлто-зелёные кристаллы-сфероиды. При добавлении KI цвет кристаллов меняется на красный, в отличие от кристаллов Cd 2+. Реакция неспецифическая. Реакция с хлоридом цезия и KI Bi(NO 3)3 + 2 Cs. Cl + 5 KI→Cs[Bi. I 4]↓ + 3 KNO 3 + 2 KCl Образуются оранжево-красные кристаллы-шестиугольники. Реакция неспецифическая. Реакция с тиомочевиной Bi(NO 3)3 + 3 S=C(NH 2)2→[Bi(S=C(NH 2)2)3] • (NO 3)3 Образуется лимонно-жёлтое окрашивание. Реакция неспецифическая. 37
 Исследоване на Zn 2+ • Предварительная реакция с дитизоном в хлороформе Хлороформный слой окрашивается в красно-фиолетовый цвет. Отрицательный результат имеет судебно-токсикологическое значение. • Выделение Zn 2+ из минерализата в виде ДДТК Для маскировки Fe 3+ используют 20% р-р кислоты лимонной, для маскировки Cd 2+ и Cu 2+ – р-ры мочевины или натрий тиосульфат (органическая фаза) (водная фаза) • Подтверждающие реакции с раствором Zn. Cl 2: v Реакция с K 4[Fe(CN)6] – образуется белый осадок K 2 Zn 3[Fe(CN)6]2 ; v Реакция с Na 2 S – образуется белый осадок Zn. S; v Реакция с (NH 4)2[Hg(NCS)4] – образуются кристаллы Zn[Hg(NCS)4]. 38
Исследоване на Zn 2+ • Предварительная реакция с дитизоном в хлороформе Хлороформный слой окрашивается в красно-фиолетовый цвет. Отрицательный результат имеет судебно-токсикологическое значение. • Выделение Zn 2+ из минерализата в виде ДДТК Для маскировки Fe 3+ используют 20% р-р кислоты лимонной, для маскировки Cd 2+ и Cu 2+ – р-ры мочевины или натрий тиосульфат (органическая фаза) (водная фаза) • Подтверждающие реакции с раствором Zn. Cl 2: v Реакция с K 4[Fe(CN)6] – образуется белый осадок K 2 Zn 3[Fe(CN)6]2 ; v Реакция с Na 2 S – образуется белый осадок Zn. S; v Реакция с (NH 4)2[Hg(NCS)4] – образуются кристаллы Zn[Hg(NCS)4]. 38
 Исследование на Cd 2+ • Выделение Cd 2+ из минерализата в виде ДДТК Для маскировки мешающих ионов используют глицерин и сегнетовую соль (органическая реэкстракция (водная фаза) Водную фазу отделяют и исследуют на Cd 2+. Предварительные реакции • Реакция с Na 2 S – образуется жёлтый осадок Cd. S • Реакция с K 4[Fe(CN)6] – образуется белый осадок Cd 2[Fe(CN)6] Отрицательный результат реакций имеет судебно-токсикологическое значение. Подтверждающие реакции • Реакция с бруцином и KBr Образуются безцветные призматические кристаллы, которые при добавлении KI не меняют окрашивание (Bi 3+ меняет на красный). • Реакция с пиридином и KBr Образуются безцветные кристаллы в виде сфероидов. 39
Исследование на Cd 2+ • Выделение Cd 2+ из минерализата в виде ДДТК Для маскировки мешающих ионов используют глицерин и сегнетовую соль (органическая реэкстракция (водная фаза) Водную фазу отделяют и исследуют на Cd 2+. Предварительные реакции • Реакция с Na 2 S – образуется жёлтый осадок Cd. S • Реакция с K 4[Fe(CN)6] – образуется белый осадок Cd 2[Fe(CN)6] Отрицательный результат реакций имеет судебно-токсикологическое значение. Подтверждающие реакции • Реакция с бруцином и KBr Образуются безцветные призматические кристаллы, которые при добавлении KI не меняют окрашивание (Bi 3+ меняет на красный). • Реакция с пиридином и KBr Образуются безцветные кристаллы в виде сфероидов. 39
 Исследование на ртуть Объекты исследования 20 г печени и 20 г почек (исследуют раздельно) Пробоподготовка Деструктивный метод минерализации смесью концентрированных кислот H 2 SO 4 и HNO 3: 20 г объекта + 5 мл H 2 O + 1 мл C 2 H 5 OH (катализатор) + 10 мл HNO 3 C 2 H 5 OH + HNO 3→C 2 H 5 ONO + H 2 O H 2 SO 4 конц. добавляют по каплям до завершения выделения оксидов азота. Деструктат разводят H 2 O. Денитрация Мочевина 40
Исследование на ртуть Объекты исследования 20 г печени и 20 г почек (исследуют раздельно) Пробоподготовка Деструктивный метод минерализации смесью концентрированных кислот H 2 SO 4 и HNO 3: 20 г объекта + 5 мл H 2 O + 1 мл C 2 H 5 OH (катализатор) + 10 мл HNO 3 C 2 H 5 OH + HNO 3→C 2 H 5 ONO + H 2 O H 2 SO 4 конц. добавляют по каплям до завершения выделения оксидов азота. Деструктат разводят H 2 O. Денитрация Мочевина 40
 Обнаружение Hg 2+ • Предварительная реакция с H 2 Dz в CHCl 3 Hg. SO 4 + H 2 Dz→Hg 2 Dz + H 2 SO 4 Образуется жёлто-оранжевое окрашивание хлороформного слоя. Предел обнаружения 0, 05 мкг в 1 мл. • Подтверждаюшая реакция с Cu. I Hg. SO 4 + 4 Cu. I→Cu 2 Hg. I 4↓ + Cu. SO 4 Образуется осадок красно-оранжевого цвета. Предел обнаружения 1 мкг. 41
Обнаружение Hg 2+ • Предварительная реакция с H 2 Dz в CHCl 3 Hg. SO 4 + H 2 Dz→Hg 2 Dz + H 2 SO 4 Образуется жёлто-оранжевое окрашивание хлороформного слоя. Предел обнаружения 0, 05 мкг в 1 мл. • Подтверждаюшая реакция с Cu. I Hg. SO 4 + 4 Cu. I→Cu 2 Hg. I 4↓ + Cu. SO 4 Образуется осадок красно-оранжевого цвета. Предел обнаружения 1 мкг. 41

 Do you like animals ? And little one ? А хомячков?
Do you like animals ? And little one ? А хомячков?
 В чем причина? Что делать? Это не суицид Это не криминальный случай
В чем причина? Что делать? Это не суицид Это не криминальный случай
 Химическое изучение проблем хомячка 1. Проводим минерализацию 2. Реакция с окислителями 3. Реакция с дитизоном 4. Реакция с ДДТК 5. Реакция с 8 -оксихинолином 6. Реакция с Na 2 S раствор Окрашивание не появляется Изменения окрашивания органического слоя не происходит Изменения окрашивания не происходит Осадок не образуется Pb 2+, Mn 2+, Ag+, Zn 2+, Cu 2+, Bi 3+, Cd 2+, Cr 3+, Ba 2+, Tl 3+
Химическое изучение проблем хомячка 1. Проводим минерализацию 2. Реакция с окислителями 3. Реакция с дитизоном 4. Реакция с ДДТК 5. Реакция с 8 -оксихинолином 6. Реакция с Na 2 S раствор Окрашивание не появляется Изменения окрашивания органического слоя не происходит Изменения окрашивания не происходит Осадок не образуется Pb 2+, Mn 2+, Ag+, Zn 2+, Cu 2+, Bi 3+, Cd 2+, Cr 3+, Ba 2+, Tl 3+
 Интерпретация результатов исследования 1. Слишком много ел
Интерпретация результатов исследования 1. Слишком много ел
 Интерпретация результатов исследования 1. Уснул до весны
Интерпретация результатов исследования 1. Уснул до весны
 В ходе химико-токсикологического исследования ни одно животное не пострадало
В ходе химико-токсикологического исследования ни одно животное не пострадало
 НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ СОЕДИНЕНИЙ МЕТАЛЛОВ, СУРЬМЫ И МЫШЬЯКА Часть 3: 1. Количественное определение соединений металлов.
НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ СОЕДИНЕНИЙ МЕТАЛЛОВ, СУРЬМЫ И МЫШЬЯКА Часть 3: 1. Количественное определение соединений металлов.
 Атомно-абсорбционная спектрометрия – метод качественного и количественного элементного анализа (Уолш, 1955 г. ), основанный на явлении селективного поглощения (абсорбции) свободными атомами УФ- и видимого излучения Схема атомно-абсорбционного спектрометра 1. Источник излучения – лампа с катодом, заполненная инертным газом (неон, диапазон излучения 190 -850 нм). 2. Атомизатор – пламя для сжигания пробы (переведение пробы в атомный газ). Для создания пламени используют смесь ацетилена с воздухом (2100°С), смесь ацетилена с закисью азота (2900°С) или графитовую печь (3000°С). 3. Монохроматор – для разложения света на спектр. 4. Фотоумножитель – для увеличения спектра света. 5. Прибор регистрации резонансных линий соответствующего элемента при переходе в возбудженное энергетическое состояние. 50
Атомно-абсорбционная спектрометрия – метод качественного и количественного элементного анализа (Уолш, 1955 г. ), основанный на явлении селективного поглощения (абсорбции) свободными атомами УФ- и видимого излучения Схема атомно-абсорбционного спектрометра 1. Источник излучения – лампа с катодом, заполненная инертным газом (неон, диапазон излучения 190 -850 нм). 2. Атомизатор – пламя для сжигания пробы (переведение пробы в атомный газ). Для создания пламени используют смесь ацетилена с воздухом (2100°С), смесь ацетилена с закисью азота (2900°С) или графитовую печь (3000°С). 3. Монохроматор – для разложения света на спектр. 4. Фотоумножитель – для увеличения спектра света. 5. Прибор регистрации резонансных линий соответствующего элемента при переходе в возбудженное энергетическое состояние. 50
 Физические основы атомно-абсорбционной спектрометрии Физической сновой метода является способность свободного атома поглощать квант света при частоте излучения, равной частоте его резонансного перехода (переход в возбужденное энергетическое состояние). Атомы в возбужденном состоянии практически не поглощают А + hν→A*, где h – постоянная Планка, ν – частота перехода: где ЕА* и ЕА – энергия атомов в возбужденном и основном энергетическом состояниях. При поглощении кванта света свободным атомом происходит снижение интенсивности излучения, которое подчиняется закону Бугера-Ламберта. Берра где І0 и І – интенсивность излучения до и после прохождения через поглощающий слой; А – оптическая плотность; k – коеффициент поглощения; L – толщина светопоглощающего слоя (пламя); С – концентрация анализируемого вещества. 51
Физические основы атомно-абсорбционной спектрометрии Физической сновой метода является способность свободного атома поглощать квант света при частоте излучения, равной частоте его резонансного перехода (переход в возбужденное энергетическое состояние). Атомы в возбужденном состоянии практически не поглощают А + hν→A*, где h – постоянная Планка, ν – частота перехода: где ЕА* и ЕА – энергия атомов в возбужденном и основном энергетическом состояниях. При поглощении кванта света свободным атомом происходит снижение интенсивности излучения, которое подчиняется закону Бугера-Ламберта. Берра где І0 и І – интенсивность излучения до и после прохождения через поглощающий слой; А – оптическая плотность; k – коеффициент поглощения; L – толщина светопоглощающего слоя (пламя); С – концентрация анализируемого вещества. 51
 Определение элементов методом атомно-абсорбционной спектрометрии Элемент Длина волны, нм Чувствительность, мкг/мл Состав пламени Ag 328, 1 0, 1 ацетилен-воздух As 193, 7 2 ацетилен-воздух Ba 553, 6 0, 4 ацетилен-кислород Bi 223, 1 0, 8 ацетилен-воздух Cd 228, 8 0, 03 ацетилен-воздух Cr 357, 9 0, 15 ацетилен-воздух Cu 324, 7 0, 15 ацетилен-воздух Hg 253, 7 15 ацетилен-воздух Mn 279, 5 0, 1 ацетилен-воздух Pb 217, 0 0, 5 ацетилен-воздух Sb 217, 6 1 ацетилен-воздух Tl 276, 8 0, 8 ацетилен-воздух Zn 213, 9 0, 04 ацетилен-кислород 52
Определение элементов методом атомно-абсорбционной спектрометрии Элемент Длина волны, нм Чувствительность, мкг/мл Состав пламени Ag 328, 1 0, 1 ацетилен-воздух As 193, 7 2 ацетилен-воздух Ba 553, 6 0, 4 ацетилен-кислород Bi 223, 1 0, 8 ацетилен-воздух Cd 228, 8 0, 03 ацетилен-воздух Cr 357, 9 0, 15 ацетилен-воздух Cu 324, 7 0, 15 ацетилен-воздух Hg 253, 7 15 ацетилен-воздух Mn 279, 5 0, 1 ацетилен-воздух Pb 217, 0 0, 5 ацетилен-воздух Sb 217, 6 1 ацетилен-воздух Tl 276, 8 0, 8 ацетилен-воздух Zn 213, 9 0, 04 ацетилен-кислород 52
 Методы расчета концентрации элементов в атомно-абсорбционной спектрометрии Метод построения градуировочного графика Для построения градуировочного графика готовят серию растворов сравнения (3 -5 растворов), которые содержат те же самые вещества, что и анализируемый раствор. Измеряют оптическую плотность растворов и строят график в координатах А–С. В этих же условиях измеряют абсорбцию анализируемого раствора и по графику определяют концентрацию вещества. Метод добавок Из анализируемого раствора отбирают несколько аликвот и добавляют к ним заведомо известные количества вещества, которое определяют (добавленное количество должно быть в 1, 5 раза больше содержания, которое определяется). К одной из аликвот добавку не вводят. Затем проводят измерения приготовленных растворов и определяют содержание вещества по разнице концентраций раствора с добавкой и раствора без добавки. 53
Методы расчета концентрации элементов в атомно-абсорбционной спектрометрии Метод построения градуировочного графика Для построения градуировочного графика готовят серию растворов сравнения (3 -5 растворов), которые содержат те же самые вещества, что и анализируемый раствор. Измеряют оптическую плотность растворов и строят график в координатах А–С. В этих же условиях измеряют абсорбцию анализируемого раствора и по графику определяют концентрацию вещества. Метод добавок Из анализируемого раствора отбирают несколько аликвот и добавляют к ним заведомо известные количества вещества, которое определяют (добавленное количество должно быть в 1, 5 раза больше содержания, которое определяется). К одной из аликвот добавку не вводят. Затем проводят измерения приготовленных растворов и определяют содержание вещества по разнице концентраций раствора с добавкой и раствора без добавки. 53
 Количественное определение элементов в минерализате Количественное определение Pb 2+ • Экстракционно-фотометрический метод (по реакции с H 2 Dz) Измеряют оптическую плотность Pb(HDz)2 в CHCl 3 (красное окрашивание), λ=252 нм. Расчет концентрации – по калибровочному графику (1 • 10 -2— 1 • 10 -3 г/мл). Предел обнаружения 0, 02 -2 мг в 100 г объекта. • Йодометрическое титрование (по реакции с K 2 Cr 2 O 7) 2 Pb(OCOCH 3)2 + K 2 Cr 2 O 7 + H 2 O→ 2 Pb. Cr. O 4↓ + 2 CH 3 COOK + 2 CH 3 COOH избыток Осадок Pb. Cr. O 4 отфильтровывают. К фильтрату добавляют 2 г KI и 5 M H 2 SO 4. Выделившийся йод титруют натрия тиосульфатом I 2 + 2 Na 2 S 2 O 3→ 2 Na. I + Na 2 S 4 O 6 Индикатор – крахмал. Предел обнаружения 2 мг в 100 г объекта. • Комплексонометрическое титрование (с комплексоном ІІІ) Pb(OCOCH 3)2 + комплексон ІІІ(избыток) + эриохром ЕТ-00 Избыток комплексона ІІІ титруют 0, 01 М Zn. SO 4 (синее→краснофиолетовое окрашивание). Предел обнаружения 1 -100 мг в 100 г объекта. 54
Количественное определение элементов в минерализате Количественное определение Pb 2+ • Экстракционно-фотометрический метод (по реакции с H 2 Dz) Измеряют оптическую плотность Pb(HDz)2 в CHCl 3 (красное окрашивание), λ=252 нм. Расчет концентрации – по калибровочному графику (1 • 10 -2— 1 • 10 -3 г/мл). Предел обнаружения 0, 02 -2 мг в 100 г объекта. • Йодометрическое титрование (по реакции с K 2 Cr 2 O 7) 2 Pb(OCOCH 3)2 + K 2 Cr 2 O 7 + H 2 O→ 2 Pb. Cr. O 4↓ + 2 CH 3 COOK + 2 CH 3 COOH избыток Осадок Pb. Cr. O 4 отфильтровывают. К фильтрату добавляют 2 г KI и 5 M H 2 SO 4. Выделившийся йод титруют натрия тиосульфатом I 2 + 2 Na 2 S 2 O 3→ 2 Na. I + Na 2 S 4 O 6 Индикатор – крахмал. Предел обнаружения 2 мг в 100 г объекта. • Комплексонометрическое титрование (с комплексоном ІІІ) Pb(OCOCH 3)2 + комплексон ІІІ(избыток) + эриохром ЕТ-00 Избыток комплексона ІІІ титруют 0, 01 М Zn. SO 4 (синее→краснофиолетовое окрашивание). Предел обнаружения 1 -100 мг в 100 г объекта. 54
 Количественное определение Ba 2+ • Гравиметрический метод (по реакции переосаждения Ba. SO 4) Ba. SO 4 растворяют в аммиачном растворе трилона Б (связывание Fe 3+ и Ca 2+). Осаждение Ba. SO 4 раствором (NH 4)2 SO 4 (в фильтрате комплексы Fe 3+ и Ca 2+ с трилоном Б). Осадок отфильтровывают, высушивают до постоянного веса и взвешивают. Граничне визначення 5 мг в 100 г об'єкту. • Комплексонометрическое титрование (с комплексоном ІІІ) Ba. SO 4 + комплексон ІІІ(избыток) + 8 М NH 4 OH + эриохром ЕТ-00 Избыток комплексона ІІІ титруют 0, 01 М Zn. Cl 2 (синее→краснофиолетовое окрашивание). Добавляют избыток Zn. Cl 2 и титруют 0, 01 М раствором трилона Б (красно-фиолетовое→синее окрашивание). Количественное содержание Ba 2+ расчитывают по разнице объемов титрантов. Предел обнаружения 0, 5 -10 мг в 100 г объекта. 55
Количественное определение Ba 2+ • Гравиметрический метод (по реакции переосаждения Ba. SO 4) Ba. SO 4 растворяют в аммиачном растворе трилона Б (связывание Fe 3+ и Ca 2+). Осаждение Ba. SO 4 раствором (NH 4)2 SO 4 (в фильтрате комплексы Fe 3+ и Ca 2+ с трилоном Б). Осадок отфильтровывают, высушивают до постоянного веса и взвешивают. Граничне визначення 5 мг в 100 г об'єкту. • Комплексонометрическое титрование (с комплексоном ІІІ) Ba. SO 4 + комплексон ІІІ(избыток) + 8 М NH 4 OH + эриохром ЕТ-00 Избыток комплексона ІІІ титруют 0, 01 М Zn. Cl 2 (синее→краснофиолетовое окрашивание). Добавляют избыток Zn. Cl 2 и титруют 0, 01 М раствором трилона Б (красно-фиолетовое→синее окрашивание). Количественное содержание Ba 2+ расчитывают по разнице объемов титрантов. Предел обнаружения 0, 5 -10 мг в 100 г объекта. 55
 Количественное определение Mn 2+ Фотоколориметрический метод (по реакции окисления Mn 2+ до Mn. O 4 -) (калия перйодатом или аммония персульфатом). Измеряют оптическую плотность раствора КMn. O 4 (красно-фиолетовое окрашивание), λ=525 нм. Расчет концентрации – по калибровочному графику. Предел обнаружения 0, 02 -20 мг в 100 г объекта. Количественное определение Cr 3+ Фотоколориметрический метод (по реакции с ДФК). После окисления Cr 3+ до Cr 6+ аммония персульфатом добавляют 0, 25% ДФК (р. Н = 1, 7) в смеси этанола и ацетона (1: 1). Измеряют оптическую плотность окрашенного комплекса [(Cr • ДФК-зон)2] (красно-фиолетовое окрашивание), λ=546 нм. Расчет концентрации – по калибровочному графику. Предел обнаружения 0, 1 -20 мг в 100 г объекта. 56
Количественное определение Mn 2+ Фотоколориметрический метод (по реакции окисления Mn 2+ до Mn. O 4 -) (калия перйодатом или аммония персульфатом). Измеряют оптическую плотность раствора КMn. O 4 (красно-фиолетовое окрашивание), λ=525 нм. Расчет концентрации – по калибровочному графику. Предел обнаружения 0, 02 -20 мг в 100 г объекта. Количественное определение Cr 3+ Фотоколориметрический метод (по реакции с ДФК). После окисления Cr 3+ до Cr 6+ аммония персульфатом добавляют 0, 25% ДФК (р. Н = 1, 7) в смеси этанола и ацетона (1: 1). Измеряют оптическую плотность окрашенного комплекса [(Cr • ДФК-зон)2] (красно-фиолетовое окрашивание), λ=546 нм. Расчет концентрации – по калибровочному графику. Предел обнаружения 0, 1 -20 мг в 100 г объекта. 56
 Количественное определение Ag+ • Титриметрический метод (по реакции с H 2 Dz) Раствор Ag. HDz в CHCl 3 титруют 0, 01 М раствором NH 4 SCN (желтое → зеленое окрашивание). Предел обнаружения 2 мг в 100 г объекта. • Экстракционно-фотометрический метод (по реакции с H 2 Dz) Измеряют оптическую плотность раствора Ag. HDz в CCl 4; λ=426 нм. Расчет концентрации – по калибровочному графику. Предел обнаружения 0, 02 мг в 100 г объекта. Количественное определение Cu 2+ • Экстракционно-фотометрический метод (по реакции образования Cu(ДДТК)2). Измеряют оптическую плотность раствора Cu(ДДТК)2 в CHCl 3 (желто-коричневое окрашивание), λ=435 нм. Расчет концентрации – по калибровочному графику. Предел обнаружения 0, 05 мг в 100 г объекта. • Комплексонометрическое титрование (с комплексоном ІІІ) Раствор Cu. Cl 2 + 2 г KI + NH 4 OH (желтое окрашивание). Титруют 0, 01 М раствором комплексона ІІІ (фиолетовое окрашивание). Предел обнаружения 0, 5 мг в 100 г объекта. 57
Количественное определение Ag+ • Титриметрический метод (по реакции с H 2 Dz) Раствор Ag. HDz в CHCl 3 титруют 0, 01 М раствором NH 4 SCN (желтое → зеленое окрашивание). Предел обнаружения 2 мг в 100 г объекта. • Экстракционно-фотометрический метод (по реакции с H 2 Dz) Измеряют оптическую плотность раствора Ag. HDz в CCl 4; λ=426 нм. Расчет концентрации – по калибровочному графику. Предел обнаружения 0, 02 мг в 100 г объекта. Количественное определение Cu 2+ • Экстракционно-фотометрический метод (по реакции образования Cu(ДДТК)2). Измеряют оптическую плотность раствора Cu(ДДТК)2 в CHCl 3 (желто-коричневое окрашивание), λ=435 нм. Расчет концентрации – по калибровочному графику. Предел обнаружения 0, 05 мг в 100 г объекта. • Комплексонометрическое титрование (с комплексоном ІІІ) Раствор Cu. Cl 2 + 2 г KI + NH 4 OH (желтое окрашивание). Титруют 0, 01 М раствором комплексона ІІІ (фиолетовое окрашивание). Предел обнаружения 0, 5 мг в 100 г объекта. 57
 Количественное определение Bi 3+ Комплексонометрическое титрование (с комплексоном ІІІ). Раствор Bi(NO 3)3 титруют 0, 01 М раствором комплексона ІІІ до перехода синего окрашивания в желтое (индикатор – пирокатехиновый фиолетовый). Предел обнаружения 1 мг в 100 г объекта. • Фотоколориметрический метод (по реакции с тиомочевиной) К раствору Bi(NO 3)3 добавляют излишек S=C(NH 2)2 (желтое окрашивание). Измеряют оптическую плотность раствора при λ=470 нм. Расчет концентрации – по калибровочному графику. Предел обнаружения 0, 1 мг в 100 г объекта. Количественное определение Zn 2+ Комплексонометрическое титрование (с комплексоном ІІІ). К раствору Zn. Cl 2 добавляют 20% раствор кислоты лимонной и титруют 0, 01 М раствором комплексона ІІІ (красно-фиолетовое→голубое окрашивание). Индикатор – эриохром черный ЕТ-00. Предел обнаружения 1 мг в 100 г объекта. 58
Количественное определение Bi 3+ Комплексонометрическое титрование (с комплексоном ІІІ). Раствор Bi(NO 3)3 титруют 0, 01 М раствором комплексона ІІІ до перехода синего окрашивания в желтое (индикатор – пирокатехиновый фиолетовый). Предел обнаружения 1 мг в 100 г объекта. • Фотоколориметрический метод (по реакции с тиомочевиной) К раствору Bi(NO 3)3 добавляют излишек S=C(NH 2)2 (желтое окрашивание). Измеряют оптическую плотность раствора при λ=470 нм. Расчет концентрации – по калибровочному графику. Предел обнаружения 0, 1 мг в 100 г объекта. Количественное определение Zn 2+ Комплексонометрическое титрование (с комплексоном ІІІ). К раствору Zn. Cl 2 добавляют 20% раствор кислоты лимонной и титруют 0, 01 М раствором комплексона ІІІ (красно-фиолетовое→голубое окрашивание). Индикатор – эриохром черный ЕТ-00. Предел обнаружения 1 мг в 100 г объекта. 58
 Количественное определение Sb 3+ Экстракционно-фотометрический метод (по реакции с малахитовым зеленым) Измеряют оптическую плотность ионного ассоциата H[Sb. Cl 6] с малахитовым зеленым в толуоле (синее окрашивание), λ=610 нм. Расчет концентрации – по калибровочному графику. Предел обнаружения 0, 1 мг в 100 г объекта. Количественное определение Tl+ Экстракционно-фотометрический метод (по реакции с бриллиантовым зеленым) Измеряют оптическую плотность ионного ассоциата H[Tl. Cl 4] с бриллиантовым зеленым в толуоле (синее окрашивание), λ=640 нм. Предел обнаружения 0, 1 мг в 100 г объекта. 59
Количественное определение Sb 3+ Экстракционно-фотометрический метод (по реакции с малахитовым зеленым) Измеряют оптическую плотность ионного ассоциата H[Sb. Cl 6] с малахитовым зеленым в толуоле (синее окрашивание), λ=610 нм. Расчет концентрации – по калибровочному графику. Предел обнаружения 0, 1 мг в 100 г объекта. Количественное определение Tl+ Экстракционно-фотометрический метод (по реакции с бриллиантовым зеленым) Измеряют оптическую плотность ионного ассоциата H[Tl. Cl 4] с бриллиантовым зеленым в толуоле (синее окрашивание), λ=640 нм. Предел обнаружения 0, 1 мг в 100 г объекта. 59
 Количественное определение Cd 2+ Комплексонометрическое титрование (с комплексоном ІІІ) К раствору Cd. Cl 2 добавляют 20% раствор кислоты лимонной (р. Н = 8) и титруют 0, 01 М раствором комплексона ІІІ (индикатор – эриохром черный ЕТ -00) до перехода красно-фиолетового окрашивания в голубое. Предел обнаружения 1 мг в 100 г объекта. Количественное определение As 3+ • Титриметрическое титрование. Основано на восстановлении H 3 As. O 4 в минерализате до летучего As. H 3 с последующим его поглощением титрованным раствором Ag. NO 3. Избыток Ag. NO 3 титруют 0, 01 М раствором NH 4 SCN до фиолетового окрашивания (индикатор – железоаммониевые квасцы) • Колориметрический метод Зангер-Блека На реактивной бумажке, пропитанная Hg. Cl 2, образуется пятно желтокоричневого цвета. Интенсивность окрашивания пятна сравнивают со стандартной шкалой (интервал концентраций 0, 1 -1, 2 мкг мыщьяка). Предел обнаружения 0, 001 мг в 20 мл минерализата. 60
Количественное определение Cd 2+ Комплексонометрическое титрование (с комплексоном ІІІ) К раствору Cd. Cl 2 добавляют 20% раствор кислоты лимонной (р. Н = 8) и титруют 0, 01 М раствором комплексона ІІІ (индикатор – эриохром черный ЕТ -00) до перехода красно-фиолетового окрашивания в голубое. Предел обнаружения 1 мг в 100 г объекта. Количественное определение As 3+ • Титриметрическое титрование. Основано на восстановлении H 3 As. O 4 в минерализате до летучего As. H 3 с последующим его поглощением титрованным раствором Ag. NO 3. Избыток Ag. NO 3 титруют 0, 01 М раствором NH 4 SCN до фиолетового окрашивания (индикатор – железоаммониевые квасцы) • Колориметрический метод Зангер-Блека На реактивной бумажке, пропитанная Hg. Cl 2, образуется пятно желтокоричневого цвета. Интенсивность окрашивания пятна сравнивают со стандартной шкалой (интервал концентраций 0, 1 -1, 2 мкг мыщьяка). Предел обнаружения 0, 001 мг в 20 мл минерализата. 60



