ER-L1.ppt
- Количество слайдов: 87
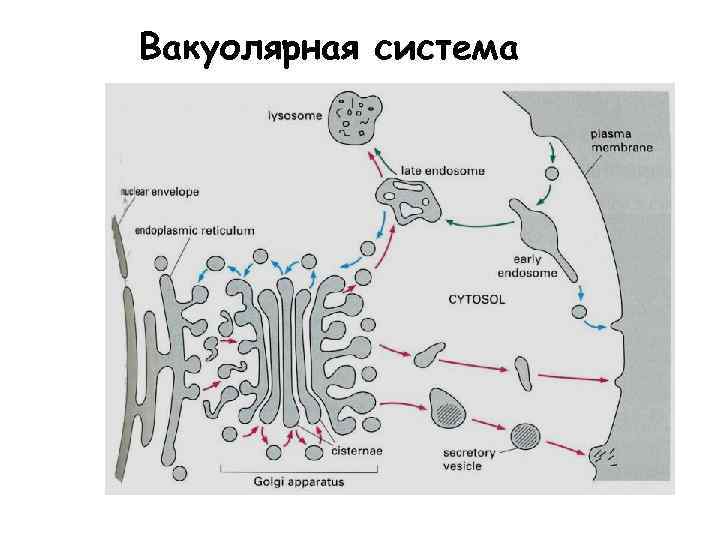
Вакуолярная система

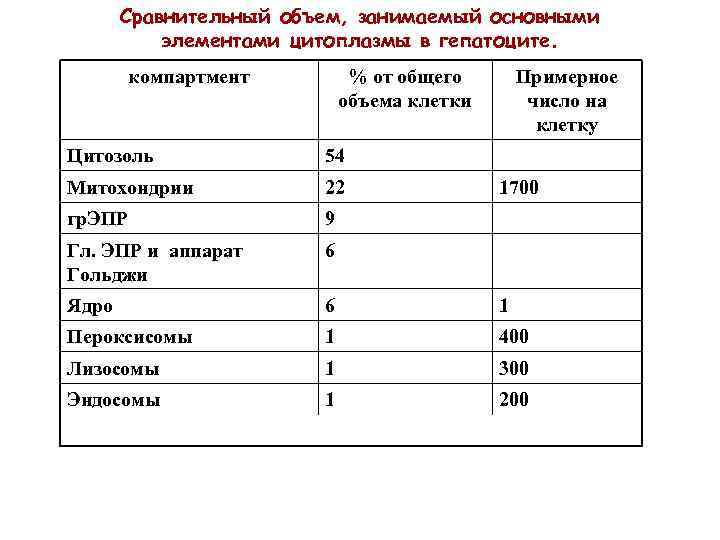
Сравнительный объем, занимаемый основными элементами цитоплазмы в гепатоците. компартмент % от общего объема клетки Примерное число на клетку Цитозоль 54 Митохондрии 22 гр. ЭПР 9 Гл. ЭПР и аппарат Гольджи 6 Ядро 6 1 Пероксисомы 1 400 Лизосомы 1 300 Эндосомы 1 200 1700
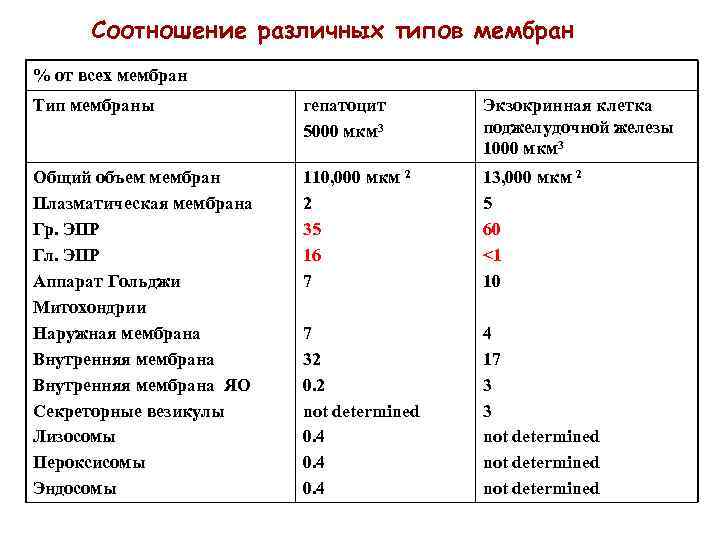
Соотношение различных типов мембран % от всех мембран Тип мембраны гепатоцит 5000 мкм 3 Экзокринная клетка поджелудочной железы 1000 мкм 3 Общий объем мембран Плазматическая мембрана Гр. ЭПР Гл. ЭПР Аппарат Гольджи Митохондрии Наружная мембрана Внутренняя мембрана ЯО Секреторные везикулы Лизосомы Пероксисомы Эндосомы 110, 000 мкм 2 2 35 16 7 13, 000 мкм 2 5 60 <1 10 7 32 0. 2 not determined 0. 4 4 17 3 3 not determined



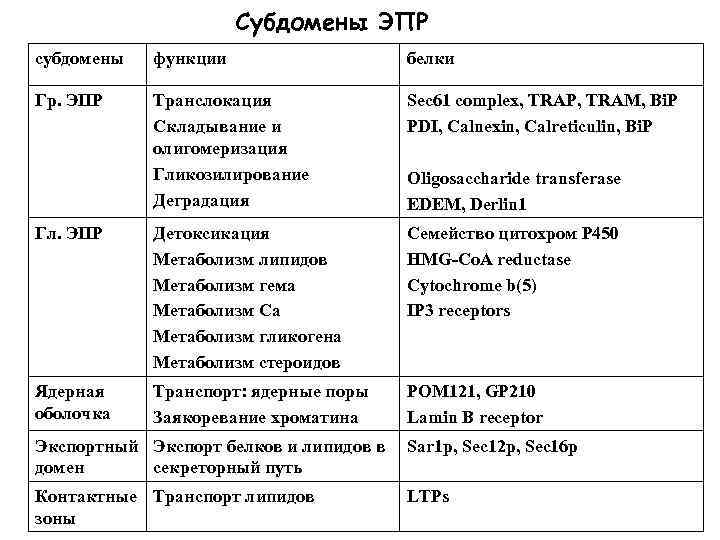
Субдомены ЭПР субдомены функции белки Гр. ЭПР Транслокация Складывание и олигомеризация Гликозилирование Деградация Sec 61 complex, TRAP, TRAM, Bi. P PDI, Calnexin, Calreticulin, Bi. P Гл. ЭПР Детоксикация Метаболизм липидов Метаболизм гема Метаболизм Са Метаболизм гликогена Метаболизм стероидов Семейство цитохром Р 450 HMG-Co. A reductase Cytochrome b(5) IP 3 receptors Ядерная оболочка Транспорт: ядерные поры Заякоревание хроматина POM 121, GP 210 Lamin B receptor Oligosaccharide transferase EDEM, Derlin 1 Экспортный Экспорт белков и липидов в Sar 1 p, Sec 12 p, Sec 16 p домен секреторный путь Контактные Транспорт липидов зоны LTPs


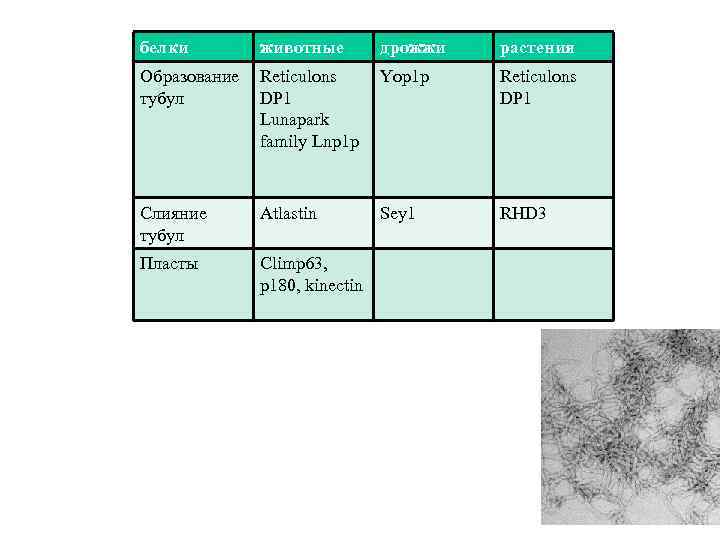
белки животные дрожжи растения Образование тубул Reticulons DP 1 Lunapark family Lnp 1 p Yop 1 p Reticulons DP 1 Слияние тубул Atlastin Sey 1 RHD 3 Пласты Climp 63, p 180, kinectin


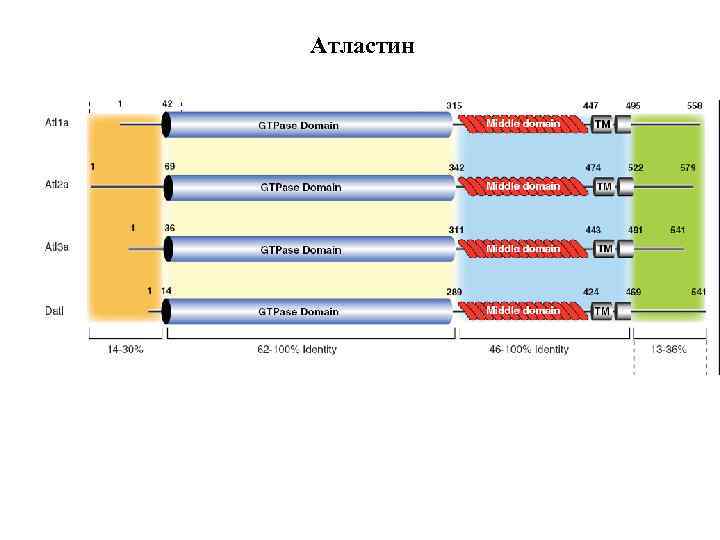
Атластин

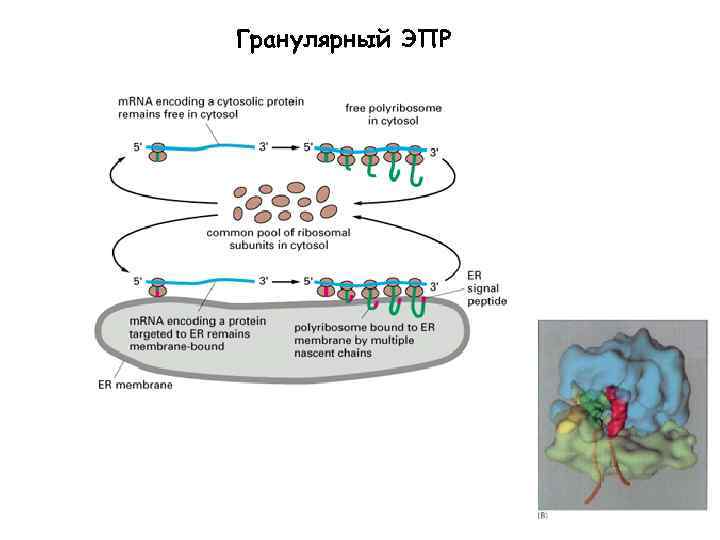
Гранулярный ЭПР
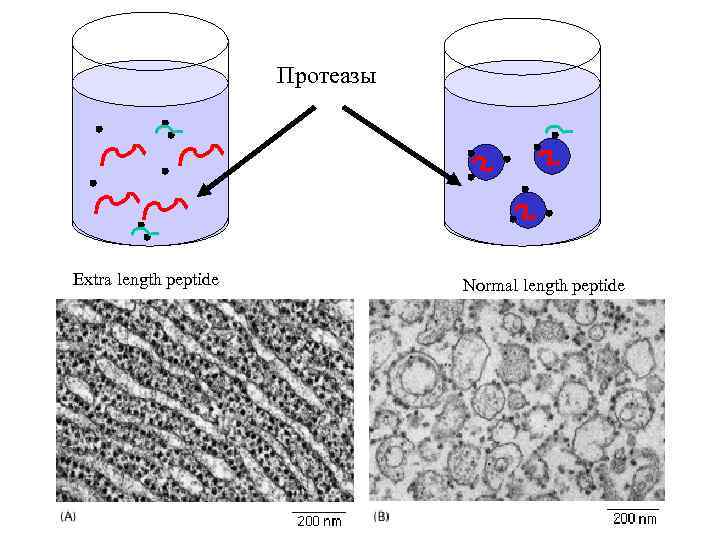
Протеазы Extra length peptide Normal length peptide
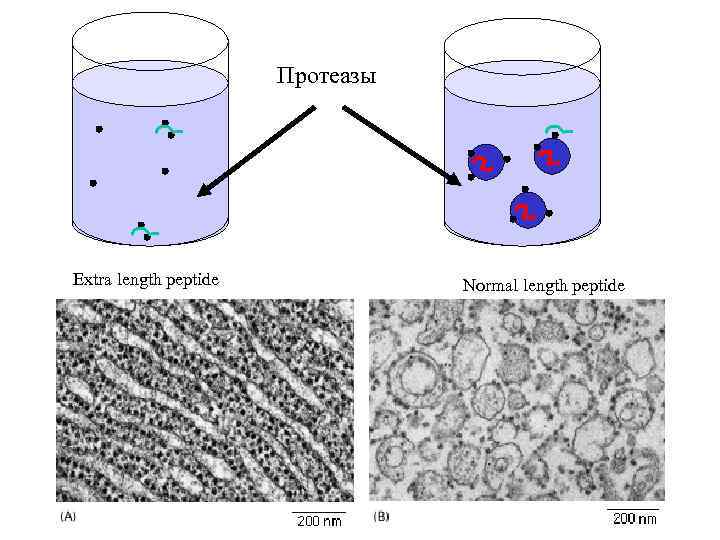
Протеазы Extra length peptide Normal length peptide




Сигнальная последовательность
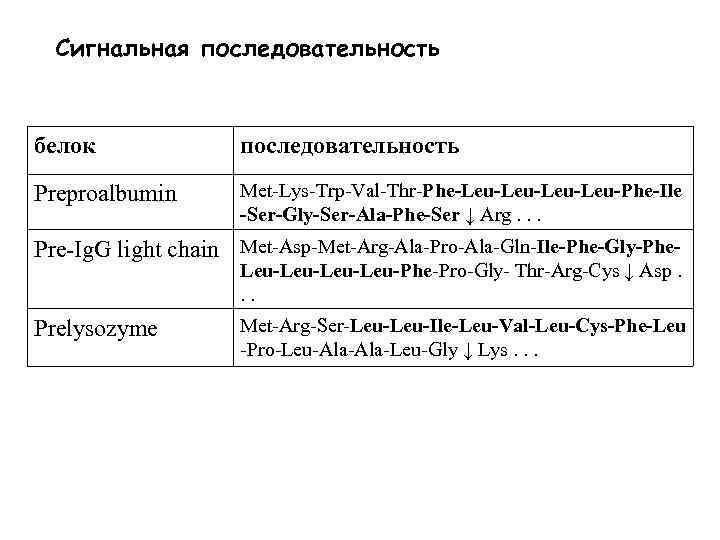
Сигнальная последовательность белок последовательность Preproalbumin Met-Lys-Trp-Val-Thr-Phe-Leu-Leu-Phe-Ile -Ser-Gly-Ser-Ala-Phe-Ser ↓ Arg. . . Pre-Ig. G light chain Met-Asp-Met-Arg-Ala-Pro-Ala-Gln-Ile-Phe-Gly-Phe- Leu-Leu-Phe-Pro-Gly- Thr-Arg-Cys ↓ Asp. . . Prelysozyme Met-Arg-Ser-Leu-Ile-Leu-Val-Leu-Cys-Phe-Leu -Pro-Leu-Ala-Leu-Gly ↓ Lys. . .
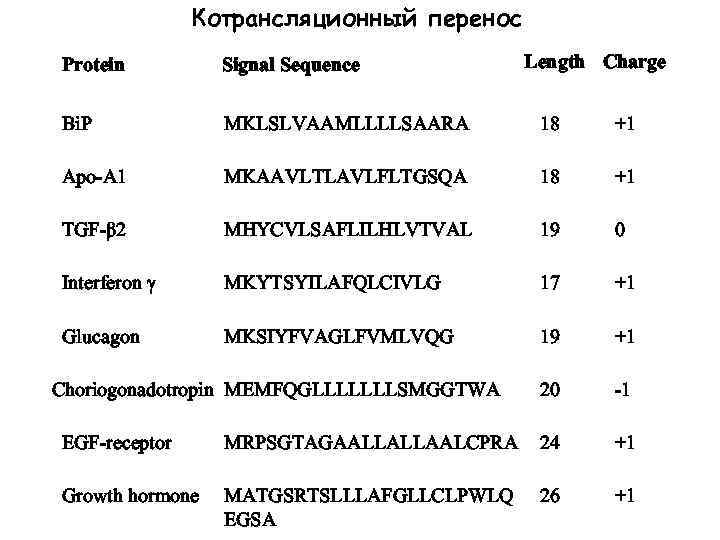
Котрансляционный перенос Length Charge Protein Signal Sequence Bi. P MKLSLVAAMLLLLSAARA 18 +1 Apo-A 1 MKAAVLTLAVLFLTGSQA 18 +1 TGF-β 2 MHYCVLSAFLILHLVTVAL 19 0 Interferon γ MKYTSYILAFQLCIVLG 17 +1 Glucagon MKSIYFVAGLFVMLVQG 19 +1 20 -1 Choriogonadotropin MEMFQGLLLLLLLSMGGTWA EGF-receptor MRPSGTAGAALLALLAALCPRA 24 +1 Growth hormone MATGSRTSLLLAFGLLCLPWLQ EGSA 26 +1

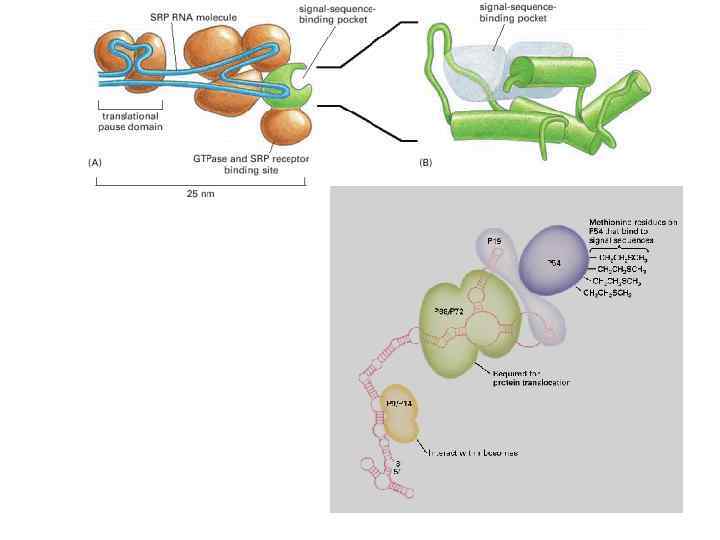


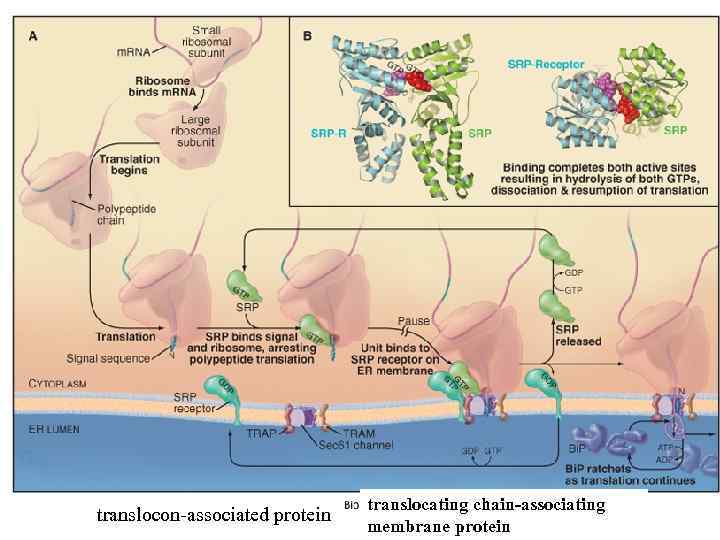
translocon-associated protein translocating chain-associating membrane protein


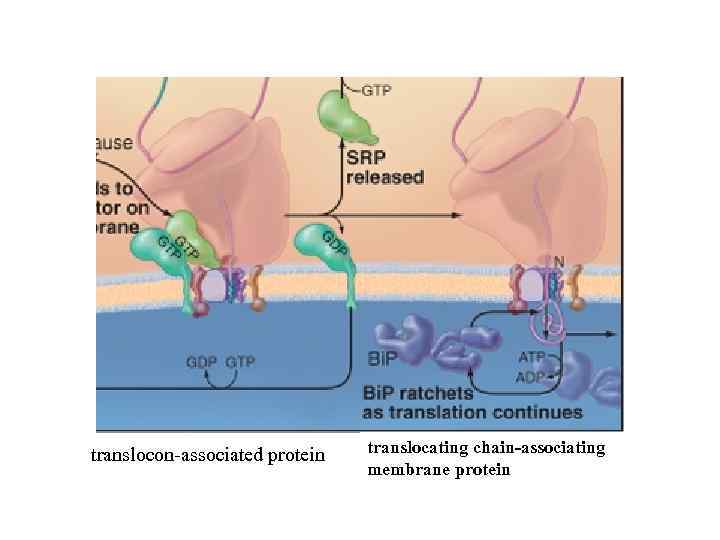
translocon-associated protein translocating chain-associating membrane protein



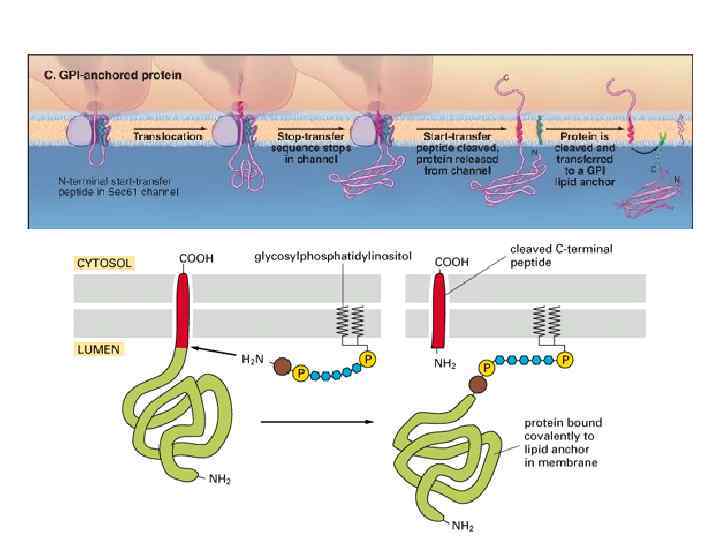
15 to 20
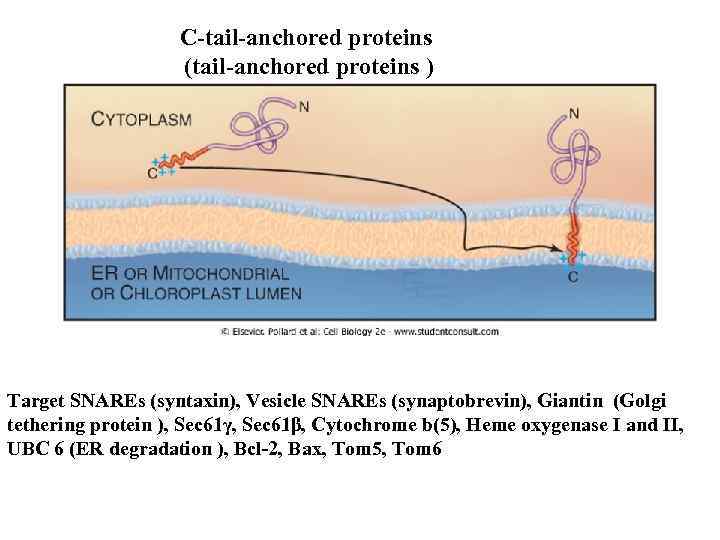
C-tail-anchored proteins (tail-anchored proteins ) Target SNAREs (syntaxin), Vesicle SNAREs (synaptobrevin), Giantin (Golgi tethering protein ), Sec 61γ, Sec 61β, Cytochrome b(5), Heme oxygenase I and II, UBC 6 (ER degradation ), Bcl-2, Bax, Tom 5, Tom 6
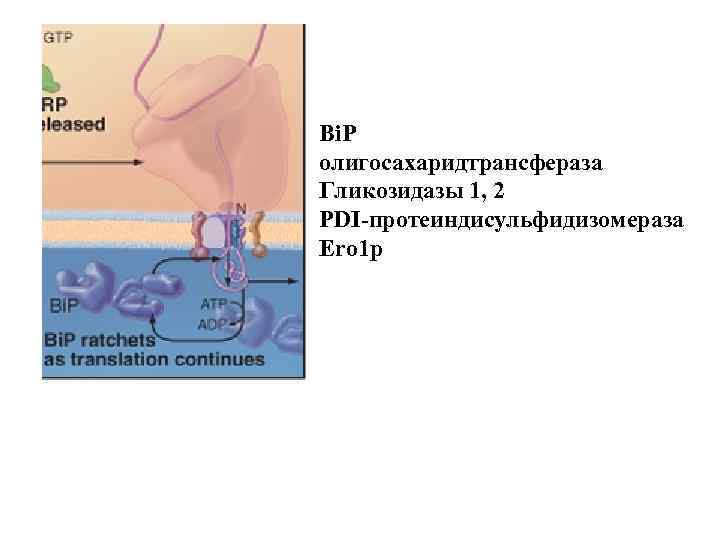
Bi. P олигосахаридтрансфераза Гликозидазы 1, 2 PDI-протеиндисульфидизомераза Ero 1 p
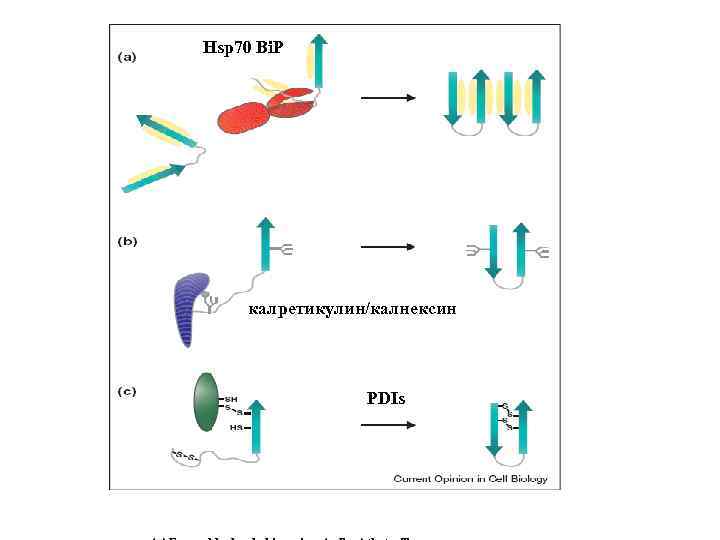
Hsp 70 Bi. P калретикулин/калнексин PDIs

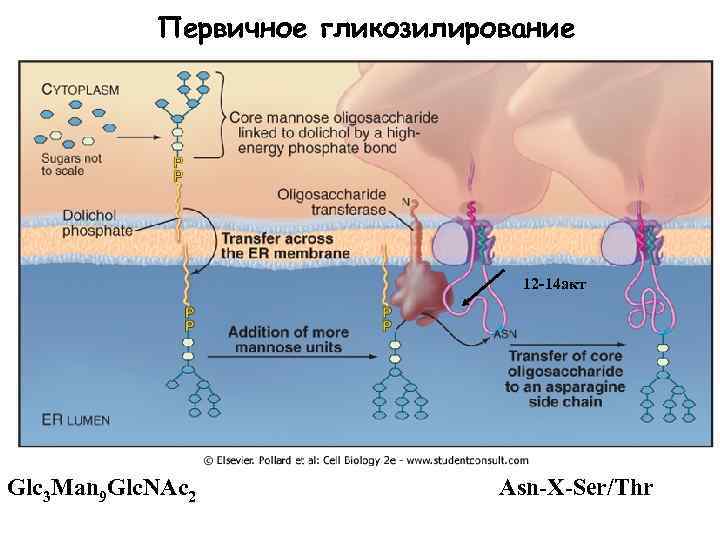
Первичное гликозилирование 12 -14 акт Glc 3 Man 9 Glc. NAc 2 Asn-X-Ser/Thr


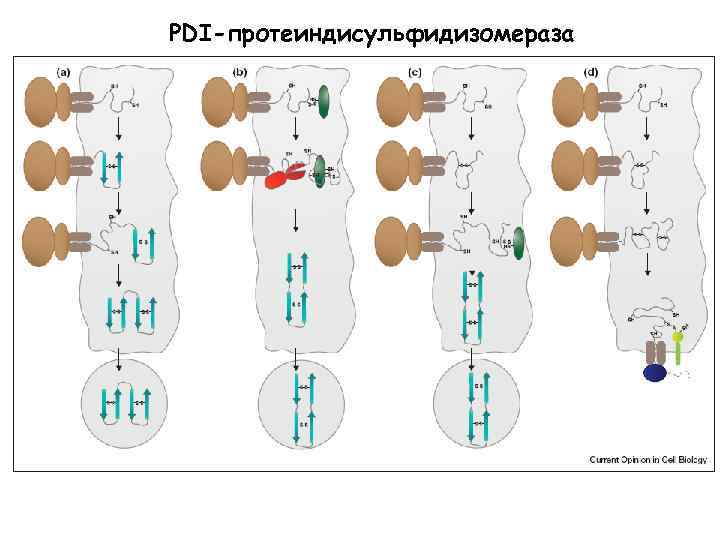
PDI-протеиндисульфидизомераза
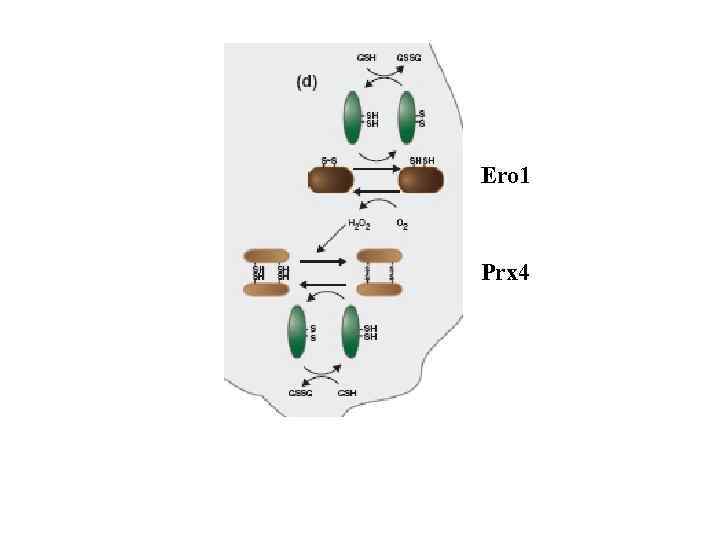
Ero 1 Prx 4
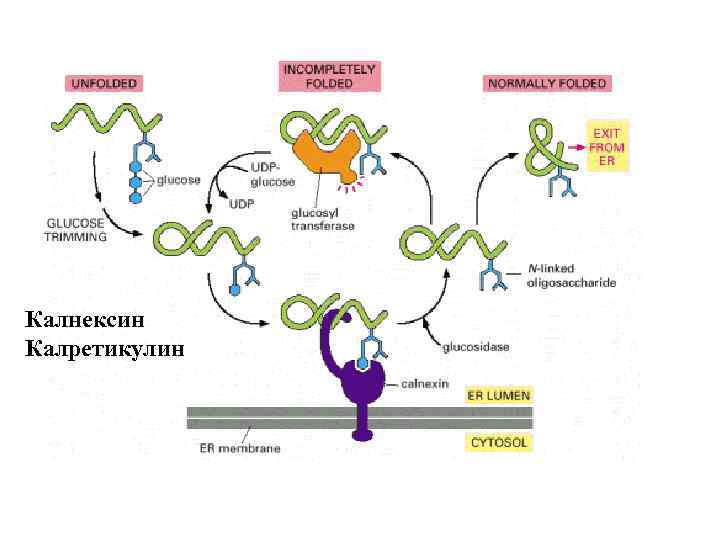
Калнексин Калретикулин
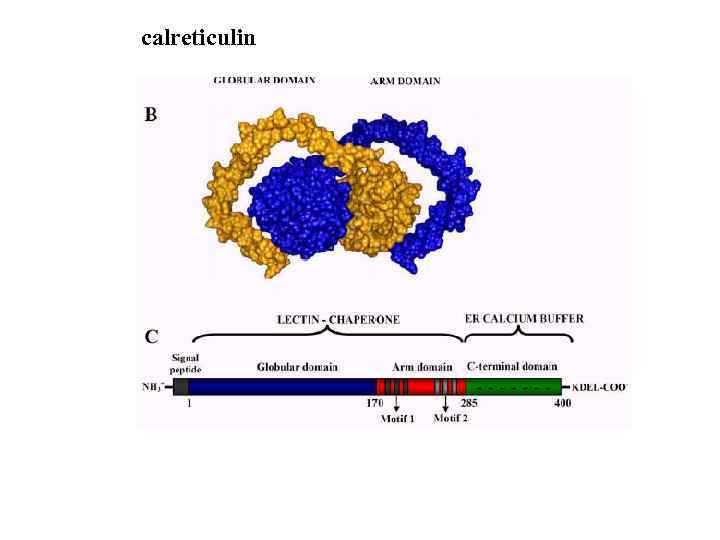
calreticulin
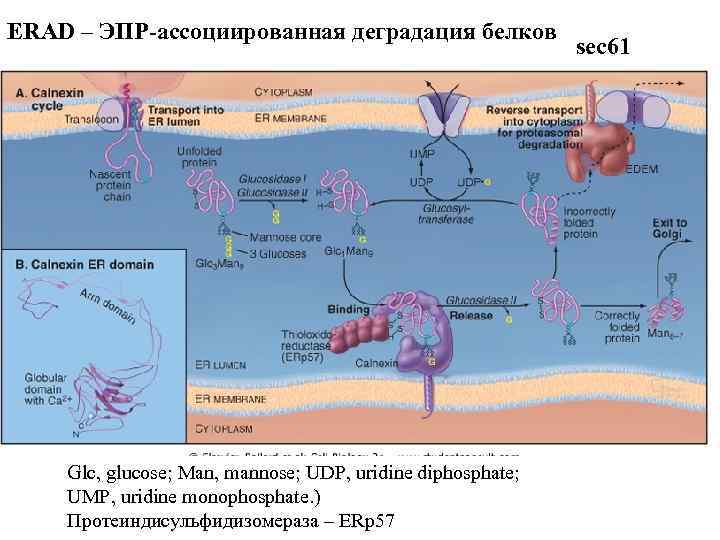
ERAD – ЭПР-ассоциированная деградация белков Glc, glucose; Man, mannose; UDP, uridine diphosphate; UMP, uridine monophosphate. ) Протеиндисульфидизомераза – ERp 57 sec 61

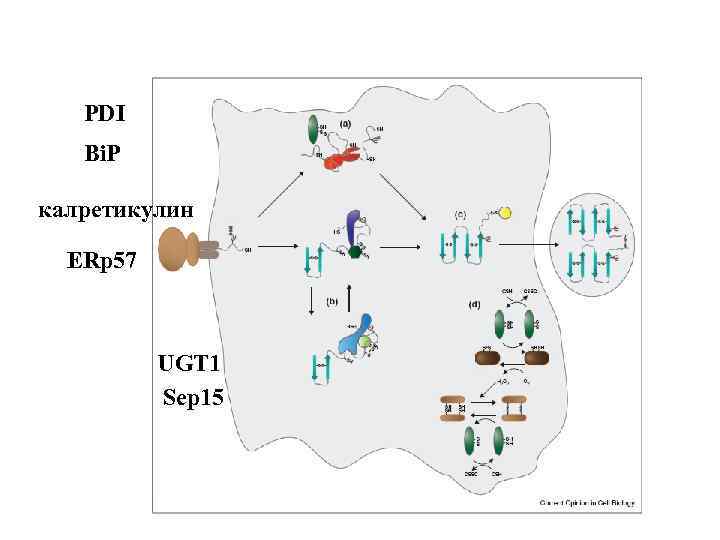
PDI Bi. P калретикулин ERp 57 UGT 1 Sep 15
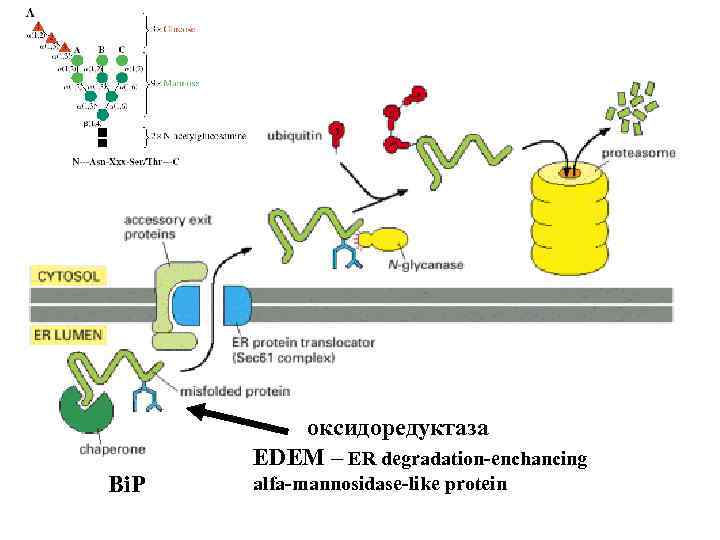
оксидоредуктаза EDEM – ER degradation-enchancing Bi. P alfa-mannosidase-like protein
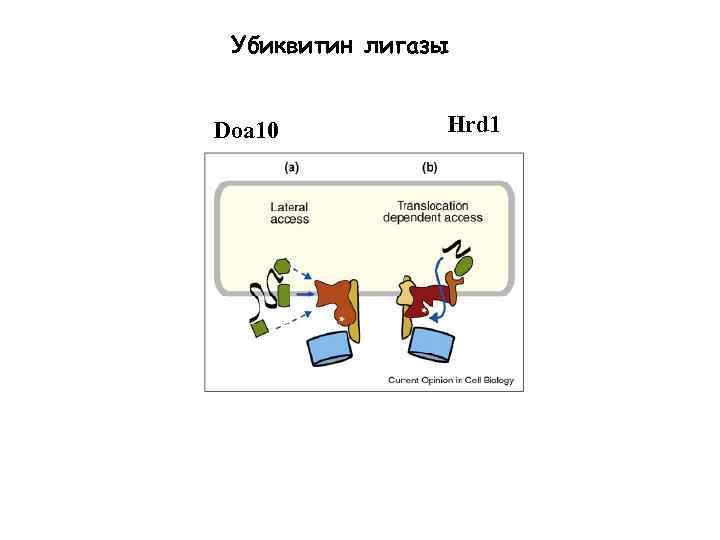
Убиквитин лигазы Doa 10 Hrd 1

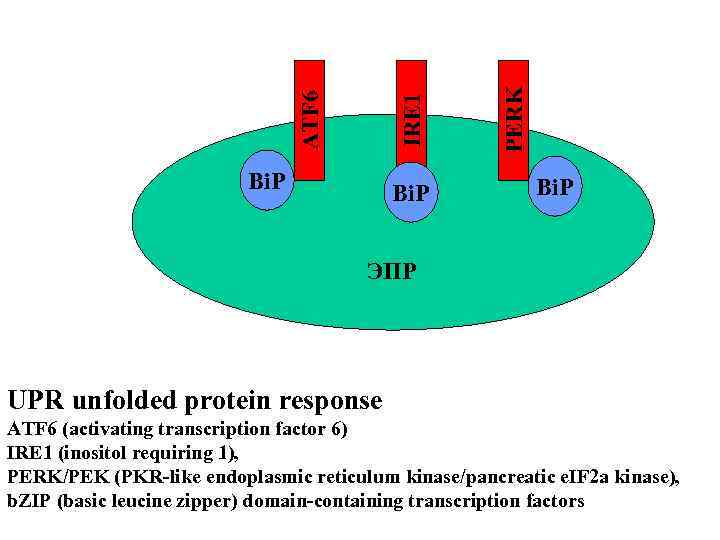
Bi. P PERK IRE 1 ATF 6 Bi. P ЭПР UPR unfolded protein response ATF 6 (activating transcription factor 6) IRE 1 (inositol requiring 1), PERK/PEK (PKR-like endoplasmic reticulum kinase/pancreatic e. IF 2 a kinase), b. ZIP (basic leucine zipper) domain-containing transcription factors
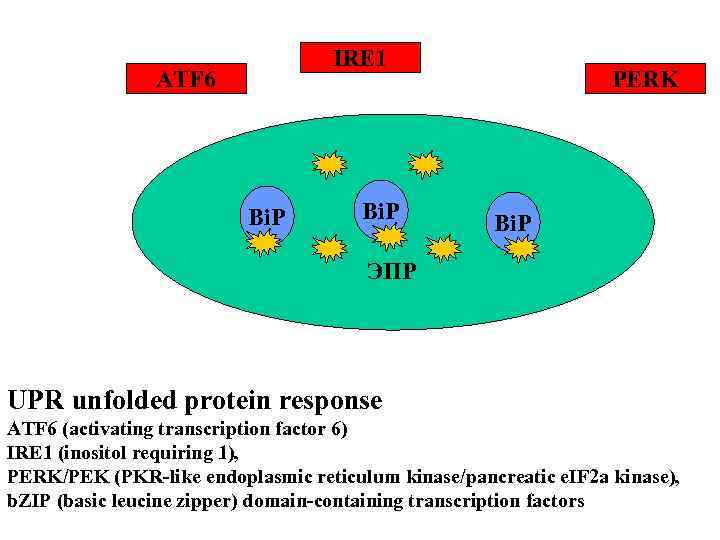
IRE 1 ATF 6 Bi. P PERK Bi. P ЭПР UPR unfolded protein response ATF 6 (activating transcription factor 6) IRE 1 (inositol requiring 1), PERK/PEK (PKR-like endoplasmic reticulum kinase/pancreatic e. IF 2 a kinase), b. ZIP (basic leucine zipper) domain-containing transcription factors
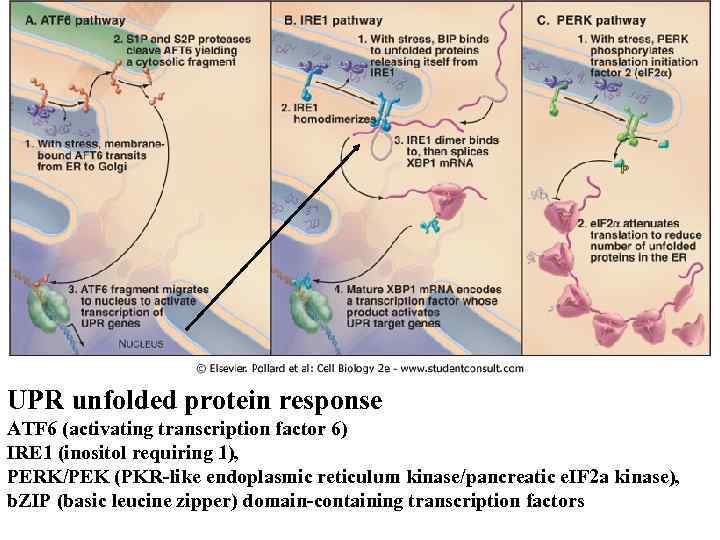
UPR unfolded protein response ATF 6 (activating transcription factor 6) IRE 1 (inositol requiring 1), PERK/PEK (PKR-like endoplasmic reticulum kinase/pancreatic e. IF 2 a kinase), b. ZIP (basic leucine zipper) domain-containing transcription factors


СИНТЕЗ ЛИПИДОВ В ЭПР

phosphatidylserine phosphatidylethanolamine sphingomyelin phosphatidylcholine N S=S C SH

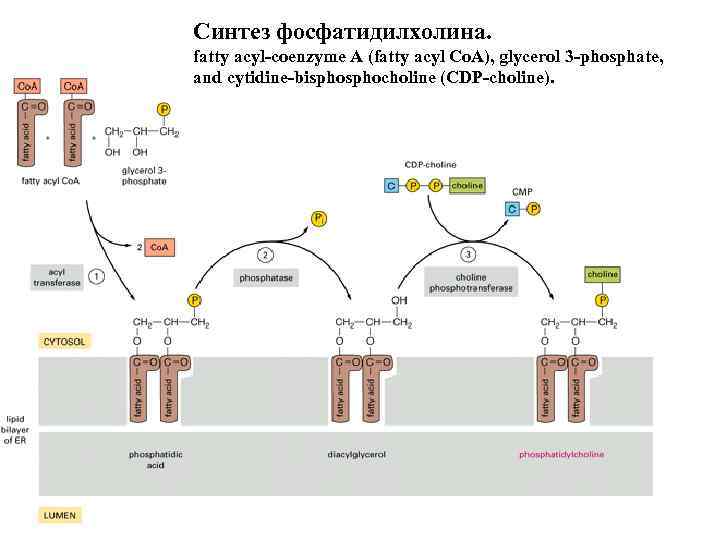
Синтез фосфатидилхолина. fatty acyl-coenzyme A (fatty acyl Co. A), glycerol 3 -phosphate, and cytidine-bisphocholine (CDP-choline).
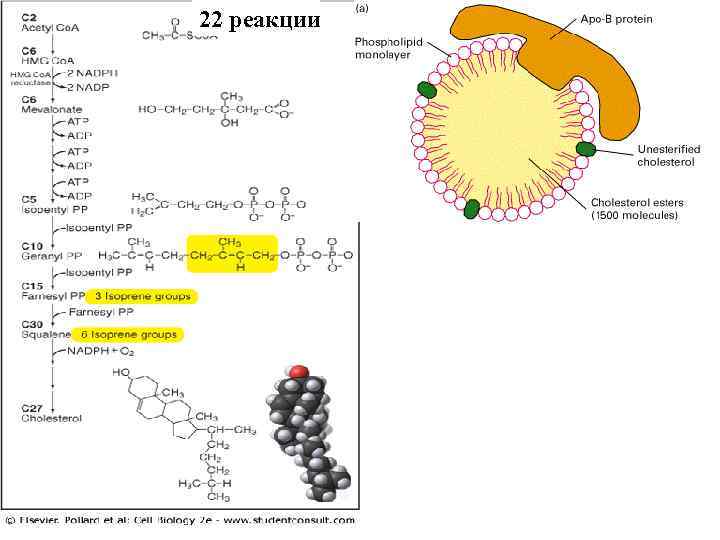
22 реакции

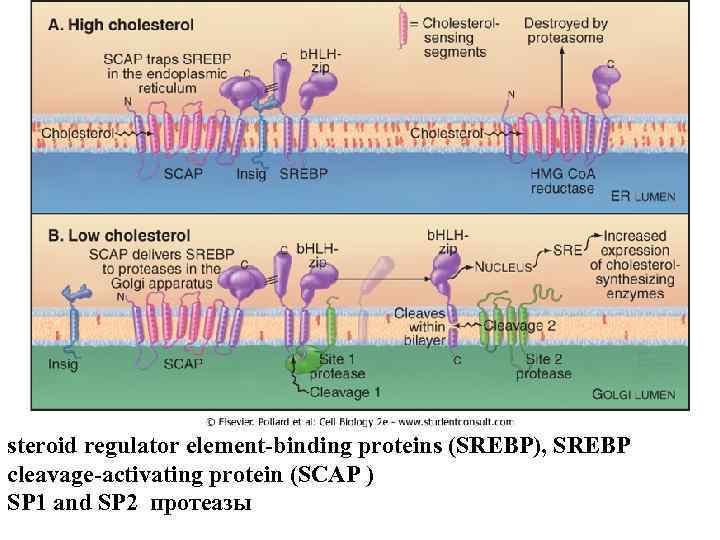
steroid regulator element-binding proteins (SREBP), SREBP cleavage-activating protein (SCAP ) SP 1 and SP 2 протеазы
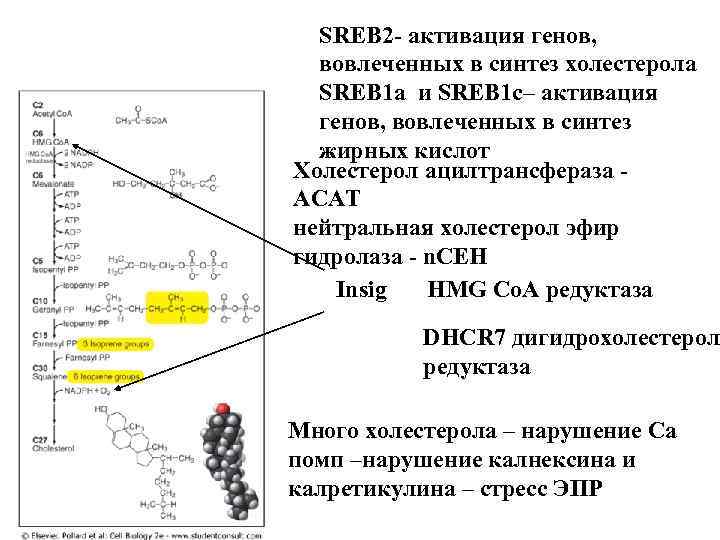
SREB 2 - активация генов, вовлеченных в синтез холестерола SREB 1 а и SREB 1 с– активация генов, вовлеченных в синтез жирных кислот Холестерол ацилтрансфераза ACAT нейтральная холестерол эфир гидролаза - n. CEH Insig HMG Co. A редуктаза DHCR 7 дигидрохолестерол редуктаза Много холестерола – нарушение Са помп –нарушение калнексина и калретикулина – стресс ЭПР
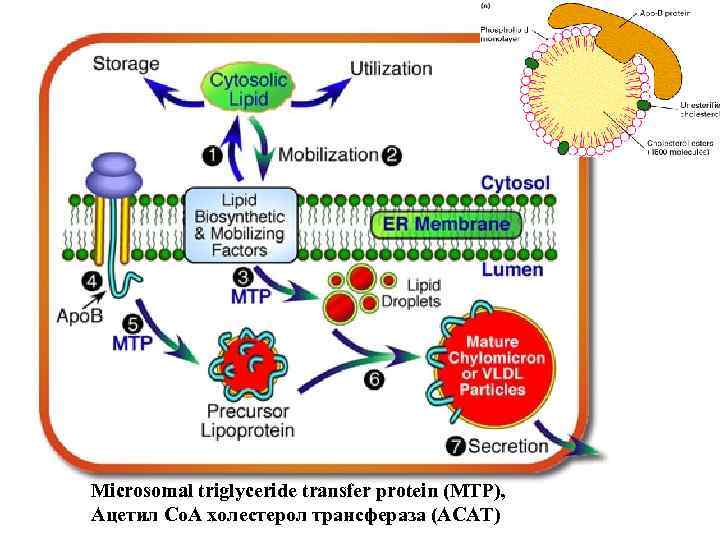
Microsomal triglyceride transfer protein (MTP), Ацетил Со. А холестерол трансфераза (АСАТ)
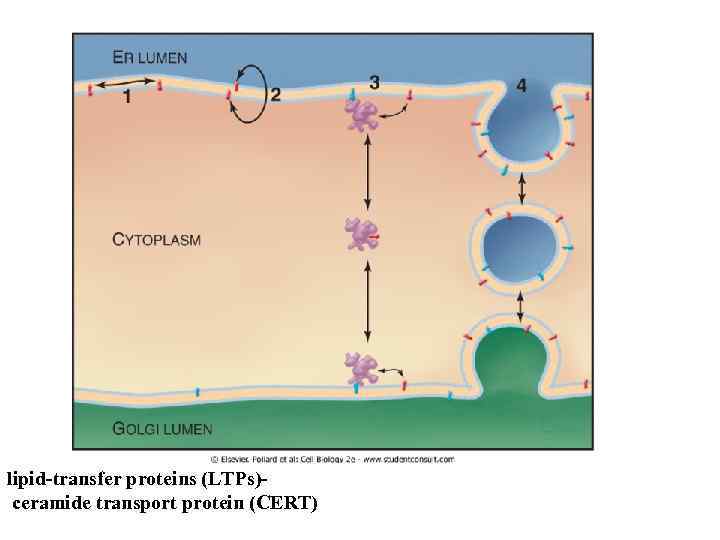
lipid-transfer proteins (LTPs) ceramide transport protein (CERT)

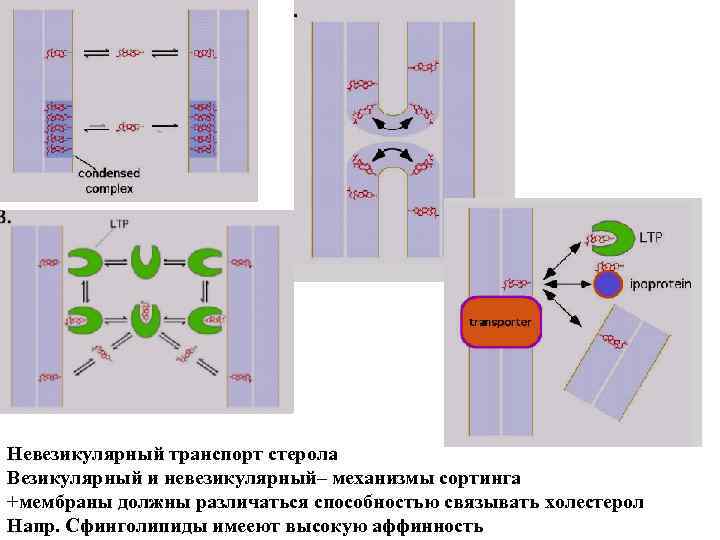
Невезикулярный транспорт стерола Везикулярный и невезикулярный– механизмы сортинга +мембраны должны различаться способностью связывать холестерол Напр. Сфинголипиды имееют высокую аффинность
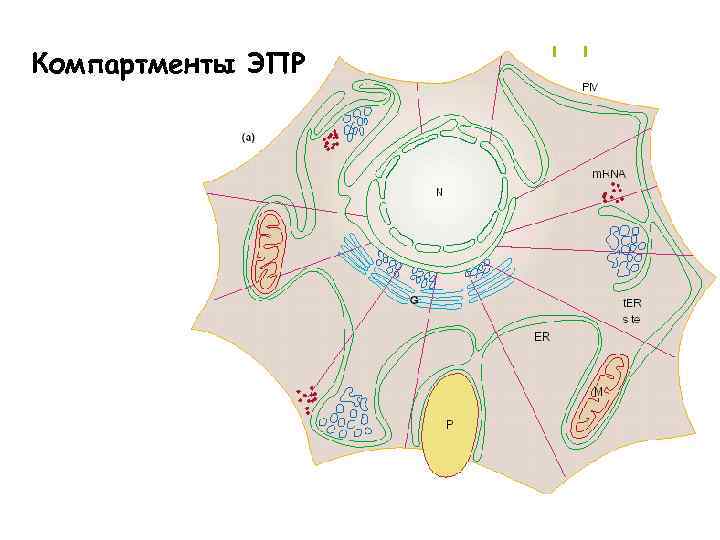
Компартменты ЭПР

Гладкий ЭПР Семейство Функции Состав CYP 1 метаболизм лекарств и стероидов (особенно эстрогена) 3 подсемейства, 3 гена, 1 псевдоген CYP 2 метаболизм лекарств и стероидов 13 подсемейств, 16 генов, 16 псевдогенов CYP 3 метаболизм лекарств и стероидов (включая тестостерон) 1 подсемейство, 4 гена, 2 псевдогена CYP 4 метаболизм арахидоновой кислоты 6 подсемейств, 12 генов, 10 псевдогенов CYP 5 синтез тромбоксана A 2 1 подсемейство, 1 ген CYP 7 биосинтез желчных кислот, участие в метаболизме стероидов 2 подсемейства, 2 гена CYP 8 различные 2 подсемейства, 2 гена CYP 11 CYP 17 биосинтез стероидов, 17 -альфа гидроксилаза 2 подсемейства, 3 гена 1 подсемейство, 1 ген CYP 19 биосинтез стероидов (ароматаза, синтезирующая эстроген) 1 подсемейство, 1 ген CYP 20 CYP 21 CYP 24 CYP 26 не установлены биосинтез стероидов биодеградация витамина D гидроксилирование ретиноловой кислоты 1 подсемейство, 1 ген 2 подсемейства, 1 ген, 1 псевдоген 1 подсемейство, 1 ген 3 подсемейства, 3 гена CYP 27 различные 3 подсемейства, 3 гена CYP 39 CYP 46 7 -альфа-гидроксилирование 24 -гидроксихолестерола холестерол 24 -гидроксилаза 1 подсемейство, 1 ген CYP 51 биосинтез холестерола 1 подсемейство, 1 ген, 3 псевдогена
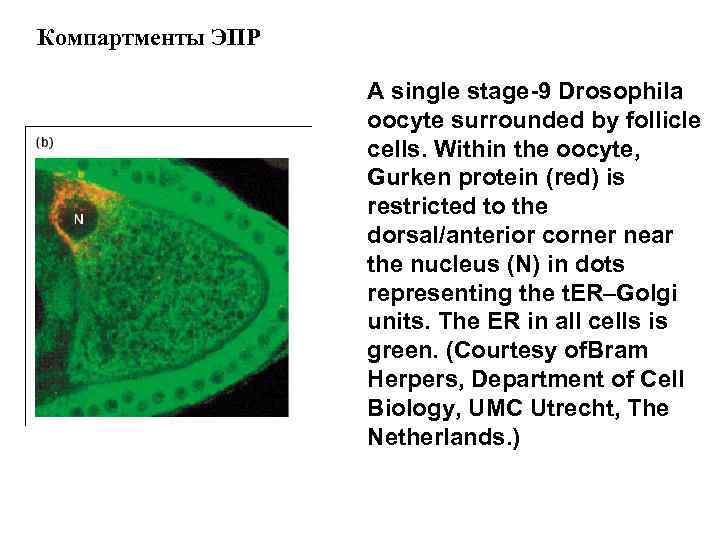
Компартменты ЭПР A single stage-9 Drosophila oocyte surrounded by follicle cells. Within the oocyte, Gurken protein (red) is restricted to the dorsal/anterior corner near the nucleus (N) in dots representing the t. ER–Golgi units. The ER in all cells is green. (Courtesy of. Bram Herpers, Department of Cell Biology, UMC Utrecht, The Netherlands. )
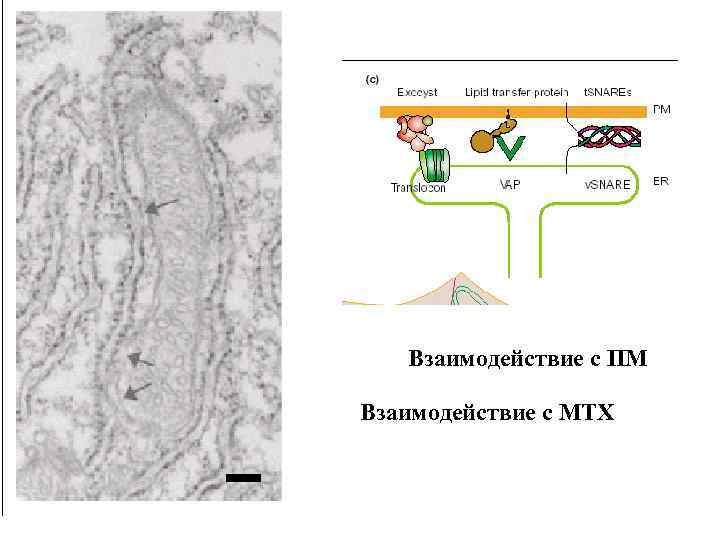
Взаимодействие с ПМ Взаимодействие с МТХ




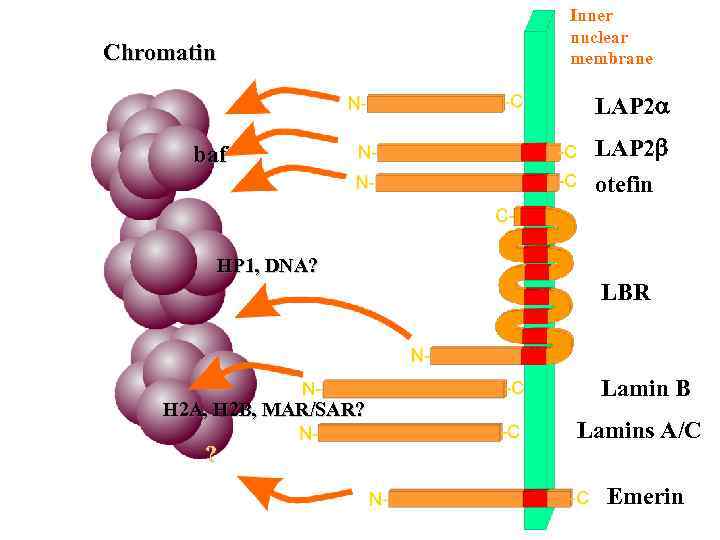
Chromatin Inner nuclear membrane LAP 2 a baf LAP 2 b otefin HP 1, DNA? LBR H 2 A, H 2 B, MAR/SAR? ? Lamin B Lamins A/C Emerin

Thus, the key events of ERAD are: (i) substrate recognition, (ii) substrate delivery to the cytosolic site of ubiquitin ligase action, (iii) substrate extraction from the ER, and (iv) delivery to the proteasome for degradation. Indeed, chaperones such as PDI, GRP 94, and Bi. P can associate with ERAD components such as Derlins, OS-9, XTP 3 -B, and signal peptide peptidase [



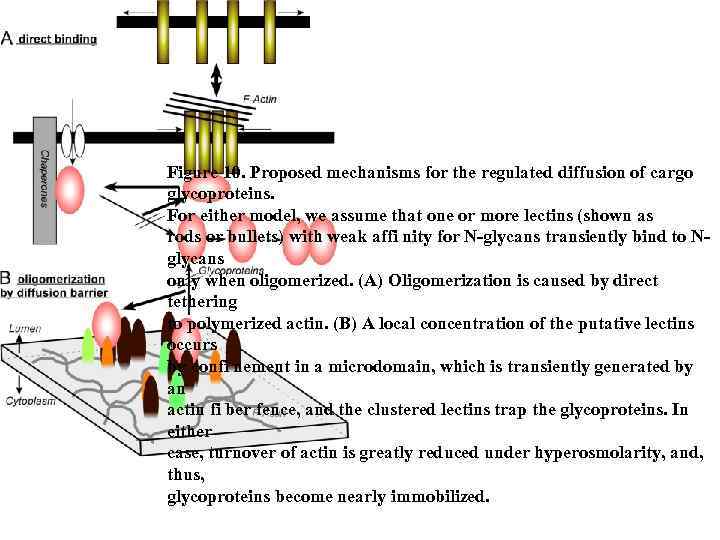
Figure 10. Proposed mechanisms for the regulated diffusion of cargo glycoproteins. For either model, we assume that one or more lectins (shown as rods or bullets) with weak affi nity for N-glycans transiently bind to Nglycans only when oligomerized. (A) Oligomerization is caused by direct tethering to polymerized actin. (B) A local concentration of the putative lectins occurs by confi nement in a microdomain, which is transiently generated by an actin fi ber fence, and the clustered lectins trap the glycoproteins. In either case, turnover of actin is greatly reduced under hyperosmolarity, and, thus, glycoproteins become nearly immobilized.

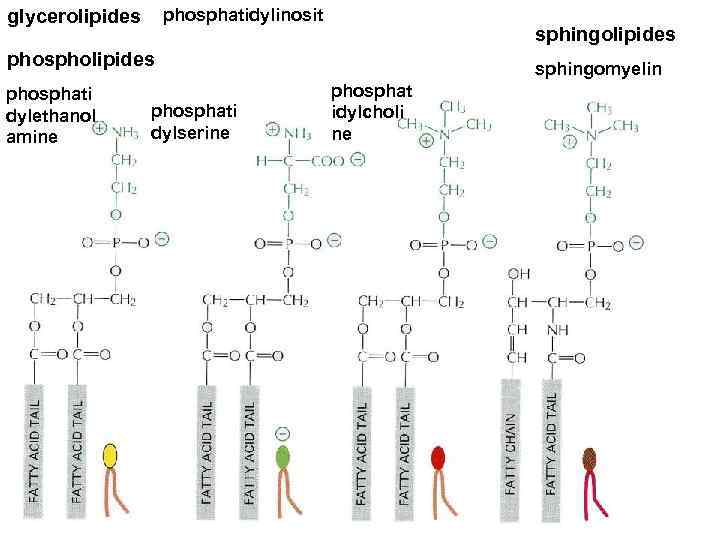
phosphatidylinosit glycerolipides sphingolipides phosphati dylethanol amine phosphati dylserine sphingomyelin phosphat idylcholi ne

Current Research: Lipid Biosynthesis; Cellular Lipid Trafficking and Mobilization; Lipoprotein Assembly and Secretion; Targeted Drug Delivery Apolipoprotein B (apo. B) is responsible for the packaging of dietary and endogenous lipids into lipoprotein particles. These particles are distributed to peripheral tissues, such as muscle and adipose, where the lipids are either utilized for energy or stored. However, intravascular metabolism of apo. B-containing lipoproteins, particular those originating from liver, give rise to low density lipoproteins (LDL), which in elevated concentrations in the blood cause atherosclerosis and heart disease. Furthermore, imbalances among hepatic and intestinal lipid biosynthesis, storage, utilization and secretion are important in the pathobiology of obesity, type 2 diabetes, and nonalcoholic fatty liver disease. Our laboratory is studying the process by which apo. B, in combination with the microsomal triglyceride transfer protein (MTP) and other cofactors, controls lipid transport by the liver and intestine. Our most recent studies have focused on the unexpected evolutionary origins of lipid transport proteins. It is now clear that MTP is the ancestral member of this gene family and exists in divergent vertebrate and invertebrate species, whose last common ancestor diverged over 550 million years ago. During its long evolutionary history, MTP has acquired distinct functions enabling it to participate in a disparate array of lipid mobilization and transport pathways, ranging from primitive lipoprotein assembly in nematodes and arthropods, to bulk lipid transport and antigenic lipid presentation in humans. Our phylogenic dissection of MTP and apo. B function coupled with ongoing structural, biochemical, and biophysical analyses, are providing new insights into mechanisms of lipid mobilization and secretion and strategies to beneficially control disturbances in lipid metabolism associated with chronic disease. As an outgrowth of our studies on the structure and function of apo. B, we are also exploring the use of apo. B’s lipid binding domains to achieve the packaging of lipophilic drugs. By fusing apo. B to single chain antibodies unique to transformed cells, we hope to achieve the selective delivery of drug-containing complexes to cancer cells without affecting healthy cells and tissues. Figure Legend: Lipid Mobilization and Secretion by Lipoprotein Producing Cells. Neutral lipids such as triglycerides and cholesterol esters are synthesized by enzymes associated with the endoplasmic reticulum (ER) membrane (1). These lipids are either stored in the cytosol or consumed for energy production (Utilization). Lipid secretion requires the mobilization of cytosolic lipid, a step that involves cytosolic and membrane-associated factors that are not well defined (2). Microsomal triglyceride transfer protein (MTP), which resides in the lumen of the ER, possesses a neutral lipid transfer activity that is required for the generation of lumenal lipid droplets. MTP also functions directly on apolipoprotein B (apo. B) to form precursor lipoprotein particles (5). These precursor particles fuse with lipid droplets to form mature intestinal chylomicrons of
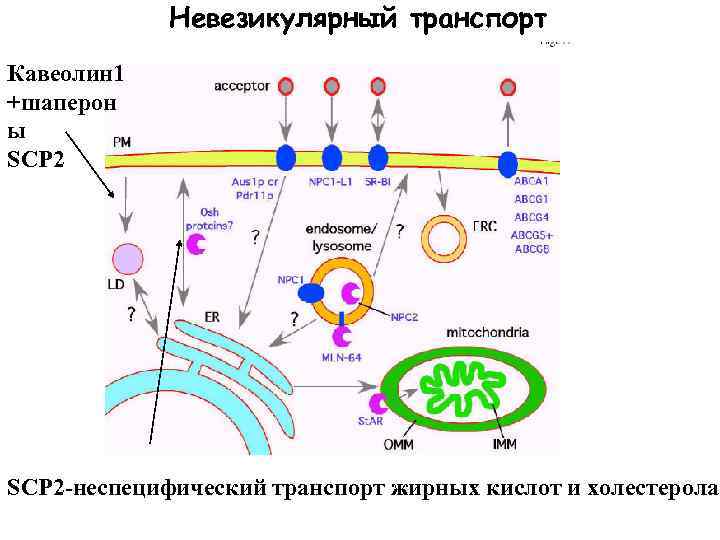
Невезикулярный транспорт Кавеолин 1 +шаперон ы SCP 2 -неспецифический транспорт жирных кислот и холестерола
ER-L1.ppt