оцтова кислота Волинець.pptx
- Количество слайдов: 16
 ва цто О ота сл ки
ва цто О ота сл ки
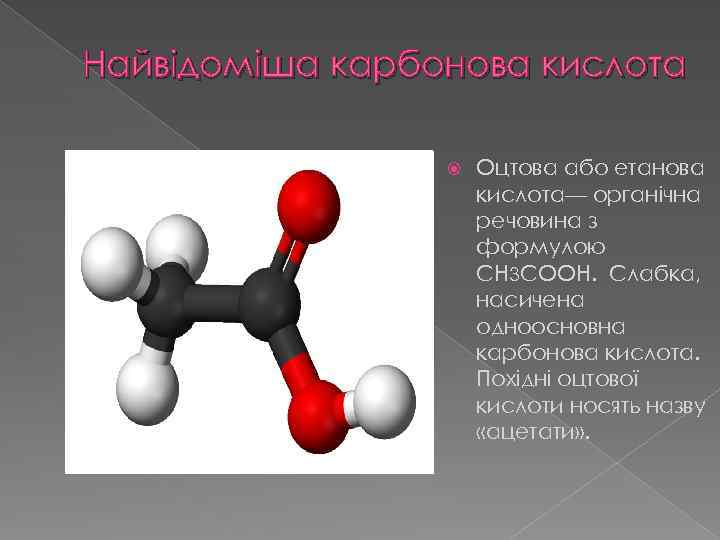 Найвідоміша карбонова кислота Оцтова або етанова кислота— органічна речовина з формулою CH 3 COOH. Слабка, насичена одноосновна карбонова кислота. Похідні оцтової кислоти носять назву «ацетати» .
Найвідоміша карбонова кислота Оцтова або етанова кислота— органічна речовина з формулою CH 3 COOH. Слабка, насичена одноосновна карбонова кислота. Похідні оцтової кислоти носять назву «ацетати» .
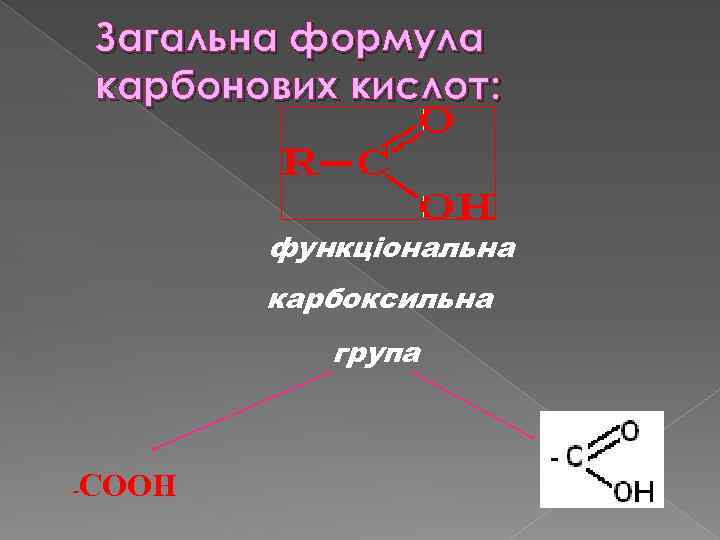 Загальна формула карбонових кислот: функціональна карбоксильна група - COOH
Загальна формула карбонових кислот: функціональна карбоксильна група - COOH
 Знайома людям з давніх часів Оцет виготовлявся людиною ще в давні часи. Про практичне його застосування вперше згадується у ІІІ ст. до н. е. Грецький вчений Теофраст вперше описав дію оцту на метали. Оцет застосовувався для добування свинцевих білил та ярь-медянки.
Знайома людям з давніх часів Оцет виготовлявся людиною ще в давні часи. Про практичне його застосування вперше згадується у ІІІ ст. до н. е. Грецький вчений Теофраст вперше описав дію оцту на метали. Оцет застосовувався для добування свинцевих білил та ярь-медянки.
 Номенклатура карбонових кислот: HCOOH – мурашина кислота (метанова) CH 3 COOH – оцтова кислота (етанова) CH 3 – (CH 2)2 – COOH – масляна кислота (бутанова) Вищі карбонові кислоти: C 15 H 33 COOH – пальмітинова кислота C 17 H 35 COOH – стеаринова кислота C 17 H 33 COOH – олеїнова кислота
Номенклатура карбонових кислот: HCOOH – мурашина кислота (метанова) CH 3 COOH – оцтова кислота (етанова) CH 3 – (CH 2)2 – COOH – масляна кислота (бутанова) Вищі карбонові кислоти: C 15 H 33 COOH – пальмітинова кислота C 17 H 35 COOH – стеаринова кислота C 17 H 33 COOH – олеїнова кислота
 Фізичні властивості оцтової кислоти: Оцтова кислота – безбарвна рідина, летка, має різкий специфічний запах, змішується з водою в будь-яких пропорціях, розчин кислий на смак; • за t < 170 С кристалізується (“крижана кислота “); • 3 -9% водний розчин – столовий оцет; • 86% водний розчин - оцтова есенція
Фізичні властивості оцтової кислоти: Оцтова кислота – безбарвна рідина, летка, має різкий специфічний запах, змішується з водою в будь-яких пропорціях, розчин кислий на смак; • за t < 170 С кристалізується (“крижана кислота “); • 3 -9% водний розчин – столовий оцет; • 86% водний розчин - оцтова есенція
 Хімічні властивості оцтової кислоти: 1) електролітична дисоціація: CH 3 COOH CH 3 COO 1 - + H 1+ ацетат - йон 2) Взаємодія з металами: 2 СН 3 СООН + Мg Mg(CH 3 COO)2 + H 2 магній ацетат 3) Взаємодія з оксидами металів: 2 СН 3 СООН + Са. О Са(СН 3 СОО)2 + Н 2 О кальцій ацетат 4) Взаємодія з лугами: СН 3 СООН + Na. OH Na. CH 3 COO + H 2 O натрій ацетат 5) Взаємодія з солями, утвореними слабшими кислотами: 2 СН 3 СООН + Na 2 CO 3 2 Na. CH 3 COO + CO 2+ H 2 O
Хімічні властивості оцтової кислоти: 1) електролітична дисоціація: CH 3 COOH CH 3 COO 1 - + H 1+ ацетат - йон 2) Взаємодія з металами: 2 СН 3 СООН + Мg Mg(CH 3 COO)2 + H 2 магній ацетат 3) Взаємодія з оксидами металів: 2 СН 3 СООН + Са. О Са(СН 3 СОО)2 + Н 2 О кальцій ацетат 4) Взаємодія з лугами: СН 3 СООН + Na. OH Na. CH 3 COO + H 2 O натрій ацетат 5) Взаємодія з солями, утвореними слабшими кислотами: 2 СН 3 СООН + Na 2 CO 3 2 Na. CH 3 COO + CO 2+ H 2 O
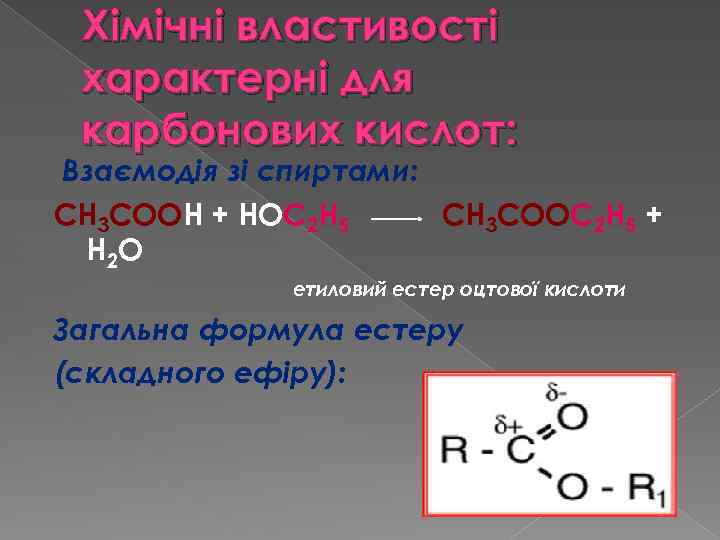 Хімічні властивості характерні для карбонових кислот: Взаємодія зі спиртами: СН 3 СООН + НОС 2 Н 5 СН 3 СООС 2 Н 5 + Н 2 О етиловий естер оцтової кислоти Загальна формула естеру (складного ефіру):
Хімічні властивості характерні для карбонових кислот: Взаємодія зі спиртами: СН 3 СООН + НОС 2 Н 5 СН 3 СООС 2 Н 5 + Н 2 О етиловий естер оцтової кислоти Загальна формула естеру (складного ефіру):
 Оцтова кислота Дисоціація З металам и З основними та амфотерними оксидами З основами З солями З спиртами
Оцтова кислота Дисоціація З металам и З основними та амфотерними оксидами З основами З солями З спиртами
 Отруйна сапа ? В Стародавньому Римі вино тримали у свинцевому посуді. При цьому отримували дуже солодкий напій – сапу. Сапа містила велику кількість ацетату плюмбуму — дуже солодкої речовини, яку називають «свинцевим цукром» або «цукром Сатурна» . Популярність сапи була причиною хронічного отруєння свинцем серед римської аристократії.
Отруйна сапа ? В Стародавньому Римі вино тримали у свинцевому посуді. При цьому отримували дуже солодкий напій – сапу. Сапа містила велику кількість ацетату плюмбуму — дуже солодкої речовини, яку називають «свинцевим цукром» або «цукром Сатурна» . Популярність сапи була причиною хронічного отруєння свинцем серед римської аристократії.
 Вклад арабських алхіміків В VIII ст. арабський алхімік Джабир ібн Хайян вперше отримав концентровану оцтову кислоту шляхом перегонки. За часів Епохи Відродження льодяну оцтову кислоту добували возгонкою ацетатів деяких металів (наприклад, ацетат купруму (II)).
Вклад арабських алхіміків В VIII ст. арабський алхімік Джабир ібн Хайян вперше отримав концентровану оцтову кислоту шляхом перегонки. За часів Епохи Відродження льодяну оцтову кислоту добували возгонкою ацетатів деяких металів (наприклад, ацетат купруму (II)).
 Довели ідентичність Довгий час хіміки помилково вважали, що кислота з вина і кислота з ацетатів насправді являються двома різними речовинами. Ідентичність речовин, отриманих різними способами, була доведена німецьким алхіміком XVI века Андреа Лібавіусом (нім. Andreas Libavius) и французьким хіміком Пьєром Августом Аде (фр. Pierre Auguste Adet)
Довели ідентичність Довгий час хіміки помилково вважали, що кислота з вина і кислота з ацетатів насправді являються двома різними речовинами. Ідентичність речовин, отриманих різними способами, була доведена німецьким алхіміком XVI века Андреа Лібавіусом (нім. Andreas Libavius) и французьким хіміком Пьєром Августом Аде (фр. Pierre Auguste Adet)
 Оцет в харчовій промисловості 70 -80 % водний розчин оцтової кислоти називають оцтовою есенцією, а 3 -6 % —оцтом. Водні розчини оцтової кислоти широко застосовуються в харчовій промисловості (харчова добавка E 260) та побутовій кулінарії, а також у консервуванні.
Оцет в харчовій промисловості 70 -80 % водний розчин оцтової кислоти називають оцтовою есенцією, а 3 -6 % —оцтом. Водні розчини оцтової кислоти широко застосовуються в харчовій промисловості (харчова добавка E 260) та побутовій кулінарії, а також у консервуванні.
 Застосування оцтової кислоти Оцтову кислоту застосовують для добування лікарських та ароматичних речовин, як розчинник (наприклад, у виробництві ацетилцелюлози), ацетону. Вона використовується при друкуванні книг та фарбуванні.
Застосування оцтової кислоти Оцтову кислоту застосовують для добування лікарських та ароматичних речовин, як розчинник (наприклад, у виробництві ацетилцелюлози), ацетону. Вона використовується при друкуванні книг та фарбуванні.
 Увага! Небезпека! Дія оцтової кислоти на біологічні тканини залежить від розведення її водою. Небезпечними вважаються розчини, в яких концентрація кислоти більше 30 %. Концентрована оцтова кислота здатна викликати хімічні опіки, які викликають некроз прилеглих тканин.
Увага! Небезпека! Дія оцтової кислоти на біологічні тканини залежить від розведення її водою. Небезпечними вважаються розчини, в яких концентрація кислоти більше 30 %. Концентрована оцтова кислота здатна викликати хімічні опіки, які викликають некроз прилеглих тканин.
 Токсикологічні властивості оцтової кислоти не залежать від способу, яким вона була отримана. Смертельна доза складає приблизно 20 мл.
Токсикологічні властивості оцтової кислоти не залежать від способу, яким вона була отримана. Смертельна доза складає приблизно 20 мл.


