лекция3.pptx
- Количество слайдов: 36

 В условиях фармацевтического рынка государственный контроль качества ЛС является основной функцией государственного регулирования в плане реализации единой государственной политики. Обеспечение населения эффективными высококачественными ЛС является актуальной проблемой, решение которой зависит от уровня стандартизации ЛС и контроля их качества. Понятие "качество" для лекарственного средства является комплексным понятием, включающим в себя такие две обязательные составляющие, как "безопасность" и "эффективность". Определение этих терминов содержится в статье 4 Федерального закона "О лекарственных средствах": - безопасность лекарственных средств - характеристика лекарственных средств, основанная на сравнительном анализе их эффективности и оценки риска причинения вреда здоровью; - эффективность лекарственных средств - характеристика степени положительного влияния лекарственных средств на течение болезни.
В условиях фармацевтического рынка государственный контроль качества ЛС является основной функцией государственного регулирования в плане реализации единой государственной политики. Обеспечение населения эффективными высококачественными ЛС является актуальной проблемой, решение которой зависит от уровня стандартизации ЛС и контроля их качества. Понятие "качество" для лекарственного средства является комплексным понятием, включающим в себя такие две обязательные составляющие, как "безопасность" и "эффективность". Определение этих терминов содержится в статье 4 Федерального закона "О лекарственных средствах": - безопасность лекарственных средств - характеристика лекарственных средств, основанная на сравнительном анализе их эффективности и оценки риска причинения вреда здоровью; - эффективность лекарственных средств - характеристика степени положительного влияния лекарственных средств на течение болезни.
 В мировой практике ведущая роль в обеспечении качества лекарств принадлежит государству. Этот же принцип в формулировке "приоритет государственного контроля производства, изготовления, качества лекарственных средств" зафиксирован в отечественном законодательстве. Следует отметить, что в данном секторе очень большая часть вовлеченности государства приходится на "разрешительные" механизмы: - разрешение к применению (регистрация); - разрешение ведения деятельности (лицензирование производства, оптовой и розничной торговли); - решение об отнесении препарата к той или иной категории (например, отнесение средства к рецептурному либо безрецептурному напрямую сказывается на особенностях торговли им); - наличие государственного контроля, осуществляемого единым уполномоченным органом; - обязательный характер подтверждения соответствия требованиям; - наличие и соблюдение особых принципов и норм обеспечения качества лекарственных средств, их эффективности и относительной безопасности (а не только безопасности, как у других товаров), сформулированных в особых правилах и рекомендациях; - нормативное регулирование информации и рекламы ЛС, методов их продвижения.
В мировой практике ведущая роль в обеспечении качества лекарств принадлежит государству. Этот же принцип в формулировке "приоритет государственного контроля производства, изготовления, качества лекарственных средств" зафиксирован в отечественном законодательстве. Следует отметить, что в данном секторе очень большая часть вовлеченности государства приходится на "разрешительные" механизмы: - разрешение к применению (регистрация); - разрешение ведения деятельности (лицензирование производства, оптовой и розничной торговли); - решение об отнесении препарата к той или иной категории (например, отнесение средства к рецептурному либо безрецептурному напрямую сказывается на особенностях торговли им); - наличие государственного контроля, осуществляемого единым уполномоченным органом; - обязательный характер подтверждения соответствия требованиям; - наличие и соблюдение особых принципов и норм обеспечения качества лекарственных средств, их эффективности и относительной безопасности (а не только безопасности, как у других товаров), сформулированных в особых правилах и рекомендациях; - нормативное регулирование информации и рекламы ЛС, методов их продвижения.
 В последние годы наиболее актуальными проблемами здравоохранения во всём мире являются качество, эффективность и безопасность лекарственных средств (ЛС). Это связано с присутствием на фармацевтическом рынке огромного количества торговых наименований лекарственных препаратов (ЛП), ростом числа воспроизведённых ЛС, проникновением в сферу гражданского оборота фальсифицированных лекарств. До настоящего времени большинство отечественных фармацевтических предприятий не имеет возможности выпускать продукцию в соответствии со стандартами Надлежащей производственной практики (GMP, «Good Manufacturing Practice» ) ввиду изношенности производственных мощностей и недостаточной финансовой поддержки со стороны государства. Всё это позволяет относить сферу обращения ЛС к зоне повышенного риска и требует закрепления на государственном уровне норм контроля качества, эффективности и безопасности в соответствии с международной практикой и законодательством [1].
В последние годы наиболее актуальными проблемами здравоохранения во всём мире являются качество, эффективность и безопасность лекарственных средств (ЛС). Это связано с присутствием на фармацевтическом рынке огромного количества торговых наименований лекарственных препаратов (ЛП), ростом числа воспроизведённых ЛС, проникновением в сферу гражданского оборота фальсифицированных лекарств. До настоящего времени большинство отечественных фармацевтических предприятий не имеет возможности выпускать продукцию в соответствии со стандартами Надлежащей производственной практики (GMP, «Good Manufacturing Practice» ) ввиду изношенности производственных мощностей и недостаточной финансовой поддержки со стороны государства. Всё это позволяет относить сферу обращения ЛС к зоне повышенного риска и требует закрепления на государственном уровне норм контроля качества, эффективности и безопасности в соответствии с международной практикой и законодательством [1].
 В большинстве развитых стран Европы, в США и Японии основными направлениями деятельности регуляторных органов в сфере обращения ЛС являются: • стандартизация в области контроля качества (Институт фармакопеи); • система надлежащих практик разработки ЛС, их исследований, производства, дистрибуции и продаж (Надлежащая лабораторная практика (GLP), Надлежащая клиническая практика (GCP), Надлежащая производственная практика (GMP), Надлежащая практика хранения (GSP), Надлежащая практика дистрибуции (GDP) и Надлежащая аптечная практика (GPP)); • фармацевтическая инспекция и контроль обращения продукции на рынке; • • фармаконадзор, представляющий собой сбор информации об эффективности и безопасности ЛС [2].
В большинстве развитых стран Европы, в США и Японии основными направлениями деятельности регуляторных органов в сфере обращения ЛС являются: • стандартизация в области контроля качества (Институт фармакопеи); • система надлежащих практик разработки ЛС, их исследований, производства, дистрибуции и продаж (Надлежащая лабораторная практика (GLP), Надлежащая клиническая практика (GCP), Надлежащая производственная практика (GMP), Надлежащая практика хранения (GSP), Надлежащая практика дистрибуции (GDP) и Надлежащая аптечная практика (GPP)); • фармацевтическая инспекция и контроль обращения продукции на рынке; • • фармаконадзор, представляющий собой сбор информации об эффективности и безопасности ЛС [2].
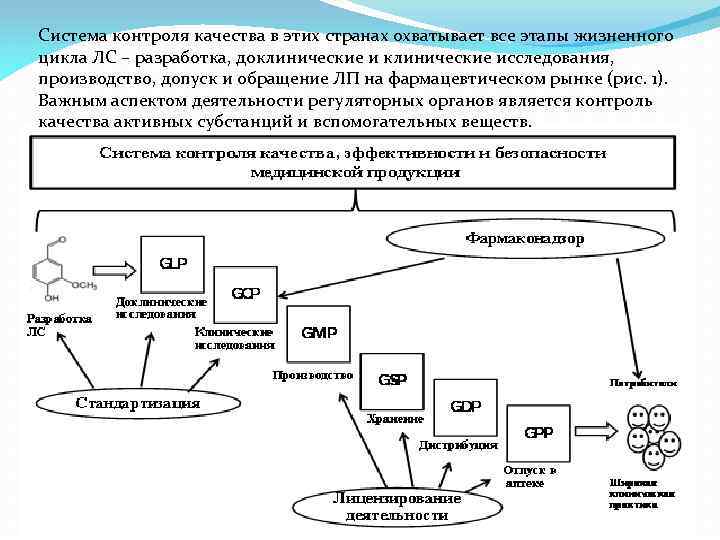 Система контроля качества в этих странах охватывает все этапы жизненного цикла ЛС – разработка, доклинические исследования, производство, допуск и обращение ЛП на фармацевтическом рынке (рис. 1). Важным аспектом деятельности регуляторных органов является контроль качества активных субстанций и вспомогательных веществ.
Система контроля качества в этих странах охватывает все этапы жизненного цикла ЛС – разработка, доклинические исследования, производство, допуск и обращение ЛП на фармацевтическом рынке (рис. 1). Важным аспектом деятельности регуляторных органов является контроль качества активных субстанций и вспомогательных веществ.
 Онлайн-формы отчётности (добровольной отчётности) размещены на сайте FDA, с её помощью можно сообщить о серьёзных НПР, в том числе о потенциальных и фактических ошибках при использовании лекарств, о проблемах качества продукции и терапевтической неэффективности [7]: • Форма добровольной отчётности (Form FDA 3500) – бланк формыизвещения о серьёзной нежелательной реакции, который может быть заполнен работником здравоохранения, потребителем, пациентом и отправлен почтой или факсом; • Форма добровольной отчётности для потребителей (Form FDA 3500 B) – специальная форма-извещение для потребителей с инструкцией по заполнению; • Форма обязательной отчётности (Form FDA 3500 A) – обязательная формаизвещение о НПР для производителей, дистрибьюторов, импортеров ЛС.
Онлайн-формы отчётности (добровольной отчётности) размещены на сайте FDA, с её помощью можно сообщить о серьёзных НПР, в том числе о потенциальных и фактических ошибках при использовании лекарств, о проблемах качества продукции и терапевтической неэффективности [7]: • Форма добровольной отчётности (Form FDA 3500) – бланк формыизвещения о серьёзной нежелательной реакции, который может быть заполнен работником здравоохранения, потребителем, пациентом и отправлен почтой или факсом; • Форма добровольной отчётности для потребителей (Form FDA 3500 B) – специальная форма-извещение для потребителей с инструкцией по заполнению; • Форма обязательной отчётности (Form FDA 3500 A) – обязательная формаизвещение о НПР для производителей, дистрибьюторов, импортеров ЛС.
 Фармакопейная конвенция США (The U. S. Pharmacopeial Convention, USP) является научной некоммерческой организацией, которая устанавливает стандарты соответствия, качества, чистоты и стабильности лекарственных средств и лекарственных препаратов, пищевых ингредиентов и пищевых добавок [4]. С момента своего основания в 1820 году, USP осуществляет обеспечение качества лекарств на американском рынке. Опираясь на это наследие, USP в настоящее время сотрудничает с учёными, практиками и регуляторными органами более чем 140 стран, чтобы помочь защитить общественное здоровье во всём мире. В разработке стандартов USP принимают участие более 900 экспертовдобровольцев, в том числе, международных, которые сотрудничают с USP со строгим соблюдением конфликта интересов и правил. Фармакопея США и Национальный формуляр (USP-NF) – это ежегодно обновляемый сборник фармакопейных стандартов фармацевтических субстанций, готовых лекарственных форм, вспомогательных веществ, биологически активных добавок (БАД) и пищевых добавок, лекарственного растительного сырья, витаминов, медицинских устройств. ЛС, присутствующее на американском рынке, в обязательном порядке должны соответствовать стандартам USP-NF, чтобы избежать возможных обвинений в фальсификации.
Фармакопейная конвенция США (The U. S. Pharmacopeial Convention, USP) является научной некоммерческой организацией, которая устанавливает стандарты соответствия, качества, чистоты и стабильности лекарственных средств и лекарственных препаратов, пищевых ингредиентов и пищевых добавок [4]. С момента своего основания в 1820 году, USP осуществляет обеспечение качества лекарств на американском рынке. Опираясь на это наследие, USP в настоящее время сотрудничает с учёными, практиками и регуляторными органами более чем 140 стран, чтобы помочь защитить общественное здоровье во всём мире. В разработке стандартов USP принимают участие более 900 экспертовдобровольцев, в том числе, международных, которые сотрудничают с USP со строгим соблюдением конфликта интересов и правил. Фармакопея США и Национальный формуляр (USP-NF) – это ежегодно обновляемый сборник фармакопейных стандартов фармацевтических субстанций, готовых лекарственных форм, вспомогательных веществ, биологически активных добавок (БАД) и пищевых добавок, лекарственного растительного сырья, витаминов, медицинских устройств. ЛС, присутствующее на американском рынке, в обязательном порядке должны соответствовать стандартам USP-NF, чтобы избежать возможных обвинений в фальсификации.
 Стандартные образцы USP (USP стандарты) представляют собой коллекцию из более 3 000 сверхчистых образцов фармацевтических субстанций, вспомогательных ингредиентов, примесей, продуктов разложения, эксципиентов, пищевых добавок, калибратов, которые используются при проведении официальных USP-NF тестов и анализов в аналитических, клинических, фармацевтических и научно-исследовательских лабораториях.
Стандартные образцы USP (USP стандарты) представляют собой коллекцию из более 3 000 сверхчистых образцов фармацевтических субстанций, вспомогательных ингредиентов, примесей, продуктов разложения, эксципиентов, пищевых добавок, калибратов, которые используются при проведении официальных USP-NF тестов и анализов в аналитических, клинических, фармацевтических и научно-исследовательских лабораториях.
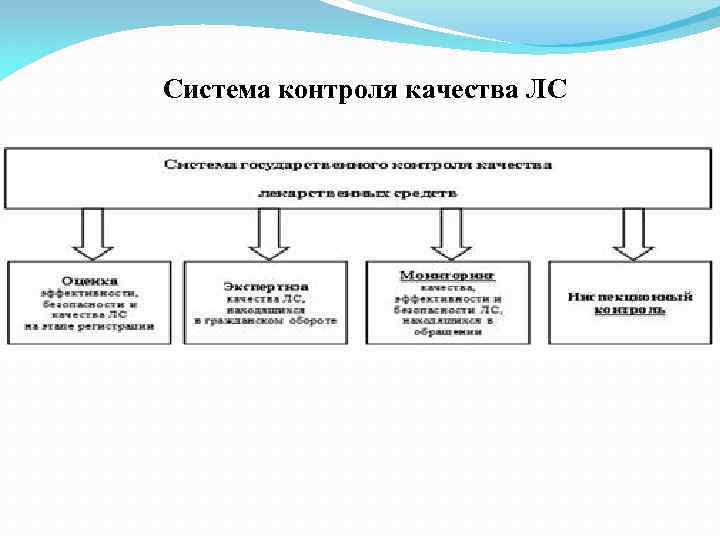 Система контроля качества ЛС
Система контроля качества ЛС
 По результатам исследований, проведенных в разных странах, от 3 до 15% всех обращений к врачу вызваны ухудшением состояния здоровья в связи с применением лекарств. Акцент в оценке эффективности и безопасности ЛС сместился в сторону продолжения изучения безопасности тех лекарств, которые уже вышли на рынок и были рекомендованы к широкому применению. Это связано с тем, что, во-первых, результаты экспериментальных исследований на животных не всегда можно использовать применительно к человеку, во-вторых - малое количество больных, задействованных в доклинических исследованиях, и это не позволяет сделать правильные выводы о безопасности и эффективности ЛС. И, кроме того, в исследования не включаются группы больных, страдающих сопутствующими заболеваниями. Словом, объективную информацию о развитии побочных эффектов можно получить только тогда, когда препарат принимают сотни тысяч пациентов".
По результатам исследований, проведенных в разных странах, от 3 до 15% всех обращений к врачу вызваны ухудшением состояния здоровья в связи с применением лекарств. Акцент в оценке эффективности и безопасности ЛС сместился в сторону продолжения изучения безопасности тех лекарств, которые уже вышли на рынок и были рекомендованы к широкому применению. Это связано с тем, что, во-первых, результаты экспериментальных исследований на животных не всегда можно использовать применительно к человеку, во-вторых - малое количество больных, задействованных в доклинических исследованиях, и это не позволяет сделать правильные выводы о безопасности и эффективности ЛС. И, кроме того, в исследования не включаются группы больных, страдающих сопутствующими заболеваниями. Словом, объективную информацию о развитии побочных эффектов можно получить только тогда, когда препарат принимают сотни тысяч пациентов".
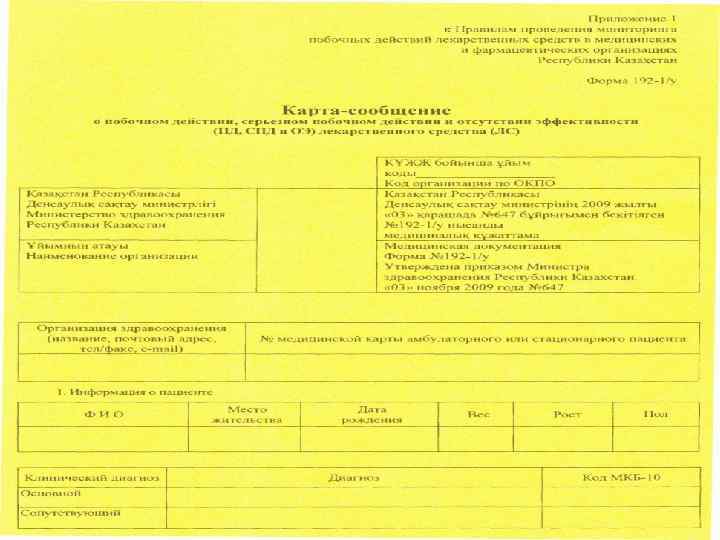
 Задачи отдела изучения побочных эффектов заключаются в организации работы по выявлению и учету побочных действий ЛС, анализу и систематизации данных о побочных реакциях, формировании заключения о причинноследственной связи между приемом препарата и развитием побочного действия. В Казахстане основной метод по оценке безопасности лекарств - метод спонтанных сообщений. Это добровольное сообщение врача, наблюдающего развитие побочного эффекта у своего пациента. Врач определенным образом оформляет свои наблюдения и направляет их в органы контрольноразрешительной системы федеральных либо региональных инстанций.
Задачи отдела изучения побочных эффектов заключаются в организации работы по выявлению и учету побочных действий ЛС, анализу и систематизации данных о побочных реакциях, формировании заключения о причинноследственной связи между приемом препарата и развитием побочного действия. В Казахстане основной метод по оценке безопасности лекарств - метод спонтанных сообщений. Это добровольное сообщение врача, наблюдающего развитие побочного эффекта у своего пациента. Врач определенным образом оформляет свои наблюдения и направляет их в органы контрольноразрешительной системы федеральных либо региональных инстанций.
 Безопасность лекарства как понятие - это характеристика ЛС, основанная на сравнительном анализе его эффективности и оценке риска причинения вреда здоровью. Основные этапы оценки безопасности новых ЛС - это доклинические исследования, экспертиза этих результатов, разрешение и клинические исследования, экспертиза результатов, разрешение регистрации препарата, широкое использование ЛС и оценка переносимости при широком медицинском применении.
Безопасность лекарства как понятие - это характеристика ЛС, основанная на сравнительном анализе его эффективности и оценке риска причинения вреда здоровью. Основные этапы оценки безопасности новых ЛС - это доклинические исследования, экспертиза этих результатов, разрешение и клинические исследования, экспертиза результатов, разрешение регистрации препарата, широкое использование ЛС и оценка переносимости при широком медицинском применении.
 В настоящее время большое внимание уделяется внедрению международных систем и международных стандартов оценки качества во многих областях, в том числе и в области фармации. Качество ЛС определяется как соответствие всем условиям регистрации по прописи, условию изготовления и свойствам. Однако соответствие всем показателям фармакопейной статьи далеко не всегда соответствует биологической идентичности ЛС.
В настоящее время большое внимание уделяется внедрению международных систем и международных стандартов оценки качества во многих областях, в том числе и в области фармации. Качество ЛС определяется как соответствие всем условиям регистрации по прописи, условию изготовления и свойствам. Однако соответствие всем показателям фармакопейной статьи далеко не всегда соответствует биологической идентичности ЛС.
 Качество, эффективность и безопасность ЛС может быть обеспечена соблюдением правил международных стандартов. Это правила GSP, GLP, GMP. Цель этих правил - обеспечение надежности и доказательности научных исследований, соблюдение этических принципов. Кроме того, в здравоохранении осуществляется стандартизация, которая заключается в установлении новых правил и характеристик с целью обеспечения безопасности продукции и работ по доклиническим исследованиям. Одно из направлений деятельности по стандартизации и по внедрению международных стандартов - разработка нормативных документов.
Качество, эффективность и безопасность ЛС может быть обеспечена соблюдением правил международных стандартов. Это правила GSP, GLP, GMP. Цель этих правил - обеспечение надежности и доказательности научных исследований, соблюдение этических принципов. Кроме того, в здравоохранении осуществляется стандартизация, которая заключается в установлении новых правил и характеристик с целью обеспечения безопасности продукции и работ по доклиническим исследованиям. Одно из направлений деятельности по стандартизации и по внедрению международных стандартов - разработка нормативных документов.
 Современные гарантии безопасности ЛС - повышение качества доклинических исследований, стандартизация и разработка нормативных документов, внедрение системы GLP, обеспечение качества токсикологической экспертизы. Все это позволит перейти от контроля к обеспечению качества и эффективности ЛС.
Современные гарантии безопасности ЛС - повышение качества доклинических исследований, стандартизация и разработка нормативных документов, внедрение системы GLP, обеспечение качества токсикологической экспертизы. Все это позволит перейти от контроля к обеспечению качества и эффективности ЛС.
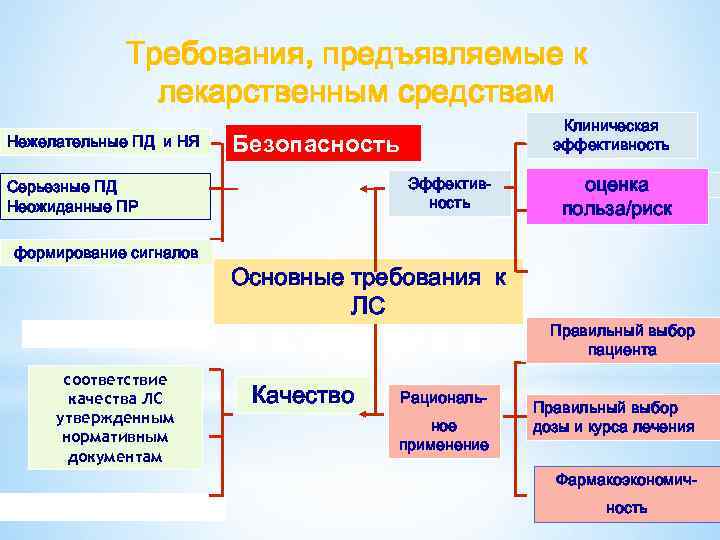 Требования, предъявляемые к лекарственным средствам Нежелательные ПД и НЯ Безопасность Эффективность Серьезные ПД Неожиданные ПР формирование сигналов соответствие качества ЛС утвержденным нормативным документам Клиническая эффективность Основные требования к ЛС Качество Рациональное применение оценка польза/риск Правильный выбор пациента Правильный выбор дозы и курса лечения Фармакоэкономичность
Требования, предъявляемые к лекарственным средствам Нежелательные ПД и НЯ Безопасность Эффективность Серьезные ПД Неожиданные ПР формирование сигналов соответствие качества ЛС утвержденным нормативным документам Клиническая эффективность Основные требования к ЛС Качество Рациональное применение оценка польза/риск Правильный выбор пациента Правильный выбор дозы и курса лечения Фармакоэкономичность

 Проблемы, связанные с фармакотерапией üНеблагоприятные побочные реакции üОсложнения, связанные с применением ЛС с нарушениями предписаний инструкций ( Off-Label) üМедицинские ошибки üНеэффективность ЛС üФальсификация ЛС üВлияние ЛС на экологию (ecopharmacovigilance) üБАД – неконтролируемые последствия
Проблемы, связанные с фармакотерапией üНеблагоприятные побочные реакции üОсложнения, связанные с применением ЛС с нарушениями предписаний инструкций ( Off-Label) üМедицинские ошибки üНеэффективность ЛС üФальсификация ЛС üВлияние ЛС на экологию (ecopharmacovigilance) üБАД – неконтролируемые последствия
 Pharmacovigilance Фармако. НАДЗОР или Фармако. БДИТЕЛЬНОСТЬ? Pharmakon (греч. ) – «лекарство» Vigilare (лат. ) – «бдительность» . Pharmacovigilance = Фармако. БДИТЕЛЬНОСТЬ
Pharmacovigilance Фармако. НАДЗОР или Фармако. БДИТЕЛЬНОСТЬ? Pharmakon (греч. ) – «лекарство» Vigilare (лат. ) – «бдительность» . Pharmacovigilance = Фармако. БДИТЕЛЬНОСТЬ
 PHARMACOVIGILANCE фармакобдительность, фармаконадзор Система фармакологического надзора – это государственная система сбора, научной оценки информации о побочных реакциях лекарственных средств при их медицинском применении с целью принятия соответствующих регуляторных мер. ВОЗ
PHARMACOVIGILANCE фармакобдительность, фармаконадзор Система фармакологического надзора – это государственная система сбора, научной оценки информации о побочных реакциях лекарственных средств при их медицинском применении с целью принятия соответствующих регуляторных мер. ВОЗ
 Необходимость фармаконадзора обусловлена как этическими, так и юридическими нормами и определяется принципами взаимодействия производителей, национальных центров по вопросам безопасности лекарств и международными организациями (WHO, EMEA, ISOP и др. ). 23
Необходимость фармаконадзора обусловлена как этическими, так и юридическими нормами и определяется принципами взаимодействия производителей, национальных центров по вопросам безопасности лекарств и международными организациями (WHO, EMEA, ISOP и др. ). 23
 Лекарственная безопасность – это не отказ от применения ЛС, а грамотное применение подходящего ЛС конкретному больному с учетом индивидуальных особенностей
Лекарственная безопасность – это не отказ от применения ЛС, а грамотное применение подходящего ЛС конкретному больному с учетом индивидуальных особенностей
 Осуществление фармакологического надзора за ПД ЛС является одним из главных направлений государственной политики в сфере лекарственного обращения. 25
Осуществление фармакологического надзора за ПД ЛС является одним из главных направлений государственной политики в сфере лекарственного обращения. 25
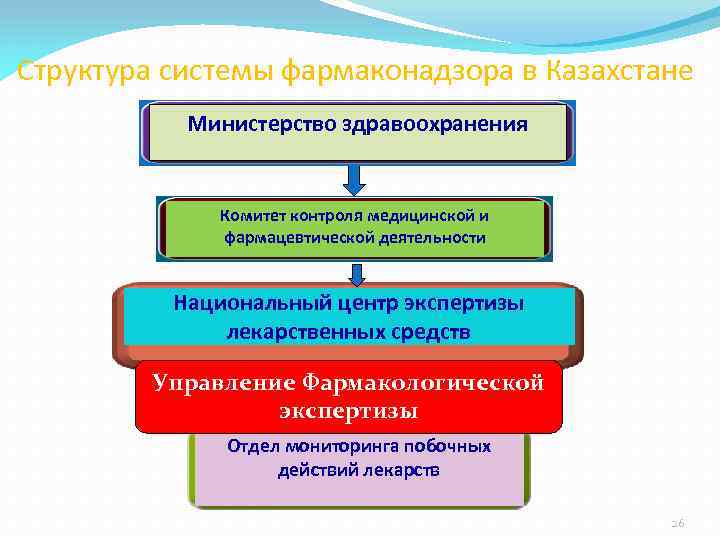 Структура системы фармаконадзора в Казахстане Министерство здравоохранения Комитет контроля медицинской и фармацевтической деятельности Национальный центр экспертизы лекарственных средств Управление Фармакологической экспертизы Отдел мониторинга побочных действий лекарств 26
Структура системы фармаконадзора в Казахстане Министерство здравоохранения Комитет контроля медицинской и фармацевтической деятельности Национальный центр экспертизы лекарственных средств Управление Фармакологической экспертизы Отдел мониторинга побочных действий лекарств 26
 Сотрудничество с центром ВОЗ по Международной программе мониторинга ПД ЛС Республика Казахстан 16 июля 2008 года признана 85 -ой полноправной странойучастницей Международной программы ВОЗ по мониторингу лекарственных средств (г. Уппсала, Швеция, http: //www. who-umc. org).
Сотрудничество с центром ВОЗ по Международной программе мониторинга ПД ЛС Республика Казахстан 16 июля 2008 года признана 85 -ой полноправной странойучастницей Международной программы ВОЗ по мониторингу лекарственных средств (г. Уппсала, Швеция, http: //www. who-umc. org).
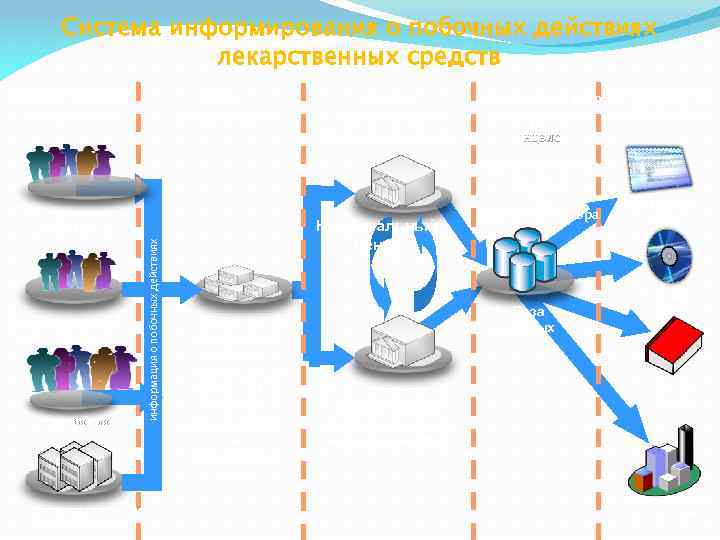 Система информирования о побочных действиях лекарственных средств Предоставление информации Сбор информации Фармацевтичес кие работники Потребители информация о побочных действиях Медицинские работники Фармацевтические производители Анализ информации и принятие решений Национальный центр Территориаль ные органы ККМФД, Территориаль ные филиалы НЦЭЛС, Департамент ы здравоохране ния Аккумулирование Распространение информации НЦЭЛС Фармакологическ ий центр Отдел фармаконадзора База данных Комитет контроля медицинской и фармацевтическо й деятельностью Интернетсайт Компактдиск Печатные издания Международные организации
Система информирования о побочных действиях лекарственных средств Предоставление информации Сбор информации Фармацевтичес кие работники Потребители информация о побочных действиях Медицинские работники Фармацевтические производители Анализ информации и принятие решений Национальный центр Территориаль ные органы ККМФД, Территориаль ные филиалы НЦЭЛС, Департамент ы здравоохране ния Аккумулирование Распространение информации НЦЭЛС Фармакологическ ий центр Отдел фармаконадзора База данных Комитет контроля медицинской и фармацевтическо й деятельностью Интернетсайт Компактдиск Печатные издания Международные организации
 Комитет контроля медицинской и фармацевтической деятельности МЗ РК на основании результатов мониторинга ПД ЛС принимает решение: 1) изменения и дополнения в инструкцию по применению лекарственного средства, изменение частоты возникновения ПД; 2) о переводе лекарственного средства из без рецептурного отпуска в категорию отпуска по рецепту врача; 3) о необходимости проведения дополнительных доклинических и/или клинических исследований; 30
Комитет контроля медицинской и фармацевтической деятельности МЗ РК на основании результатов мониторинга ПД ЛС принимает решение: 1) изменения и дополнения в инструкцию по применению лекарственного средства, изменение частоты возникновения ПД; 2) о переводе лекарственного средства из без рецептурного отпуска в категорию отпуска по рецепту врача; 3) о необходимости проведения дополнительных доклинических и/или клинических исследований; 30
 4) о необходимости проведения дополнительного контроля качества лекарственного средства; 5) о приостановлении действия регистрационного удостоверения на лекарственное средство; 6) об отзыве решения о государственной регистрации лекарственного средства, т. е. запрещении применения препарата 31
4) о необходимости проведения дополнительного контроля качества лекарственного средства; 5) о приостановлении действия регистрационного удостоверения на лекарственное средство; 6) об отзыве решения о государственной регистрации лекарственного средства, т. е. запрещении применения препарата 31
 На сайте www. dari. kz и в журнале «Фармация Казахстана» РГП «Национальный центр экспертизы лекарственных средств» открыта страница «Фармаконадзор»
На сайте www. dari. kz и в журнале «Фармация Казахстана» РГП «Национальный центр экспертизы лекарственных средств» открыта страница «Фармаконадзор»
 Основные принципы контроля безопасности лекарственной терапии С целью профилактики развития побочных эффектов лекарств необходимо соблюдение следующих правил: 1. учитывать не только основное лечебное свойство ЛС, но и его возможные побочные эффекты, особенно если они обусловлены структурой вещества или механизмом действия; 2. назначать оптимальные дозы лекарств, соблюдать курсовые дозы и правила отмены некоторых ЛП; 3. при комбинированной фармакотерапии учитывать возможное взаимодействие ЛС между собой и с пищей. При установлении такового предусматривать интервалы между приемом взаимно реагирующих субстратов; 4. не использовать одновременно лекарства со сходным механизмом действия и избегать полипрагмазии и политерапии, которые повышают риск нежелательных явлений;
Основные принципы контроля безопасности лекарственной терапии С целью профилактики развития побочных эффектов лекарств необходимо соблюдение следующих правил: 1. учитывать не только основное лечебное свойство ЛС, но и его возможные побочные эффекты, особенно если они обусловлены структурой вещества или механизмом действия; 2. назначать оптимальные дозы лекарств, соблюдать курсовые дозы и правила отмены некоторых ЛП; 3. при комбинированной фармакотерапии учитывать возможное взаимодействие ЛС между собой и с пищей. При установлении такового предусматривать интервалы между приемом взаимно реагирующих субстратов; 4. не использовать одновременно лекарства со сходным механизмом действия и избегать полипрагмазии и политерапии, которые повышают риск нежелательных явлений;
 5. избегать (по возможности) инъекционного метода введения, при котором побочное действие ЛС проявляются наиболее сильно; 6. соблюдать индивидуальный подход к назначению лекарственных препаратов с учетом возраста (особенно для детей и людей преклонного возраста), особенностей естественных (беременность, кормление грудью) и патологических состояний пациентов и наличия сопутствующих заболеваний, сопровождающихся функциональным изменением важных органов и систем (печень, почки, ЖКТ, сердечно-сосудистая система и др. ), что существенно влияет на биотрансформацию лекарств; 7. более широко применять метод «прикрытия» побочного действия лекарств другими препаратами, например, профилактика развития кандидоза путем использования антигрибковых препаратов и др.
5. избегать (по возможности) инъекционного метода введения, при котором побочное действие ЛС проявляются наиболее сильно; 6. соблюдать индивидуальный подход к назначению лекарственных препаратов с учетом возраста (особенно для детей и людей преклонного возраста), особенностей естественных (беременность, кормление грудью) и патологических состояний пациентов и наличия сопутствующих заболеваний, сопровождающихся функциональным изменением важных органов и систем (печень, почки, ЖКТ, сердечно-сосудистая система и др. ), что существенно влияет на биотрансформацию лекарств; 7. более широко применять метод «прикрытия» побочного действия лекарств другими препаратами, например, профилактика развития кандидоза путем использования антигрибковых препаратов и др.
 8. в случаях известного негативного взаимодействия назначенного препарата с алкоголем, кофе, цитрусовыми, а также с курением следует отказаться от последних; 9. лекарственные препараты, наиболее часто вызывающие побочные эффекты, необходимо назначать по строгим показаниям. Для оптимальной фармакотерапии очень важное значение имеют медицинская культура и дисциплинированность пациентов при выполнении рекомендаций врача. Просветительная работа специалистов-медиков иногда играет решающую роль в повышении эффективности лекарственной терапии и приверженности пациентов лечению
8. в случаях известного негативного взаимодействия назначенного препарата с алкоголем, кофе, цитрусовыми, а также с курением следует отказаться от последних; 9. лекарственные препараты, наиболее часто вызывающие побочные эффекты, необходимо назначать по строгим показаниям. Для оптимальной фармакотерапии очень важное значение имеют медицинская культура и дисциплинированность пациентов при выполнении рекомендаций врача. Просветительная работа специалистов-медиков иногда играет решающую роль в повышении эффективности лекарственной терапии и приверженности пациентов лечению
 Благодарю за внимание! Не испытывайте на себе и близких Вам людях побочные действия лекарственных средств 36
Благодарю за внимание! Не испытывайте на себе и близких Вам людях побочные действия лекарственных средств 36
