2_Насл_ДСТ_Баранов.ppt
- Количество слайдов: 70

В. Н. Горбунова

Дисплазия соединительной ткани это полиорганная и полисистемная патология с прогредиентным течением, в основе которой лежат нарушения развития этой ткани в эмбриональном или постнатальном периодах

В некоторых случаях подобные заболевания носят наследственный характер, но чаще они возникают вследствие неблагоприятных внешних воздействий на течение беременности или раннее развитие ребенка

Наследственные ДСТ - это гетерогенная группа моногенных заболеваний, большая часть которых обусловлена генетическими дефектами синтеза и распада белков внеклеточного матрикса, а также белков, участвующих в морфогенезе соединительной ткани

Во всех разновидностях соединительной ткани • межклеточное вещество занимает больше места, чем клеточные элементы • присутствуют своеобразные волокнистые фибриллярные структуры - коллагеновые, эластические и ретикулиновые волокна

Коллагены составляют более 30% общей массы белков млекопитающих, причём около 40% находится в коже, примерно 50% - в тканях скелета и 10% - в строме внутренних органов

Коллагены • обеспечивают поддержание структурной целостности различных соединительных тканей • участвуют в онто- и органогенезе • аггрегации тромбоцитов • хемотаксисе • заживлении ран и переломов костей

В настоящее время идентифицированы 27 типов коллагенов, различающихся по аминокислотному составу, хроматографическим и иммунологическим свойствам, макромолекулярной организации и распространенности в тканях

СТРУКТУРА КОЛЛАГЕНОВ • Зрелые молекулы коллагеновых белков состоят из трех равномерно скрученных полипептидных альфа-цепей, образующих структуру, подобную трехгранному шнуру • Разные типы коллагенов могут быть образованы либо тремя одинаковыми альфа цепями, либо двумя или тремя различными полипептидами в соотношении 2: 1 или 1: 1: 1 • Каждая альфа-цепь кодируется собственным геном, так что общее число коллагеновых генов немногим более 40 • Любая альфа-цепь содержит коллагеновой домен, на всем протяжении которого за исключением короткого Cтерминального участка каждая третья аминокислота является глицином - (Gly-X-Y)n

ПРОЦЕССИНГ КОЛЛАГЕНОВ ПРОХОДИТ В 2 ЭТАПА ПОД ДЕЙСТВИЕМ 14 ФЕРМЕНТОВ • внутриклеточно с образованием проколлагена • внеклеточно с образованием тропоколлагена и супрамолекулярных агрегатов

Внутриклеточные модификации • удаление сигнальной последовательности • гидроксилирование определенных пролиновых остатков до 4 -гидроксипролина и 3 -гидроксипролина, а также лизиновых остатков до гидроксилизина • гликозилирование некоторых гидроксилизиновых остатков до галактозил-гидроксилизина и глюкозил-галактозилгидроксилизина • гликозилирование определенных аспарагиновых остатков в карбокси-терминальных участках пропептидов • ассоциацию и дисульфидное связывание C-концевых районов пропептидов • скручивание по типу «застежки-молнии» модифицированных альфа-цепей по направлению от С- к N-концам с образованием тройной спирали

Внеклеточный посттрансляционный процессинг • отщепление NH 2 - и COOH-концевых пропептидов от молекулы проколлагена на плазматической мембране • секреция тропоколлагеновых молекул через плазматическую мембрану • соединение мономеров тропоколлагена по типу «конец в конец» и образование в С-концевых областях межцепочечных дисульфидных связей • окисление остатков лизина и формирование специфических межфибриллярных сшивок по типу «пиридинолиновых мостиков» • образование супрамолекулярных агрегатов, стабилизация которых осуществляется за счет поперечных сшивок
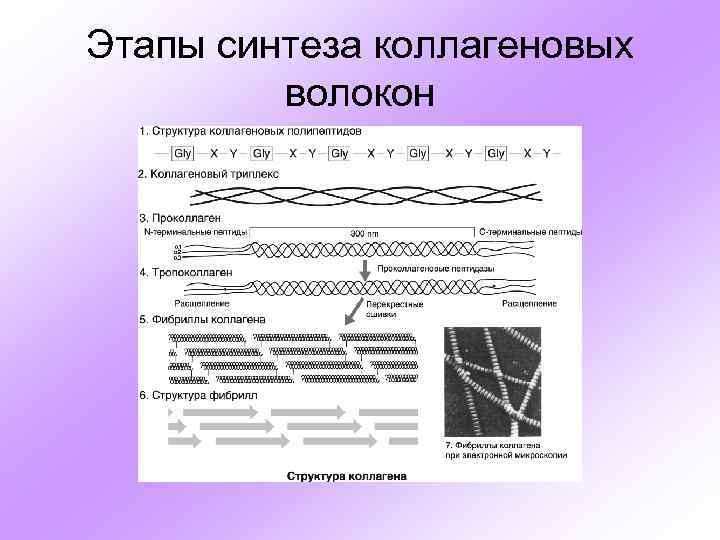
Этапы синтеза коллагеновых волокон

Фибриллярные коллагегны I, II и III типа являются мажорными и составляют более 95% всех коллагеновых белков

ЭКСПРЕССИЯ КОЛЛАГЕНОВ • • • I – повсеместно, в костной системе, сухожилиях и коже II, IX, X, XI и XII – в хрящевой ткани III – эмбриональный, в стенках сосудов и кишечника IV – в базальных мембранах V, XI – образуют кор внутри фибрилл мажорных коллагенов VI – осуществляют взаимодействие фибрилл коллагена со структурными компонентами внеклеточного матрикса • VII, XVII – в эпидермальных кератиноцитах, компоненты кожных опорных фибрилл • VIII – в эндотелии сосудов и роговице, образует мембраны Десцемета • XVIII и IV типов участвуют в регуляции неоваскуляризации • Остальные - ассоциируются с коллагенами I и II для осуществления их взаимодействия с другими белками внеклеточного матрикса

Более 50 молекул взаимодействуют с коллагенами, причем сайты связывания с этими молекулами располагаются неслучайным образом, и большинство из них находится в С-концевых участках коллагенов

Это -протеогликаны, интегрины, ламинины, фибронектин, хондронектин, тромбоспондин, энтактин, C 1 q-компонент комплемента 1, регуляторы капиллярного морфогенеза, тромбоцитарные гликопротеины (GP VI и CD 36), остеонектин, трансформирующий фактор роста β и другие белки, получившие общее название коллигинов

НАСЛЕДСТВЕННЫЕ КОЛЛАГЕНОПАТИИ – большая группа болезней соединительных тканей человека, обусловленных мутациями в генах коллагенов, либо в генах, кодирующих ферменты их биосинтеза. МУТАЦИИ описаны для 25 коллагеновых генов, участвующих в синтезе 13 различных типов коллагенов, а также в 3 генах ферментов биосинтеза коллагенов

Наибольшим повреждающим эффектом обладают мутации, приводящие к локальным нарушениям процесса скручивания тройной спирали. Это – миссенс-мутации Gly-типа и C-концевые мутации Заболевание протекает легче, если альфа-цепь полностью утрачивает способность участвовать в формировании зрелых проколлагеновых молекул. При этом дефектные полипептиды не входят в триплексные структуры и вскоре после синтеза подвергаются внутриклеточному протеолизу. Это – мутации, сопровождающиеся преждевременной терминацией трансляции и N-концевые мутации

БОЛЕЕ 70 ЗАБОЛЕВАНИЙ, ОБУСЛОВЛЕНЫ МУТАЦИЯМИ В КОЛЛАГЕНОВЫХ ГЕНАХ Это – несовершенный остеогенез, синдром Элерса-Данло, хондродисплазии, офтальмопатии, нефропатии, аномалии суставов, органа зрения, миопатии, буллёзный эпидермолиз и др. Частыми сопутствующими проявлениями являются тугоухость, патология зубов, пародонта и ногтей, пролапс митрального клапана, преждевременное старение

Коллаген I типа присутствует во многих тканях, но особенно обильно в костной системе, сухожилиях и коже Кодируется генами COL 1 A 1 и COL 1 A 2

НЕСОВЕРШЕННЫЙ ОСТЕОГЕНЕЗ • I - голубые склеры, множественные переломы костей в 4 -6 декаде жизни, потеря слуха в 50% случаев • II - врожденная летальная форма; деформация и повышенная ломкость костей, голубые склеры, «янтарные» зубы, отосклероз • III – переломы и быстро прогрессирующая деформация длинных трубчатых костей, нормальные склеры, несовершенный дентиногенез • IV - редкие переломы и медленно прогрессирующая деформация костей, отосклероз, нормальные склеры • III/ IV с синдромом Элерса-Данло - переломы и деформация костей в сочетании с гипермобильностью суставов, растяжимостью и ломкостью кожи • синдром Брука - переломы костей в сочетании с врожденными контрактурами суставов и дефицитом лизилгидроксилазы 2

СООТНОШЕНИЕ МУТАЦИЙ В ГЕНАХ COL 1 A 2/ COL 1 A 1 + COL 1 A 2 • ВСЕГО • • • НО III НО IV НО III/IV + СЭД Остеопороз СЭД I СЭД VII СЭД кардиальный – – – – – 134/394 = 34% 20/123 = 16% 28/ 99 = 28% 33/ 79 = 42% 33/ 57 = 58% 1/ 8 = 12% 3/4 = 75% 0/1 = 0% 9/12 = 75% 6/ 6 = 100%

МУТАЦИИ В ГЕНЕ COL 1 A 1 Миссенс Gly-типа + С-концевые • Всего – 47% • Всего • • • • • НО III НО IV НО III/IV + СЭД Остеопороз СЭД I СЭД VII СЭД кард. – 11% – 76% – 69% – 72% – 86% – 75% – 0% Терминация синтеза НО III НО IV III/IV + СЭД Остеопороз СЭД I СЭД VII СЭД кард. – 44% – 85% – 9% – 22% – 24% – 14% – 25% – 0% – 92% – 83%

Коллаген II типа - мажорный хрящевой коллаген Кодируется геном COL 2 A 1 Коллагены IX, X, XI и XII - минорные хрящевые коллагены

ХОНДРОДИСПЛАЗИИ, ОБУСЛОВЛЕННЫЕ МУТАЦИЯМИ В ГЕНАХ ХРЯЩЕВЫХ КОЛЛАГЕНОВ • ахондрогенез II; гипохондрогенез • спондилоэпифизарная дисплазия • • – COL 2 A 1 (6 -100%) – COL 2 A 1 (7 -29%), СOL 10 A 1(1– 100%) дисплазия Книста – COL 2 A 1(6100%) спондилоэпиметафизарная дисплазия – COL 2 A 1 (5 - 80%) спондилопериферальная дисплазия – COL 2 A 1 (3 - 0%) платиспондилическая скелетная дисплазия – COL 2 A 1 (2 – 0%) эпифизарная дисплазия с миопией и глухотой – COL 2 A 1 (1– 0%) аваскулярный некроз головки бедра – COL 2 A 1(2 -100%) остеоартроз – COL 2 A 1 (2 - 0%) • метафизарная хондродисплазия Шмида – СOL 10 A 1(19 -11%) • отоспондиломегаэпифизарная дисплазия – СOL 11 A 2 (4 - 50%)

АРТРООФТАЛЬМОПАТИИ, ОБУСЛОВЛЕННЫЕ МУТАЦИЯМИ В ГЕНАХ ХРЯЩЕВЫХ КОЛЛАГЕНОВ • синдром Стиклера 1 - дегенеративные изменения в суставах, прогрессирующая миопия, пролапс митрального клапана – COL 2 A 1 (10 – 0%) • витреоретинопатия с эпифизарной дисплазией фаланг дегенерация стекловидного тела и сетчатки, эпифизарная дисплазия фаланг – COL 2 A 1 (1 – 100%) • синдром Стиклера 2 - неспецифическая артропатия, марфаноидный фенотип, миопия, гипоплазия средней части лица, расщелина нёба – COL 11 A 1 (3– 67%) • синдром Маршалла - окулярный гипертелоризм, седловидный нос, дефекты слуха, тяжёлая миопия, врождённая катаракта, эктодермальная дисплазия, задержка речевого развития – COL 11 A 1 (2 – 0%) • синдром Стиклера 3 - «мягкая» артропатия, нарушение слуха, тяжёлая миопия, дегенерация сетчатки, гипоплазия средней части лица, расщелина нёба – COL 11 A 2 (3 – 0%)

НАСЛЕДСТВЕННЫЕ КОЛЛАГЕНОПАТИИ, ОБУСЛОВЛЕННЫЕ МУТАЦИЯМИ В ГЕНАХ ХРЯЩЕВОГО КОЛЛАГЕНА IХ • Эпифизарная дисплазия 1 - переразгибание, остеоратриты коленных суставов, нарушение походки, грыжи Шморля, остеофиты грудо-поясничной области позвоночника – COL 9 A 1 (1 – 0%) • Эпифизарная дисплазия 2 - переразгибание коленных суставов с развитием хронической артропатии, задержка роста, Х-образная деформация нижних конечностей – COL 9 A 2 (4 – 0%) • Эпифизарная дисплазия 3 - ранние артропатии коленных суставов, нарушение походки, миотонический синдром – COL 9 A 3 (3 – 0%) • Болезнь межпозвоночных дисков - множественные межпозвоночные грыжи поясничного отдела позвоночника – COL 9 A 2 (1 – 0%), COL 9 A 3 (1 – 0%)

Мажорный эмбриональный коллаген III типа, присутствует в стенках сосудов и кишечника Кодируется геном COL 3 A 1 Минорный коллаген V типа образуют кор внутри фибрилл мажорных коллагенов Кодируется генами COL 5 A 1 и COL 5 A 2

Синдром Элерса-Данло • I, II - гиперрастяжимость кожи, гипермобильность, вывихи суставов, скелетные деформации, варикозное расширение вен, пролабирование клапанов сердца – COL 1 A 1 (1), COL 5 A 1 (10), COL 5 A 2 (3) • IV - «артериальный» , разрывы артерий, геморрагический синдром, перфорации внутренних органов, ломкость кожи – COL 3 A 1 (152); аневризма аорты – COL 3 A 1 (2) • VI - «кифосколиотический» , хрупкость тканей глаза, дефицит лизилгидроксилазы 1 – PLOD 1 (10) • VIIA - нанизм, скелетные дисплазии, выраженная гипермобильность суставов, гиперрастяжимость и лёгкая ранимость кожи – COL 1 A 1 (3) • VIIB – COL 1 A 2 (9) • VIIC – ADAMTS 2 (2) • аут. -рец. - кардиальный, с пролапсом митрального клапана – COL 1 A 2 (6)

Коллаген IV типа присутствует в базальных мембранах Кодируется генами COL 4 A 1, COL 4 A 3 и COL 4 A 4, COL 4 A 5 и COL 4 A 6

НАСЛЕДСТВЕННЫЕ КОЛЛАГЕНОПАТИИ, ОБУСЛОВЛЕННЫЕ МУТАЦИЯМИ В ГЕНАХ БАЗАЛЬНОГО КОЛЛАГЕНА IV • перинатальное кровоизлияние мозга, порэнцефалия – COL 4 A 1 (10 – 0%) • синдром Альпорта, аутосомно-рецессивный – COL 4 A 3 (6 – 0%), COL 4 A 4 (5 – 20%) • гематурия доброкачественная без нарушения функции почек – COL 4 A 3 (6 – 0%), COL 4 A 4 (5 – 20%) • синдром Альпорта, X-сцепленный – COL 4 A 5 (15 – 40%) • Лейомиоматоз пищевода и гениталий с нефропатией – COL 4 A 5 + COL 4 A 6 (14 – 0%)

Коллаген VI типа осуществляет взаимодействие фибрилл коллагена со структурными компонентами внеклеточного матрикса Кодируется генами COL 6 A 1, COL 6 A 2 и COL 4 A 3

НАСЛЕДСТВЕННЫЕ КОЛЛАГЕНОПАТИИ, ОБУСЛОВЛЕННЫЕ МУТАЦИЯМИ В ГЕНАХ КОЛЛАГЕНА VI • Миопатия Бетлема, доброкачественная, врожденная с контрактурами – COL 6 A 1 (7 – 29%), COL 6 A 2 (2 – 50%), COL 6 A 3 (1 – 100%) • Миодистрофия Ульриха, врожденная, склероатоническая – COL 6 A 1 (7 – 29%), COL 6 A 2 (5 – 0%), COL 6 A 3 (2 – 0%)

Коллагены VII и XVII типов присутствуют в эпидермальных кератиноцитах и являются компонентами кожных опорных фибрилл Кодируются генами COL 7 A 1 и COL 17 A 1, соответственно

Буллозный эпидермолиз • • дистрофический, аутосомно-рецессивный – COL 7 A 1 (10 – 10%) дистрофический, Пасини-типа – COL 7 A 1 (7 – 100%) дистрофический, претибиальный – COL 7 A 1 (4 – 25%) дистрофический, Cockayne-Touraine – COL 7 A 1 (7 – 100%) дистрофический, pruriginosa – COL 7 A 1 (4 – 25%) дистрофический, Барт-типа – COL 7 A 1 (1 – 100%) дистрофический, с расщеплением роговицы – COL 7 A 1 (1 – 100%) • преходящий буллёзный дермолизис новорожденных – COL 7 A 1 (2 – 100%) • атрофический, доброкачественный, аутосомно-рецессивный – COL 17 A 1 (14 – 7%) • junctional, localisata variant, аутосомно-доминантный – COL 17 A 1 (1 – 0%)

Коллагены VIII и XVIII типов присутствуют в эндотелии сосудов и роговице VIII - образует мембраны Десцемета XVIII - участвует в регуляции неоваскуляризации Кодируются генами COL 8 A 1 и COL 18 A 1, соответственно

ОФТАЛЬМОПАТИИ , ОБУСЛОВЛЕННЫЕ МУТАЦИЯМИ В КОЛЛАГЕНОВЫХ ГЕНАХ • витреоретинальная дегенерация Вагнера- дегенерация стекловидного тела, решётчатая дегенерация сетчатки, ранняя катаракта – COL 2 A 1 (2 – 50%) • регматогенное отслоение сетчатки без сопутствующих симптомов синдрома Стиклера – COL 2 A 1 (2 – 50%) • дистрофия роговицы глаза, Fuchs-типа, сопровождающаяся эндотелиальным отёком с прогрессирующим течением – COL 8 A 1 (3 – 0%) • дистрофия роговицы глаза, полиморфная задняя – COL 8 A 1 (3 – 0%) • Витреоретинальная дегенерация с отслоением сетчатки, Кноблоха синдром – COL 18 A 1 (4 – 0%)

ТУГОУХОСТЬ часто входит в структуру наследственных коллагенопатий, обусловленных мутациям в генах коллагегнов I, IV и особенно XI, участвующих в передаче слухового сигнала

Пролапс митрального клапана является сопутствующим симптомом при классическом течении синдрома Элерса-Данло (COL 5 A 1 , COL 5 A 2) , при аутосомно-рецессивной форме этого заболевания (COL 1 A 2), а также при синдроме Стиклера 1, связанного с мутациями в гене COL 2 A 1

Микрофибриллярные белки • Фибриллин - основной структурный компонент микрофибрилл внеклеточного матрикса, выполняющий в большинстве соединительных тканей архитектурные функции • Эластин – большой аморфный белок, составляющий более 90% всей массы эластических волокон в эластической и неэластической соединительной ткани • Фибулин - взаимодействующий с эластином и интегринами секреторный белок, располагающийся вдоль поверхности эластической ламины, соседствующей с мембранами эндотелиальных клеток • Эмилин - матриксный белок, располагающейся в местах контактов эластина и микрофибрилл • Микрофибрилл-ассоциированный гликопротеин - Ca 2+зависимымй адгезивный белок, ассоциированный с эластином

Структура фибриллина • Транслирующиеся профибриллин содержит сигнальный пептид и пять отдельных структурных районов • Наибольший из этих районов, занимающий около 75% всего белка, состоит из 46 EGF-подобных повторов, формирующих конценсусные последовательности для связывания кальция и осуществления белок-белковых взаимодействий • Тандемные EGF-подобные домены прерываются семью мотивами, содержащими 8 цистеинов - TB домены ( впервые идентифицированы в рецепторе Tgfβ) • Фибриллин содержит интегрин-связывающие (arg-glyasp) и TGF-связывающие мотивы

Фибриллинопатии • синдром Марфана - наследственный фиброз соединительной ткани, затрагивающий скелетную, окулярную и кардиоваскулярную системы с выраженным плейотропизмом и клинической гетерогенностью - FBN 1 (>350) • MASS-синдром - пролапс митрального клапана, выраженная долихостеномелия, ранняя миопия без специфических черт синдрома Марфана - FBN 1 (1) • эктопия хрусталика с мягкими скелетными проявлениями марфаноидного типа без кардиоваскулярной патологии - FBN 1 (2) • синдром Марфана в сочетании с синдромом Shprintzen-Goldberg - FBN 1 (1) • марфаноидный скелетный синдром без кардиоваскулярных и окулярных аномалий - FBN 1 (1) • синдром Вейла-Марчезани - низкий рост, брахидактилия, тугоподвижность суставов, и аномалии хрусталика - FBN 1 (1) • контрактурная арахнодактилия - тяжелый кифосколиоз, генерализованная остеопения, аномальная форма ушных раковин без кардиоваскулярной и окулярной патологии – FBN 2 (10)

Эластинопатии • стеноз суправалвулярной аорты, часто в сочетании со стенозом легочной артерии - ELN (12) • синдром Williams-Beuren - гиперкальцемия, лицевые особенности, умственная отсталость в сочетании с васкулярными аномалиями – делеции, включающие ELN • cutis laxa, врожденная, аутосомнодоминантная - ELN (2)

Фибулинопатии • cutis laxa, врожденная, аутосомнодоминантная - FBLN 5 • cutis laxa, врожденная, аутосомнорецессивная - FBLN 5 • Макулярная дегенерация сетчатки, возрастзависимая - FBLN 5 • Doyne honeycomb дистрофия сетчатки прогрессирующая потеря зрения, обусловленная накоплением желто-белых отложений под пигментным эпителиумом сетчатки, известных как drusen - FBLN 3

ПРОТЕОГЛИКАНОПАТИИ • Всего 35 генов протеогликанов, часть их которых взаимодействует с коллагенами и участвует в регуляции их пространственной организации • В 9 генах найдены мутации, связанные с наследственными заболеваниями • Для 8 имеются модели на мышах • Спектр фенотипических аномалий: хондродисплазия, аномалии суставов, офтальмопатии, нефропатии, буллёзный эпидермолиз

ГЛИКОПРОТЕИНЫ • Главными гликопротеинами внеклеточного матрикса являются фибронектин, хондронектин, ламинины и тромбоспондины • С мутациями в генах ламининов ассоциированы некоторые генетические варианты буллёзного эпидермолиза, нефропатии и врожденной миопатии • Мутации в гене хрящевого тромбоспондина, ответственны за псевдоахондроплазию и множественную эпифизиарную дисплазию • Полиморфная мутации в одном из генов тромбоспондина ассоциирован с семейной формой коронарной недостаточности

ФАКТОРЫ РОСТА, ИХ АНТАГОНИСТЫ И РЕЦЕПТОРЫ • Мутации в генах рецепторов фибробластных факторов роста ассоциированы с различными формами краниосиностоза и ахондроплазии • Мутации в генах рецепторов трансформирующих факторов роста β ассоциированы с различными формами хондродисплазии и брахидактилии • Мутации в генах антагонистов костных морфогенетических белков ассоциированы с различными формами симфалангизма, синдромов множественного синостоза, анкилоза, склероостеоза

Ферменты протеолиза белков внеклеточного матрикса • мутации в генах матриксных металлопротеиназ ассоциированы с редкими наследственными вариантами остеолизиса, артропатии, остеоартрита и тромбоцитопении • полиморфизмы в генах матриксных металлопротеиназ предрасполагают к развитию фиброваскулярных образований при заболеваниях, индуцируемых курением или действием других канцерогенов • Это различные варианты бронхо-легочной патологии, включая астму, хроническую обструктивную болезнь легких, эмфизему легких, легочный фиброз, а также сердечно-сосудистой недостаточности, ретинопатии, эндометриоза, старения кожи • Мутации в генах дизинтегрин-подобных металлопротеиназ ассоциированы с редкими наследственными вариантами синдрома Элерса-Данло, тромбоцитопении, а также синдромами, в структуру которых входит остеоартрит и хондродисплазия
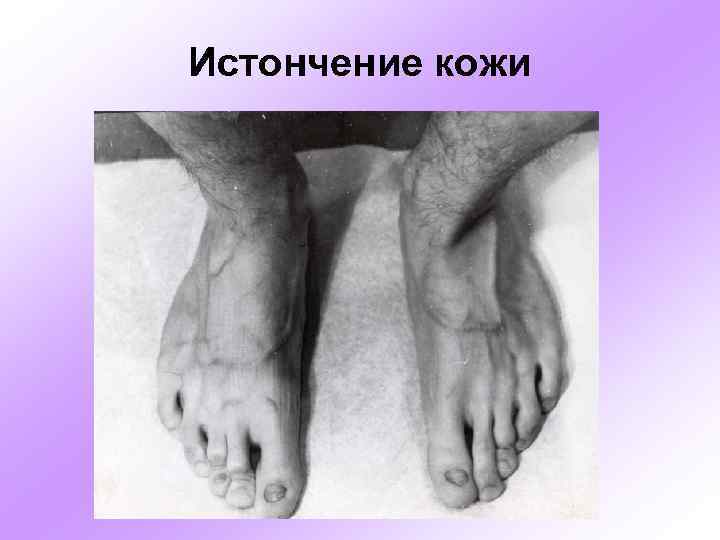
Истончение кожи

Гиперрастяжимость кожи

Гиперрастяжимость кожи

Гипермобильность межфаланговых суставов
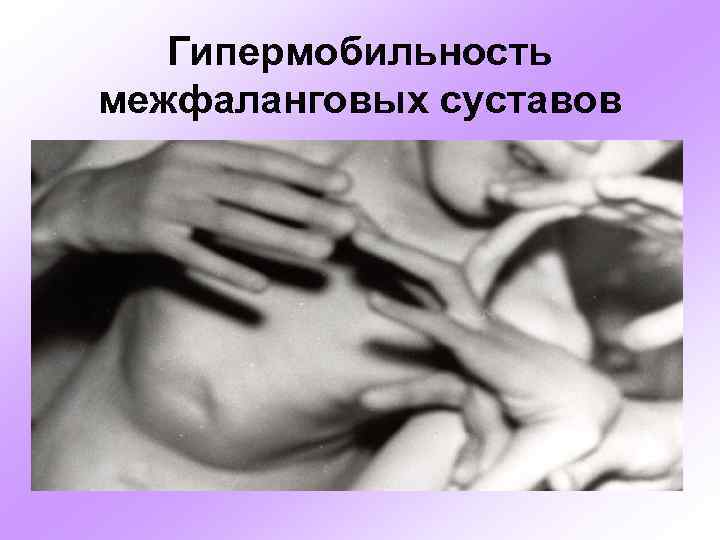
Гипермобильность межфаланговых суставов
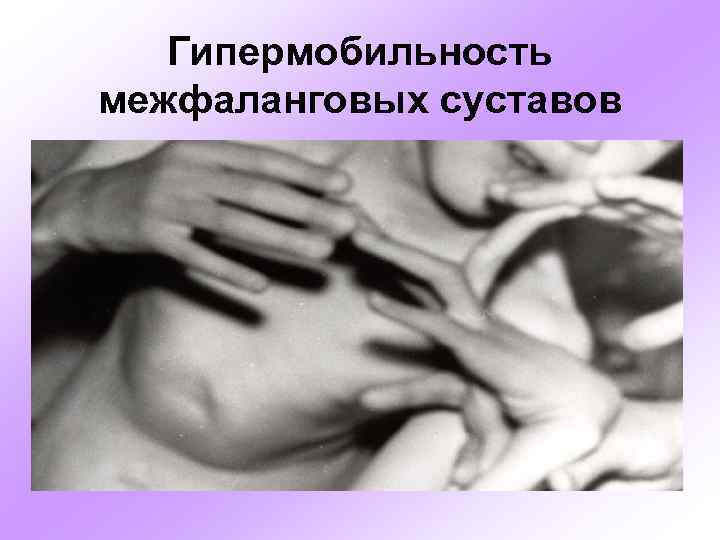
Гипермобильность межфаланговых суставов
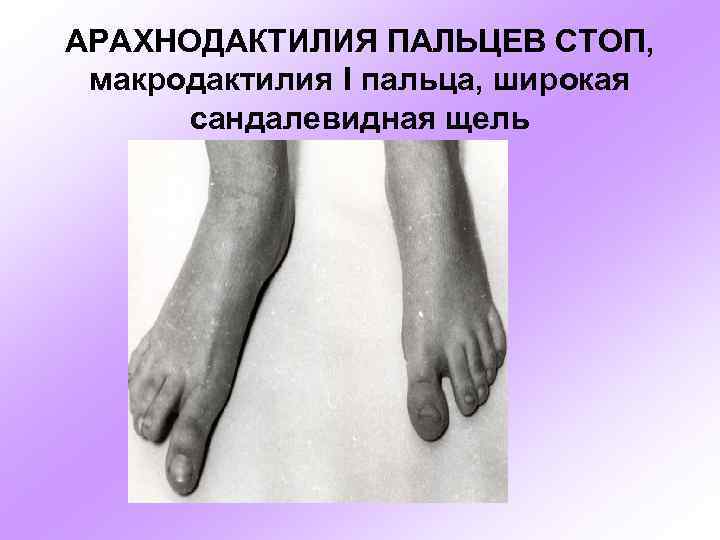
АРАХНОДАКТИЛИЯ ПАЛЬЦЕВ СТОП, макродактилия I пальца, широкая сандалевидная щель

Вялая осанка, сколиоз, ассиметрия стояния лопаток

КИФОСКОЛИОЗ
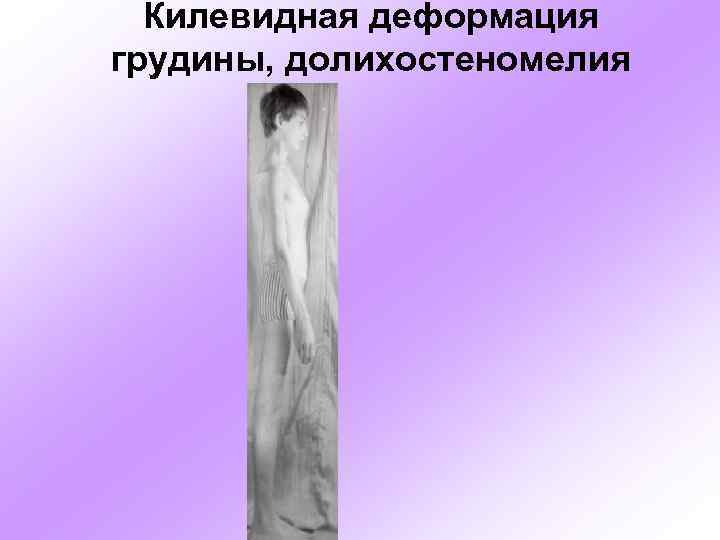
Килевидная деформация грудины, долихостеномелия
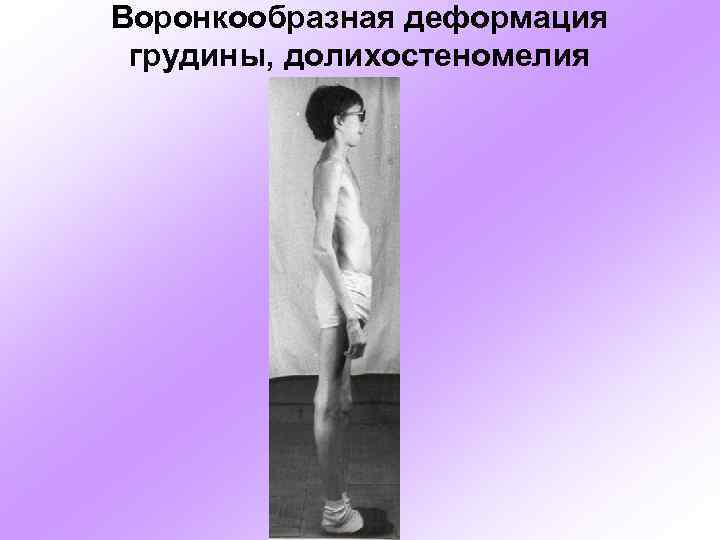
Воронкообразная деформация грудины, долихостеномелия
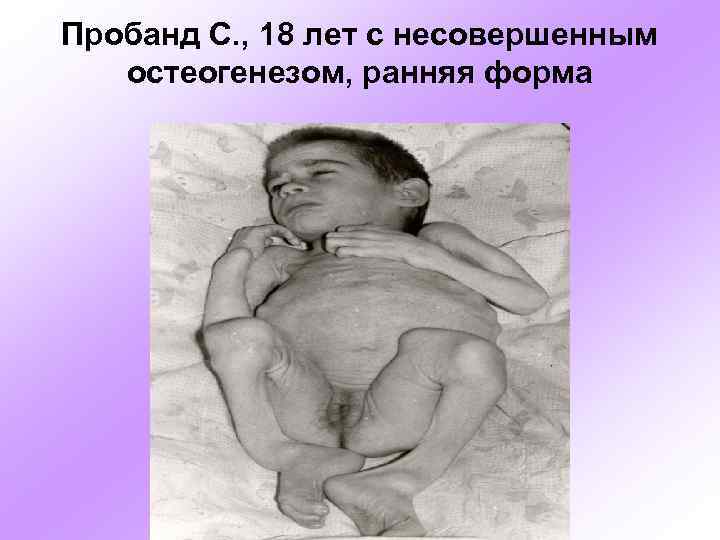
Пробанд С. , 18 лет с несовершенным остеогенезом, ранняя форма
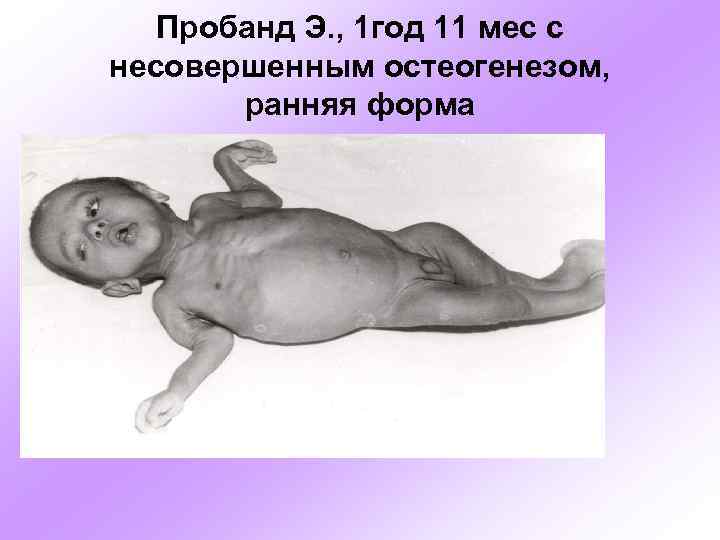
Пробанд Э. , 1 год 11 мес с несовершенным остеогенезом, ранняя форма

Больной П. , 11 лет с синдромом Элерса-Данлоса YII типа
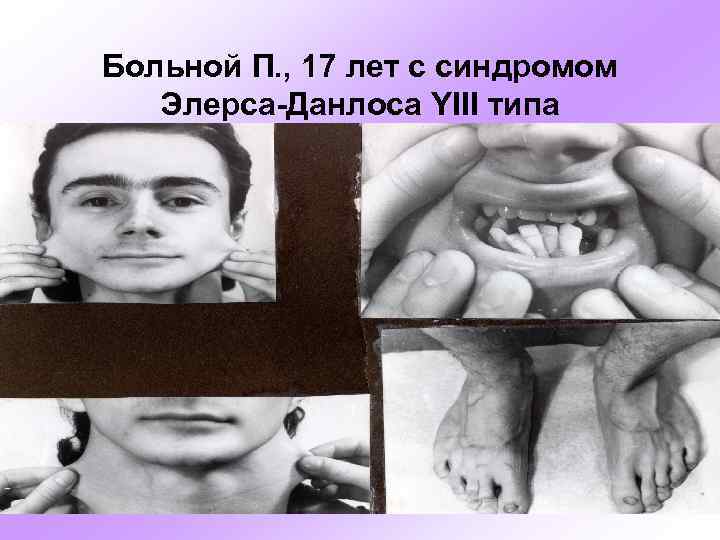
Больной П. , 17 лет с синдромом Элерса-Данлоса YIII типа

Родные сибсы с синдромом Марфана • В 95% случаев синдром Марфана вызывают мутации в гене белка фибриллина (FBN 1), (локализован на 15 q 21. 1). Фибриллин участвует в микрофибриллярной системе, обеспечивающей основу эластическим волокнам соединительной ткани
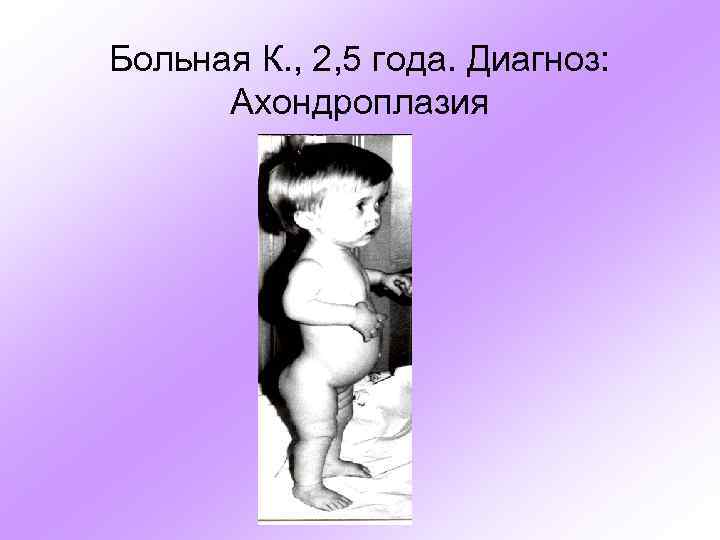
Больная К. , 2, 5 года. Диагноз: Ахондроплазия
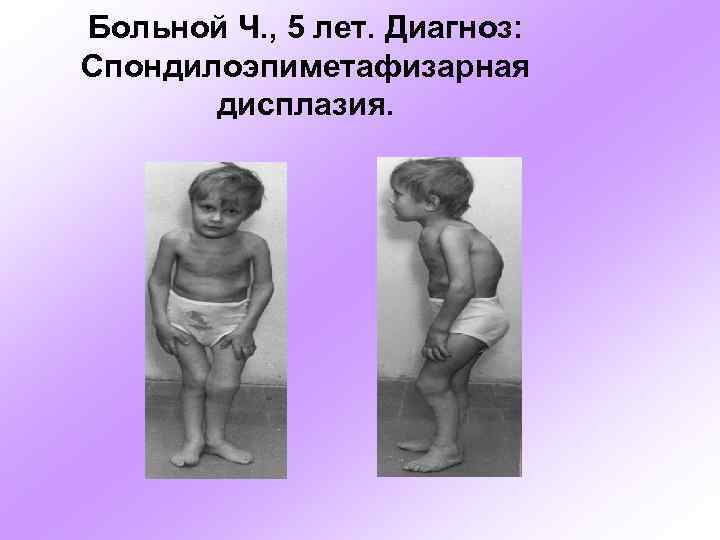
Больной Ч. , 5 лет. Диагноз: Спондилоэпиметафизарная дисплазия.

Поздняя форма спондилоэпиметафизарной дисплазии у двух родных сибсов Ю. , 21 г и П, . 16 лет. Х-сцепленный рецессивный тип наследования
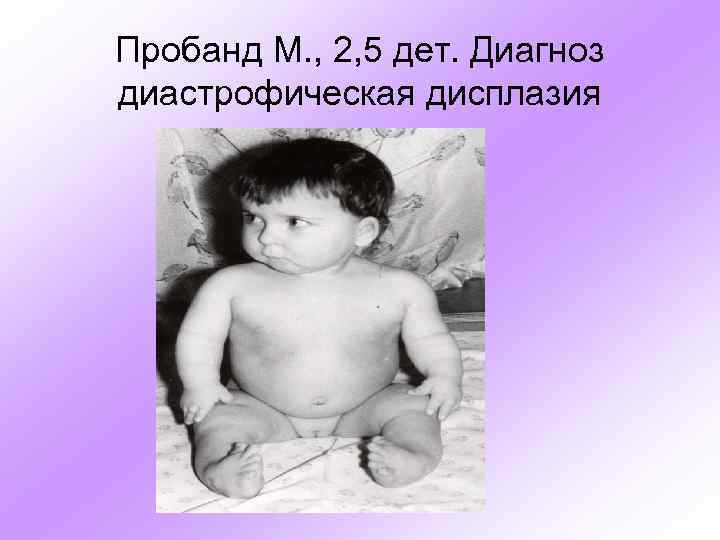
Пробанд М. , 2, 5 дет. Диагноз диастрофическая дисплазия

2_Насл_ДСТ_Баранов.ppt