ядерная физика.pptx
- Количество слайдов: 55
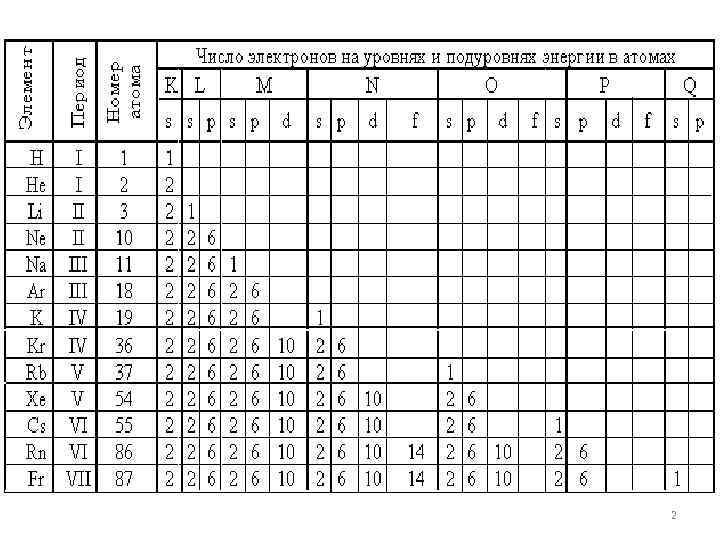
 В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или оболочку, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д. 1
В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или оболочку, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д. 1
 2
2
 Орбитальное (азимутальное) квантовое число — в квантовой физике квантовое число ℓ, определяющее форму электронное облако. Определяет подуровень энергетического уровня, задаваемого главным квантовым числом n и может принимать значения. l = 0, 1, 2, …; n-1 3
Орбитальное (азимутальное) квантовое число — в квантовой физике квантовое число ℓ, определяющее форму электронное облако. Определяет подуровень энергетического уровня, задаваемого главным квантовым числом n и может принимать значения. l = 0, 1, 2, …; n-1 3
 Кроме числовых ℓ имеет буквенные обозначения. Электроны с одинаковым значением ℓ образуют подуровень. Квантовое число ℓ определяет квантование орбитального момента количества движения электрона в сферически симметричном кулоновском поле ядра. l =01234… l =s pdf g… 4
Кроме числовых ℓ имеет буквенные обозначения. Электроны с одинаковым значением ℓ образуют подуровень. Квантовое число ℓ определяет квантование орбитального момента количества движения электрона в сферически симметричном кулоновском поле ядра. l =01234… l =s pdf g… 4
 Квантовое число ml называют магнитным. Оно определяет пространственное расположение атомной орбитали и принимает целые значения от –l до +l через нуль, то есть 2 l + 1 значений. 5
Квантовое число ml называют магнитным. Оно определяет пространственное расположение атомной орбитали и принимает целые значения от –l до +l через нуль, то есть 2 l + 1 значений. 5
 Орбитальное квантовое число Магнитное квантовое число Число орбиталей с данным значением l l ml 2 l + 1 0 (s) 0 1 1 (p) – 1, 0, +1 3 2 (d) 3 (f) – 2, – 1, 0, +1, +2 – 3, – 2, – 1, 0, 5 7 6
Орбитальное квантовое число Магнитное квантовое число Число орбиталей с данным значением l l ml 2 l + 1 0 (s) 0 1 1 (p) – 1, 0, +1 3 2 (d) 3 (f) – 2, – 1, 0, +1, +2 – 3, – 2, – 1, 0, 5 7 6
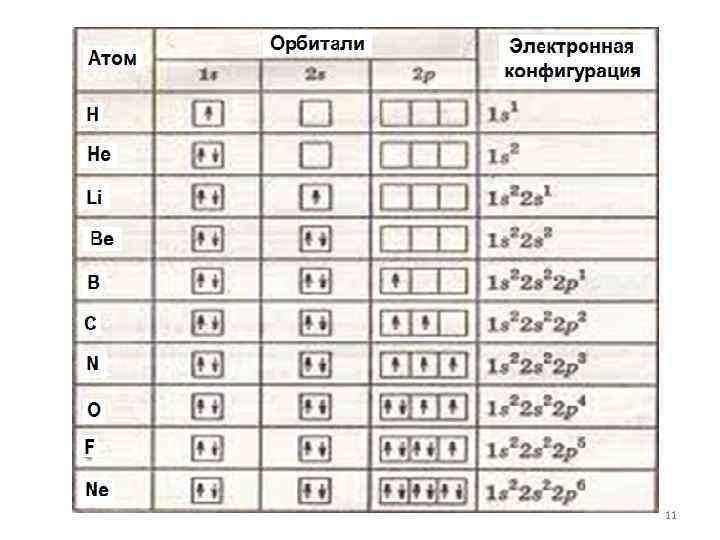
 Квантовые числа n, l и ml не полностью характеризуют состояние электрона в атоме. Экспериментально установленно, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое число ms имеет только два значения ms = ± 1/2, представляющие собой две проекции углового момента электрона на выделенную ось. Электроны с разными ms обозначаются стрелками, направленными вверх и вниз . 7
Квантовые числа n, l и ml не полностью характеризуют состояние электрона в атоме. Экспериментально установленно, что электрон имеет еще одно свойство – спин. Упрощенно спин можно представить как вращение электрона вокруг собственной оси. Спиновое квантовое число ms имеет только два значения ms = ± 1/2, представляющие собой две проекции углового момента электрона на выделенную ось. Электроны с разными ms обозначаются стрелками, направленными вверх и вниз . 7
 1907) - русский химик, педагог, разносторонний ученый. Оставил свыше 500 печатных трудов, среди которых классические "Основы химии" — первое стройное изложение неорганической химии. Автор фундаментальных исследований по химии, химической технологии, физике, метеорологии, воздухоплаванию, сельскому 6 марта 1869 хозяйству, народному просвещению и года на заседании Русского физикохимического общества профессор Н. А. Меншуткин др. прочитал доклад Менделеева "Опыт системы элементов, основанной на их атомном весе и химическом сродстве". Это была самая первая формулировка всемирно известного Периодического закона, окончательная редакция которого вышла в 1869 -1870 годах и является одним из фундаментальных 8
1907) - русский химик, педагог, разносторонний ученый. Оставил свыше 500 печатных трудов, среди которых классические "Основы химии" — первое стройное изложение неорганической химии. Автор фундаментальных исследований по химии, химической технологии, физике, метеорологии, воздухоплаванию, сельскому 6 марта 1869 хозяйству, народному просвещению и года на заседании Русского физикохимического общества профессор Н. А. Меншуткин др. прочитал доклад Менделеева "Опыт системы элементов, основанной на их атомном весе и химическом сродстве". Это была самая первая формулировка всемирно известного Периодического закона, окончательная редакция которого вышла в 1869 -1870 годах и является одним из фундаментальных 8
 Периодическая система химических элементов (табли ца Менделе ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико -химические свойства, а строки представляют 9 собой периоды, в определённой мере
Периодическая система химических элементов (табли ца Менделе ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико -химические свойства, а строки представляют 9 собой периоды, в определённой мере
 10
10
 11
11
 12
12
 К 20 -м годам XX века физики уже не сомневались в том, что атомные ядра, открытые Э. Резерфордом в 1911 г. , также как и сами атомы, имеют сложную структуру. В этом их убеждали многочисленные экспериментальные факты, накопленные к этому времени: • открытие радиоактивности, • экспериментальное доказательство ядерной модели ядра, • измерение отношения e / m для электрона, α-частицы и для ядра атома водорода, • открытие искусственной радиоактивности, • открытие ядерных реакций, 13
К 20 -м годам XX века физики уже не сомневались в том, что атомные ядра, открытые Э. Резерфордом в 1911 г. , также как и сами атомы, имеют сложную структуру. В этом их убеждали многочисленные экспериментальные факты, накопленные к этому времени: • открытие радиоактивности, • экспериментальное доказательство ядерной модели ядра, • измерение отношения e / m для электрона, α-частицы и для ядра атома водорода, • открытие искусственной радиоактивности, • открытие ядерных реакций, 13
 В настоящее время твердо установлено, что атомные ядра различных элементов состоят из двух частиц – протонов и нейтронов. 14
В настоящее время твердо установлено, что атомные ядра различных элементов состоят из двух частиц – протонов и нейтронов. 14
 По современным измерениям, положительный заряд протона в точности равен элементарному заряду e = 1, 60217733· 10– 19 Кл, то есть равен по модулю отрицательному заряду электрона. В настоящее время равенство зарядов протона и электрона проверено с точностью 10– 22. Масса mp = 1, 67262· 10– 27 кг. протона, по современным измерениям, равна 15
По современным измерениям, положительный заряд протона в точности равен элементарному заряду e = 1, 60217733· 10– 19 Кл, то есть равен по модулю отрицательному заряду электрона. В настоящее время равенство зарядов протона и электрона проверено с точностью 10– 22. Масса mp = 1, 67262· 10– 27 кг. протона, по современным измерениям, равна 15
 В ядерной физике массу частицы часто выражают в атомных единицах массы (а. е. м. ), равной 1/12 массы атома углерода с массовым числом 12: 1 а. е. м. =1. 66057 · 10 -27 кг mp = 1, 007276 · а. е. м. 16
В ядерной физике массу частицы часто выражают в атомных единицах массы (а. е. м. ), равной 1/12 массы атома углерода с массовым числом 12: 1 а. е. м. =1. 66057 · 10 -27 кг mp = 1, 007276 · а. е. м. 16
 Во многих случаях массу частицы удобно выражать в эквивалентных значениях энергии в соответствии с формулой E = mc 2. Так как 1 э. В = 1, 60218· 10– 19 Дж, в энергетических единицах масса протона равна mp = 938, 272331 Мэ. В. 17
Во многих случаях массу частицы удобно выражать в эквивалентных значениях энергии в соответствии с формулой E = mc 2. Так как 1 э. В = 1, 60218· 10– 19 Дж, в энергетических единицах масса протона равна mp = 938, 272331 Мэ. В. 17
 Нейтрон – это нейтральная частица. По современным измерениям, масса нейтрона mn = 1, 67493· 10– 27 кг = 1, 008665 а. е. м. В энергетических единицах масса нейтрона равна 939, 56563 Мэ. В. Масса нейтрона приблизительно на две электронные массы превосходит массу протона. 18
Нейтрон – это нейтральная частица. По современным измерениям, масса нейтрона mn = 1, 67493· 10– 27 кг = 1, 008665 а. е. м. В энергетических единицах масса нейтрона равна 939, 56563 Мэ. В. Масса нейтрона приблизительно на две электронные массы превосходит массу протона. 18
 Число протонов, входящих в состав атомного ядра, обозначают символом Z и называют зарядовым числом или атомным номером (это порядковый номер в периодической таблице Менделеева). Заряд ядра равен Ze, где e – элементарный заряд. Число нейтронов обозначают символом N. Общее число нуклонов (т. е. протонов и нейтронов) называют 19
Число протонов, входящих в состав атомного ядра, обозначают символом Z и называют зарядовым числом или атомным номером (это порядковый номер в периодической таблице Менделеева). Заряд ядра равен Ze, где e – элементарный заряд. Число нейтронов обозначают символом N. Общее число нуклонов (т. е. протонов и нейтронов) называют 19
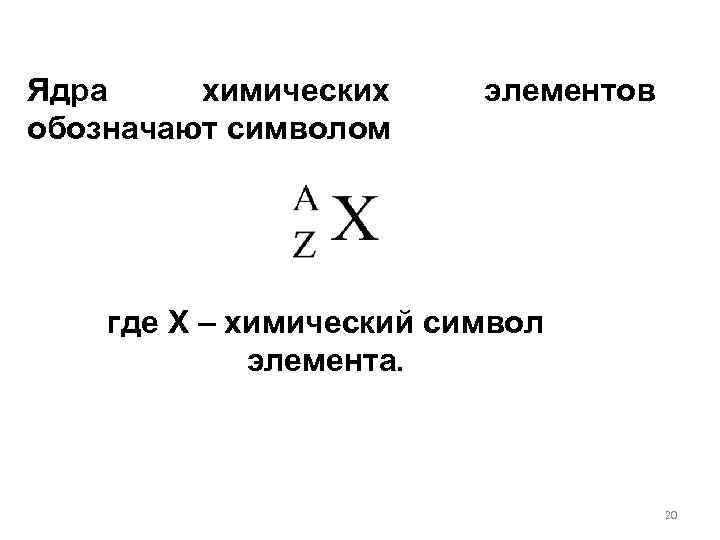 Ядра химических обозначают символом элементов где X – химический символ элемента. 20
Ядра химических обозначают символом элементов где X – химический символ элемента. 20
 Энергия связи ядра равна минимальной энергии, которую необходимо затратить для полного расщепления ядра на отдельные частицы. Из закона сохранения энергии следует, что энергия связи равна той энергии, которая выделяется при образовании ядра из отдельных частиц. Энергию связи любого ядра можно определить с помощью точного измерения его массы. 21
Энергия связи ядра равна минимальной энергии, которую необходимо затратить для полного расщепления ядра на отдельные частицы. Из закона сохранения энергии следует, что энергия связи равна той энергии, которая выделяется при образовании ядра из отдельных частиц. Энергию связи любого ядра можно определить с помощью точного измерения его массы. 21
 22
22
 По дефекту массы можно определить с помощью формулы Эйнштейна E = mc 2 энергию, выделившуюся при образовании данного ядра, т. е. энергию связи ядра Eсв: Eсв = ΔMc 2 = (Zmp + Nmn – Mя)c 2. Эта энергия выделяется при образовании ядра в виде излучения квантов. 23
По дефекту массы можно определить с помощью формулы Эйнштейна E = mc 2 энергию, выделившуюся при образовании данного ядра, т. е. энергию связи ядра Eсв: Eсв = ΔMc 2 = (Zmp + Nmn – Mя)c 2. Эта энергия выделяется при образовании ядра в виде излучения квантов. 23
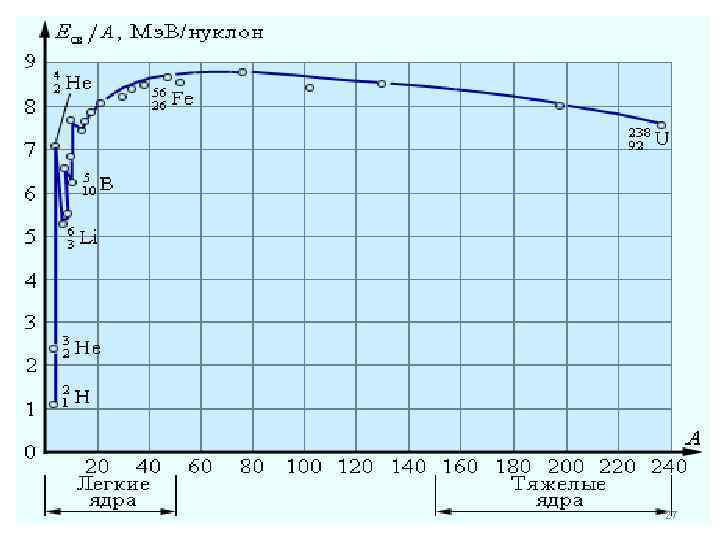
 В таблицах принято указывать удельную энергию связи, т. е. энергию связи на один нуклон. Удельная энергия связи нуклонов у разных атомных ядер неодинакова. Уменьшение удельной энергии связи при переходе к тяжелым элементам объясняется увеличением энергии кулоновского отталкивания протонов. В тяжелых ядрах связь между нуклонами ослабевает, а сами ядра 24
В таблицах принято указывать удельную энергию связи, т. е. энергию связи на один нуклон. Удельная энергия связи нуклонов у разных атомных ядер неодинакова. Уменьшение удельной энергии связи при переходе к тяжелым элементам объясняется увеличением энергии кулоновского отталкивания протонов. В тяжелых ядрах связь между нуклонами ослабевает, а сами ядра 24
 Устойчивыми с энергетической точки зрения являются ядра элементов средней части таблицы Менделеева ( с массовым числом 40 – 60 , то есть от кальция до хрома ). Ядра химических элементов, у которых число протонов или число нейтронов равно одному из магических чисел – 2, 8, 20, 28, 50, 82, 126 – называются магическими ядрами. Они – наиболее устойчивые. Особенно стабильны дважды магические ядра, у которых и число протонов и число нейтронов – магические. Таких элементов всего пять: 25
Устойчивыми с энергетической точки зрения являются ядра элементов средней части таблицы Менделеева ( с массовым числом 40 – 60 , то есть от кальция до хрома ). Ядра химических элементов, у которых число протонов или число нейтронов равно одному из магических чисел – 2, 8, 20, 28, 50, 82, 126 – называются магическими ядрами. Они – наиболее устойчивые. Особенно стабильны дважды магические ядра, у которых и число протонов и число нейтронов – магические. Таких элементов всего пять: 25
 Существуют две возможности получения положительного энергетического выхода при ядерных превращениях: 1) деление тяжелых ядер на более легкие (цепная ядерная реакция); 2) слияние легких ядер в более тяжелые (термоядерный синтез). В обоих этих процессах выделяется огромное количество энергии. 26
Существуют две возможности получения положительного энергетического выхода при ядерных превращениях: 1) деление тяжелых ядер на более легкие (цепная ядерная реакция); 2) слияние легких ядер в более тяжелые (термоядерный синтез). В обоих этих процессах выделяется огромное количество энергии. 26
 27
27
 Отметим, что величина энергии связи, приходящаяся на один нуклон для наиболее устойчивых ядер составляет 8, 7 Мэ. В, а у тяжелых элементов она равна 7, 6 Мэв. Для сравнения: энергия связи валентных электронов в атомах 10 э. В ( На 6 порядков меньше !!!) 28
Отметим, что величина энергии связи, приходящаяся на один нуклон для наиболее устойчивых ядер составляет 8, 7 Мэ. В, а у тяжелых элементов она равна 7, 6 Мэв. Для сравнения: энергия связи валентных электронов в атомах 10 э. В ( На 6 порядков меньше !!!) 28
 В настоящее время оба процесса осуществлены практически. При сгорании 1 кг угля выделяется 5 э. В, в ядерной цепной реакции ~ 240 Мэв, при термоядерном синтезе получаем 29
В настоящее время оба процесса осуществлены практически. При сгорании 1 кг угля выделяется 5 э. В, в ядерной цепной реакции ~ 240 Мэв, при термоядерном синтезе получаем 29
 Цепная ядерная реакция 30
Цепная ядерная реакция 30
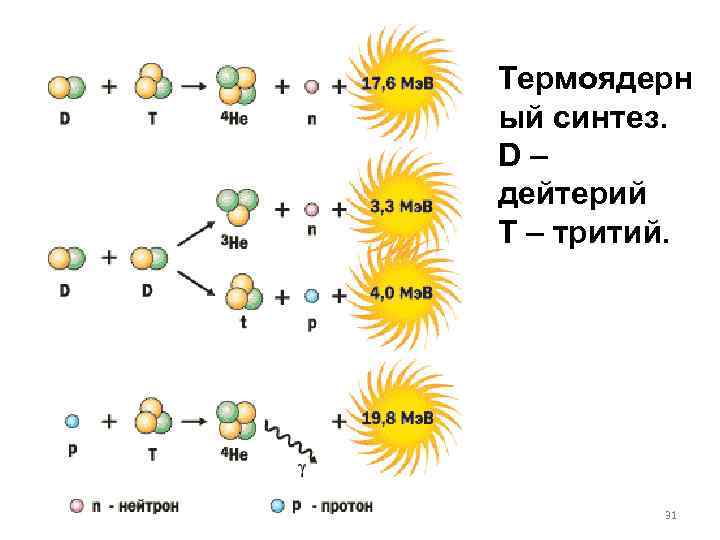 Термоядерн ый синтез. D – дейтерий Т – тритий. 31
Термоядерн ый синтез. D – дейтерий Т – тритий. 31
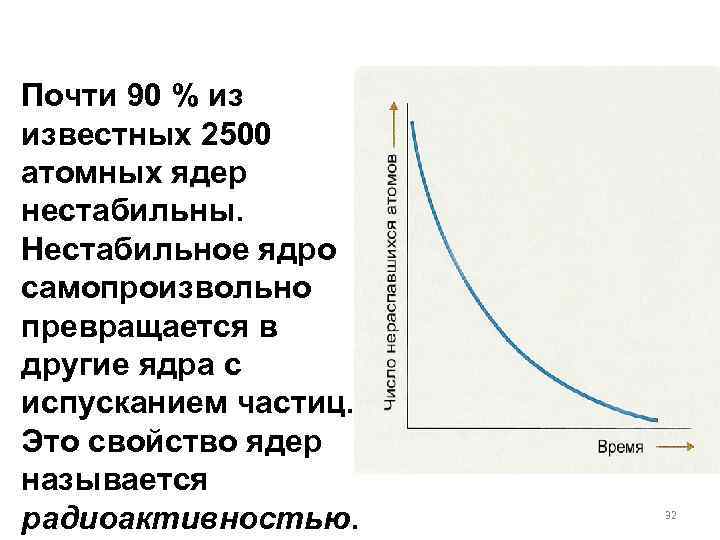 Почти 90 % из известных 2500 атомных ядер нестабильны. Нестабильное ядро самопроизвольно превращается в другие ядра с испусканием частиц. Это свойство ядер называется радиоактивностью. 32
Почти 90 % из известных 2500 атомных ядер нестабильны. Нестабильное ядро самопроизвольно превращается в другие ядра с испусканием частиц. Это свойство ядер называется радиоактивностью. 32
 Радиоактивный распад имеет случайный характер и не зависит от внешних условий. Закон убывания количества N(t) нераспавшихся к данному моменту времени t ядер служит статистической характеристикой процесса радиоактивного распада. N 0 – число нераспавшихся частиц в начальный момент времени, λ – постоянная радиоактивного распада, которая характеризует вероятность распада ядра в единицу времени. 33
Радиоактивный распад имеет случайный характер и не зависит от внешних условий. Закон убывания количества N(t) нераспавшихся к данному моменту времени t ядер служит статистической характеристикой процесса радиоактивного распада. N 0 – число нераспавшихся частиц в начальный момент времени, λ – постоянная радиоактивного распада, которая характеризует вероятность распада ядра в единицу времени. 33
 За время = 1 / λ количество нераспавшихся ядер уменьшится в e ≈ 2, 7 раза. Величину называют средним временем жизни радиоактивного ядра. Для практического использования закон радиоактивного распада удобно записать в другом виде, используя в качестве основания число 2, а не e: 34
За время = 1 / λ количество нераспавшихся ядер уменьшится в e ≈ 2, 7 раза. Величину называют средним временем жизни радиоактивного ядра. Для практического использования закон радиоактивного распада удобно записать в другом виде, используя в качестве основания число 2, а не e: 34
 Величина T называется периодом полураспада. За время T распадается половина первоначального количества радиоактивных ядер. Величины T и связаны соотношением: 35
Величина T называется периодом полураспада. За время T распадается половина первоначального количества радиоактивных ядер. Величины T и связаны соотношением: 35
 Впервые явление радиоактивности наблюдал А. Беккерель в 1896 г. при изучении люминисценции солей урана. М. Кюри и П. Кори в дальнейшем выделили два новых элемента . Существуют три вида радиоактивных распада: - распад, - распад и распад. 36
Впервые явление радиоактивности наблюдал А. Беккерель в 1896 г. при изучении люминисценции солей урана. М. Кюри и П. Кори в дальнейшем выделили два новых элемента . Существуют три вида радиоактивных распада: - распад, - распад и распад. 36
 Антуан Анри Беккерель ( Antoine Henri Becquerel; 1852 -1908) — французский физик, лауреат Нобелевской премии по физике (1903) и один из первооткрывателей радиоактивности. В 1896 г. Беккерель открыл радиоактивность во время работ по исследованию фосфоресценции в солях урана. Нобелевскую премию по физике «В знак признания его выдающихся заслуг, выразившихся в открытии самопроизвольной радиоактивности» А. Беккерель Изображение фотопластинки Беккереля, которая была получил солей урана. Ясно видна тень засвечена излучением совместно с Пьером и Марией Кюри. металлического мальтийского креста, помещённого между пластинкой и солью урана. 37
Антуан Анри Беккерель ( Antoine Henri Becquerel; 1852 -1908) — французский физик, лауреат Нобелевской премии по физике (1903) и один из первооткрывателей радиоактивности. В 1896 г. Беккерель открыл радиоактивность во время работ по исследованию фосфоресценции в солях урана. Нобелевскую премию по физике «В знак признания его выдающихся заслуг, выразившихся в открытии самопроизвольной радиоактивности» А. Беккерель Изображение фотопластинки Беккереля, которая была получил солей урана. Ясно видна тень засвечена излучением совместно с Пьером и Марией Кюри. металлического мальтийского креста, помещённого между пластинкой и солью урана. 37
 В магнитном поле поток радиоактивного излучения распадается на 3 составляющих: альфа- лучи, бета-лучи и гамма-лучи. 38
В магнитном поле поток радиоактивного излучения распадается на 3 составляющих: альфа- лучи, бета-лучи и гамма-лучи. 38
 Альфа-распадом называется самопроизвольное превращение атомного ядра с числом протонов Z и нейтронов N в другое (дочернее) ядро, содержащее число протонов Z – 2 и нейтронов N – 2. При этом испускается α-частица – ядро атома гелия. Примером такого процесса может служить α-распад радия: 39
Альфа-распадом называется самопроизвольное превращение атомного ядра с числом протонов Z и нейтронов N в другое (дочернее) ядро, содержащее число протонов Z – 2 и нейтронов N – 2. При этом испускается α-частица – ядро атома гелия. Примером такого процесса может служить α-распад радия: 39
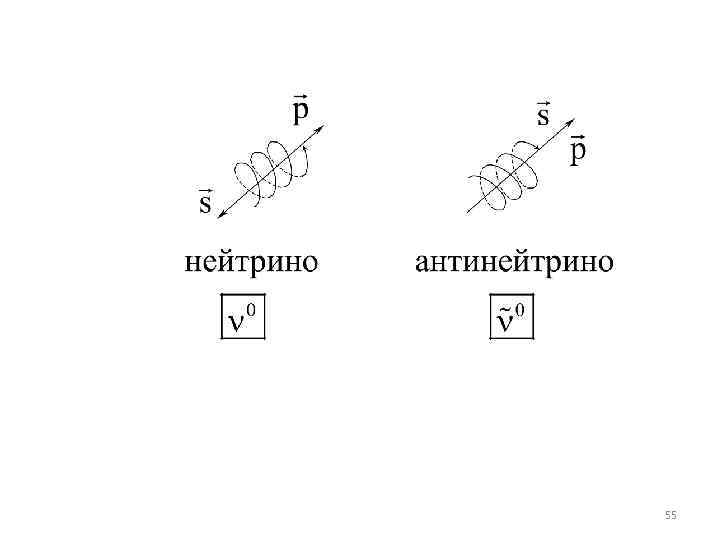
 При бета-распаде из ядра вылетает электрон. Внутри ядер электроны существовать не могут, они возникают при β-распаде в результате превращения нейтрона в протон. Этот процесс может происходить не только внутри ядра, но и со свободными нейтронами. Среднее время жизни свободного нейтрона составляет около 15 минут. При распаде нейтрон превращается в протон и электрон. В процессе распада нейтрона возникает частица, которая называется электронным антинейтрино 40
При бета-распаде из ядра вылетает электрон. Внутри ядер электроны существовать не могут, они возникают при β-распаде в результате превращения нейтрона в протон. Этот процесс может происходить не только внутри ядра, но и со свободными нейтронами. Среднее время жизни свободного нейтрона составляет около 15 минут. При распаде нейтрон превращается в протон и электрон. В процессе распада нейтрона возникает частица, которая называется электронным антинейтрино 40
 В отличие от α- и βрадиоактивности радиоактивность ядер не связана с изменением внутренней структуры ядра и не сопровождается изменением зарядового или массового чисел. Как при α-, так и при β-распаде дочернее ядро может оказаться в некотором возбужденном состоянии и иметь избыток энергии. Переход ядра из возбужденного состояния в основное сопровождается испусканием одного или нескольких 41
В отличие от α- и βрадиоактивности радиоактивность ядер не связана с изменением внутренней структуры ядра и не сопровождается изменением зарядового или массового чисел. Как при α-, так и при β-распаде дочернее ядро может оказаться в некотором возбужденном состоянии и иметь избыток энергии. Переход ядра из возбужденного состояния в основное сопровождается испусканием одного или нескольких 41
 42
42
 Пьер Кюри (Pierre Curie; 1859— 1906) — французский учёный-физик, один из первых исследователей радиоактивности, член Французской Академии наук, лауреат Нобелевской премии по физике (1903). В 1880 г. открыл пьезоэлектрический эффект — возникновение поляризации диэлектрика под действием механических напряжений. Обратный эффект - возникновение механических деформаций под Полоний (не имеет стабильных изотопов) открыт в 1898 действием электрического поля (используется в г. , применяется для изготовления компактных и очень мощных «кварцевых часах» ). нейтронных источников, источников тепла для автономных установок. Полоний-210 высокотоксичен, имеет период полураспада 138 дней и 9 часов. (Облучение экипажа подводной лодки К 27 в 1968 г. , в течение нескольких дней погибло восемь человек. Смерть Александра Литвиненко в 2006 г. предположительно в результате отравления полонием-210). Радий — обладает высокой химической активностью, радиоактивен; наиболее устойчив нуклид 226 Ra(период полураспада около 1600 лет). За прошедшее с момента его открытия время во всём мире удалось добыть всего только 1, 5 кг чистого радия. Радий иногда используют в компактных источниках нейтронов. В медицине радий используют как источник радона для 43
Пьер Кюри (Pierre Curie; 1859— 1906) — французский учёный-физик, один из первых исследователей радиоактивности, член Французской Академии наук, лауреат Нобелевской премии по физике (1903). В 1880 г. открыл пьезоэлектрический эффект — возникновение поляризации диэлектрика под действием механических напряжений. Обратный эффект - возникновение механических деформаций под Полоний (не имеет стабильных изотопов) открыт в 1898 действием электрического поля (используется в г. , применяется для изготовления компактных и очень мощных «кварцевых часах» ). нейтронных источников, источников тепла для автономных установок. Полоний-210 высокотоксичен, имеет период полураспада 138 дней и 9 часов. (Облучение экипажа подводной лодки К 27 в 1968 г. , в течение нескольких дней погибло восемь человек. Смерть Александра Литвиненко в 2006 г. предположительно в результате отравления полонием-210). Радий — обладает высокой химической активностью, радиоактивен; наиболее устойчив нуклид 226 Ra(период полураспада около 1600 лет). За прошедшее с момента его открытия время во всём мире удалось добыть всего только 1, 5 кг чистого радия. Радий иногда используют в компактных источниках нейтронов. В медицине радий используют как источник радона для 43
 Мария Склодовская-Кюри ( Marie Curie, 1867 — 1934) — ольско-французский п учёный-экспериментатор (физик, химик), педагог, общественный деятель. Склодовская-Кюри стала первым (и на сегодняшний день единственной женщиной в мире) дважды лауреатом совместных исследованиях явлений радиации» (1903) Нобелевской премии: по физике «за и химии «за выдающиеся заслуги в развитии химии: выдающиеся заслуги в открытие элементов радия и полония, выделение радия и изучение природы и соединений этого замечательного элемента» (1911). М. Кюри стала первой в истории Сорбонны женщинойпреподавателем, была членом 85 научных обществ всего мира, в том числе Французской медицинской академии, получила 20 почетных степеней, принимала участие в престижных Сольвеевских конгрессах по физике, в течение 12 лет была сотрудником 44
Мария Склодовская-Кюри ( Marie Curie, 1867 — 1934) — ольско-французский п учёный-экспериментатор (физик, химик), педагог, общественный деятель. Склодовская-Кюри стала первым (и на сегодняшний день единственной женщиной в мире) дважды лауреатом совместных исследованиях явлений радиации» (1903) Нобелевской премии: по физике «за и химии «за выдающиеся заслуги в развитии химии: выдающиеся заслуги в открытие элементов радия и полония, выделение радия и изучение природы и соединений этого замечательного элемента» (1911). М. Кюри стала первой в истории Сорбонны женщинойпреподавателем, была членом 85 научных обществ всего мира, в том числе Французской медицинской академии, получила 20 почетных степеней, принимала участие в престижных Сольвеевских конгрессах по физике, в течение 12 лет была сотрудником 44
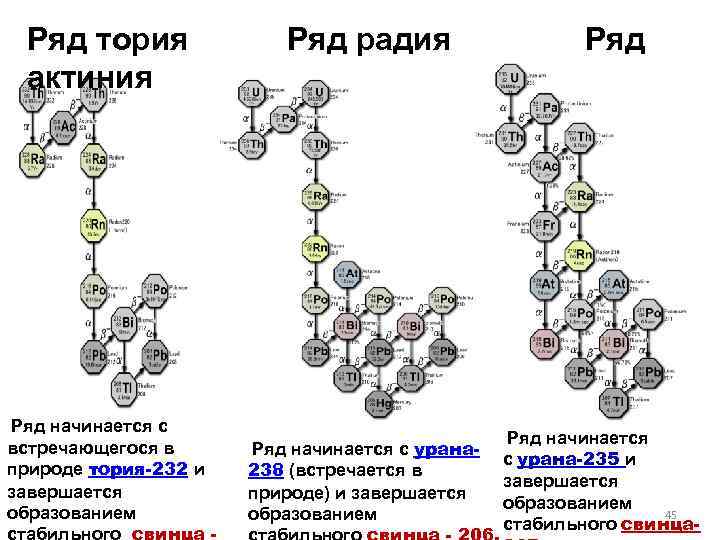 Ряд тория Ряд радия Ряд актиния Ряд начинается с встречающегося в природе тория-232 и завершается образованием Ряд начинается с урана 238 (встречается в природе) и завершается образованием Ряд начинается с урана-235 и завершается образованием 45 стабильного свинца-
Ряд тория Ряд радия Ряд актиния Ряд начинается с встречающегося в природе тория-232 и завершается образованием Ряд начинается с урана 238 (встречается в природе) и завершается образованием Ряд начинается с урана-235 и завершается образованием 45 стабильного свинца-
 46
46
 47
47
 48
48
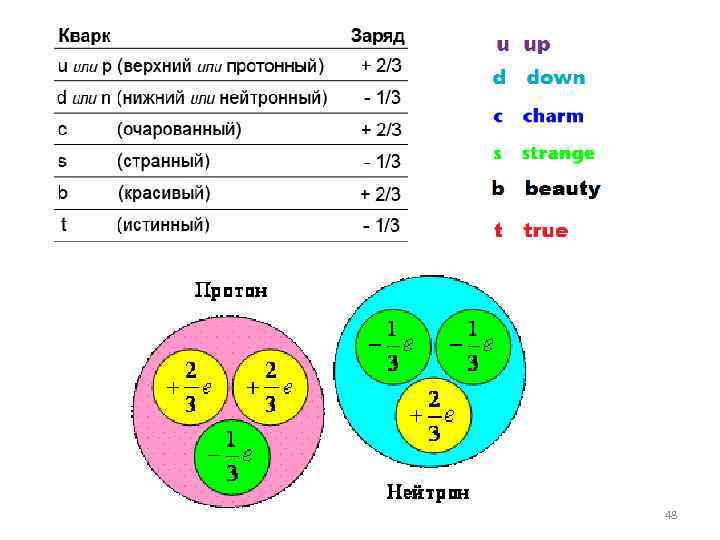
 Кварк Название Масса Заряд u up от 1. 5 до 5 Мэ. В d down от 3 до 9 Мэ. В -1/3 s strange от 60 до 170 Мэ. В -1/3 c charm от 1. 1 до 1. 4 Гэ. В 2/3 b bottom от 4. 1 до 4. 4 Гэ. В -1/3 t top от 168 до 178 Гэ. В 2/3 49
Кварк Название Масса Заряд u up от 1. 5 до 5 Мэ. В d down от 3 до 9 Мэ. В -1/3 s strange от 60 до 170 Мэ. В -1/3 c charm от 1. 1 до 1. 4 Гэ. В 2/3 b bottom от 4. 1 до 4. 4 Гэ. В -1/3 t top от 168 до 178 Гэ. В 2/3 49
 50
50
 51
51
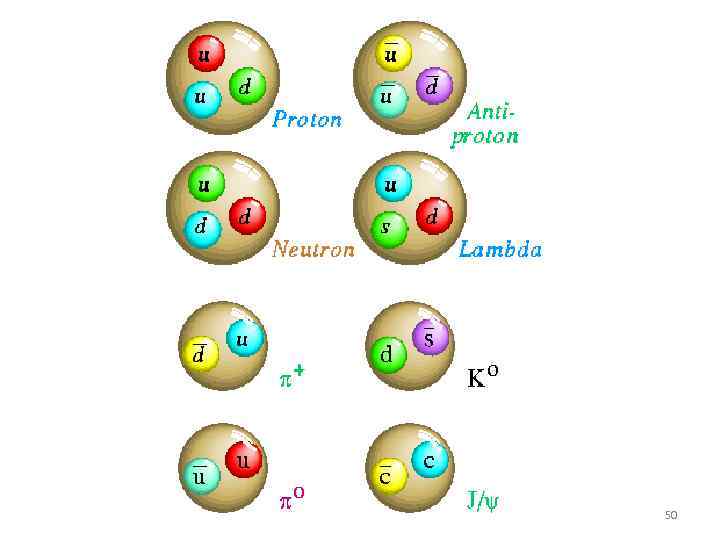
 Некоторые реакции с участием элементарных частиц. 52
Некоторые реакции с участием элементарных частиц. 52
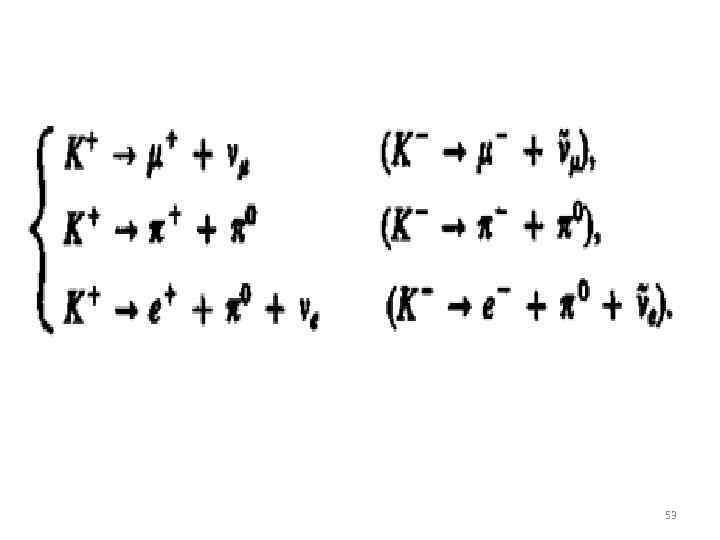 53
53
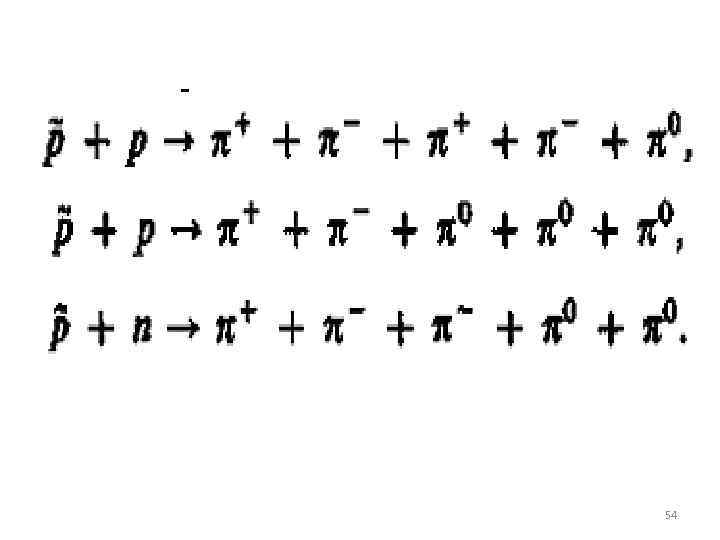 54
54
 55
55


