лекция_контакты_молек_физиол_2014_осень.ppt
- Количество слайдов: 39

В целостном многоклеточном организме клетки должны быть связаны между собой. Механизмы когезии определяют: архитектуру тела обмен сигналами прикрепление к соседним клеткам и к внеклеточному матриксу ориентацию внутренних структур миграцию клеток - участвуют во всех проявлениях организации, функционирования и динамики многоклеточных организмов.

Два основных способа прикрепления животных клеток другу.
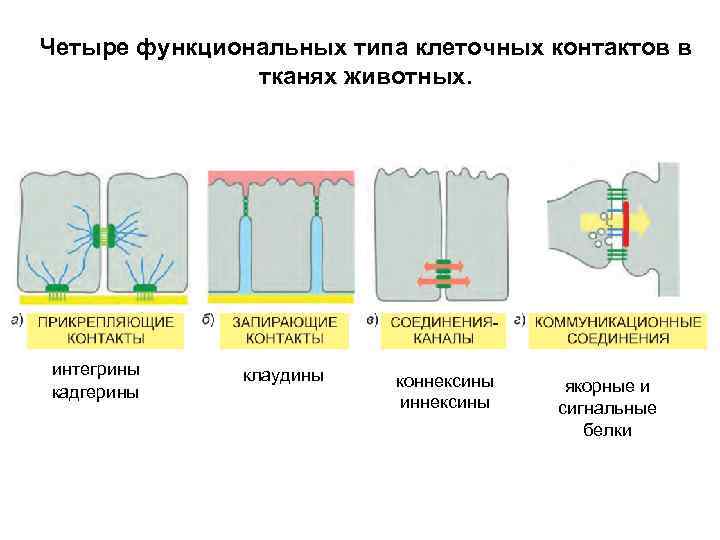
Четыре функциональных типа клеточных контактов в тканях животных. интегрины кадгерины клаудины коннексины иннексины якорные и сигнальные белки

Прикрепляющие контакты

Запирающие соединения

Каналообразующие соединения

Коммуникационные соединения 1. Химические синапсы (в нервной системе) 2. Иммунные синапсы (в иммунной системе) 3. Передача сигнала между клетками через взаимодействие лиганда с рецептором (Delta. Notch, ephrin-Eph и т. п. ). Прикрепляющие, запирающие и каналообразующие соединения, помимо структурной роли, могут выполнять еще и сигнальную функцию

типы соединений, различимые в электронный микроскоп на срезе зрелого эпителия

4 типа межклеточных контактов: Плотные контакты Адгезионные контакты Десмосомы Щелевые контакты центральную роль играют трансмембранные белки адгезии, пронизывающие мембрану, один конец которых связан внутри клетки с ее цитоскелетом, а другой — с некоторой структурой вне ее Это 2 суперсемейства кадгерины и интегрины

Трансмембранные белки адгезии связывают цитоскелет с внеклеточными структурами.

Прикрепительные контакты Межклеточные контакты Адгезионное соединение Контакты клетки и матрикса Фокальные контакты клетки с матриксом Полудесмосома Десмосома Структуры цитоскелета Актиновые филаменты Промежуточные филаменты

Прикрепляющие контакты соединение белок адгезии лиганд присоединение якорный белок

Суперсемейство кадгеринов 180 белков человека Классические кадгерины E-кадгерин N-кадгерин P-кадгерин и др. Неклассические кадгерины протокадгерины десмоколлины десмоглеины T-кадгерин Fat и Flamingo

внеклеточную часть, состоящую из нескольких копий последовательности, называют кадгериновым доменом. У классических она включает 5 таких повторов, у десмоглеинов и десмоколлинов — 4 или 5, у некоторых неклассических кадгеринов превышает 30.

Локализация Участие в соединениях Фенотип мышей при инактивации

Локализация Участие в соединениях Фенотип мышей при инактивации

кадгерины опосредуют гомофильную адгезию

Внеклеточная часть каждого полипептида состоит из ряда компактных доменов, соединенных гибкими шарнирными участками. Ион кальция вязывается в окрестности каждого шарнира, предотвращая его сгибание. В отсутствие Ca 2+ молекула становится недостаточно жесткой, и межклеточный контакт не образуется

Обычно молекулы кадгерина выстраиваются параллельно друг к другу, соединяя клетки по принципу застежки- «липучки» .

Клетки, взятые из разных частей раннего эмбриона земноводного, расслаиваются согласно своему происхождению
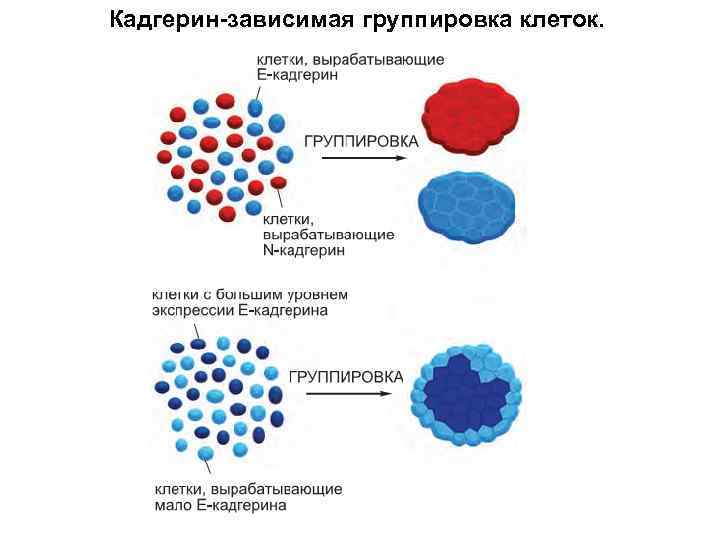
Кадгерин-зависимая группировка клеток.

Участие якорных белков (катенинов) в адгезии Кадгерины напрямую крепятся к актиновым филаментам с помощью β-катенина и других якорных белков. α-катенин, винкулин и лакоглобин (белок, родственный β-катенину, его также называют γ-катенином), возможно, тоже присутствуют в этом комплексе либо принимают участие в его сборке. Детали этого процесса не ясны. Другой внутриклеточный белок, p 120 -катенин, также связывается с цитоплазматическим доменом кадгерина и регулирует функцию последнего
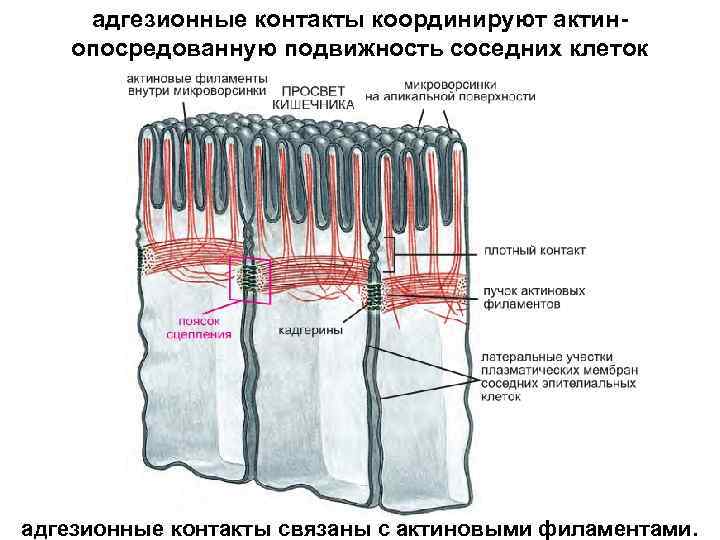
адгезионные контакты координируют актинопосредованную подвижность соседних клеток адгезионные контакты связаны с актиновыми филаментами.
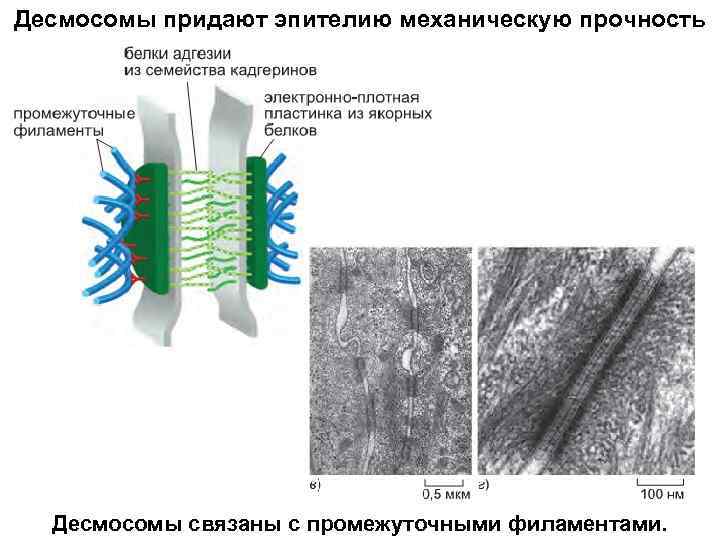
Десмосомы придают эпителию механическую прочность Десмосомы связаны с промежуточными филаментами.

Молекулярные компоненты десмосомы. Десмоглеин и десмоколлин — представители кадгеринового семейства белков адгезии. Их цитоплазматические концы связываются с плакоглобином (γ-катенином) и плакофилином (дальний родственник p 120 -катенина), который, в свою очередь, связан с десмоплакином, который связывается с боковыми поверхностями промежуточных филаментов, закрепляя их на десмосоме.

Селектины опосредуют временные межклеточные контакты в кровяном потоке Структура Р-селектина Селектины - поверхностные углеводсвязывающие белки (лектины), участвуют различные временные межклеточные адгезионные взаимодействия в кровотоке. Их основная роль участие в воспалительной реакции и в управлении движением лейкоцитов. Селектины контролируют связывание лейкоцитов с клетками эндотелия, выстилающими кровяные сосуды, тем самым позволяя клеткам крови покидать кровяное русло и внедряться в ткань.

Селектины эндотелиальных клеток связываются с олигосахаридами на поверхности белой клетки крови, в результате чего она непрочно прикрепляется к стенке сосуда. Затем в плазматической мембране лейкоцита активируется интегрин (обычно это интегрин LFA 1). Теперь этот интегрин может связаться с белком-иммуноглобулином ICAM 1 на мембране эндотелиальной клетки. Эта более прочная связь позволяет лейкоциту покинуть кровяное русло

Иммуноглобулины участвуют в Ca 2+-независимой межклеточной адгезии Основные белки эндотелиальных клеток, которые распознают интегрины лейкоцитов, носят название ICAM (intercellular cell adhesion molecules, межклеточные белки клеточной адгезии) и v. CAM (vascular cell adhesion molecules, белки адгезии клеток сосудов).

в формировании синапса участвуют многие молекулы клеточной адгезии белок Fasciclin 2, родственный NCAM, определяет направление роста аксона и управляет образованием специфических нервных соединений; Fasciclin 3, позволяет конусам роста нейронов приближении к своим целям успешно их распознавать кадгерины, как правило, сконцентрированы точечно на периферии синапса, а также непосредственно в области взаимодействия мембран. В клетках нервной системы позвоночных вырабатывается около 20 различных классических кадгеринов, причем в разных субпопуляциях нейронов они представлены в различных комбинациях центральная роль в связывании молекул адгезии с другими компонентами синапса и удержание их на своем месте принадлежит белкам скэффолда.

белки скэффолда Эти внутриклеточные молекулы состоят из серии белок-связывающих доменов, включающей, как правило, несколько PDZ-доменов — сегментов длиной около 70 аминокислотных остатков, которые могут распознавать и связывать C-концевые внутриклеточные хвосты определенных трансмембранных молекул составляющих синапс. Они могут связываться друг с другом и другими молекулами скэффолда, создавая обширную сеть, объединяющую все компоненты синапса.
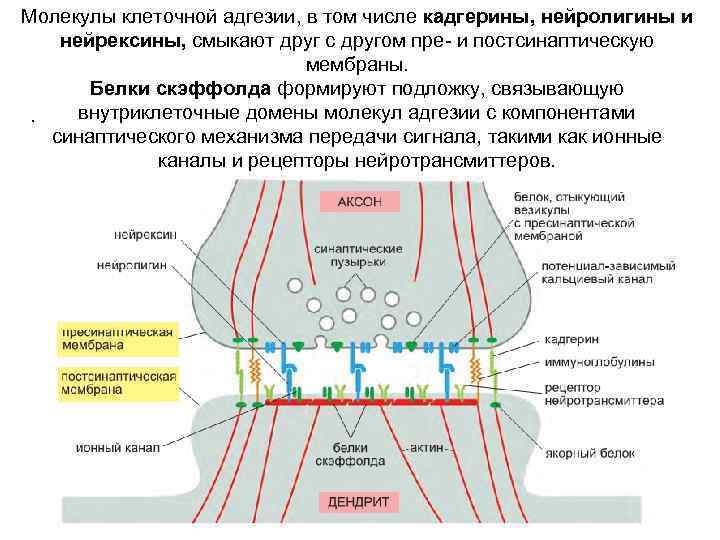
Молекулы клеточной адгезии, в том числе кадгерины, нейролигины и нейрексины, смыкают друг с другом пре- и постсинаптическую мембраны. Белки скэффолда формируют подложку, связывающую внутриклеточные домены молекул адгезии с компонентами. синаптического механизма передачи сигнала, такими как ионные каналы и рецепторы нейротрансмиттеров.
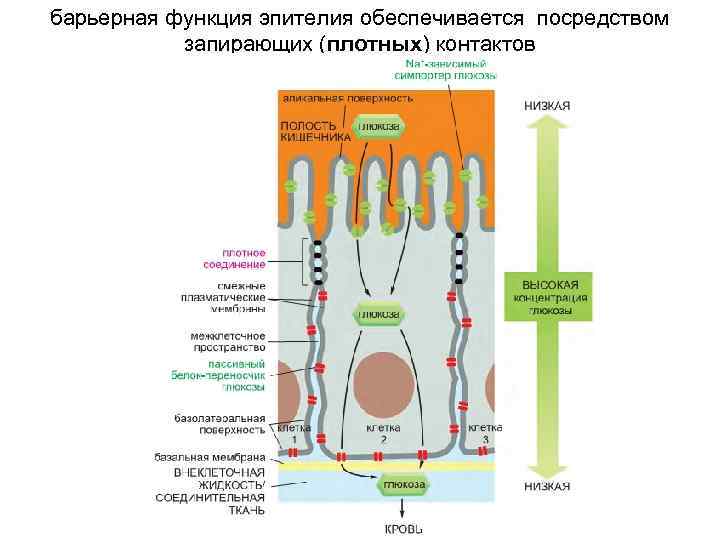
барьерная функция эпителия обеспечивается посредством запирающих (плотных) контактов
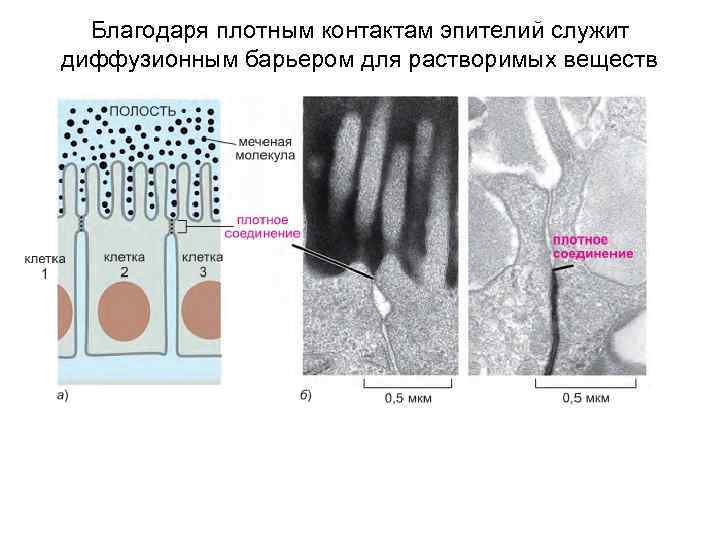
Благодаря плотным контактам эпителий служит диффузионным барьером для растворимых веществ

плотные контакты представляют собой сеть из ветвящихся герметизирующих цепочек, которая оплетает апикальный конец каждой клетки по всей его окружности

Герметизирующая цепочка плотного контакта состоит из серии трансмембранных белков адгезии К ним относятся: клаудины, окклюдин и трицеллюлин. Основными трансмембранными белками, формирующими эти волокна, являются клаудины, необходимые для образования и функционирования плотных соединений. Трицеллюлин (родственный окклюдину), необходим для сшивания мембран клеток и предотвращения утечки через эпителий. В размещении плотных соединений относительно других структур участвуют внутриклеточные белки скэффолда, принадлежащие семейству Tjp (Tight junction protein, белок плотного соединения), также называемые ZO-белки (от лат. zonula occludens — замыкающая пластинка; так иначе называется плотное соединение).
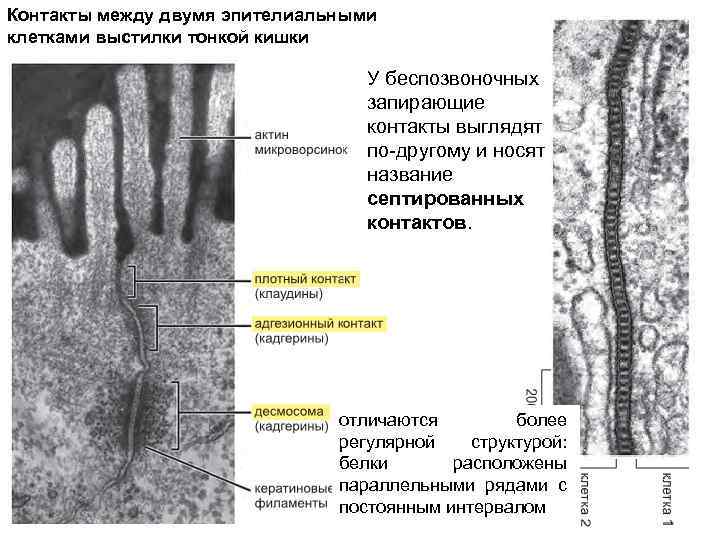
Контакты между двумя эпителиальными клетками выстилки тонкой кишки У беспозвоночных запирающие контакты выглядят по-другому и носят название септированных контактов. отличаются более регулярной структурой: белки расположены параллельными рядами с постоянным интервалом

Молекулы, необходимые для установления полярности эпителиальных клеток, это в основном три связанных с мембраной белка: Par 3, Par 6 и атипичная протеинкиназа C (a. PKC). Par 3 и Par 6 - белки скэффолда, содержащие PDZ-домены, и они связываются друг с другом и с a. PKC. Этот имеет сайты связывания различных молекул, включая малые GTPазы Rac и Cdc 42. Последние имеют большое значение. Так, например, если в группе клеток MDCK блокирована активность Rac, то клетки развиваются с обратной полярностью. Rac и Cdc 42 являются ключевыми регуляторами сборки актина.

«мостиками» через межклеточные пространства, по которым вещества могут переходить из клетки в клетку являются щелевые контакты (у животных ) и плазмодесмы (у растений ) Щелевые контакты обеспечивают электрическое и метаболическое сопряжение клеток Электронные микрофотографии щелевых контактов между фибробластами в культуре.

коннексон щелевого контакта состоит из шести трансмембранных субъединиц
лекция_контакты_молек_физиол_2014_осень.ppt