Электролиз аккум-лекция слайд.pptx
- Количество слайдов: 31
 Устройства, в которых электрическая энергия превращается в химическую, а химическая снова в электрическую, называют аккумуляторами.
Устройства, в которых электрическая энергия превращается в химическую, а химическая снова в электрическую, называют аккумуляторами.
 Процесс накопления химической энергии называется зарядом аккумулятора. Процесс превращения химической энергии в электрическую – разрядом аккумулятора.
Процесс накопления химической энергии называется зарядом аккумулятора. Процесс превращения химической энергии в электрическую – разрядом аккумулятора.
 Схема кислотного свинцового аккумулятора Pb | H 2 SO 4 || Pb. O 2. Катод(+): Pb. SO 4 + 2 H 2 O – 2ē → Pb. O 2 + 4 H+ + SO 42 Анод(-): Pb. SO 4 + 2ē → Pb + SO 42 -. Pb + Pb. O 2 + 2 H 2 SO 4 разряд заряд 2 Pb. SO 4 + 2 H 2 O.
Схема кислотного свинцового аккумулятора Pb | H 2 SO 4 || Pb. O 2. Катод(+): Pb. SO 4 + 2 H 2 O – 2ē → Pb. O 2 + 4 H+ + SO 42 Анод(-): Pb. SO 4 + 2ē → Pb + SO 42 -. Pb + Pb. O 2 + 2 H 2 SO 4 разряд заряд 2 Pb. SO 4 + 2 H 2 O.
 Электролиз Совокупность химических процессов, протекающих под действием электр. тока на электродах, погруженных в рр или р-в электролита
Электролиз Совокупность химических процессов, протекающих под действием электр. тока на электродах, погруженных в рр или р-в электролита
 Электроды “− “катод + nē восстановление “+“ анод − nē окисление Инертные (нерастворимые) электроды – графит, Pt Активные (растворимые) – Ме (Cu, Ni, Sn и др. ) Инертные электроды не окисляются Активные: Ме – nē → Меn+
Электроды “− “катод + nē восстановление “+“ анод − nē окисление Инертные (нерастворимые) электроды – графит, Pt Активные (растворимые) – Ме (Cu, Ni, Sn и др. ) Инертные электроды не окисляются Активные: Ме – nē → Меn+
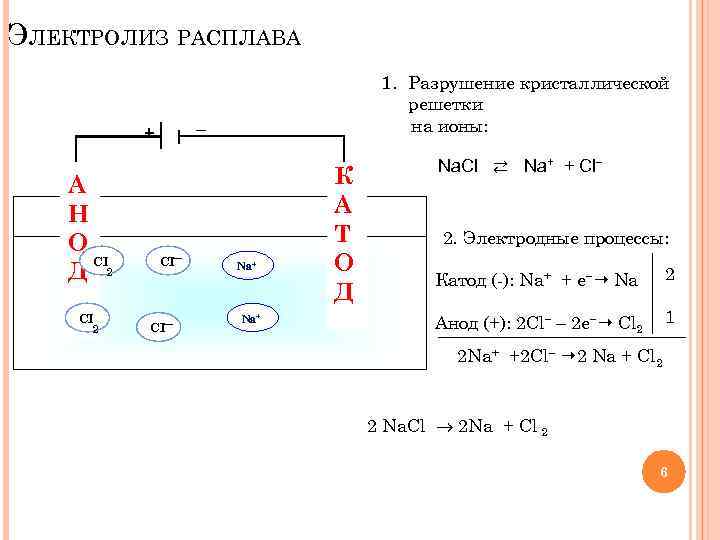 ЭЛЕКТРОЛИЗ РАСПЛАВА + А Н О CI Д 2 CI 2 1. Разрушение кристаллической решетки на ионы: CI Na+ К А Т О Д Na. Cl ⇄ Na+ + Cl 2. Электродные процессы: Катод (-): Na+ + е Na 2 Анод (+): 2 Cl 2 е Cl 2 1 2 Na+ +2 Cl 2 Na + Cl 2 2 Na. Cl 2 Na + Cl 2 6
ЭЛЕКТРОЛИЗ РАСПЛАВА + А Н О CI Д 2 CI 2 1. Разрушение кристаллической решетки на ионы: CI Na+ К А Т О Д Na. Cl ⇄ Na+ + Cl 2. Электродные процессы: Катод (-): Na+ + е Na 2 Анод (+): 2 Cl 2 е Cl 2 1 2 Na+ +2 Cl 2 Na + Cl 2 2 Na. Cl 2 Na + Cl 2 6
 Электролиз расплавов на угольных(инертных) электродах KCl ↔ K+ + Clкатод(-): K+ + 1ē = K 2 восстановление анод(+): 2 Cl- - 2ē = Cl 2 1 окисление 2 KCl 2 K + Cl 2 на катоде на аноде
Электролиз расплавов на угольных(инертных) электродах KCl ↔ K+ + Clкатод(-): K+ + 1ē = K 2 восстановление анод(+): 2 Cl- - 2ē = Cl 2 1 окисление 2 KCl 2 K + Cl 2 на катоде на аноде
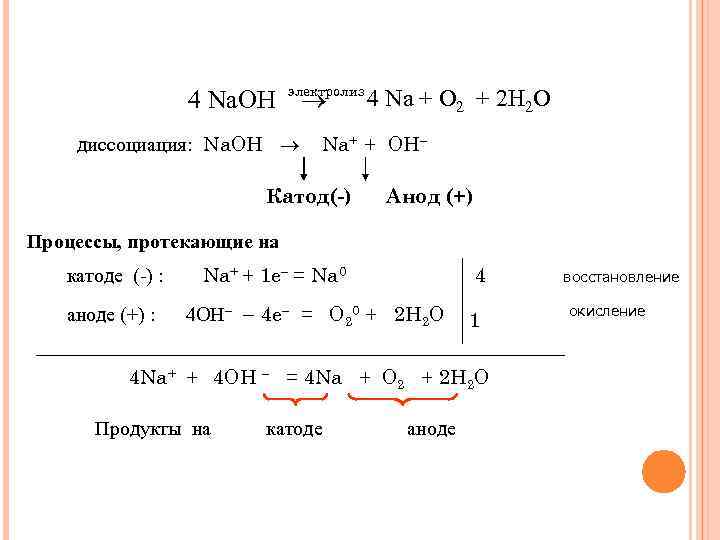 4 Na. ОН электролиз диссоциация: Na. ОН 4 Na + O 2 + 2 Н 2 O Na+ + ОН Катод(-) Анод (+) Процессы, протекающие на катоде (-) : аноде (+) : Na+ + 1 e = Na 0 4 4 ОН 4 e = О 20 + 2 Н 2 O 1 4 Na+ + 4 ОН = 4 Na + O 2 + 2 Н 2 О Продукты на катоде аноде восстановление окисление
4 Na. ОН электролиз диссоциация: Na. ОН 4 Na + O 2 + 2 Н 2 O Na+ + ОН Катод(-) Анод (+) Процессы, протекающие на катоде (-) : аноде (+) : Na+ + 1 e = Na 0 4 4 ОН 4 e = О 20 + 2 Н 2 O 1 4 Na+ + 4 ОН = 4 Na + O 2 + 2 Н 2 О Продукты на катоде аноде восстановление окисление
 Электролиз растворов с инертным анодом 1. Порядок разрядки ионов на электродах 2. Электролиз раствора Cu. Cl 2 3. Электролиз раствора Na. Cl 4. Электролиз раствора Ni. SO 4 5. Электролиз раствора Na 2 SO 4 6. Законы Фарадея
Электролиз растворов с инертным анодом 1. Порядок разрядки ионов на электродах 2. Электролиз раствора Cu. Cl 2 3. Электролиз раствора Na. Cl 4. Электролиз раствора Ni. SO 4 5. Электролиз раствора Na 2 SO 4 6. Законы Фарадея
 КАТОДНЫЕ И АНОДНЫЕ ПРОЦЕССЫ Катодные процессы Li Rb K Ba Ca Na Mg AI Mn Zn Cr Fe Co Sn Pb H Cu Hg Ag Pt Au Восстанавливаются молекулы вода: 2 H 2 O + 2 e =H 2 + 2 OH Совместное восстановление: Меn++ ne = Me 0 Восстанавливается металл Меn+ + ne = Me 0 2 H 2 O+2 e = H 2+2 OH Анодные процессы на инертном аноде Нейтральные растворы окисляются анионы: Cl Br I S 2 2 Cl – 2 e = Cl 2 Щелочные растворы не окисляются анионы: окисляются: F SO 42 NO 3 4 OH – 4 e =O 2 + 2 H 2 О
КАТОДНЫЕ И АНОДНЫЕ ПРОЦЕССЫ Катодные процессы Li Rb K Ba Ca Na Mg AI Mn Zn Cr Fe Co Sn Pb H Cu Hg Ag Pt Au Восстанавливаются молекулы вода: 2 H 2 O + 2 e =H 2 + 2 OH Совместное восстановление: Меn++ ne = Me 0 Восстанавливается металл Меn+ + ne = Me 0 2 H 2 O+2 e = H 2+2 OH Анодные процессы на инертном аноде Нейтральные растворы окисляются анионы: Cl Br I S 2 2 Cl – 2 e = Cl 2 Щелочные растворы не окисляются анионы: окисляются: F SO 42 NO 3 4 OH – 4 e =O 2 + 2 H 2 О
 СХЕМА ЭЛЕКТРОЛИЗА РАСТВОРА Сu. CI 2 + H 2 O электролиз инертные электроды Cu + CI 2 диссоциация: Cu. CI 2 Cu 2+ + 2 CI Катод(-) Анод (+) Процессы, протекающие на катоде (-) : Cu 2+ , Н 2 О: Cu 2+ + 2 e = Cu 0 1 аноде (+) : CI , Н 2 О: 1 2 CI 2 e = CI 2 восстановление окисление Cu 2+ + 2 CI = Cu + CI 2 Продукты на катоде: Cu аноде: CI 2 11
СХЕМА ЭЛЕКТРОЛИЗА РАСТВОРА Сu. CI 2 + H 2 O электролиз инертные электроды Cu + CI 2 диссоциация: Cu. CI 2 Cu 2+ + 2 CI Катод(-) Анод (+) Процессы, протекающие на катоде (-) : Cu 2+ , Н 2 О: Cu 2+ + 2 e = Cu 0 1 аноде (+) : CI , Н 2 О: 1 2 CI 2 e = CI 2 восстановление окисление Cu 2+ + 2 CI = Cu + CI 2 Продукты на катоде: Cu аноде: CI 2 11
 СХЕМА ЭЛЕКТРОЛИЗА РАСТВОРА инертные электроды 2 Na. СI + 2 электролиз H 2 O диссоциация: Nа. СI 2 Na. ОН + СI 2 + Н 2 Na+ + CI Катод(-) Анод (+) Процессы, протекающие на катоде (-) : Na+ , Н 2 О : аноде (+) : CI , Н 2 О: 2 Н 2 О + 2 e = Н 20 + 2 ОН 1 2 CI 2 e = CI 20 1 восстановление окисление 2 Н 2 О + 2 CI = Н 2 + 2 ОН + CI 2 Продукты на катоде: Н 2 , Na. ОН аноде: CI 2 12
СХЕМА ЭЛЕКТРОЛИЗА РАСТВОРА инертные электроды 2 Na. СI + 2 электролиз H 2 O диссоциация: Nа. СI 2 Na. ОН + СI 2 + Н 2 Na+ + CI Катод(-) Анод (+) Процессы, протекающие на катоде (-) : Na+ , Н 2 О : аноде (+) : CI , Н 2 О: 2 Н 2 О + 2 e = Н 20 + 2 ОН 1 2 CI 2 e = CI 20 1 восстановление окисление 2 Н 2 О + 2 CI = Н 2 + 2 ОН + CI 2 Продукты на катоде: Н 2 , Na. ОН аноде: CI 2 12
 СХЕМА ЭЛЕКТРОЛИЗА РАСТВОРА инертные электроды электролиз Ni. SO 4 + 2 H 2 O Ni + Н 2 + O 2 + Н 2 SO 4 диссоциация: Ni. SO 4 Ni 2+ + SO 42 Катод(-) Анод (+) Процессы, протекающие на катоде (-) : Ni 2+ , Н 2 О: аноде (+) : SO 42 , Н 2 О: 2 Н 2 О 4 e = О 20 + 4 Н+ восстановление Ni 2+ + 2 e = Ni 0 2 Н 2 О + 2 e = Н 20 + 2 ОН Ni + 4 Н 2 О = Ni + Н 2 + 2 ОН + O 2 + 4 Н+ 2 H 2 O Продукты на катоде: Ni, Н 2 аноде: O 2 , H 2 SO 4 2 Н 2 O 2 H+ 1 1 окисление
СХЕМА ЭЛЕКТРОЛИЗА РАСТВОРА инертные электроды электролиз Ni. SO 4 + 2 H 2 O Ni + Н 2 + O 2 + Н 2 SO 4 диссоциация: Ni. SO 4 Ni 2+ + SO 42 Катод(-) Анод (+) Процессы, протекающие на катоде (-) : Ni 2+ , Н 2 О: аноде (+) : SO 42 , Н 2 О: 2 Н 2 О 4 e = О 20 + 4 Н+ восстановление Ni 2+ + 2 e = Ni 0 2 Н 2 О + 2 e = Н 20 + 2 ОН Ni + 4 Н 2 О = Ni + Н 2 + 2 ОН + O 2 + 4 Н+ 2 H 2 O Продукты на катоде: Ni, Н 2 аноде: O 2 , H 2 SO 4 2 Н 2 O 2 H+ 1 1 окисление
 СХЕМА ЭЛЕКТРОЛИЗА РАСТВОРА электролиз 2 Na 2 SO 4 + 6 H 2 O диссоциация: 4 Na. ОН + 2 Н 2 + O 2 + 2 Н 2 SO 4 Na 2 SO 4 2 Na+ + SO 42 Катод(-) Анод (+) Процессы, протекающие на катоде (-) : Na+ , Н 2 О : аноде (+) : SO 42 , Н 2 О: 2 Н 2 О + 2 e = Н 20 + 2 ОН 2 2 Н 2 О 4 e = О 20 + 4 Н+ 1 6 Н 2 О = 2 Н 2 + 4 ОН + O 2 + 4 Н+ Продукты на катоде: Н 2 , Na. ОН аноде: O 2 , Н 2 SO 4 восстановление окисление
СХЕМА ЭЛЕКТРОЛИЗА РАСТВОРА электролиз 2 Na 2 SO 4 + 6 H 2 O диссоциация: 4 Na. ОН + 2 Н 2 + O 2 + 2 Н 2 SO 4 Na 2 SO 4 2 Na+ + SO 42 Катод(-) Анод (+) Процессы, протекающие на катоде (-) : Na+ , Н 2 О : аноде (+) : SO 42 , Н 2 О: 2 Н 2 О + 2 e = Н 20 + 2 ОН 2 2 Н 2 О 4 e = О 20 + 4 Н+ 1 6 Н 2 О = 2 Н 2 + 4 ОН + O 2 + 4 Н+ Продукты на катоде: Н 2 , Na. ОН аноде: O 2 , Н 2 SO 4 восстановление окисление
 Электролиз водного раствора Zn. SO 4 с электродами из цинка катод (Zn) Zn. SO 4 анод (Zn) ← Zn 2+ + SO 42 - → Н 2 О Zn 2+ + 2ē → Zn Znо – 2ē → Zn 2+
Электролиз водного раствора Zn. SO 4 с электродами из цинка катод (Zn) Zn. SO 4 анод (Zn) ← Zn 2+ + SO 42 - → Н 2 О Zn 2+ + 2ē → Zn Znо – 2ē → Zn 2+
 ЗАКОНЫ ФАРАДЕЯ I·t·Э m= F m – масса образовавшегося или подвергшегося превращению вещества Э – эквивалентная масса вещества I – сила тока, А t – время, с F – постоянная Фарадея: 96500 Кл/моль - при превращении одного моля эквивалентов вещества на электроде через него проходит 96500 Кл (А*с)
ЗАКОНЫ ФАРАДЕЯ I·t·Э m= F m – масса образовавшегося или подвергшегося превращению вещества Э – эквивалентная масса вещества I – сила тока, А t – время, с F – постоянная Фарадея: 96500 Кл/моль - при превращении одного моля эквивалентов вещества на электроде через него проходит 96500 Кл (А*с)
 Выход по току (η) отношение количества вещества, получаемого в данных условиях электролиза (mэ), к количеству, теоретически вычисленному на основании закона Фарадея (mт)
Выход по току (η) отношение количества вещества, получаемого в данных условиях электролиза (mэ), к количеству, теоретически вычисленному на основании закона Фарадея (mт)

 КОРРОЗИЯ МЕТАЛЛОВ – ПРОЦЕСС РАЗРУШЕНИЯ МЕТАЛЛОВ ПОД ДЕЙСТВИЕМ ОКРУЖАЮЩЕЙ СРЕДЫ Химизм процесса Me 0 – n e Men+
КОРРОЗИЯ МЕТАЛЛОВ – ПРОЦЕСС РАЗРУШЕНИЯ МЕТАЛЛОВ ПОД ДЕЙСТВИЕМ ОКРУЖАЮЩЕЙ СРЕДЫ Химизм процесса Me 0 – n e Men+
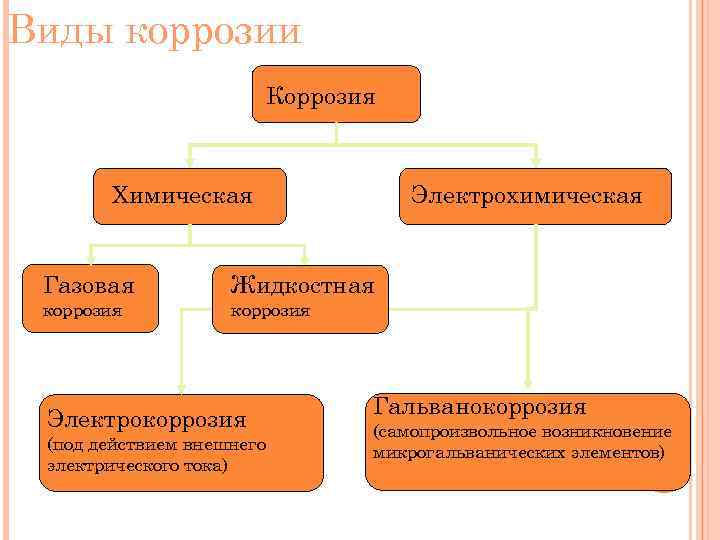 Виды коррозии Коррозия Электрохимическая Химическая Газовая Жидкостная коррозия Электрокоррозия (под действием внешнего электрического тока) Гальванокоррозия (самопроизвольное возникновение микрогальванических элементов) 20
Виды коррозии Коррозия Электрохимическая Химическая Газовая Жидкостная коррозия Электрокоррозия (под действием внешнего электрического тока) Гальванокоррозия (самопроизвольное возникновение микрогальванических элементов) 20
 ВИДЫ КОРРОЗИИ 1 вид - ХИМИЧЕСКАЯ КОРРОЗИЯ -процесс разрушения металлов под действием химических веществ окружающей среды Примеры: A) Повышенная кислотность воздуха Fe + H 2 SO 4 = Fe. SO 4 + H 2 Б) Пожары 3 Fe + 2 O 2 = Fe 3 O 4 В) Длительное воздействие кислорода воздуха во влажной среде 4 Fe +3 O 2 + 6 H 2 O = 4 Fe(OН)3
ВИДЫ КОРРОЗИИ 1 вид - ХИМИЧЕСКАЯ КОРРОЗИЯ -процесс разрушения металлов под действием химических веществ окружающей среды Примеры: A) Повышенная кислотность воздуха Fe + H 2 SO 4 = Fe. SO 4 + H 2 Б) Пожары 3 Fe + 2 O 2 = Fe 3 O 4 В) Длительное воздействие кислорода воздуха во влажной среде 4 Fe +3 O 2 + 6 H 2 O = 4 Fe(OН)3
 Контактная электрохимическая коррозия 22
Контактная электрохимическая коррозия 22
 Анодное покрытие Fe (+) K 23
Анодное покрытие Fe (+) K 23
 Катодное покрытие Fe (–) A 24
Катодное покрытие Fe (–) A 24
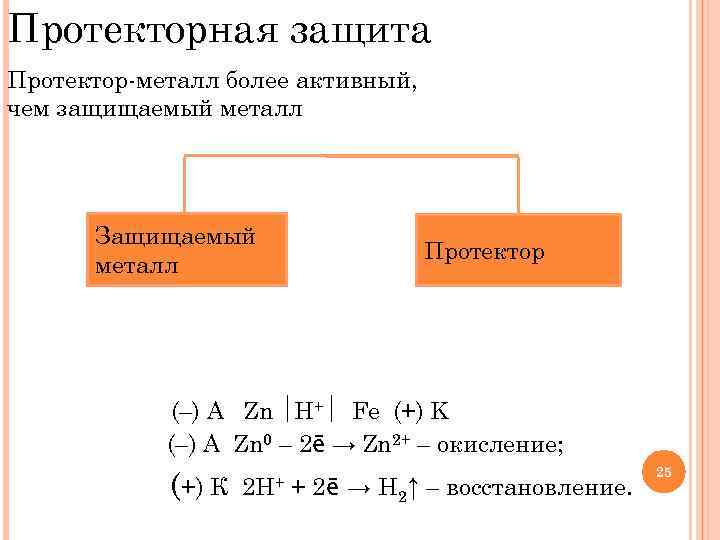 Протекторная защита Протектор-металл более активный, чем защищаемый металл Внешний проводник Защищаемый металл Fe Протектор В кислой среде E 0 Fe 2+/Fe = – 0, 44 В Zn Е 0 Zn 2+/Zn = – 0, 76 В (–) А Zn H+ Fe (+) K (–) A Zn 0 – 2ē → Zn 2+ – окисление; (+) К 2 Н+ + 2ē → Н 2↑ – восстановление. 25
Протекторная защита Протектор-металл более активный, чем защищаемый металл Внешний проводник Защищаемый металл Fe Протектор В кислой среде E 0 Fe 2+/Fe = – 0, 44 В Zn Е 0 Zn 2+/Zn = – 0, 76 В (–) А Zn H+ Fe (+) K (–) A Zn 0 – 2ē → Zn 2+ – окисление; (+) К 2 Н+ + 2ē → Н 2↑ – восстановление. 25
 Электрозащита Для защиты металла от коррозии применяется электрический ток. (–) К (+) А Защищаемый металл Металлический лом Fe. К Fe. А В среде электролита (+) А Fe 0 А – 2ē → Fe. А 2+ – окисление. (–) К Восстановление – процесс, зависящий от состава электролита. 26
Электрозащита Для защиты металла от коррозии применяется электрический ток. (–) К (+) А Защищаемый металл Металлический лом Fe. К Fe. А В среде электролита (+) А Fe 0 А – 2ē → Fe. А 2+ – окисление. (–) К Восстановление – процесс, зависящий от состава электролита. 26
 Электрозащита Для защиты металла от коррозии применяется электрический ток. (–) К (+) А Защищаемый металл Металлический лом Fe. К Fe. А В среде электролита (+) А Fe 0 А – 2ē → Fe. А 2+ – окисление. (–) К Восстановление – процесс, зависящий от состава электролита. 27
Электрозащита Для защиты металла от коррозии применяется электрический ток. (–) К (+) А Защищаемый металл Металлический лом Fe. К Fe. А В среде электролита (+) А Fe 0 А – 2ē → Fe. А 2+ – окисление. (–) К Восстановление – процесс, зависящий от состава электролита. 27
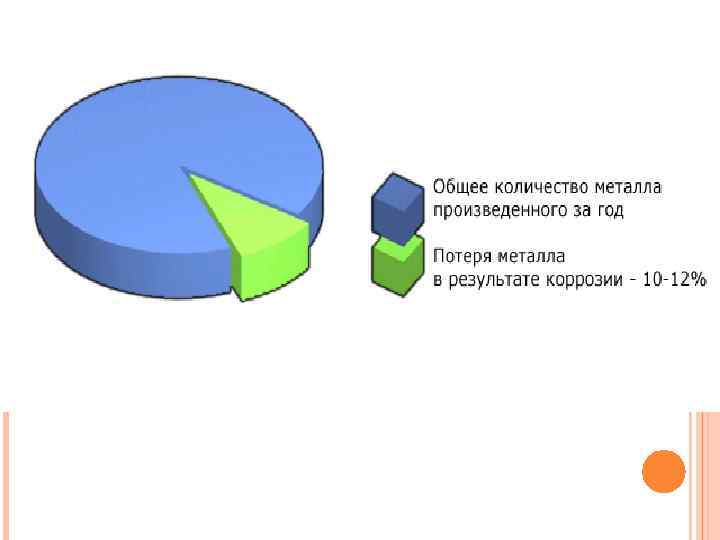
 МЕРЫ ПРЕДУПРЕЖДЕНИЯ КОРРОЗИИ
МЕРЫ ПРЕДУПРЕЖДЕНИЯ КОРРОЗИИ




