f3876288c6ee70f4e658e2a614b978b3.ppt
- Количество слайдов: 46

Uso e validazione del WBC Marker Kit ® - Celltech per la marcatura in vitro di leucociti autologhi A. F. Sedda 1, 2, S. Boemi 2 1 )ENEA 2) Ospedale S. Eugenio Roma

WBC Marker Kit ® - Celltech • Utilizza materiali monouso sterili, apirogeni, latex free. • Secondo le indicazioni “PICS (Pharmaceutical Inspection Convention)/GMP Guide for blood establishment del 25 -9 -2007” e EU Guidelines to GMP-Annex 1 del 14 -2 -2008, può essere considerato un “sistema chiuso”. • Tutte le manovre di trasferimento fra le siringhe e di passaggio nelle varie fasi di preparazione avvengono sempre in sistema chiuso e in isolamento.

EU Guidelines to Good Manufacturing Practice Medicinal Products for Human and Veterinary Use Annex 1 Manufacture of Sterile Medicinal Products • 34. Prior to the completion of stoppering, transfer of partially closed containers, …. . , should be done either in a grade A environment with grade B background, or in sealed transfer trays in a grade B environment.

WBC-Marker Kit monouso

Reagenti del WBC Marker Kit

L'isolamento dall'ambiente esterno è garantito dall'uso di valvole Luer activated certificate, che aprono e chiudono il passaggio dei fluidi automaticamente per semplice connessione o disconnessione.

Certificazione fornita dalla Cardinal Health sulla sicurezza alla contaminazione della valvola femmina Smart. Site.

Certificazione fornita dalla Cardinal Health sulla sicurezza alla contaminazione della valvola femmina Smart. Site.

Certificazione fornita dalla Cardinal Health sulla sicurezza alla contaminazione della valvola maschio Texium.

WBC Marker Kit ® - Celltech • Il Kit è validato per resa di marcatura, vitalità delle cellule leucocitarie marcate, sterilità del processo (dal prelievo di sangue, compreso, fino al momento della re-iniezione dei leucociti marcati).

WBC Marker Kit ® - Celltech • Massima semplificazione nella manipolazione in tutte le fasi del processo, e garanzia di isolamento del materiale biologico dall'ambiente esterno. • Le valvole di transito sono certificate dal costruttore per un uso sicuro fino a 50 connessioni/disconnessioni, e per un tempo di permanenza su catetere venoso centrale certificato fino a 72 ore
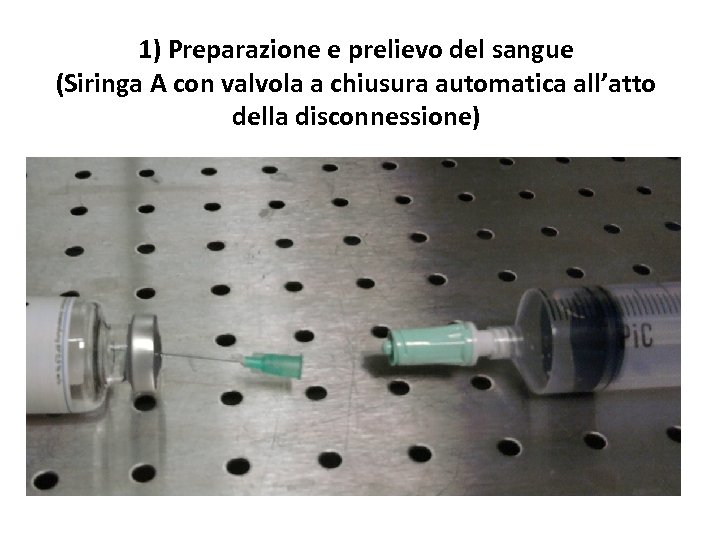
1) Preparazione e prelievo del sangue (Siringa A con valvola a chiusura automatica all’atto della disconnessione)

Sedimentazione in siringa A, con valvola maschio chiusa

2) Separazione del plasma arricchito in leucociti (Sangue in siringa A con valvola maschio chiusa)

3) Separazione del plasma arricchito in leucociti (Eritrociti in siringa A, plasma in siringa B, attraverso le due valvole a chiusura automatica alla disconnessione)

3) Separazione del plasma arricchito in leucociti (Plasma in siringa B, valvola femmina chiusa)

La siringa B contenente il plasma arricchito in leucociti viene resecata con un apposito Syringe Cutter ®

4) Separazione dei leucociti (Plasma in siringa B, resecata, con valvola chiusa)

4) Separazione dei leucociti (Plasma in siringa B, resecata, con valvola chiusa, centrifugata)

5) Separazione dei leucociti (Leucociti in siringa B, plasma depleto in siringa C)

Vial contenente il radiofarmaco, con perforatore e valvola chiusa

Prelievo del radiofarmaco

6) Marcatura dei leucociti (Leucociti + 99 m. Tc-HMPAO in siringa B resecata)

7) Purificazione dei leucociti marcati (Leucociti in siringa B con valvola chiusa, centrifugata)

8) Trasferimento dei leucociti marcati (Leucociti in siringa finale per iniezione al paziente)

Studio di ottimizzazione della sedimentazione • Per studiare il processo di sedimentazione, è stato effettuato un prelievo di sangue e una marcatura su sei volontari sani. • Al termine della marcatura, i leucociti marcati sono stati miscelati con il plasma depleto e con gli eritrociti, per studiare in dettaglio la cinetica della sedimentazione dei leucociti stessi.

• Ogni 15 minuti la siringa di sedimentazione di ognuno dei soggetti è stata fotografata ogni 15 minuti, e contemporaneamente è stata acquisita una scintigrafia gamma della stessa siringa. • In tal modo è stato possibile confrontare il processo di formazione della interfaccia plasma-eritrociti con la cinetica reale di separazione dei leucociti.
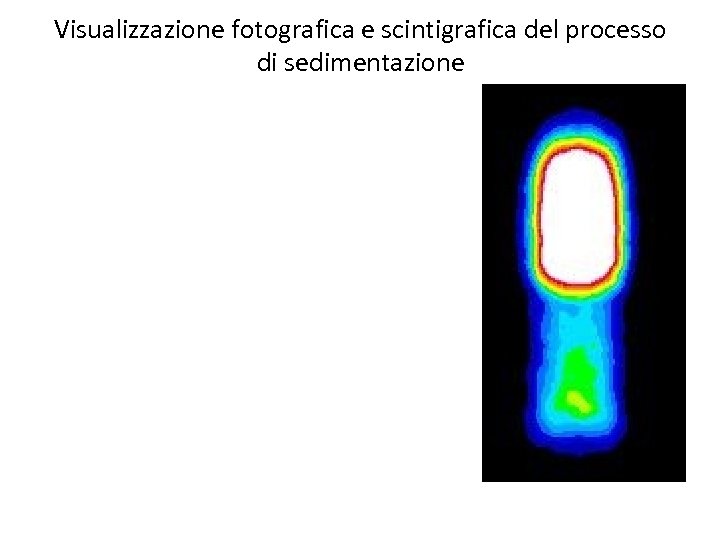
Visualizzazione fotografica e scintigrafica del processo di sedimentazione
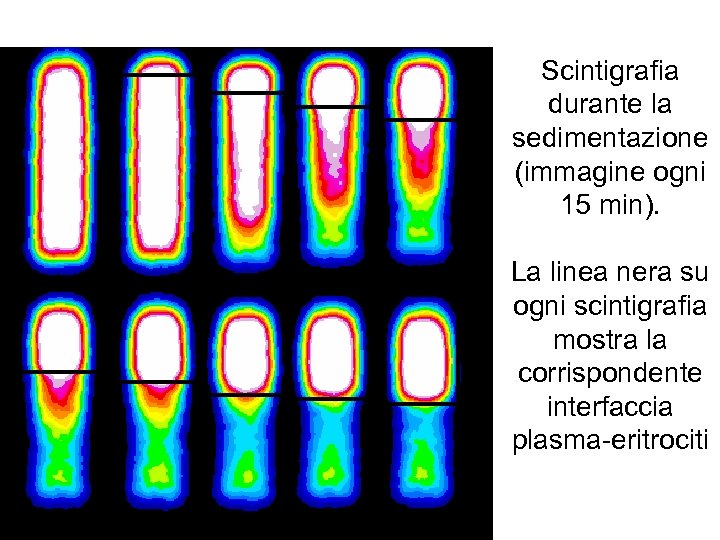
Scintigrafia durante la sedimentazione (immagine ogni 15 min). La linea nera su ogni scintigrafia mostra la corrispondente interfaccia plasma-eritrociti
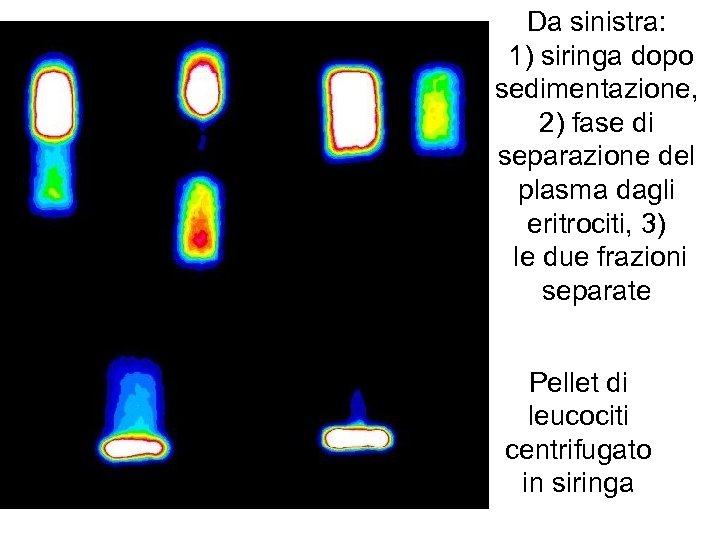
Da sinistra: 1) siringa dopo sedimentazione, 2) fase di separazione del plasma dagli eritrociti, 3) le due frazioni separate Pellet di leucociti centrifugato in siringa
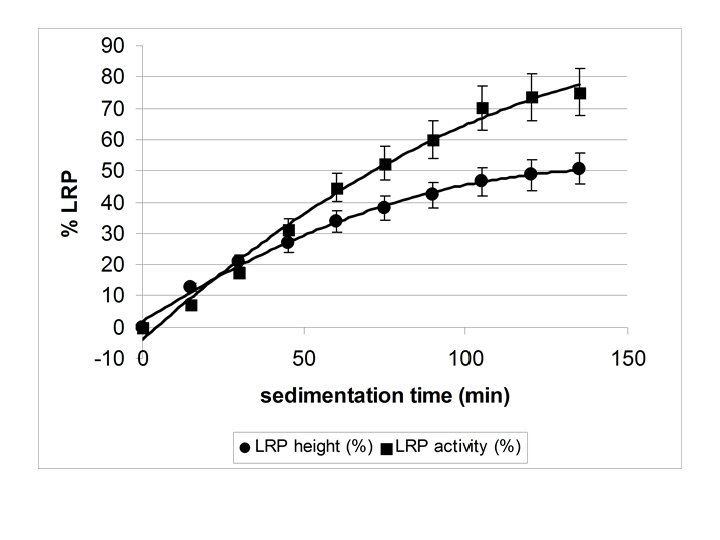

La figura precedente mostra come la formazione dell’interfaccia plasma-eritrociti sia praticamente completa dopo circa un’ora, mentre la separazione dei leucociti marcati prosegue fino a due ore dall’inizio della sedimentazione. Un appropriato tempo di attesa consente quindi di aumentare notevolmente la resa finale della marcatura

Durante il processo, la contaminazione da batteri (media fill test e piastra di coltura) è sempre (n=30) risultata negativa Durante il processo, la contaminazione da muffe (piastra di coltura) e lieviti ( piastra di coltura) è sempre (n=30) risultata negativa Durante il processo, la concentrazione di pirogeni determinata mediante Limulus Test è sempre (n=30) risultata inferiore al limite di rivelabilità del test (0. 125 UI/ml) (circa 30 volte inferiore al limite massimo ammesso dalla FDA per radiofarmaci marcati con 99 m. Tc)
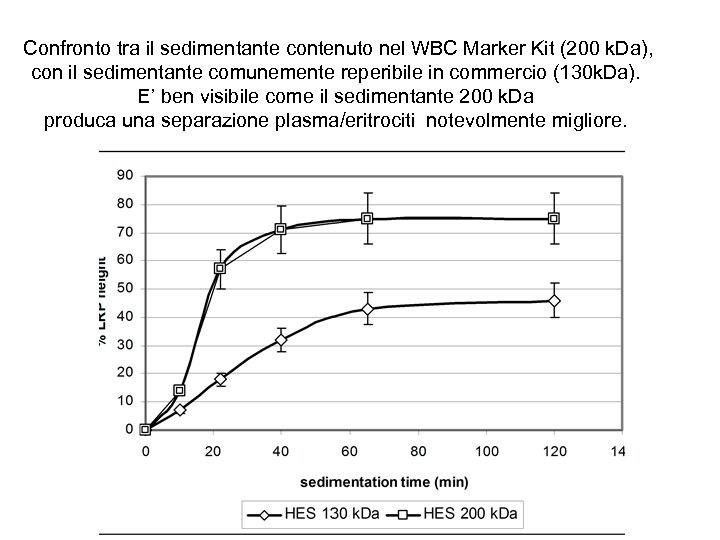
Confronto tra il sedimentante contenuto nel WBC Marker Kit (200 k. Da), con il sedimentante comunemente reperibile in commercio (130 k. Da). E’ ben visibile come il sedimentante 200 k. Da produca una separazione plasma/eritrociti notevolmente migliore.
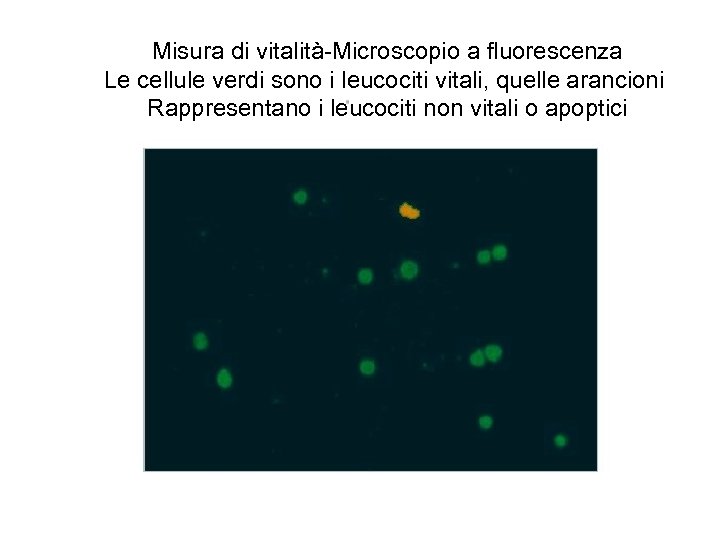
Misura di vitalità-Microscopio a fluorescenza Le cellule verdi sono i leucociti vitali, quelle arancioni Rappresentano i leucociti non vitali o apoptici
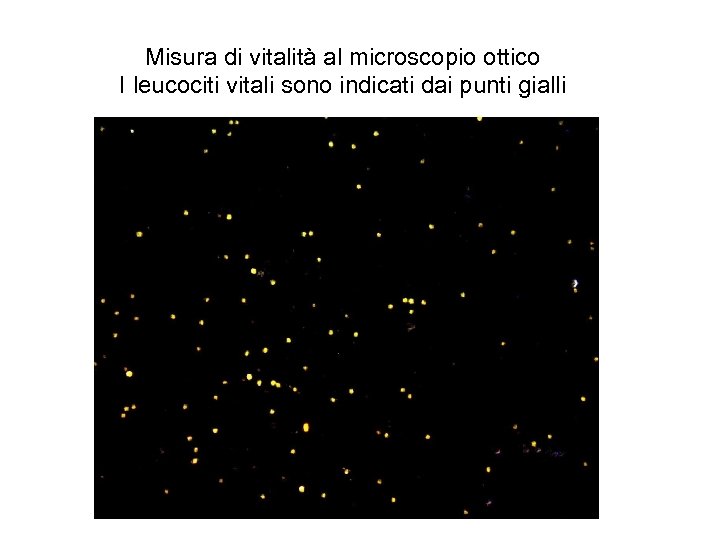
Misura di vitalità al microscopio ottico I leucociti vitali sono indicati dai punti gialli
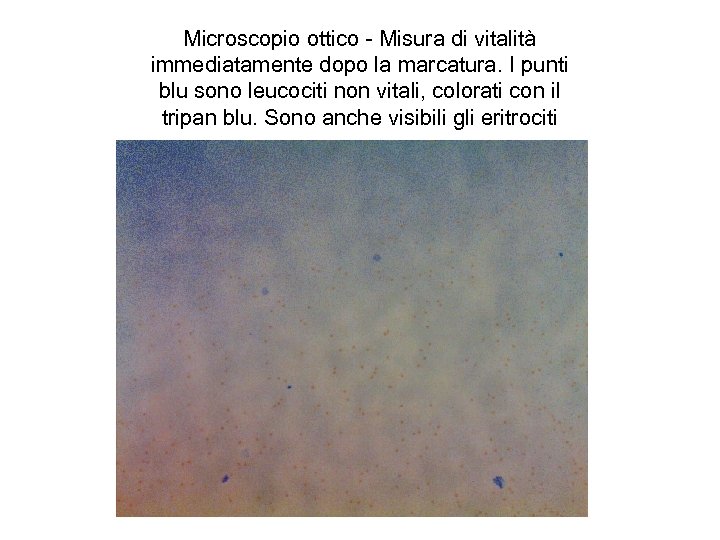
Microscopio ottico - Misura di vitalità immediatamente dopo la marcatura. I punti blu sono leucociti non vitali, colorati con il tripan blu. Sono anche visibili gli eritrociti
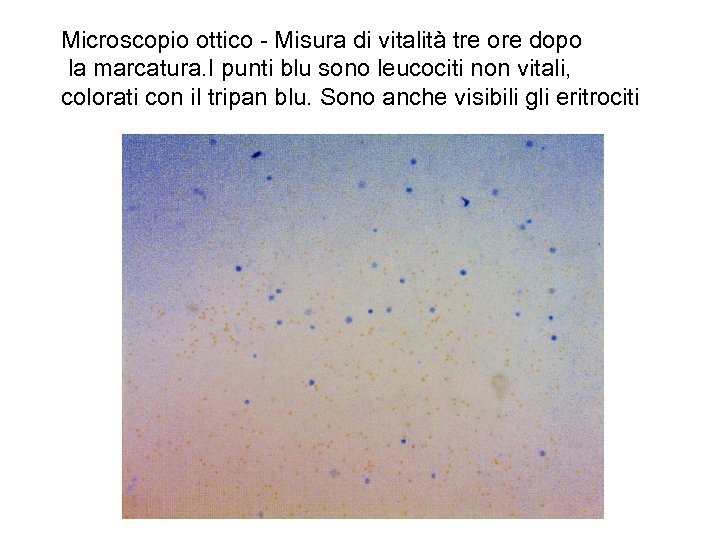
Microscopio ottico - Misura di vitalità tre ore dopo la marcatura. I punti blu sono leucociti non vitali, colorati con il tripan blu. Sono anche visibili gli eritrociti
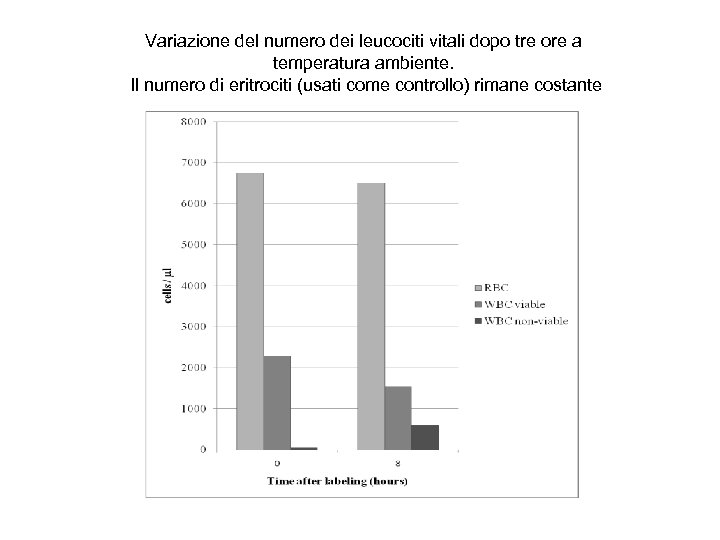
Variazione del numero dei leucociti vitali dopo tre ore a temperatura ambiente. Il numero di eritrociti (usati come controllo) rimane costante

Chemiotassi sotto agar dei leucociti marcati (i due pozzetti laterali), diretta verso LPS di E. Coli (pozzetto centrale). Rivelazione effettuata mediante radioactivity phosphor image screen Cyclone PE. O O O Iniziale O O O Dopo 1 ora

Chemiotassi dei leucociti marcati in capillare, diretta verso LPS di E. Coli , dopo 1 ora. E’ visibile al microscopio il “ventaglio” dei leucociti che migrano nel pozzetto con LPS
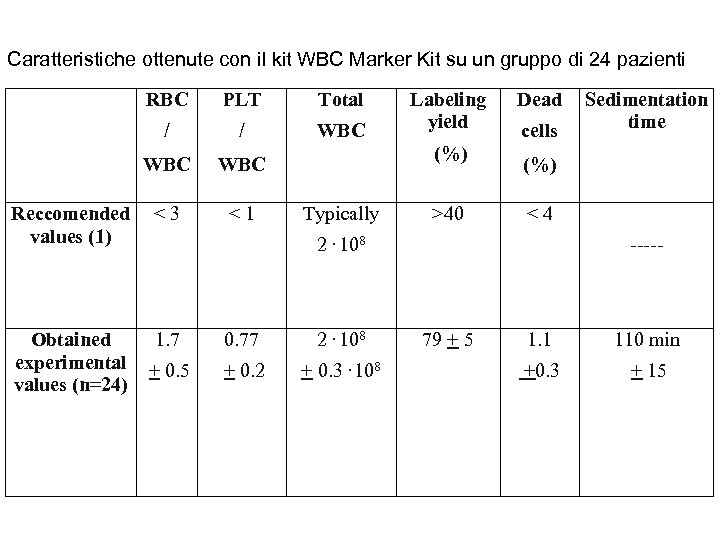
Caratteristiche ottenute con il kit WBC Marker Kit su un gruppo di 24 pazienti RBC PLT Total / / WBC WBC Reccomended values (1) <3 <1 Obtained experimental values (n=24) 1. 7 0. 77 2. 108 + 0. 5 + 0. 2 + 0. 3. 108 Labeling yield (%) Typically >40 Dead cells Sedimentation time (%) <4 2. 108 ----- 79 + 5 1. 1 110 min +0. 3 + 15

I risultati riportati in tabella mostrano un rapporto RBC/WBC e piastrine/WBC migliore del valore raccomandato dalle linee guida Europee. La vitalità si è sempre mantenuta entro valori eccellenti La resa di marcatura ha mostrato valori costantemente dell’ordine dell’ 80%, ottenuti con un prelievo di 32 ml di sangue, e con l’uso di una sola confezione di HMPAO per 5 -6 marcature (< 100 microgrammi/marcatura)
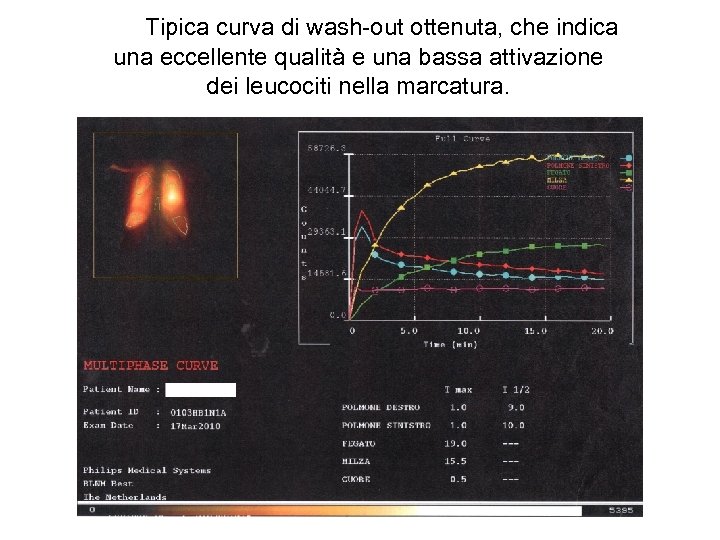
Tipica curva di wash-out ottenuta, che indica una eccellente qualità e una bassa attivazione dei leucociti nella marcatura.

Rapporto attività milza/attività fegato, ottenuta su un gruppo di 42 pazienti. 2 ore 2. 79 + 0. 4 20 ore 2. 32 + 0. 2
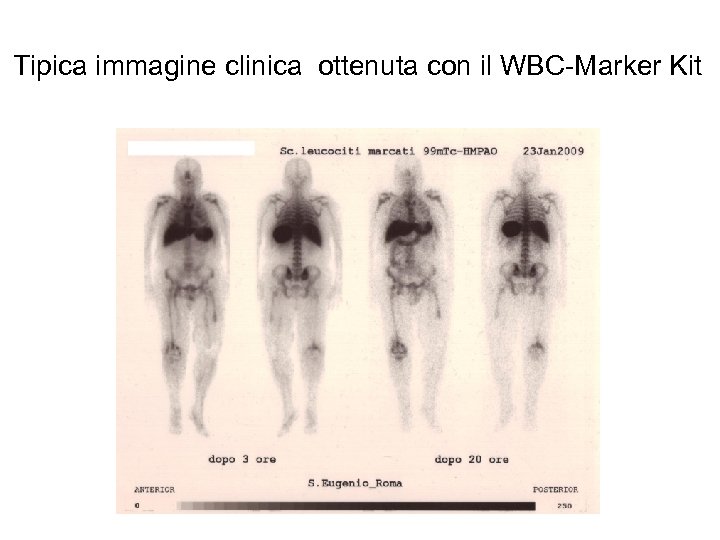
Tipica immagine clinica ottenuta con il WBC-Marker Kit
f3876288c6ee70f4e658e2a614b978b3.ppt