lecture_9.ppt
- Количество слайдов: 53
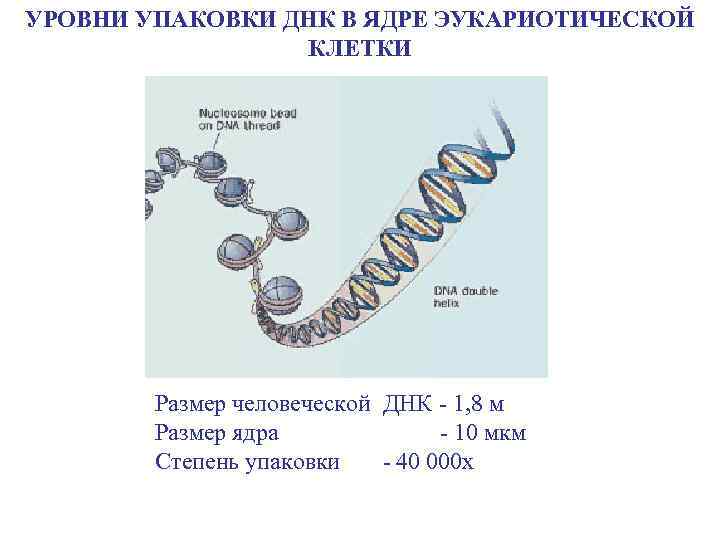 УРОВНИ УПАКОВКИ ДНК В ЯДРЕ ЭУКАРИOТИЧЕСКОЙ КЛЕТКИ Размер человеческой ДНК - 1, 8 м Размер ядра - 10 мкм Степень упаковки - 40 000 х
УРОВНИ УПАКОВКИ ДНК В ЯДРЕ ЭУКАРИOТИЧЕСКОЙ КЛЕТКИ Размер человеческой ДНК - 1, 8 м Размер ядра - 10 мкм Степень упаковки - 40 000 х
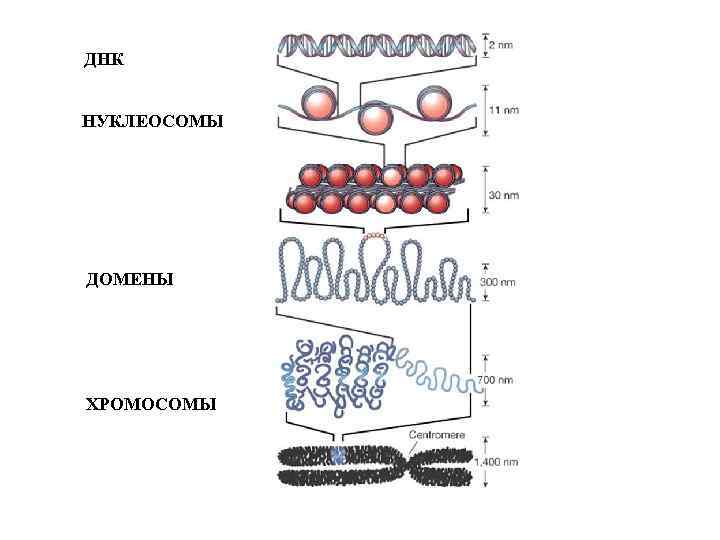 ДНК НУКЛЕОСОМЫ ДОМЕНЫ ХРОМОСОМЫ
ДНК НУКЛЕОСОМЫ ДОМЕНЫ ХРОМОСОМЫ
 Компактизация ДНК в ядре осуществляется при посредстве сложного комплекса белков, среди которых принято выделять гистоны и негистоновые белки Гистоны являются чрезвычайно консервативными белками. Выделяют 5 основных типов гистонов Н 1, Н 2 А, Н 2 В, Н 3, Н 4 Гистоны Н 2 А, Н 2 В, Н 3, Н 4 входят в состав минимальной нуклеосомы (так называемой “Core Particle”). По-этому их нередко называют «коровыми» гистонами
Компактизация ДНК в ядре осуществляется при посредстве сложного комплекса белков, среди которых принято выделять гистоны и негистоновые белки Гистоны являются чрезвычайно консервативными белками. Выделяют 5 основных типов гистонов Н 1, Н 2 А, Н 2 В, Н 3, Н 4 Гистоны Н 2 А, Н 2 В, Н 3, Н 4 входят в состав минимальной нуклеосомы (так называемой “Core Particle”). По-этому их нередко называют «коровыми» гистонами
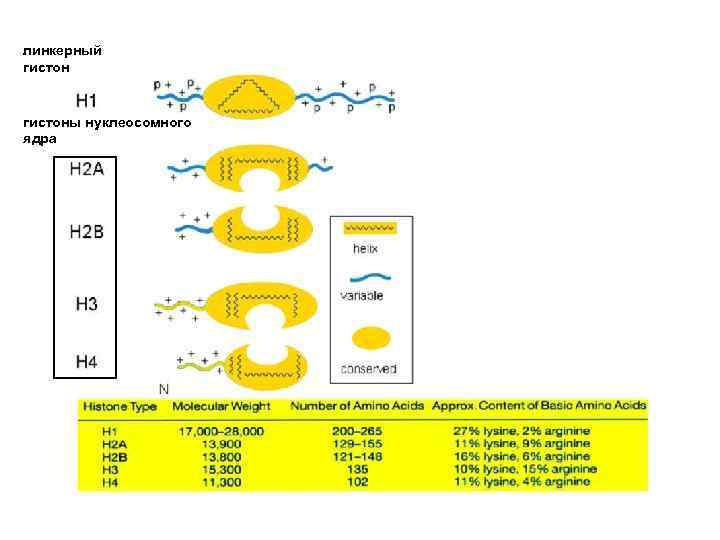 линкерный гистоны нуклеосомного ядра
линкерный гистоны нуклеосомного ядра
 К открытию нуклеосом привели две группы экспериментов: 1. Электронная микроскопия препаратов хроматина в низкой ионной силе 2. Анализ продуктов расщепления хроматина стафилококковой нуклеазой
К открытию нуклеосом привели две группы экспериментов: 1. Электронная микроскопия препаратов хроматина в низкой ионной силе 2. Анализ продуктов расщепления хроматина стафилококковой нуклеазой
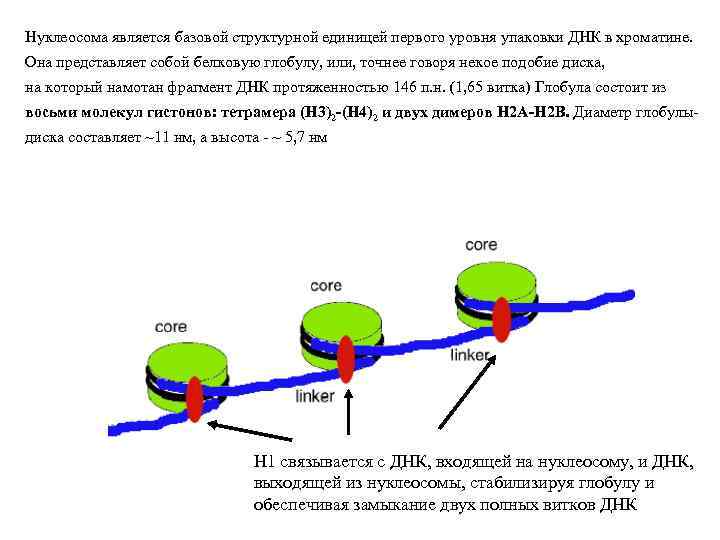 Нуклеосома является базовой структурной единицей первого уровня упаковки ДНК в хроматине. Она представляет собой белковую глобулу, или, точнее говоря некое подобие диска, на который намотан фрагмент ДНК протяженностью 146 п. н. (1, 65 витка) Глобула состоит из восьми молекул гистонов: тетрамера (Н 3)2 -(Н 4)2 и двух димеров Н 2 А-Н 2 В. Диаметр глобулыдиска составляет ~11 нм, а высота - ~ 5, 7 нм H 1 связывается с ДНК, входящей на нуклеосому, и ДНК, выходящей из нуклеосомы, стабилизируя глобулу и обеспечивая замыкание двух полных витков ДНК
Нуклеосома является базовой структурной единицей первого уровня упаковки ДНК в хроматине. Она представляет собой белковую глобулу, или, точнее говоря некое подобие диска, на который намотан фрагмент ДНК протяженностью 146 п. н. (1, 65 витка) Глобула состоит из восьми молекул гистонов: тетрамера (Н 3)2 -(Н 4)2 и двух димеров Н 2 А-Н 2 В. Диаметр глобулыдиска составляет ~11 нм, а высота - ~ 5, 7 нм H 1 связывается с ДНК, входящей на нуклеосому, и ДНК, выходящей из нуклеосомы, стабилизируя глобулу и обеспечивая замыкание двух полных витков ДНК
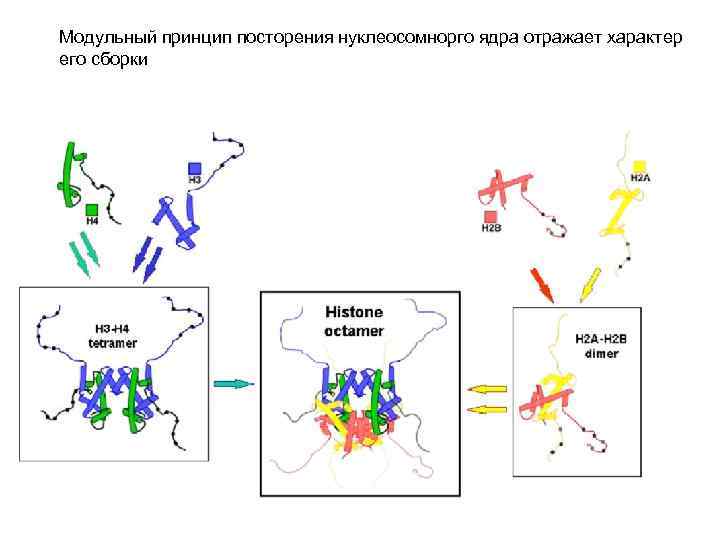 Модульный принцип посторения нуклеосомнорго ядра отражает характер его сборки
Модульный принцип посторения нуклеосомнорго ядра отражает характер его сборки

 Гистоны контактируют с фосфодиэфирным остовом молекулы ДНК. Контакты реализуются через каждые 10 пар оснований, когда малая бороздка ДНК оказывается развернутой внутрь. В целом, накрученная на нуклеомную глобулу ДНК образует 14 прочных электростатических контактов с молекулами гистонов.
Гистоны контактируют с фосфодиэфирным остовом молекулы ДНК. Контакты реализуются через каждые 10 пар оснований, когда малая бороздка ДНК оказывается развернутой внутрь. В целом, накрученная на нуклеомную глобулу ДНК образует 14 прочных электростатических контактов с молекулами гистонов.
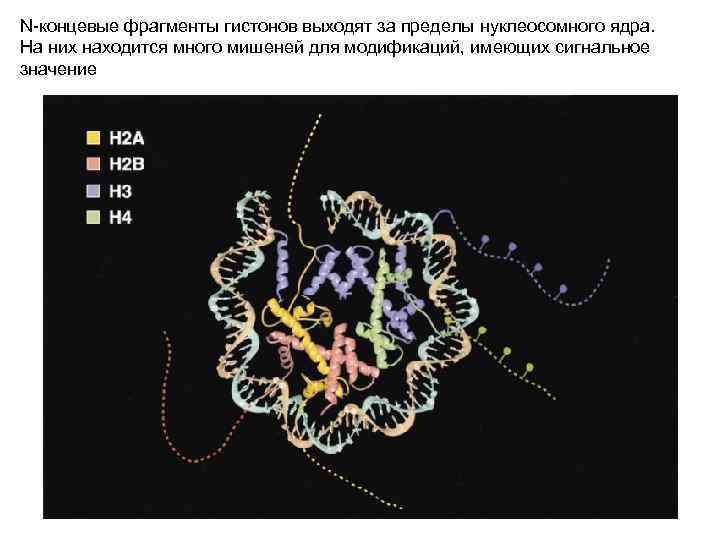 N-концевые фрагменты гистонов выходят за пределы нуклеосомного ядра. На них находится много мишеней для модификаций, имеющих сигнальное значение
N-концевые фрагменты гистонов выходят за пределы нуклеосомного ядра. На них находится много мишеней для модификаций, имеющих сигнальное значение
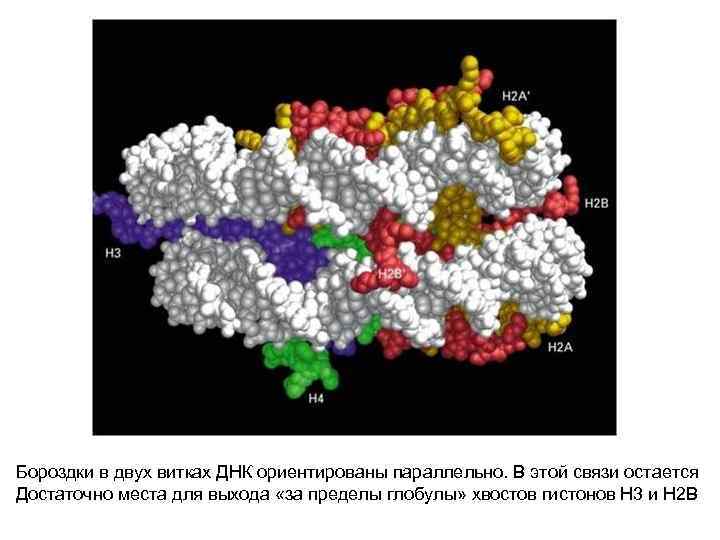 Бороздки в двух витках ДНК ориентированы параллельно. В этой связи остается Достаточно места для выхода «за пределы глобулы» хвостов гистонов Н 3 и Н 2 В
Бороздки в двух витках ДНК ориентированы параллельно. В этой связи остается Достаточно места для выхода «за пределы глобулы» хвостов гистонов Н 3 и Н 2 В

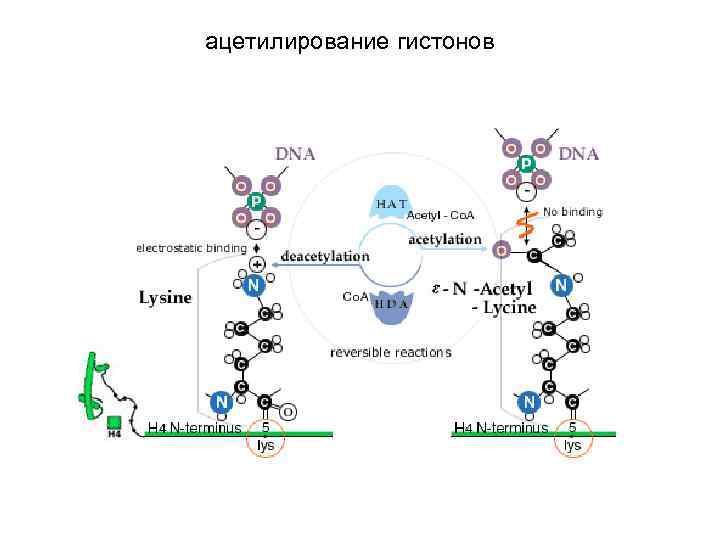 ацетилирование гистонов
ацетилирование гистонов

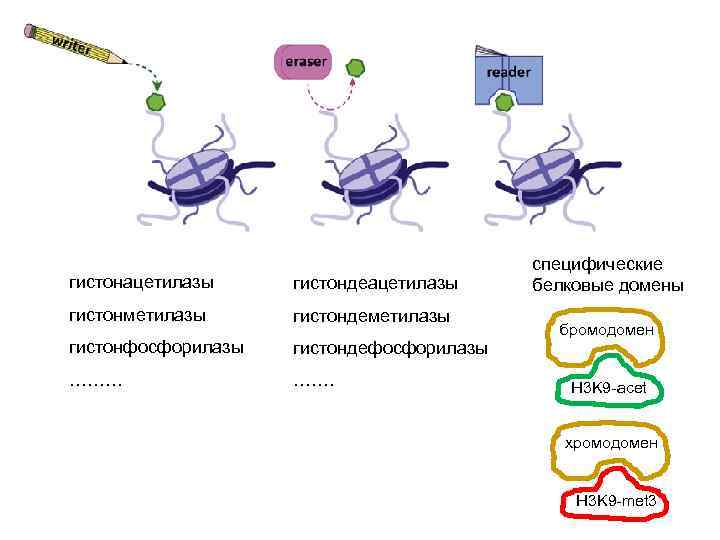 гистонацетилазы гистондеацетилазы гистонметилазы гистондеметилазы гистонфосфорилазы гистондефосфорилазы ……… ……. специфические белковые домены бромодомен H 3 K 9 -acet хромодомен H 3 K 9 -met 3
гистонацетилазы гистондеацетилазы гистонметилазы гистондеметилазы гистонфосфорилазы гистондефосфорилазы ……… ……. специфические белковые домены бромодомен H 3 K 9 -acet хромодомен H 3 K 9 -met 3
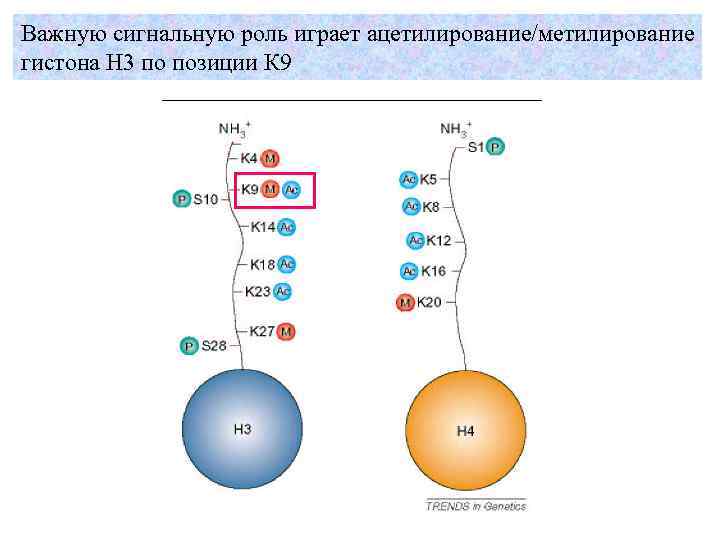 Важную сигнальную роль играет ацетилирование/метилирование гистона H 3 по позиции К 9
Важную сигнальную роль играет ацетилирование/метилирование гистона H 3 по позиции К 9
 Модификации гистонов могут: 1. прямо влиять на свойство октамера гистонов (например посредством снижения заряда) 2. Выполнять сигнальную функцию, способствую привлечения различных белков (ГИСТОНОВЫЙ КОД) Важен не только тип модификации, но и количественные характеристики модификаций Например монометилирование и триметилирование лизина могут иметь прямо противоположные последствия
Модификации гистонов могут: 1. прямо влиять на свойство октамера гистонов (например посредством снижения заряда) 2. Выполнять сигнальную функцию, способствую привлечения различных белков (ГИСТОНОВЫЙ КОД) Важен не только тип модификации, но и количественные характеристики модификаций Например монометилирование и триметилирование лизина могут иметь прямо противоположные последствия
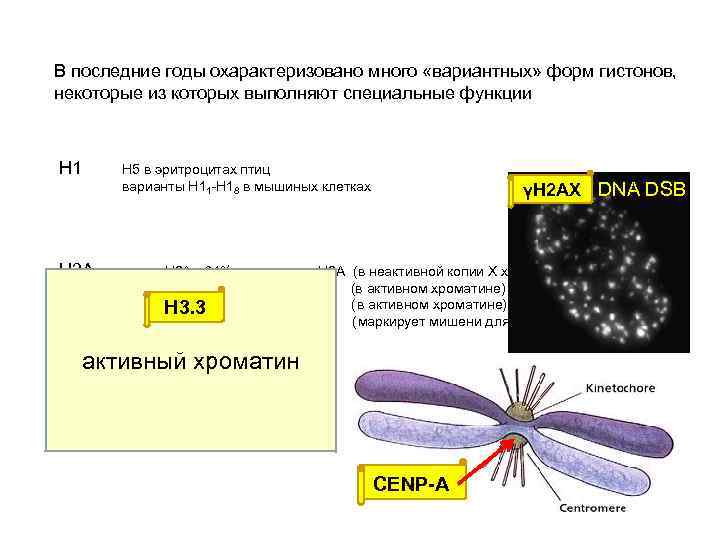 В последние годы охарактеризовано много «вариантных» форм гистонов, некоторые из которых выполняют специальные функции Н 1 Н 2 А Н 5 в эритроцитах птиц варианты Н 11 -Н 18 в мышиных клетках γH 2 AX DNA DSB macro H 2 A - 64% гомологии с H 2 A (в неактивной копии Х хромосомы) H 2 A-Bbd – 42% гомологии с H 2 A (в активном хроматине) H 2 A. Z (в активном хроматине) H 3. 3 H 2 A. X (маркирует мишени для репарации) активный хроматин Н 3 СENP-A (центромерный белок) Cid (центромерный белок) Н. 3. 3 (активный хроматин) CENP-A
В последние годы охарактеризовано много «вариантных» форм гистонов, некоторые из которых выполняют специальные функции Н 1 Н 2 А Н 5 в эритроцитах птиц варианты Н 11 -Н 18 в мышиных клетках γH 2 AX DNA DSB macro H 2 A - 64% гомологии с H 2 A (в неактивной копии Х хромосомы) H 2 A-Bbd – 42% гомологии с H 2 A (в активном хроматине) H 2 A. Z (в активном хроматине) H 3. 3 H 2 A. X (маркирует мишени для репарации) активный хроматин Н 3 СENP-A (центромерный белок) Cid (центромерный белок) Н. 3. 3 (активный хроматин) CENP-A
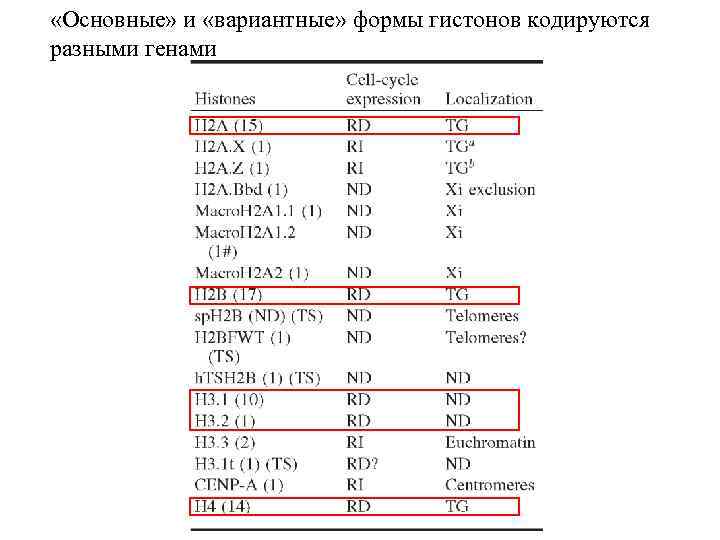 «Основные» и «вариантные» формы гистонов кодируются разными генами
«Основные» и «вариантные» формы гистонов кодируются разными генами
 Нуклеосомные частицы не вполне одинаковы Количество различных нуклеосомных глобул, которые можно построить с использованием модифицированных и вариантных форм гистонов существенно превосходит общее число нуклеосом в ядре эукариотической клетки.
Нуклеосомные частицы не вполне одинаковы Количество различных нуклеосомных глобул, которые можно построить с использованием модифицированных и вариантных форм гистонов существенно превосходит общее число нуклеосом в ядре эукариотической клетки.

 позиционирование нуклеосом на ДНК
позиционирование нуклеосом на ДНК
 Связывание гистонов с ДНК не является специфичным в отношении последовательности так как гистоны не не образуют водородных связей с азотистыми основаниями Тем не менее Позиционирование нуклеосом на ДНК подчиняется определенным закономерностям Существует две важных характеристики СПЕЙСИНГ ФЭЙЗИНГ
Связывание гистонов с ДНК не является специфичным в отношении последовательности так как гистоны не не образуют водородных связей с азотистыми основаниями Тем не менее Позиционирование нуклеосом на ДНК подчиняется определенным закономерностям Существует две важных характеристики СПЕЙСИНГ ФЭЙЗИНГ
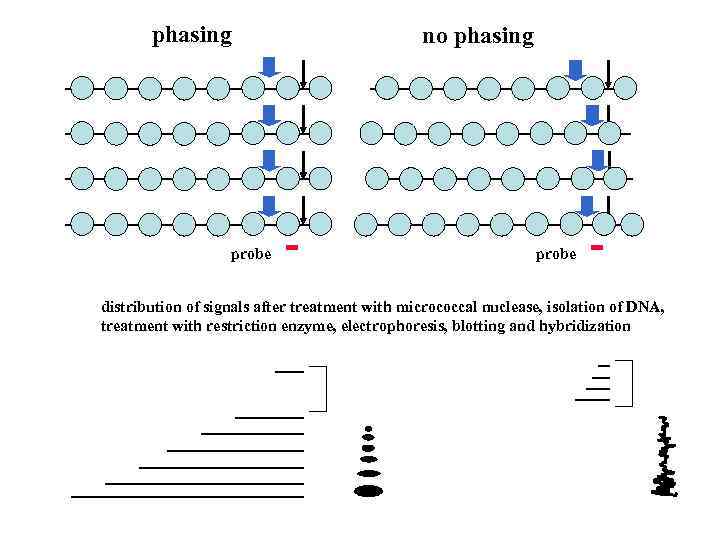 phasing probe no phasing probe distribution of signals after treatment with micrococcal nuclease, isolation of DNA, treatment with restriction enzyme, electrophoresis, blotting and hybridization
phasing probe no phasing probe distribution of signals after treatment with micrococcal nuclease, isolation of DNA, treatment with restriction enzyme, electrophoresis, blotting and hybridization
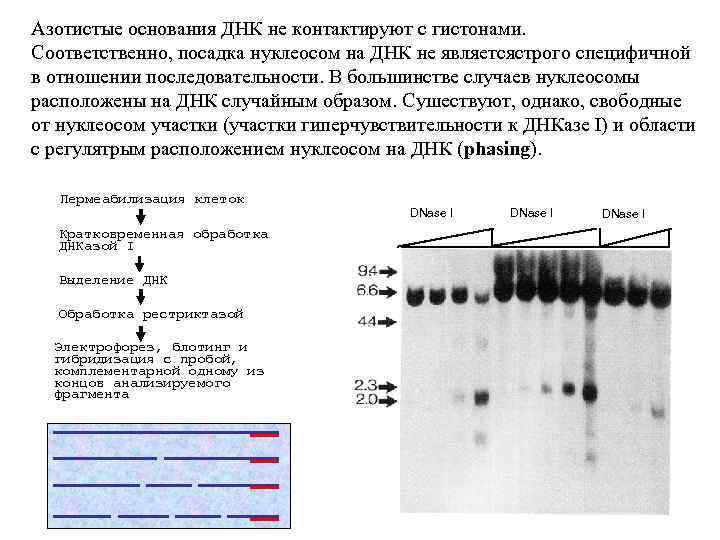 Азотистые основания ДНК не контактируют с гистонами. Соответственно, посадка нуклеосом на ДНК не являетсястрого специфичной в отношении последовательности. В большинстве случаев нуклеосомы расположены на ДНК случайным образом. Сушествуют, однако, свободные от нуклеосом участки (участки гиперчувствительности к ДНКазе I) и области с регулятрым расположением нуклеосом на ДНК (phasing). Пермеабилизация клеток Кратковременная обработка ДНКазой I Выделение ДНК Обработка рестриктазой Электрофорез, блотинг и гибридизация с пробой, комплементарной одному из концов анализируемого фрагмента DNase I
Азотистые основания ДНК не контактируют с гистонами. Соответственно, посадка нуклеосом на ДНК не являетсястрого специфичной в отношении последовательности. В большинстве случаев нуклеосомы расположены на ДНК случайным образом. Сушествуют, однако, свободные от нуклеосом участки (участки гиперчувствительности к ДНКазе I) и области с регулятрым расположением нуклеосом на ДНК (phasing). Пермеабилизация клеток Кратковременная обработка ДНКазой I Выделение ДНК Обработка рестриктазой Электрофорез, блотинг и гибридизация с пробой, комплементарной одному из концов анализируемого фрагмента DNase I
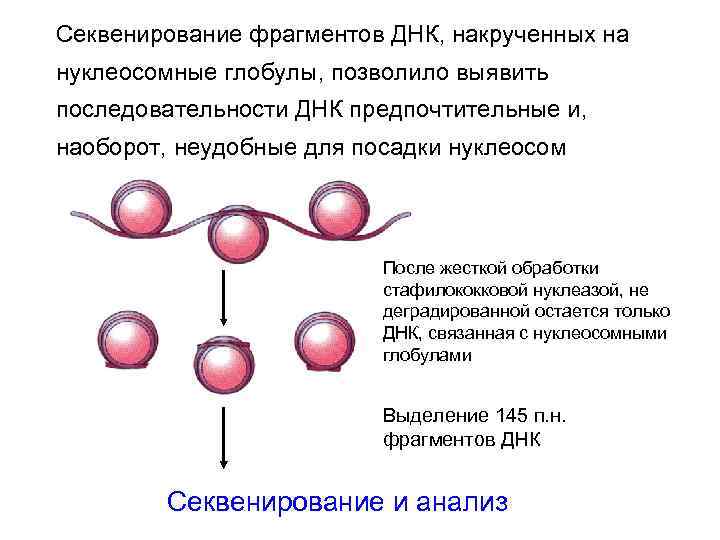 Секвенирование фрагментов ДНК, накрученных на нуклеосомные глобулы, позволило выявить последовательности ДНК предпочтительные и, наоборот, неудобные для посадки нуклеосом После жесткой обработки стафилококковой нуклеазой, не деградированной остается только ДНК, связанная с нуклеосомными глобулами Выделение 145 п. н. фрагментов ДНК Секвенирование и анализ
Секвенирование фрагментов ДНК, накрученных на нуклеосомные глобулы, позволило выявить последовательности ДНК предпочтительные и, наоборот, неудобные для посадки нуклеосом После жесткой обработки стафилококковой нуклеазой, не деградированной остается только ДНК, связанная с нуклеосомными глобулами Выделение 145 п. н. фрагментов ДНК Секвенирование и анализ
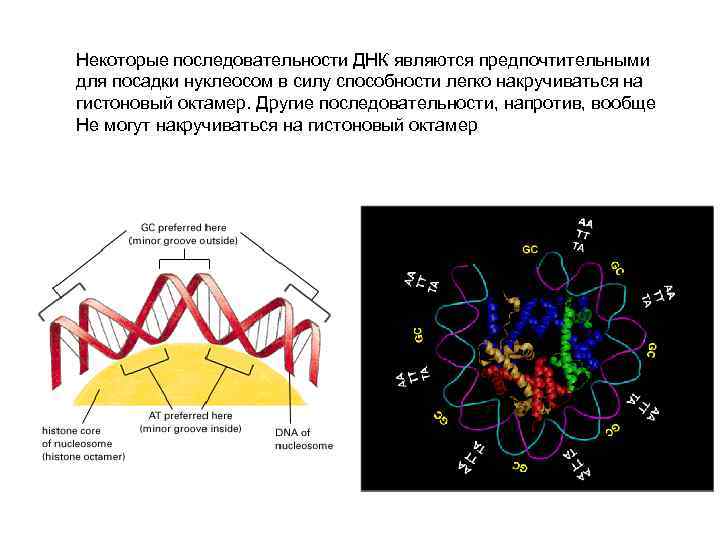 Некоторые последовательности ДНК являются предпочтительными для посадки нуклеосом в силу способности легко накручиваться на гистоновый октамер. Другие последовательности, напротив, вообще Не могут накручиваться на гистоновый октамер
Некоторые последовательности ДНК являются предпочтительными для посадки нуклеосом в силу способности легко накручиваться на гистоновый октамер. Другие последовательности, напротив, вообще Не могут накручиваться на гистоновый октамер
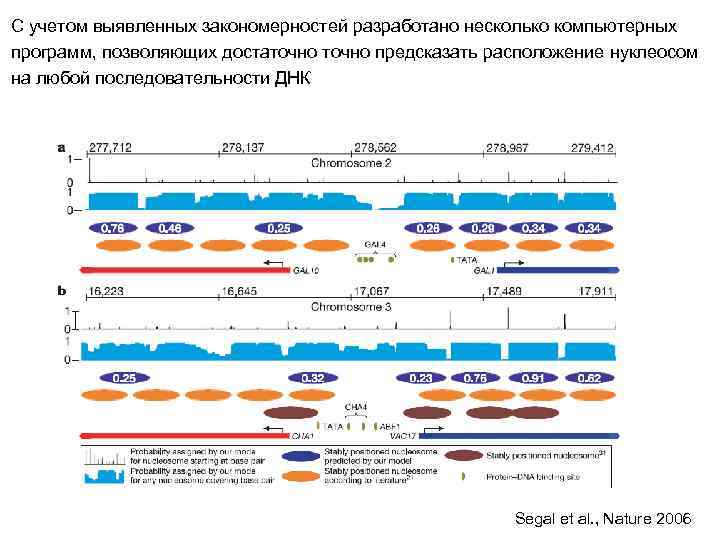 С учетом выявленных закономерностей разработано несколько компьютерных программ, позволяющих достаточно предсказать расположение нуклеосом на любой последовательности ДНК Segal et al. , Nature 2006
С учетом выявленных закономерностей разработано несколько компьютерных программ, позволяющих достаточно предсказать расположение нуклеосом на любой последовательности ДНК Segal et al. , Nature 2006
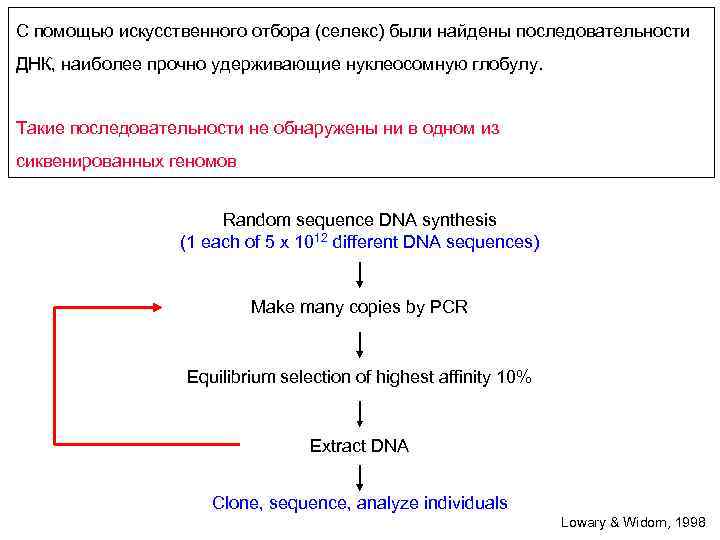 С помощью искусственного отбора (селекс) были найдены последовательности ДНК, наиболее прочно удерживающие нуклеосомную глобулу. Такие последовательности не обнаружены ни в одном из сиквенированных геномов Random sequence DNA synthesis (1 each of 5 x 1012 different DNA sequences) Make many copies by PCR Equilibrium selection of highest affinity 10% Extract DNA Clone, sequence, analyze individuals Lowary & Widom, 1998
С помощью искусственного отбора (селекс) были найдены последовательности ДНК, наиболее прочно удерживающие нуклеосомную глобулу. Такие последовательности не обнаружены ни в одном из сиквенированных геномов Random sequence DNA synthesis (1 each of 5 x 1012 different DNA sequences) Make many copies by PCR Equilibrium selection of highest affinity 10% Extract DNA Clone, sequence, analyze individuals Lowary & Widom, 1998
 TATA
TATA
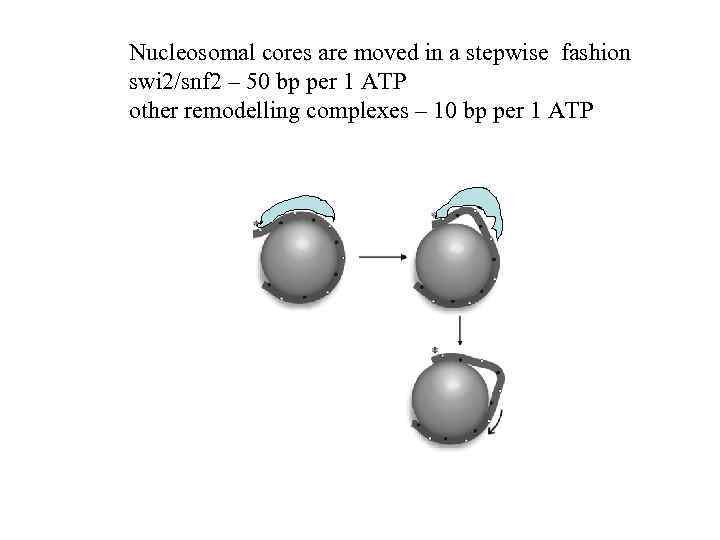 Nucleosomal cores are moved in a stepwise fashion swi 2/snf 2 – 50 bp per 1 ATP other remodelling complexes – 10 bp per 1 ATP
Nucleosomal cores are moved in a stepwise fashion swi 2/snf 2 – 50 bp per 1 ATP other remodelling complexes – 10 bp per 1 ATP
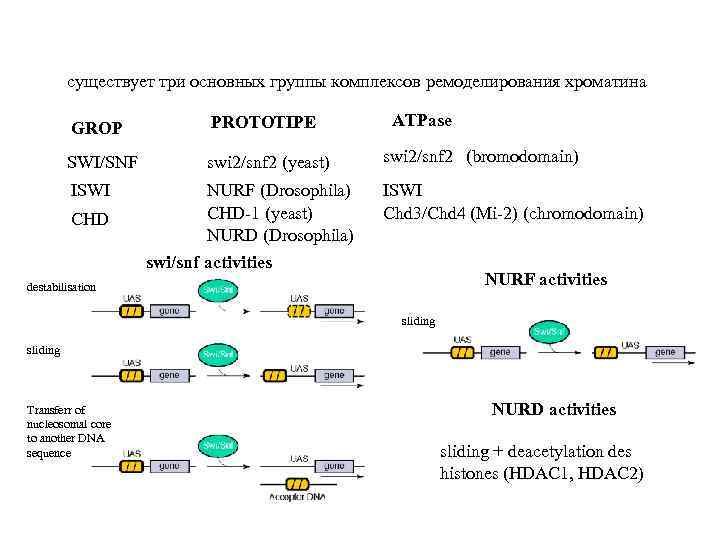 существует три основных группы комплексов ремоделирования хроматина ATPase GROP PROTOTIPE SWI/SNF swi 2/snf 2 (yeast) swi 2/snf 2 (bromodomain) ISWI NURF (Drosophila) CHD-1 (yeast) NURD (Drosophila) ISWI Chd 3/Chd 4 (Mi-2) (chromodomain) CHD swi/snf activities NURF activities destabilisation sliding Transferr of nucleosomal core to another DNA sequence NURD activities sliding + deacetylation des histones (HDAC 1, HDAC 2)
существует три основных группы комплексов ремоделирования хроматина ATPase GROP PROTOTIPE SWI/SNF swi 2/snf 2 (yeast) swi 2/snf 2 (bromodomain) ISWI NURF (Drosophila) CHD-1 (yeast) NURD (Drosophila) ISWI Chd 3/Chd 4 (Mi-2) (chromodomain) CHD swi/snf activities NURF activities destabilisation sliding Transferr of nucleosomal core to another DNA sequence NURD activities sliding + deacetylation des histones (HDAC 1, HDAC 2)



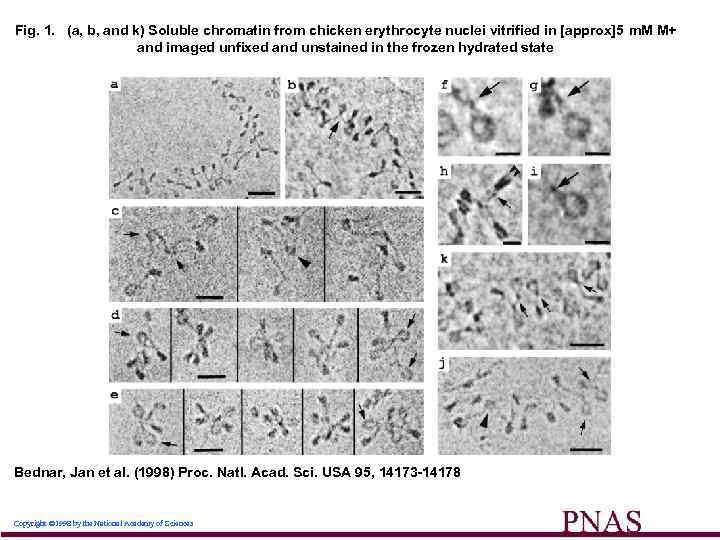 Fig. 1. (a, b, and k) Soluble chromatin from chicken erythrocyte nuclei vitrified in [approx]5 m. M M+ and imaged unfixed and unstained in the frozen hydrated state Bednar, Jan et al. (1998) Proc. Natl. Acad. Sci. USA 95, 14173 -14178 Copyright © 1998 by the National Academy of Sciences
Fig. 1. (a, b, and k) Soluble chromatin from chicken erythrocyte nuclei vitrified in [approx]5 m. M M+ and imaged unfixed and unstained in the frozen hydrated state Bednar, Jan et al. (1998) Proc. Natl. Acad. Sci. USA 95, 14173 -14178 Copyright © 1998 by the National Academy of Sciences
 Атомный силовой микроскоп
Атомный силовой микроскоп

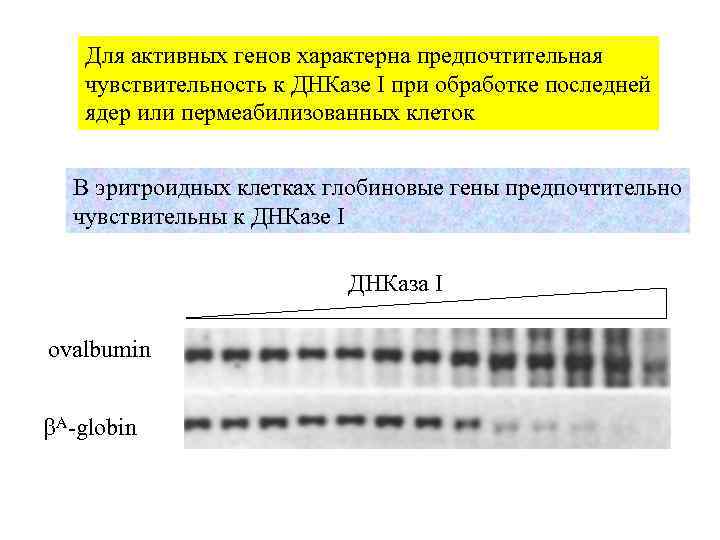 Для активных генов характерна предпочтительная чувствительность к ДНКазе I при обработке последней ядер или пермеабилизованных клеток В эритроидных клетках глобиновые гены предпочтительно чувствительны к ДНКазе I ДНКаза I ovalbumin A-globin
Для активных генов характерна предпочтительная чувствительность к ДНКазе I при обработке последней ядер или пермеабилизованных клеток В эритроидных клетках глобиновые гены предпочтительно чувствительны к ДНКазе I ДНКаза I ovalbumin A-globin

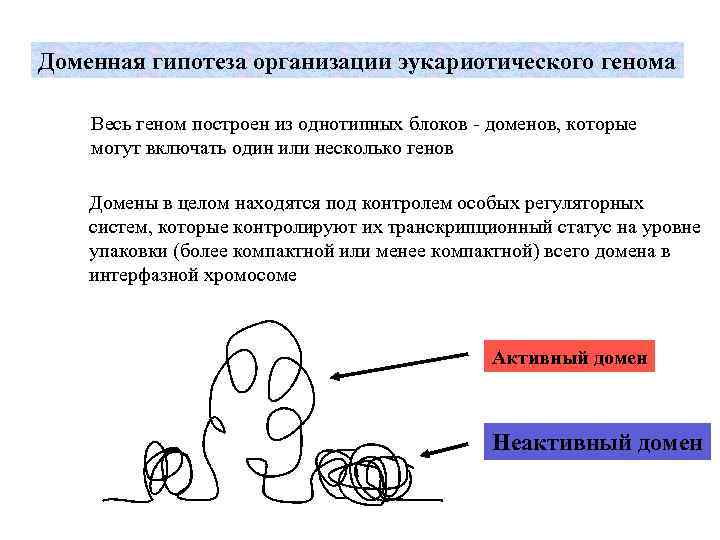 Доменная гипотеза организации эукариотического генома Весь геном построен из однотипных блоков - доменов, которые могут включать один или несколько генов Домены в целом находятся под контролем особых регуляторных систем, которые контролируют их транскрипционный статус на уровне упаковки (более компактной или менее компактной) всего домена в интерфазной хромосоме Активный домен Неактивный домен
Доменная гипотеза организации эукариотического генома Весь геном построен из однотипных блоков - доменов, которые могут включать один или несколько генов Домены в целом находятся под контролем особых регуляторных систем, которые контролируют их транскрипционный статус на уровне упаковки (более компактной или менее компактной) всего домена в интерфазной хромосоме Активный домен Неактивный домен
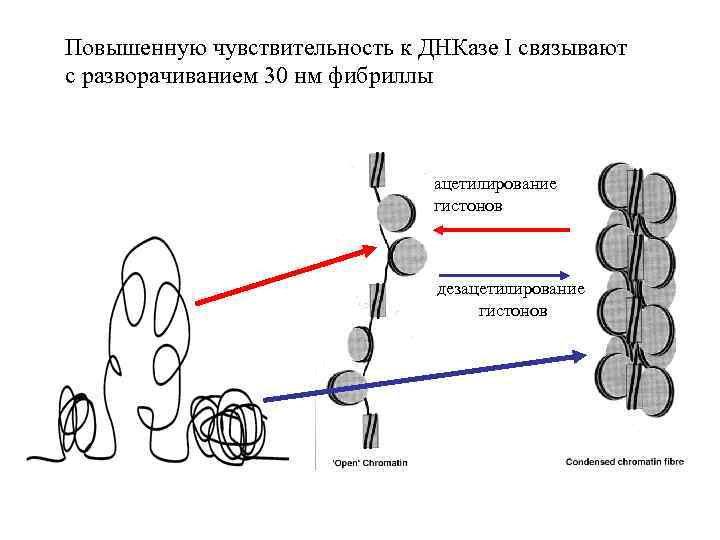 Повышенную чувствительность к ДНКазе I связывают с разворачиванием 30 нм фибриллы ацетилирование гистонов дезацетилирование гистонов
Повышенную чувствительность к ДНКазе I связывают с разворачиванием 30 нм фибриллы ацетилирование гистонов дезацетилирование гистонов
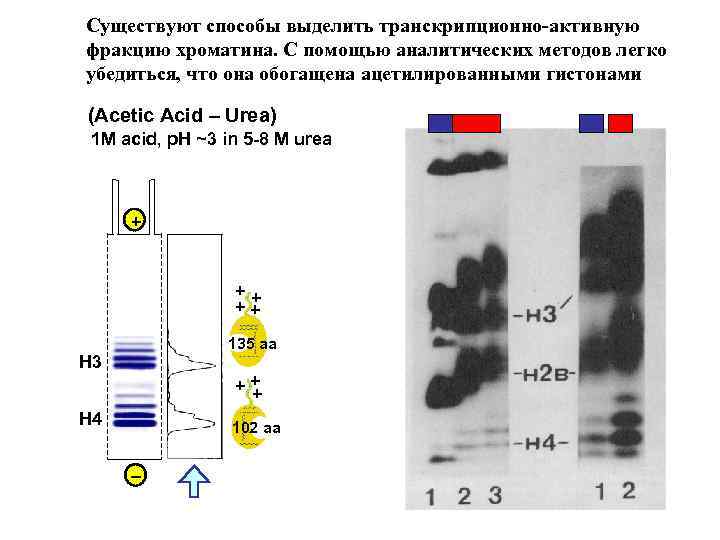 Существуют способы выделить транскрипционно-активную фракцию хроматина. С помощью аналитических методов легко убедиться, что она обогащена ацетилированными гистонами (Acetic Acid – Urea) 1 M acid, p. H ~3 in 5 -8 M urea + ++ ++ 135 aa H 3 ++ + H 4 102 aa _
Существуют способы выделить транскрипционно-активную фракцию хроматина. С помощью аналитических методов легко убедиться, что она обогащена ацетилированными гистонами (Acetic Acid – Urea) 1 M acid, p. H ~3 in 5 -8 M urea + ++ ++ 135 aa H 3 ++ + H 4 102 aa _
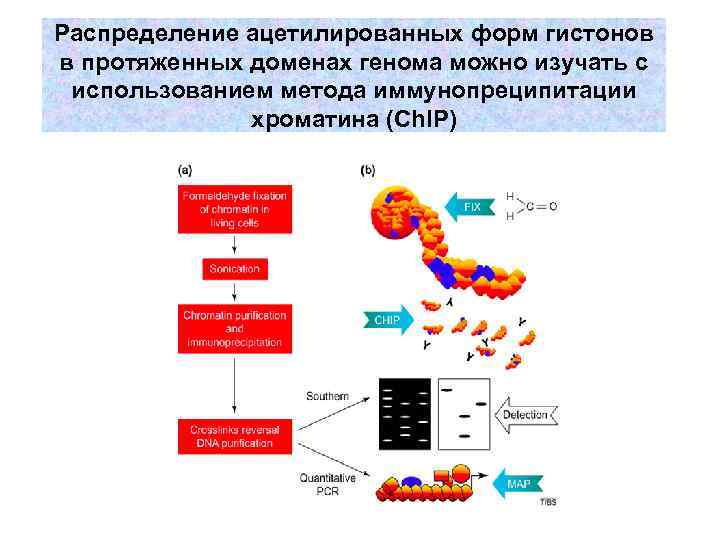 Распределение ацетилированных форм гистонов в протяженных доменах генома можно изучать с использованием метода иммунопреципитации хроматина (Ch. IP)
Распределение ацетилированных форм гистонов в протяженных доменах генома можно изучать с использованием метода иммунопреципитации хроматина (Ch. IP)
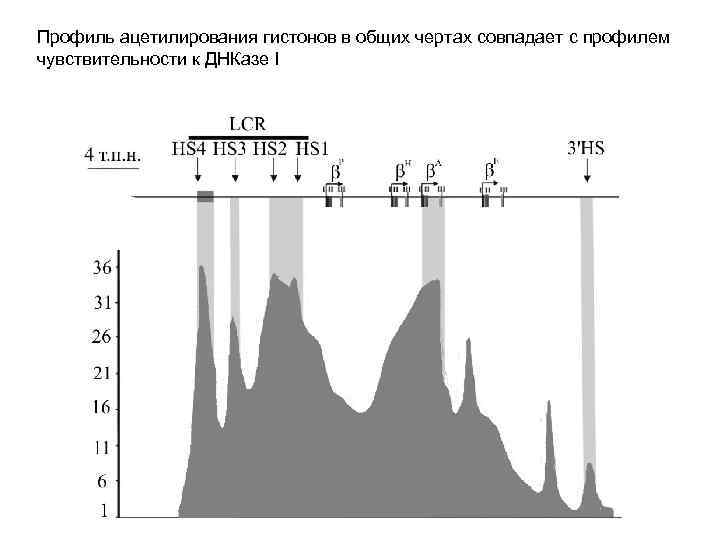 Профиль ацетилирования гистонов в общих чертах совпадает с профилем чувствительности к ДНКазе I
Профиль ацетилирования гистонов в общих чертах совпадает с профилем чувствительности к ДНКазе I
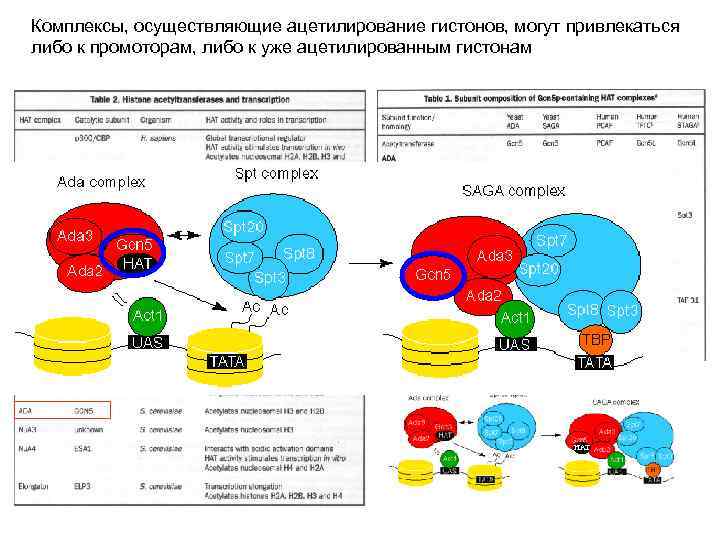 Комплексы, осуществляющие ацетилирование гистонов, могут привлекаться либо к промоторам, либо к уже ацетилированным гистонам HAT
Комплексы, осуществляющие ацетилирование гистонов, могут привлекаться либо к промоторам, либо к уже ацетилированным гистонам HAT
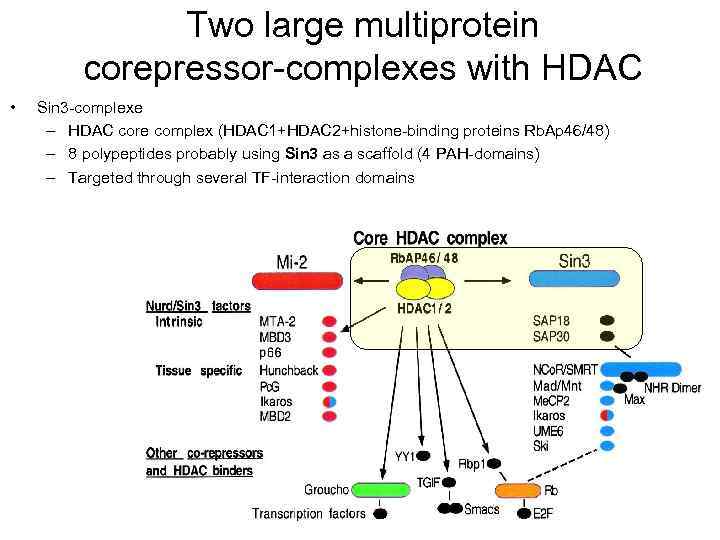 Two large multiprotein corepressor-complexes with HDAC • Sin 3 -complexe – HDAC core complex (HDAC 1+HDAC 2+histone-binding proteins Rb. Ap 46/48) – 8 polypeptides probably using Sin 3 as a scaffold (4 PAH-domains) – Targeted through several TF-interaction domains
Two large multiprotein corepressor-complexes with HDAC • Sin 3 -complexe – HDAC core complex (HDAC 1+HDAC 2+histone-binding proteins Rb. Ap 46/48) – 8 polypeptides probably using Sin 3 as a scaffold (4 PAH-domains) – Targeted through several TF-interaction domains
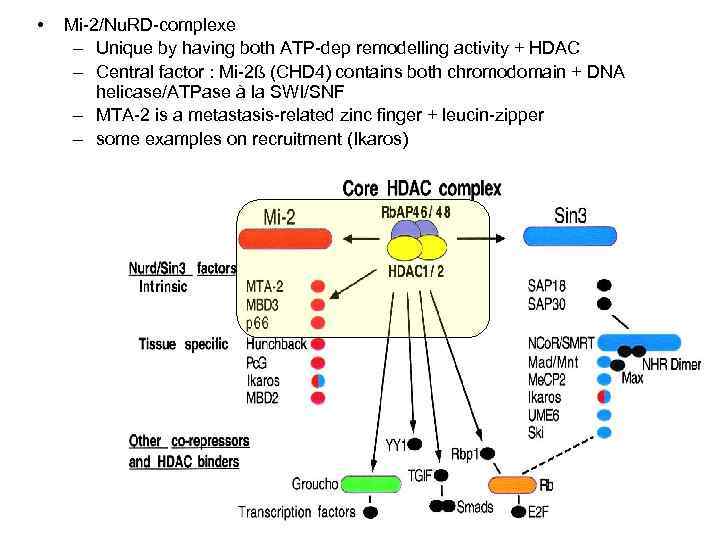 • Mi-2/Nu. RD-complexe – Unique by having both ATP-dep remodelling activity + HDAC – Central factor : Mi-2ß (CHD 4) contains both chromodomain + DNA helicase/ATPase à la SWI/SNF – MTA-2 is a metastasis-related zinc finger + leucin-zipper – some examples on recruitment (Ikaros)
• Mi-2/Nu. RD-complexe – Unique by having both ATP-dep remodelling activity + HDAC – Central factor : Mi-2ß (CHD 4) contains both chromodomain + DNA helicase/ATPase à la SWI/SNF – MTA-2 is a metastasis-related zinc finger + leucin-zipper – some examples on recruitment (Ikaros)
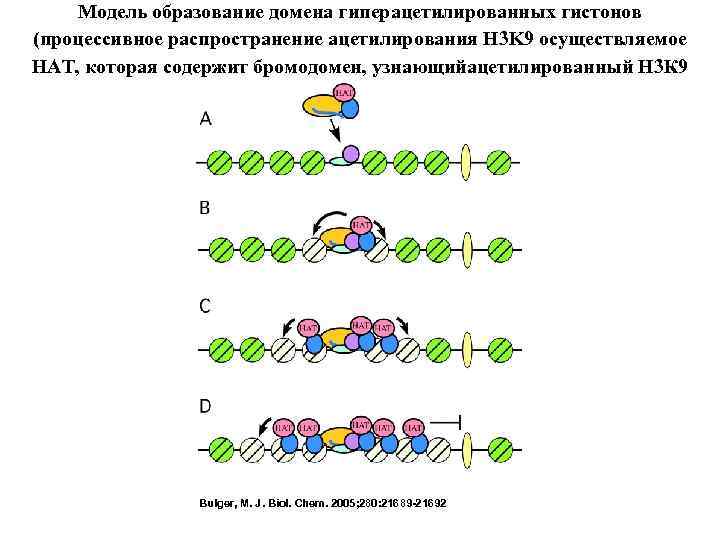 Модель образование домена гиперацетилированных гистонов (процессивное распространение ацетилирования H 3 K 9 осуществляемое HAT, которая содержит бромодомен, узнающийацетилированный Н 3 К 9 Bulger, M. J. Biol. Chem. 2005; 280: 21689 -21692
Модель образование домена гиперацетилированных гистонов (процессивное распространение ацетилирования H 3 K 9 осуществляемое HAT, которая содержит бромодомен, узнающийацетилированный Н 3 К 9 Bulger, M. J. Biol. Chem. 2005; 280: 21689 -21692
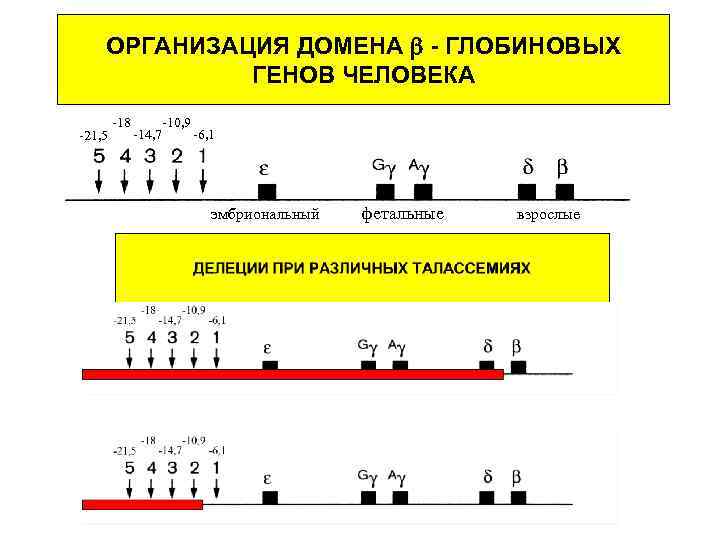 ОРГАНИЗАЦИЯ ДОМЕНА - ГЛОБИНОВЫХ ГЕНОВ ЧЕЛОВЕКА -21, 5 -18 -10, 9 -14, 7 -6, 1 эмбриональный фетальные взрослые
ОРГАНИЗАЦИЯ ДОМЕНА - ГЛОБИНОВЫХ ГЕНОВ ЧЕЛОВЕКА -21, 5 -18 -10, 9 -14, 7 -6, 1 эмбриональный фетальные взрослые
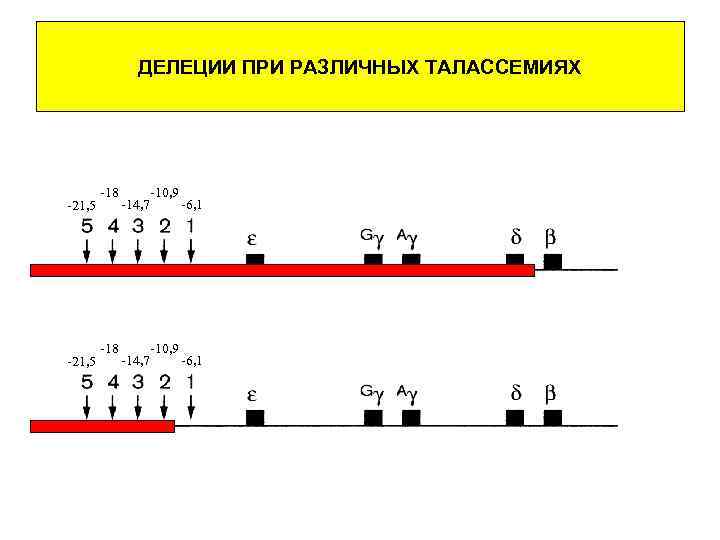 ДЕЛЕЦИИ ПРИ РАЗЛИЧНЫХ ТАЛАССЕМИЯХ -21, 5 -18 -10, 9 -14, 7 -6, 1
ДЕЛЕЦИИ ПРИ РАЗЛИЧНЫХ ТАЛАССЕМИЯХ -21, 5 -18 -10, 9 -14, 7 -6, 1
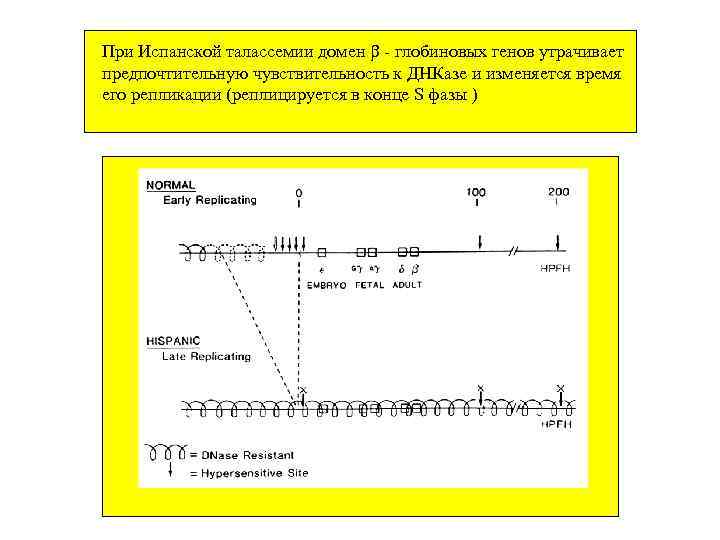 При Испанской талассемии домен - глобиновых генов утрачивает предпочтительную чувствительность к ДНКазе и изменяется время его репликации (реплицируется в конце S фазы )
При Испанской талассемии домен - глобиновых генов утрачивает предпочтительную чувствительность к ДНКазе и изменяется время его репликации (реплицируется в конце S фазы )
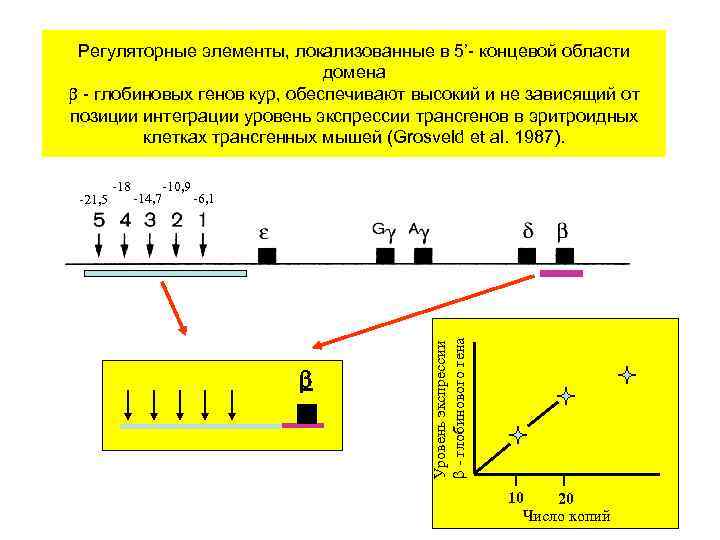 Регуляторные элементы, локализованные в 5’- концевой области домена - глобиновых генов кур, обеспечивают высокий и не зависящий от позиции интеграции уровень экспрессии трансгенов в эритроидных клетках трансгенных мышей (Grosveld et al. 1987). -18 -10, 9 -14, 7 -6, 1 Уровень экспрессии - глобинового гена -21, 5 10 20 Число копий
Регуляторные элементы, локализованные в 5’- концевой области домена - глобиновых генов кур, обеспечивают высокий и не зависящий от позиции интеграции уровень экспрессии трансгенов в эритроидных клетках трансгенных мышей (Grosveld et al. 1987). -18 -10, 9 -14, 7 -6, 1 Уровень экспрессии - глобинового гена -21, 5 10 20 Число копий


