578304 (1).pptx
- Количество слайдов: 12

Урок химии 10 класс Арены. Бензол. Подготовили: Шитов Игорь Назаров Андрей

• А • Р • Е • Н • Ы 1)Углеводороды с общей формулой Сn. Н 2 n+2 2) Частица с одним свободным электроном 3) Суффикс "ЕН", используется в названиях органических веществ для указания наличия в их молекуле двойной связи 4) Реакция взаимодействия органических веществ с азотной кислотой

АРЕНЫ. • Представитель - С 6 Н 6 бензол • Общая формула - Сn. Н 2 n-6

История открытия 1. Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменно -угольной смолы. Но вещество ни названия не получило, ни состав его не был известен. 2. Своё второе рождение бензол получил благодаря работам Фарадея. Бензол был открыт в 1825 году английским физиком Майклом Фарадеем, который выделил его из жидкого конденсата светильного газа. 3. В 1833 году немецкий физикохимик Эйльгард Мичерлих получил бензол при сухой перегонке кальциевой соли бензойной кислоты (именно от этого и произошло название бензол)
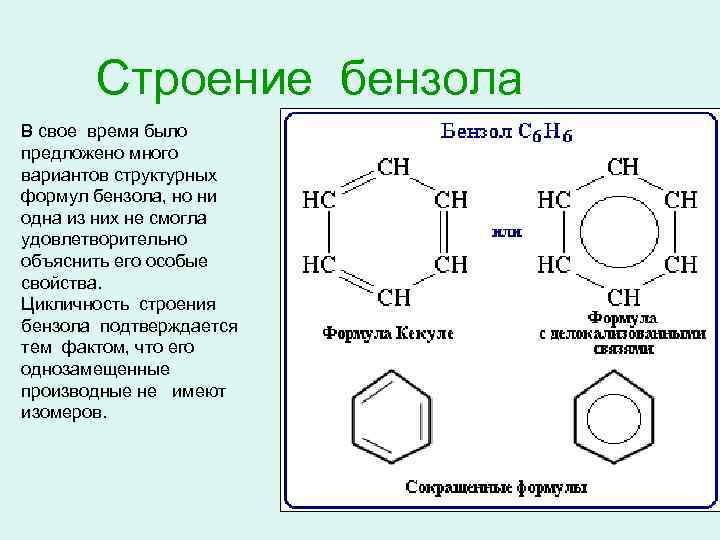
Строение бензола В свое время было предложено много вариантов структурных формул бензола, но ни одна из них не смогла удовлетворительно объяснить его особые свойства. Цикличность строения бензола подтверждается тем фактом, что его однозамещенные производные не имеют изомеров.

Получение • Бензол получают из каменноугольной смолы, образующейся при коксовании угля. • В настоящее время бензол получают из нефти. • Бензол получают синтетическими методами.

Другие способы получения • С 6 Н 14 С 6 Н 6 + 4 Н 2 • С 6 Н 12 С 6 Н 6 + 3 Н 2 • 3 С 2 Н 2 С 6 Н 6

Природные источники получения: • Природные и попутные газы • Нефть • Каменный уголь

Физические свойства • Бензол представляет собой бесцветную, легкоподвижную жидкость с температурой кипения +80ºС и температурой плавления + 5ºС. • Он обладает своеобразным запахом, горит сильно коптящим пламенем, легче воды и не растворяется в ней. • Пары бензола с воздухом образуют взрывчатую смесь.

Химические свойства 1. Горение бензола: 2 С 6 Н 6 + 15 О 2 = 12 СО 2 + 6 Н 2 О 2. Реакция замещения: С 6 Н 6 + Br 2 C 6 H 5 Br + HBr 3. Нитрование: С 6 Н 6 + НОNО 2 С 6 Н 5 NО 2 + Н 2 О 4. Гидрирование: С 6 Н 6 + 3 Н 2 С 6 Н 12 5. Хлорирование: С 6 Н 6 + 3 Cl 2 C 6 H 6 Cl 6
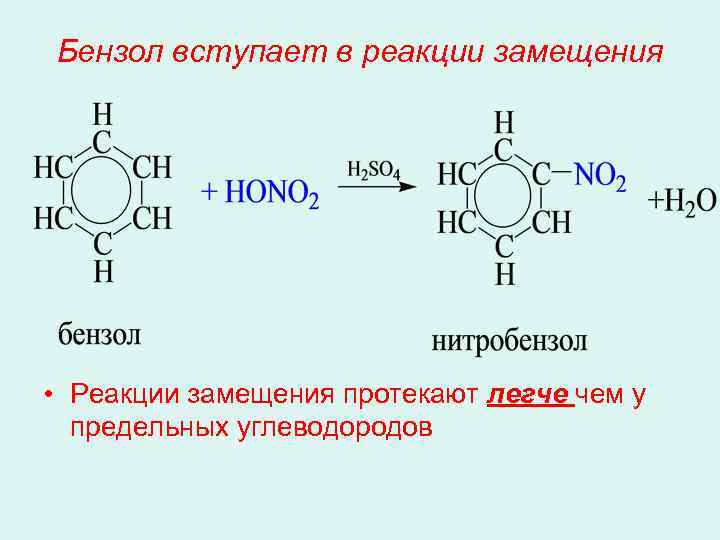
Бензол вступает в реакции замещения • Реакции замещения протекают легче чем у предельных углеводородов
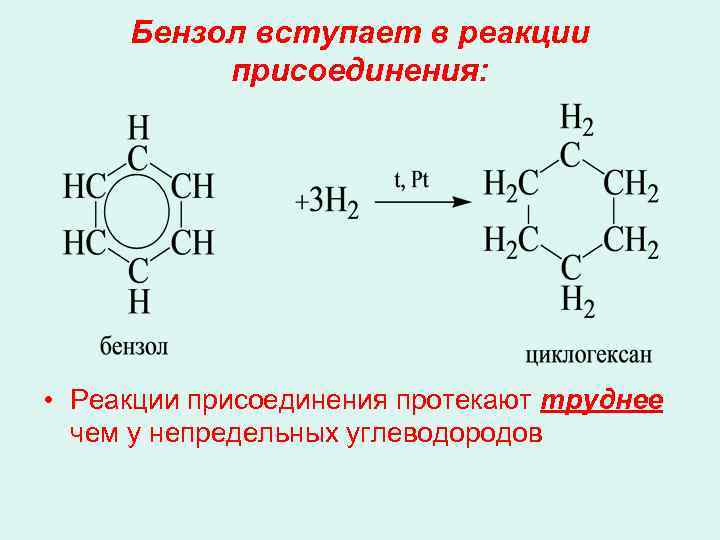
Бензол вступает в реакции присоединения: • Реакции присоединения протекают труднее чем у непредельных углеводородов
578304 (1).pptx