 УРОК В 8 КЛАССЕ ПО ТЕМЕ: «ОСНОВАНИЯ»
УРОК В 8 КЛАССЕ ПО ТЕМЕ: «ОСНОВАНИЯ»
 ЗАДАНИЕ ВЫБЕРИТЕ ИЗ ПЕРЕЧНЯ ВЕЩЕСТВ ФОРМУЛЫ ОКСИДОВ. ДАЙТЕ ИМ НАЗВАНИЯ. Сu. O CO 2 Na 2 O Cu(OH)2 N 2 KOH Cu(OH)2 AL(OH)3 Cs. OH Mg(OH)2 H 2 O Li 2 O P 2 O 5 Fe 2 O 3
ЗАДАНИЕ ВЫБЕРИТЕ ИЗ ПЕРЕЧНЯ ВЕЩЕСТВ ФОРМУЛЫ ОКСИДОВ. ДАЙТЕ ИМ НАЗВАНИЯ. Сu. O CO 2 Na 2 O Cu(OH)2 N 2 KOH Cu(OH)2 AL(OH)3 Cs. OH Mg(OH)2 H 2 O Li 2 O P 2 O 5 Fe 2 O 3
 ТЕМА УРОКА: Цель ОСНОВАНИЯ урока: познакомиться с новым классом веществ – основания изучить номенклатуру , классификацию , строение, свойства и применение оснований
ТЕМА УРОКА: Цель ОСНОВАНИЯ урока: познакомиться с новым классом веществ – основания изучить номенклатуру , классификацию , строение, свойства и применение оснований
 Основания – сложные вещества, состоящие из атомов металла и одной или нескольких групп ОН (гидроксильная группа). Общая формула – Ме(ОН)n где n – валентность металла.
Основания – сложные вещества, состоящие из атомов металла и одной или нескольких групп ОН (гидроксильная группа). Общая формула – Ме(ОН)n где n – валентность металла.
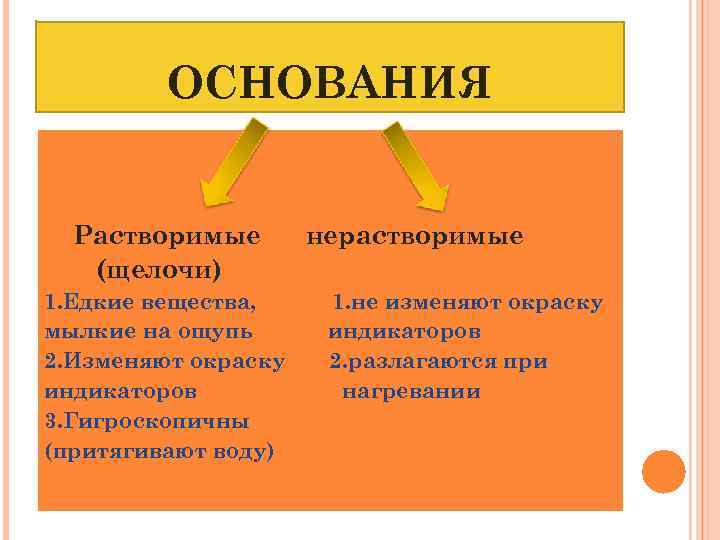 ОСНОВАНИЯ Растворимые (щелочи) 1. Едкие вещества, мылкие на ощупь 2. Изменяют окраску индикаторов 3. Гигроскопичны (притягивают воду) нерастворимые 1. не изменяют окраску индикаторов 2. разлагаются при нагревании
ОСНОВАНИЯ Растворимые (щелочи) 1. Едкие вещества, мылкие на ощупь 2. Изменяют окраску индикаторов 3. Гигроскопичны (притягивают воду) нерастворимые 1. не изменяют окраску индикаторов 2. разлагаются при нагревании
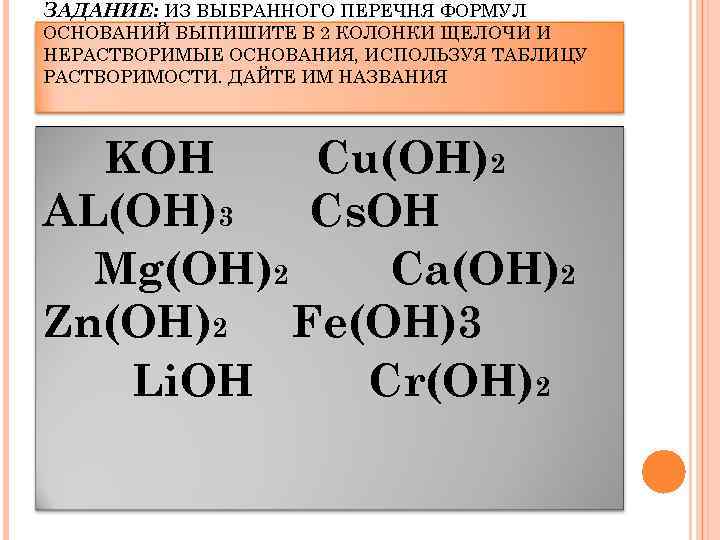 ЗАДАНИЕ: ИЗ ВЫБРАННОГО ПЕРЕЧНЯ ФОРМУЛ ОСНОВАНИЙ ВЫПИШИТЕ В 2 КОЛОНКИ ЩЕЛОЧИ И НЕРАСТВОРИМЫЕ ОСНОВАНИЯ, ИСПОЛЬЗУЯ ТАБЛИЦУ РАСТВОРИМОСТИ. ДАЙТЕ ИМ НАЗВАНИЯ KOH Cu(OH)2 AL(OH)3 Cs. OH Mg(OH)2 Ca(OH)2 Zn(OH)2 Fe(OH)3 Li. OH Cr(OH)2
ЗАДАНИЕ: ИЗ ВЫБРАННОГО ПЕРЕЧНЯ ФОРМУЛ ОСНОВАНИЙ ВЫПИШИТЕ В 2 КОЛОНКИ ЩЕЛОЧИ И НЕРАСТВОРИМЫЕ ОСНОВАНИЯ, ИСПОЛЬЗУЯ ТАБЛИЦУ РАСТВОРИМОСТИ. ДАЙТЕ ИМ НАЗВАНИЯ KOH Cu(OH)2 AL(OH)3 Cs. OH Mg(OH)2 Ca(OH)2 Zn(OH)2 Fe(OH)3 Li. OH Cr(OH)2
 ПОЛУЧЕНИЕ ОСНОВАНИЙ 1) Активный металл + вода: 2 Na + 2 H 2 O = 2 Na. OH + H 2 2) Оксид активного металла + вода: Ca. O +H 2 O= Ca (OH)2 3)Нерастворимые основания получают путем реакции обмена между солями и щелочами: Cu. Cl 2 + 2 Na. OH = Cu(OH)2 + 2 Na. Cl
ПОЛУЧЕНИЕ ОСНОВАНИЙ 1) Активный металл + вода: 2 Na + 2 H 2 O = 2 Na. OH + H 2 2) Оксид активного металла + вода: Ca. O +H 2 O= Ca (OH)2 3)Нерастворимые основания получают путем реакции обмена между солями и щелочами: Cu. Cl 2 + 2 Na. OH = Cu(OH)2 + 2 Na. Cl
 ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ взаимодействие с кислотами Na. OH+HCL=Na. CL+H 2 O взаимодействие щелочей кислотными оксидами Na. OH+CO 2=Na 2 CO 3+H 2 O разложение при нагревании нерастворимых оснований Cu(OH)2= Cu. O+H 2 O
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ взаимодействие с кислотами Na. OH+HCL=Na. CL+H 2 O взаимодействие щелочей кислотными оксидами Na. OH+CO 2=Na 2 CO 3+H 2 O разложение при нагревании нерастворимых оснований Cu(OH)2= Cu. O+H 2 O
 В. 1 Что такое основания? В. 2 Какие по растворимости бывают основания? В. 3 Каким оксидам соответствуют основания? Задание Составьте формулы гидроксидов, соответствующим им оксидам : K 2 O, Ba. O, Cr 2 O 3. Дайте им названия. Допишите уравнения реакции: Na 2 O+H 2 O= Na. OH+H 2 SO 4= Na. OH+CO 2= Na. OH+H 3 PO 4= Zn(OH)2=
В. 1 Что такое основания? В. 2 Какие по растворимости бывают основания? В. 3 Каким оксидам соответствуют основания? Задание Составьте формулы гидроксидов, соответствующим им оксидам : K 2 O, Ba. O, Cr 2 O 3. Дайте им названия. Допишите уравнения реакции: Na 2 O+H 2 O= Na. OH+H 2 SO 4= Na. OH+CO 2= Na. OH+H 3 PO 4= Zn(OH)2=
 ИСПОЛЬЗУЕМАЯ ЛИТЕРАТУРА: 1. Андреева Л. С. Урок по теме «Основания» . //Химия в школе. – 2009. № 3. с. 30 32. 2. Гара, Н. Н. Химия. Уроки в 8 классе : пособие для учителя / Н. Н. Гара. М. : Просвеще ние, 2009. 95 с. 3. Настольная книга учителя химии / авт. сост. Н. Н. Гара, Р. Г. Иванова, А. А. Каверина. М. : ACT : Астрель, 2002. 190 с. 3. Рудзитис Г. Е. , Фельдман. Химия. 8 класс. М: «Просвещение» , 2008. 176 с.
ИСПОЛЬЗУЕМАЯ ЛИТЕРАТУРА: 1. Андреева Л. С. Урок по теме «Основания» . //Химия в школе. – 2009. № 3. с. 30 32. 2. Гара, Н. Н. Химия. Уроки в 8 классе : пособие для учителя / Н. Н. Гара. М. : Просвеще ние, 2009. 95 с. 3. Настольная книга учителя химии / авт. сост. Н. Н. Гара, Р. Г. Иванова, А. А. Каверина. М. : ACT : Астрель, 2002. 190 с. 3. Рудзитис Г. Е. , Фельдман. Химия. 8 класс. М: «Просвещение» , 2008. 176 с.