Пять знаменитых химиков XVIII в.ppt
- Количество слайдов: 27

Урок –обобщение в 9 классе по теме «Азот и его соединения» МОБУ «СОШ № 1 с. Бураево 2/14/2018

Пять знаменитых химиков XVIII в. дали некоему неметаллу, который в виде простого вещества представляет собой газ и состоит из двухатомных молекул, пять разных имен. В 1772 году шотландский химик, - «ядовитый воздух» ботаник и врач Даниел Резерфорд - «дефлогистированный В 1772 году английский химик Джозеф Пристли воздух» В 1773 году шведский химик - «испорченный воздух» аптекарь Карл Шееле В 1774 году английский химик - «удушливый воздух» Генри Кавендиш - «безжизненный воздух» В 1776 году французский химик Антуан Лавуазье О каком неметалле идет речь?


Парадоксы названия l l Что означает в переводе с греческого «азот» ? Каково латинское название азота? Что оно означает в переводе на русский язык? Каково содержание азота в атмосфере? Почему же азот называют «безжизненным» ?

Какие соединения азота вы знаете? NH 3 N 2 O NO 2 N 2 O 3 HNO 2 N 2 O 5 n NO Me. N Определите степени окисления азота в соединениях.

N 2 • Каковы физические свойства азота? • Почему азот химически инертен при обычных условиях? • При каких условиях и с какими веществами он взаимодействует?

NH 3 n n n «летучая щелочь» «щелочной воздух» Раствор аммиака в воде – нашатырный спирт. Но почему спирт? Латинское spiritus означает «дух» , «душа» . Очевидно химик растворивший в воде аммиак, полученный из нашатыря (NH 4 Cl), назвал осторо пахнущую жидкость «душой нашатыря» . n n В 1774 г. Английский химик Джозеф Пристли получил газообразный аммиак смешав порошки хлорида аммония и гидроксида кальция (Напишите уравнение реакции). Когда ученый попытался собрать аммиак путем вытеснения жидкости из перевернутого сосуда, то газ растворялся в воде. Как Пристли удалось собрать газ?

Горение аммиака n +О 2 ( с кат-ром)=N 2 О +Н 2 О NH 3 +О 2 ( без кат-ра)=N 2 +Н 2 О

Применение

Оксидов у азота – пять. И нам давно пора уж знать, Их нравы, вкусы, настроенье, Манеру жизни, поведенье.

Оксид азота (I) монооксид диазота «веселящий газ» N 2 O o Бесцветный газ со o Несолеобразующ слабым приятным ий оксид. запахом и o Можно получить сладковатым термическим привкусом. разложением o В смеси с воздухом нитрата аммония. он действует на o Данный оксид людей по-разному – неустойчив и кого «веселит» , а кого погружает в сон. легко разлагается на азот и o Применяют в медицине, кислород. обеспечивая безопасный наркоз. Напишите уравнения упомянутых реакций

Оксид азота (II) – монооксид азота n Легко окисляется кислородом воздуха до оксида азота (IV) NO n Восстанавливается водородом до свободного азота. Напишите уравнения упомянутых реакций

Оксид азота (III) N 2 O 3 l l l Жидкость темносинего цвета. Кислотный оксид. Получают охлаждением смеси оксидов азота (II) и (IV). l l При взаимодействии с водой образуются азотистая кислота Оксид взаимодействует со щелочью. Составьте уравнения реакций

Оксид азота (IV) – диоксид азота, «бурый газ» , «лисий хвост» NO 2 o При взаимодействии с o Газ с резким водой образуются запахом, хорошо азотистая и азотная растворим в воде. кислоты o !!! Токсичен. o Если это кислотный o Получают оксид, то с какими окислением NO и веществами он будет взаимодействием взаимодействовать? концентрирован. Напишите уравнения ной азотной реакций. кислоты с медью.

Оксид азота (V) N 2 O 5 o Кислотный оксид. o При взаимодействии с o Белое твердое вещество, хорошо водой образуются растворимое в воде. азотная кислота o Получают o Взаимодействует с осторожным водой и щелочами. обезвоживанием o Очень неустойчив, азотной кислоты с разлагается со помощью оксида взрывом на фосфора (V) или кислород и оксид действием озона на оксид азота (IV). Напишите уравнения реакций.

Опыты Каблукова Российский химик Иван Каблуков преподавал в Московском университете. Однажды он показал своим студентам удивительный опыт с четырьмя газометрами наполненными ртутью, где хранились четыре газа – два бесцветных, а два другие – красно-бурого цвета. Каблуков пропускал поочередно эти газы над раскаленной медной стружкой и показывал, что каждый раз получаются одни и те же продукты: оксид меди (I) и азот. Студенты терялись в догадках – как такое стало возможно? Помогите найти объяснение опытам Каблукова.

- Это вещество было описано арабским химиком в VIII веке Джабиром ибн Хайяном (Гебер) в его труде «Ямщик мудрости» , а с ХV века это вещество добывалось для производственных целей - Благодаря этому веществу русский учёный В. Ф. Петрушевский в 1866 году впервые получил динамит. - Это вещество является компонентом ракетного топлива, его использовали для двигателя первого в мире советского реактивного самолёта БИ – 1 -Это вещество – прародитель большинства взрывчатых веществ (например, тротила, или тола) - Это вещество в смеси с соляной кислотой растворяет платину и золото, признанное «царём» металлов. Сама смесь, состоящая из 1 -ого объёма этого вещества и 3 -ёх объёмов соляной кислоты, называется «царской водкой» .

HNO 2 HNO 3 Азотистая кислота Азотная кислота n n n Какая из кислот более сильная? Как называются соли данных кислот? Окислителем или восстановителем могут быть данные кислоты? В чем заключается особая опасность азотной кислоты? С какими веществами реагируют эти кислоты?
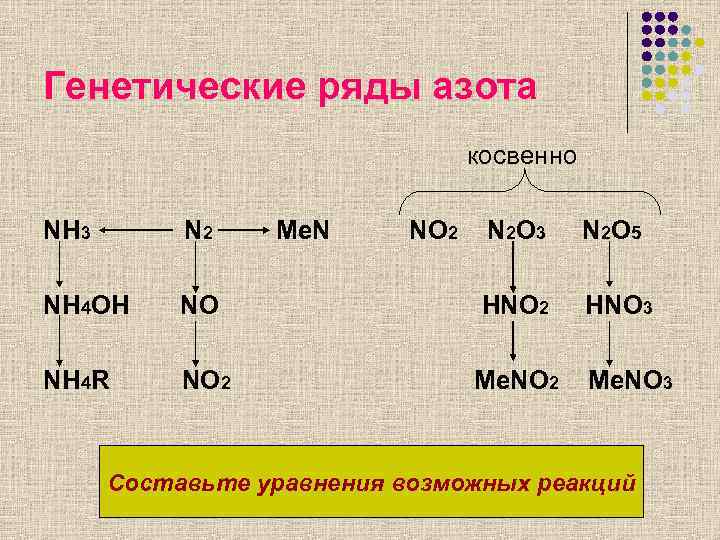
Генетические ряды азота косвенно NH 3 N 2 Me. N NO 2 N 2 O 3 N 2 O 5 NH 4 OH NO HNO 2 HNO 3 NH 4 R NO 2 Me. NO 2 Me. NO 3 Составьте уравнения возможных реакций

Свойства азотной кислоты
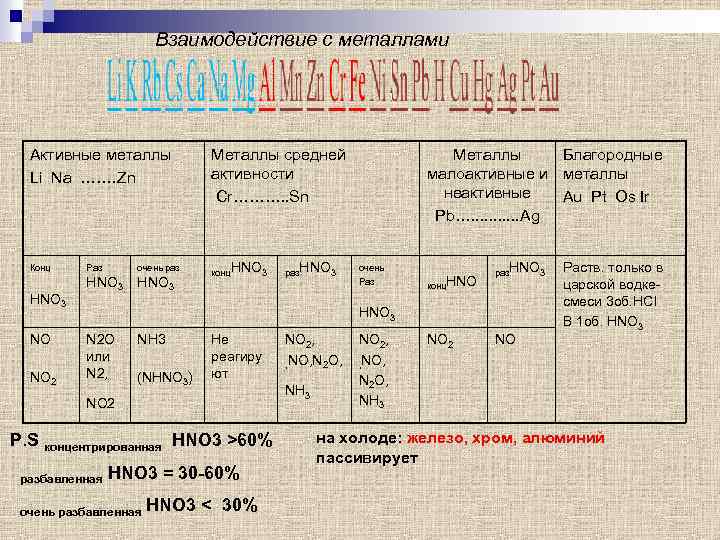
Взаимодействие с металлами Активные металлы Li Na ……. Zn Металлы средней активности Cr………. . Sn Конц конц. HNO 3 NO NO 2 Раз очень раз HNO 3 раз. HNO 3 Металлы Благородные малоактивные и металлы неактивные Au Pt Os Ir Pb…. . . Ag очень Раз конц. HNO раз. HNO 3 N 2 O или N 2, NH 3 (NHNO 3) Не реагиру ют NO 2 P. S концентрированная HNO 3 >60% разбавленная HNO 3 = 30 -60% очень разбавленная HNO 3 < 30% NO 2, , NO, N 2 O, NH 3 NO 2 Раств. только в царской водкесмеси 3 об. HCl B 1 об. HNO 3 NO на холоде: железо, хром, алюминий пассивирует

Промышленный способ получения азотной кислоты был открыт в 1916 году инженером-химиком И. И. Андреевым. На какие три этапа можно разделить данный процесс?

Разложение нитратов

Роль азотных соединений в жизни человека и общества велика, а применение разнообразно. l Азот – основа жизни на земле. l На Земле постоянно происходят процессы превращения веществ живой и неживой природы. В результате этих превращений неорганические вещества неживой природы – соли аммония, нитраты, могут превращаться в сложные органические вещества – белки. А белки – это основа всего живого. В белках содержится 18% азота. «Жизнь – есть способ существования белковых тел» Ф. Энгельс Без азота → нет белка →без белка →нет жизни.

Проверь себя: Степень окисления азота в HNO 3 а)-3 б)0 в)+5 г)+4 2. При хранении на свету HNO 3 а) краснеет б) желтеет в) остается бесцветной 3. При взаимодействии с металлами азотная кислота является: а)окислителем, б)восстановителем, в)и тем, и другим. 4. Азотная кислота в растворе не реагирует с веществом, формула которого: а) CO 2 ; б) Na. OH; в) Al(OH)3 ; г) NH 3. 5. Царская водка- это а)концентрированный спирт б)3 объема HCl и 1 объем HNO 3 в) концентрированная азотная кислота 1.

ключ l 1 - в l 2 - б l 3 - а l 4 - а l 5 - б

Пять знаменитых химиков XVIII в.ppt