9М_14-15_9.pptx
- Количество слайдов: 22
 Урок 9 M класса. Электролитическая диссоциация. 14. 09. 2016 1
Урок 9 M класса. Электролитическая диссоциация. 14. 09. 2016 1
 Вода как растворитель 14. 09. 2016 2
Вода как растворитель 14. 09. 2016 2
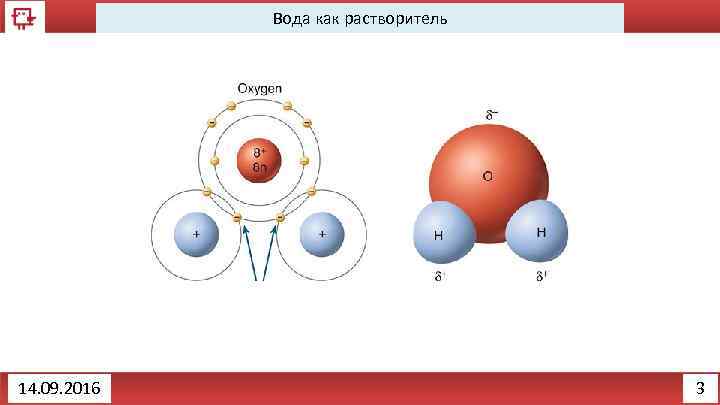 Вода как растворитель 14. 09. 2016 3
Вода как растворитель 14. 09. 2016 3
 Вода как растворитель Вещества с какой связь лучше будут растворяться в воде? • С ковалентной неполярной • С ковалентной полярной • С ионной • С металлической 14. 09. 2016 4
Вода как растворитель Вещества с какой связь лучше будут растворяться в воде? • С ковалентной неполярной • С ковалентной полярной • С ионной • С металлической 14. 09. 2016 4
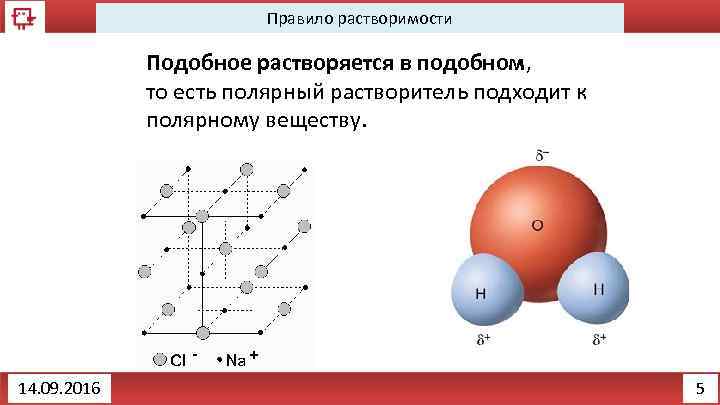 Правило растворимости Подобное растворяется в подобном, то есть полярный растворитель подходит к полярному веществу. 14. 09. 2016 5
Правило растворимости Подобное растворяется в подобном, то есть полярный растворитель подходит к полярному веществу. 14. 09. 2016 5
 Гидратация – присоединение воды к ионам, атомам или молекулам. Продукты такого процесса называют гидратами. Обратная реакция называется дегидратацией. 14. 09. 2016 6
Гидратация – присоединение воды к ионам, атомам или молекулам. Продукты такого процесса называют гидратами. Обратная реакция называется дегидратацией. 14. 09. 2016 6
 Гидратация Кристаллогидраты – кристаллические вещества, в состав которых входит химически связанная вода. Такую воду называют кристаллизационной водой. 14. 09. 2016 7
Гидратация Кристаллогидраты – кристаллические вещества, в состав которых входит химически связанная вода. Такую воду называют кристаллизационной водой. 14. 09. 2016 7
 Урок 9 M класса. Электролитическая диссоциация. 15. 09. 2016 1
Урок 9 M класса. Электролитическая диссоциация. 15. 09. 2016 1
 Основные положения электролитической диссоциации Основные положения теории электролитической диссоциации: 1. Электролиты при растворении или плавлении распадаются на ионы (диссоциируют) – положительные и отрицательные. 2. Под действием электрического тока ионы приобретают направленное движение: положительные ионы стремятся к катоду, отрицательные - к аноду. 3. Направленное движение происходит в результате притяжения их противоположно заряженными электродами. 4. Диссоциация – обратимый процесс: одновременно вещество распадается на ионы и ионы собираются в вещество. 15. 09. 2016 2
Основные положения электролитической диссоциации Основные положения теории электролитической диссоциации: 1. Электролиты при растворении или плавлении распадаются на ионы (диссоциируют) – положительные и отрицательные. 2. Под действием электрического тока ионы приобретают направленное движение: положительные ионы стремятся к катоду, отрицательные - к аноду. 3. Направленное движение происходит в результате притяжения их противоположно заряженными электродами. 4. Диссоциация – обратимый процесс: одновременно вещество распадается на ионы и ионы собираются в вещество. 15. 09. 2016 2
 Диссоциация разных веществ Диссоциировать могут соли, кислоты, щелочки. Наиболее хорошо диссоцируют вещества с ионной связью (большой разностью электроотрицательностей). 2 H 2 O H 3 O+ К и с л о т ы 15. 09. 2016 Ион гидроксония HCl H+ + Cl. HCl + H 2 O H 3 O+ + Cl. HNO 3 + n. H 2 O H 3 O+ + NO 3 - + m. H 2 O HNO 3 NO 3 - + H+ 3
Диссоциация разных веществ Диссоциировать могут соли, кислоты, щелочки. Наиболее хорошо диссоцируют вещества с ионной связью (большой разностью электроотрицательностей). 2 H 2 O H 3 O+ К и с л о т ы 15. 09. 2016 Ион гидроксония HCl H+ + Cl. HCl + H 2 O H 3 O+ + Cl. HNO 3 + n. H 2 O H 3 O+ + NO 3 - + m. H 2 O HNO 3 NO 3 - + H+ 3
 Диссоциация кислот Кислоты – такие вещества, при диссоциации в водных растворах которых в качестве катиона отщепляется только водород (или гидроксония ион). 2 H 2 O H+ + OHК и с л о т ы 15. 09. 2016 HCl H+ + Cl. HCl + H 2 O H 3 O+ + Cl. HNO 3 + n. H 2 O H 3 O+ + NO 3 - + m. H 2 O HNO 3 NO 3 - + H+ 4
Диссоциация кислот Кислоты – такие вещества, при диссоциации в водных растворах которых в качестве катиона отщепляется только водород (или гидроксония ион). 2 H 2 O H+ + OHК и с л о т ы 15. 09. 2016 HCl H+ + Cl. HCl + H 2 O H 3 O+ + Cl. HNO 3 + n. H 2 O H 3 O+ + NO 3 - + m. H 2 O HNO 3 NO 3 - + H+ 4
 Диссоциация кислот H 2 SO 4 HSO 4 - + H+ HSO 4 - SO 42 - + H+ H 3 PO 4 H+ +H 2 PO 4 - дигидроортофосфат ион H 2 PO 4 - H+ +HPO 42 - гидроортофосфат ион HPO 42 - H+ + PO 43 - ортофосфат ион 15. 09. 2016 5
Диссоциация кислот H 2 SO 4 HSO 4 - + H+ HSO 4 - SO 42 - + H+ H 3 PO 4 H+ +H 2 PO 4 - дигидроортофосфат ион H 2 PO 4 - H+ +HPO 42 - гидроортофосфат ион HPO 42 - H+ + PO 43 - ортофосфат ион 15. 09. 2016 5
 Диссоциация щелочей Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH -). 2 H 2 O H+ + OHЩ е л о ч и 15. 09. 2016 Гидроксид-ион Na. OH Na+ + OHBa(ОН)2 Bа(ОН)+ + OH- Ba(OH)+ Ba 2++OH 6
Диссоциация щелочей Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы (OH -). 2 H 2 O H+ + OHЩ е л о ч и 15. 09. 2016 Гидроксид-ион Na. OH Na+ + OHBa(ОН)2 Bа(ОН)+ + OH- Ba(OH)+ Ba 2++OH 6
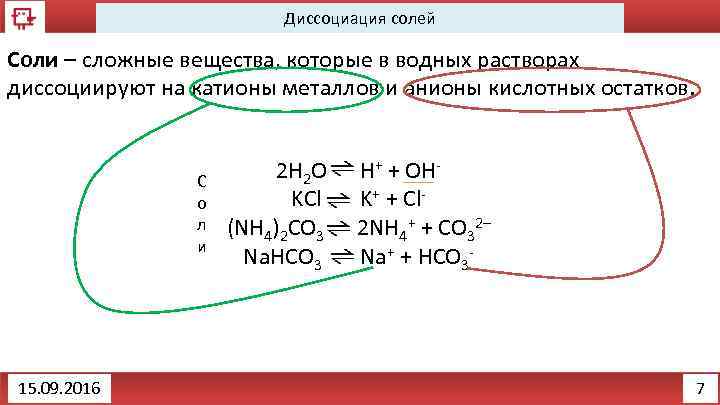 Диссоциация солей Соли – сложные вещества, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков. С о л и 15. 09. 2016 2 H 2 O H+ + OHKCl K+ + Cl(NH 4)2 CO 3 2 NH 4+ + CO 32– Na. HCO 3 Na+ + HCO 3 - 7
Диссоциация солей Соли – сложные вещества, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков. С о л и 15. 09. 2016 2 H 2 O H+ + OHKCl K+ + Cl(NH 4)2 CO 3 2 NH 4+ + CO 32– Na. HCO 3 Na+ + HCO 3 - 7
 Сильные и слабые электролиты Бывают электролиты распадающиеся полностью, например: Na. OH Na+ + OHБывают электролиты распадающиеся не полностью: H 2 CO 3 H+ + HCO 3 Сильные электролиты – химические соединения, которые при растворении в воде полностью распадаются на ионы. В 0. 1 М растворе больше 30%. Слабые электролиты – соединения, которые незначительно диссоциируют на ионы. В 0. 1 М растворе менее 3%. 15. 09. 2016 8
Сильные и слабые электролиты Бывают электролиты распадающиеся полностью, например: Na. OH Na+ + OHБывают электролиты распадающиеся не полностью: H 2 CO 3 H+ + HCO 3 Сильные электролиты – химические соединения, которые при растворении в воде полностью распадаются на ионы. В 0. 1 М растворе больше 30%. Слабые электролиты – соединения, которые незначительно диссоциируют на ионы. В 0. 1 М растворе менее 3%. 15. 09. 2016 8
 Сильные и слабые электролиты Бывают электролиты распадающиеся полностью, например: Na. OH Na+ + OHБывают электролиты распадающиеся не полностью: Молярная доля H 2 CO 3 H+ + HCO 3 М = vi/vобщ Сильные электролиты – химические соединения, которые при растворении в воде полностью распадаются на ионы. В 0. 1 М растворе больше 30%. Слабые электролиты – соединения, которые незначительно диссоциируют на ионы. В 0. 1 М растворе менее 3%. 15. 09. 2016 8
Сильные и слабые электролиты Бывают электролиты распадающиеся полностью, например: Na. OH Na+ + OHБывают электролиты распадающиеся не полностью: Молярная доля H 2 CO 3 H+ + HCO 3 М = vi/vобщ Сильные электролиты – химические соединения, которые при растворении в воде полностью распадаются на ионы. В 0. 1 М растворе больше 30%. Слабые электролиты – соединения, которые незначительно диссоциируют на ионы. В 0. 1 М растворе менее 3%. 15. 09. 2016 8
 Степень диссоциации Различить слабые электролиты и сильные электролиты помогает показатель степень диссоциации (α). Степень диссоциации (α) – отношение числа молекул, распавшихся (n) на ионы к общему числу растворенных молекул (N). 15. 09. 2016 9
Степень диссоциации Различить слабые электролиты и сильные электролиты помогает показатель степень диссоциации (α). Степень диссоциации (α) – отношение числа молекул, распавшихся (n) на ионы к общему числу растворенных молекул (N). 15. 09. 2016 9
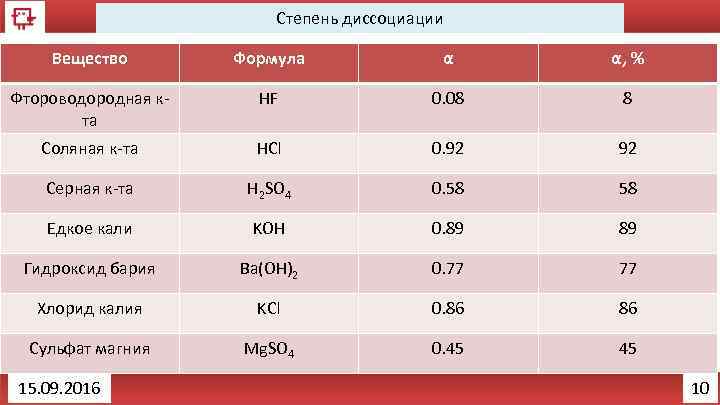 Степень диссоциации Вещество Формула α α, % Фтороводородная кта HF 0. 08 8 Соляная к-та HCl 0. 92 92 Серная к-та H 2 SO 4 0. 58 58 Едкое кали KOH 0. 89 89 Гидроксид бария Ba(OH)2 0. 77 77 Хлорид калия KCl 0. 86 86 Сульфат магния Mg. SO 4 0. 45 45 15. 09. 2016 10
Степень диссоциации Вещество Формула α α, % Фтороводородная кта HF 0. 08 8 Соляная к-та HCl 0. 92 92 Серная к-та H 2 SO 4 0. 58 58 Едкое кали KOH 0. 89 89 Гидроксид бария Ba(OH)2 0. 77 77 Хлорид калия KCl 0. 86 86 Сульфат магния Mg. SO 4 0. 45 45 15. 09. 2016 10
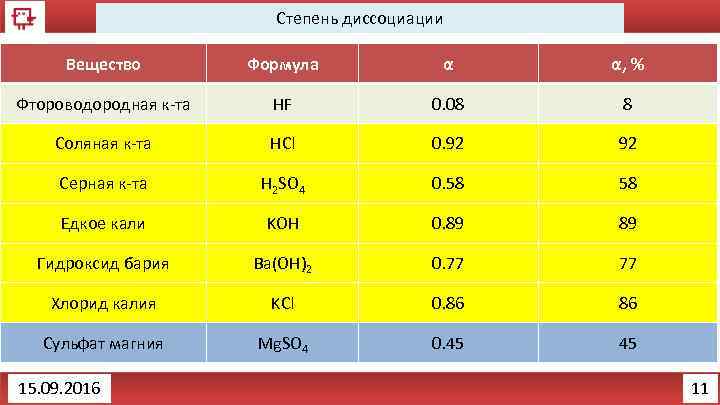 Степень диссоциации Вещество Формула α α, % Фтороводородная к-та HF 0. 08 8 Соляная к-та HCl 0. 92 92 Серная к-та H 2 SO 4 0. 58 58 Едкое кали KOH 0. 89 89 Гидроксид бария Ba(OH)2 0. 77 77 Хлорид калия KCl 0. 86 86 Сульфат магния Mg. SO 4 0. 45 45 15. 09. 2016 11
Степень диссоциации Вещество Формула α α, % Фтороводородная к-та HF 0. 08 8 Соляная к-та HCl 0. 92 92 Серная к-та H 2 SO 4 0. 58 58 Едкое кали KOH 0. 89 89 Гидроксид бария Ba(OH)2 0. 77 77 Хлорид калия KCl 0. 86 86 Сульфат магния Mg. SO 4 0. 45 45 15. 09. 2016 11
 Степень диссоциации Нужно отметить, что при диссоциации электролита происходит увеличение количества частиц в растворе. Al(OH)3 – 1 М Сколько частичек в банках? Al(OH)3 Al(OH)2 - + OH 15. 09. 2016 HI – 1 M HI H+ + I 12
Степень диссоциации Нужно отметить, что при диссоциации электролита происходит увеличение количества частиц в растворе. Al(OH)3 – 1 М Сколько частичек в банках? Al(OH)3 Al(OH)2 - + OH 15. 09. 2016 HI – 1 M HI H+ + I 12
 Степень диссоциации Давайте считать! Взяли 154 г. Ba(OH)2, потом растворили в воде. Сколько частиц оказалось в растворе? 15. 09. 2016 13
Степень диссоциации Давайте считать! Взяли 154 г. Ba(OH)2, потом растворили в воде. Сколько частиц оказалось в растворе? 15. 09. 2016 13
 Степень диссоциации Дано: 171 г. Ba(OH)2 α - 77% МВа – 137 г/моль МО – 16 г/моль МН – 1 г/моль n частиц в растворе - ? МВа(ОН)2 = Мва + МО + МН = =137 [г/моль] + 2*16 [г/моль] + 2*1 [г/моль] = МВа(ОН)2 = 171 [г/моль] ν = 171 [г] / 171 [г/моль] = 1 [моль] N = ν * NA = 1 [моль] * 6, 02· 10²³ [моль⁻¹] = 6, 02· 10²³ α *N = n = 0. 77* 6, 02· 10²³ = 5· 10²³ + cсколько вещества осталось 15. 09. 2016 14
Степень диссоциации Дано: 171 г. Ba(OH)2 α - 77% МВа – 137 г/моль МО – 16 г/моль МН – 1 г/моль n частиц в растворе - ? МВа(ОН)2 = Мва + МО + МН = =137 [г/моль] + 2*16 [г/моль] + 2*1 [г/моль] = МВа(ОН)2 = 171 [г/моль] ν = 171 [г] / 171 [г/моль] = 1 [моль] N = ν * NA = 1 [моль] * 6, 02· 10²³ [моль⁻¹] = 6, 02· 10²³ α *N = n = 0. 77* 6, 02· 10²³ = 5· 10²³ + cсколько вещества осталось 15. 09. 2016 14


