Урок 9 класса Углерод Металлы ОГЭ: По
















9m_2_12.pptx
- Размер: 2.2 Мб
- Автор:
- Количество слайдов: 21
Описание презентации Урок 9 класса Углерод Металлы ОГЭ: По по слайдам
 Урок 9 класса Углерод Металлы
Урок 9 класса Углерод Металлы
 ОГЭ: По четвергм в 410 в 17: 00 до 18:
ОГЭ: По четвергм в 410 в 17: 00 до 18:
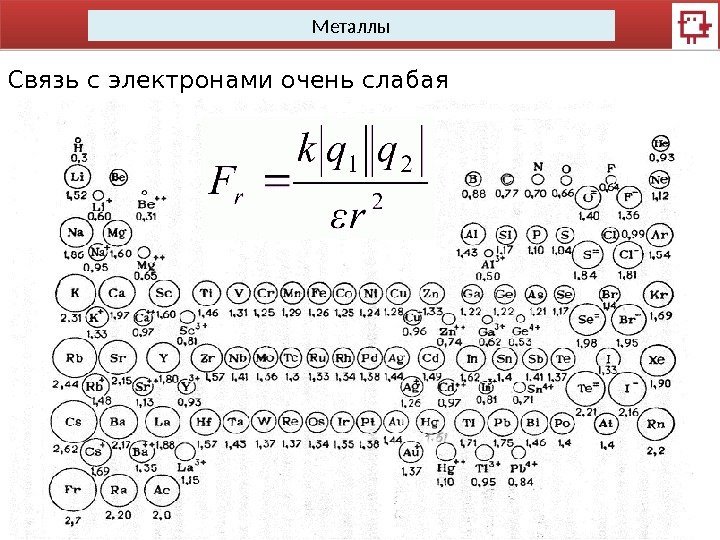
 Металлы Связь с электронами очень слабая
Металлы Связь с электронами очень слабая
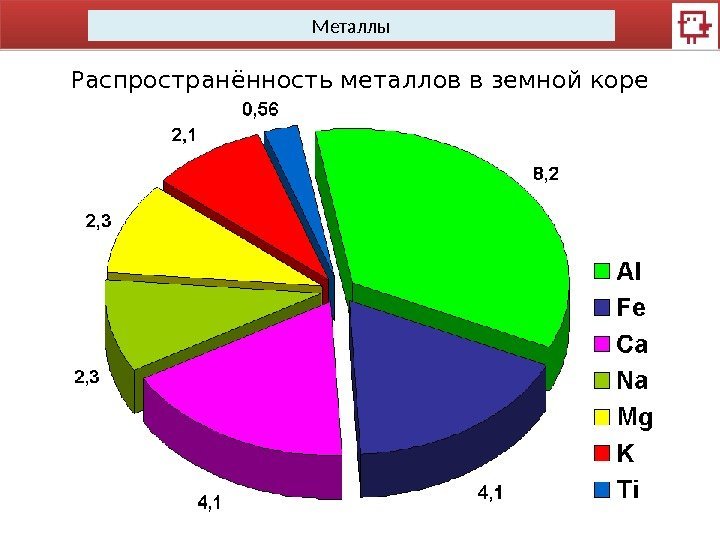
 Металлы Распространённость металлов в земной коре
Металлы Распространённость металлов в земной коре
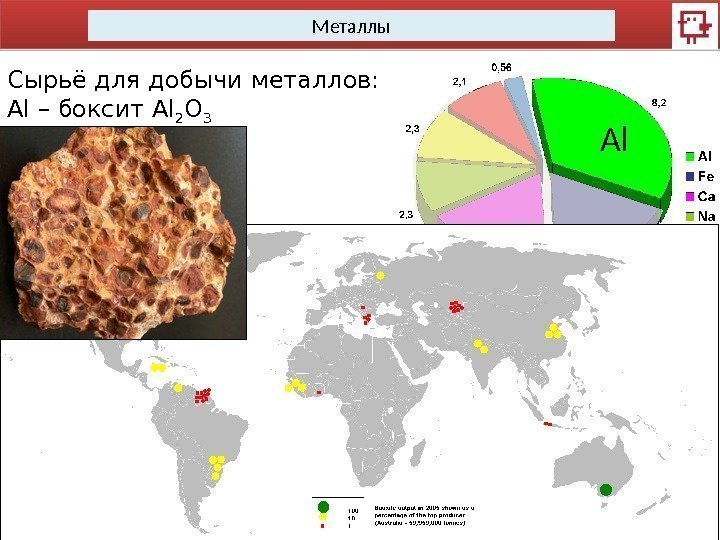
 Металлы Сырьё для добычи металлов: Al – боксит Al 2 O 3 Al
Металлы Сырьё для добычи металлов: Al – боксит Al 2 O 3 Al
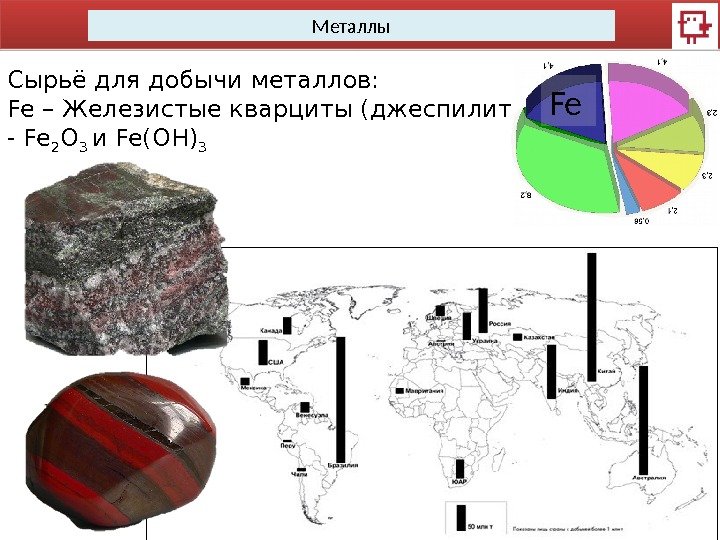
 Металлы Сырьё для добычи металлов: Fe – Железистые кварциты (джеспилиты) — — Fe 2 O 3 и Fe(OH) 3 Fe
Металлы Сырьё для добычи металлов: Fe – Железистые кварциты (джеспилиты) — — Fe 2 O 3 и Fe(OH) 3 Fe
 Металлы Сырьё для добычи металлов: Ti – ильменит-гематитовые габбро Ti Ильменит – Fe. Ti. O 3 Горная порода габбро
Металлы Сырьё для добычи металлов: Ti – ильменит-гематитовые габбро Ti Ильменит – Fe. Ti. O 3 Горная порода габбро
 Металлы Нахождение металлов в природе Активные : — Хлориды Na. Cl, KCl, Mg. Cl; — Сульфаты Na 2 SO 4 , Ca. SO 4 , Mg. SO 4 ; — Нитраты Na. NO 3 , KNO 3 ; — Ортофосфаты Ca 3 (PO 4) 2 Средней активности: — Оксиды Fe 2 O 3 , Fe 3 O 4 , Cr 2 O 3 ; — Сульфиды Pb. S, Hg. S, Zn. S Благородные: — В самородном виде Ag, Au, Pt
Металлы Нахождение металлов в природе Активные : — Хлориды Na. Cl, KCl, Mg. Cl; — Сульфаты Na 2 SO 4 , Ca. SO 4 , Mg. SO 4 ; — Нитраты Na. NO 3 , KNO 3 ; — Ортофосфаты Ca 3 (PO 4) 2 Средней активности: — Оксиды Fe 2 O 3 , Fe 3 O 4 , Cr 2 O 3 ; — Сульфиды Pb. S, Hg. S, Zn. S Благородные: — В самородном виде Ag, Au, Pt
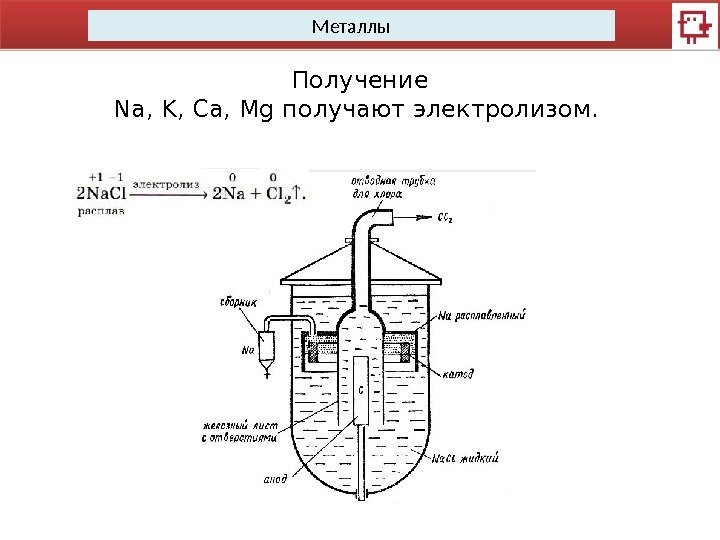
 Металлы Получение Na, K, Ca, Mg получают электролизом.
Металлы Получение Na, K, Ca, Mg получают электролизом.
 Металлы Получение Менее активные металлы получают восстановлением с С, CO или Al. Sn. O 2 + C = Fe 2 O 3 + CO = Mn. O 2 + Al =
Металлы Получение Менее активные металлы получают восстановлением с С, CO или Al. Sn. O 2 + C = Fe 2 O 3 + CO = Mn. O 2 + Al =
 Металлы Получение Менее активные металлы получают восстановлением с С, CO или Al. Сульфиды сначала обжигают. Zn. S + O 2 = Zn. O + C =
Металлы Получение Менее активные металлы получают восстановлением с С, CO или Al. Сульфиды сначала обжигают. Zn. S + O 2 = Zn. O + C =
 Металлы Химические свойства. На свежем разрезе, s-металлы имеют блестящую поверхности, но вступая в реакцию с кислородом, быстро тускнеют. Все s-металлы горят в атмосфере воздуха образуя оксиды: 1) Нормальные оксиды состава Me 2 O (1 группа), Me. O (2 группа) 2) Пероксиды Me 2 O 2 (1 группа), Me. O 2 (2 группа) 3) Супероксиды Me. O 2 (1 группа), Me. O 4 (2 группа) Так, только литий сгорает на воздухе с образованием оксида: 4 Li + O 2 = 2 Li 2 O Натрий образует смесь пероксида и супероксида: 3 Na + 2 O 2 = Na 2 O 2 + Na. O
Металлы Химические свойства. На свежем разрезе, s-металлы имеют блестящую поверхности, но вступая в реакцию с кислородом, быстро тускнеют. Все s-металлы горят в атмосфере воздуха образуя оксиды: 1) Нормальные оксиды состава Me 2 O (1 группа), Me. O (2 группа) 2) Пероксиды Me 2 O 2 (1 группа), Me. O 2 (2 группа) 3) Супероксиды Me. O 2 (1 группа), Me. O 4 (2 группа) Так, только литий сгорает на воздухе с образованием оксида: 4 Li + O 2 = 2 Li 2 O Натрий образует смесь пероксида и супероксида: 3 Na + 2 O 2 = Na 2 O 2 + Na. O
 Металлы Так, только литий сгорает на воздухе с образованием оксида: 4 Li + O 2 = 2 Li 2 O Натрий образует смесь пероксида и супероксида: 3 Na + 2 O 2 = Na 2 O 2 + Na. O 2 Для того, что бы получить оксиды натрия и калия нужно: K 2 O 2 + 2 K = 2 K 2 O
Металлы Так, только литий сгорает на воздухе с образованием оксида: 4 Li + O 2 = 2 Li 2 O Натрий образует смесь пероксида и супероксида: 3 Na + 2 O 2 = Na 2 O 2 + Na. O 2 Для того, что бы получить оксиды натрия и калия нужно: K 2 O 2 + 2 K = 2 K 2 O
 Металлы Все металлы, кроме бериллия, вступают в реакцию с водородом, образую гидриды: 2 Li + H 2 = 2 Li. H При реакции с галогенами: Hal 2 + Ca = Ca. Hal 2 Так же, образуются сульфиды, нитриды, фосфиды, карбиды, силициды.
Металлы Все металлы, кроме бериллия, вступают в реакцию с водородом, образую гидриды: 2 Li + H 2 = 2 Li. H При реакции с галогенами: Hal 2 + Ca = Ca. Hal 2 Так же, образуются сульфиды, нитриды, фосфиды, карбиды, силициды.
 Металлы Реакции с водой приводят к образованию основания и… 2 Li + 2 H 2 O = 2 Li. OH + H 2 Na 2 O + H 2 O = 2 Na. OH или Na 2 O + H 2 O = Na. OH + H 2 Zn + 2 HCl = Zn. Cl 2 + H 2 Cu + HCl = Fe + Cu. SO 4 = Fe. SO 4 + Cu Cu + Fe. SO 4 =
Металлы Реакции с водой приводят к образованию основания и… 2 Li + 2 H 2 O = 2 Li. OH + H 2 Na 2 O + H 2 O = 2 Na. OH или Na 2 O + H 2 O = Na. OH + H 2 Zn + 2 HCl = Zn. Cl 2 + H 2 Cu + HCl = Fe + Cu. SO 4 = Fe. SO 4 + Cu Cu + Fe. SO 4 =
 Металлы Zn + 2 HCl = Zn. Cl 2 + H 2 Cu + HCl = Fe + Cu. SO 4 = Fe. SO 4 + Cu Cu + Fe. SO 4 = Чем левее стоит металл в ряду стандартных электродных потенциалов, тем более сильным восстановителем он является, самый сильный восстановитель – металлический литий, золото – самый слабый, и, наоборот, ион золото (III) – самый сильный окислитель, литий (I) – самый слабый.
Металлы Zn + 2 HCl = Zn. Cl 2 + H 2 Cu + HCl = Fe + Cu. SO 4 = Fe. SO 4 + Cu Cu + Fe. SO 4 = Чем левее стоит металл в ряду стандартных электродных потенциалов, тем более сильным восстановителем он является, самый сильный восстановитель – металлический литий, золото – самый слабый, и, наоборот, ион золото (III) – самый сильный окислитель, литий (I) – самый слабый.
 Металлы Цинковая пластинка массой 10, 0 г опущена в раствор сульфата меди(II). После окончания реакции 1 промытая и высушенная пластинка имеет массу 9, 90 г. Объясните изменение массы пластинки и определите массу сульфата ме- ди(II), находившегося в растворе (M(Cu) = 63, 54 г/моль, M(Zn) = 65, 38 г/моль).
Металлы Цинковая пластинка массой 10, 0 г опущена в раствор сульфата меди(II). После окончания реакции 1 промытая и высушенная пластинка имеет массу 9, 90 г. Объясните изменение массы пластинки и определите массу сульфата ме- ди(II), находившегося в растворе (M(Cu) = 63, 54 г/моль, M(Zn) = 65, 38 г/моль).
 Металлы Цепочка: Mg – Mg. SO 4 – Mg(NO 3)2 – Mg. O – (CH 3 COO)2 Mg
Металлы Цепочка: Mg – Mg. SO 4 – Mg(NO 3)2 – Mg. O – (CH 3 COO)2 Mg
 Металлы Как доказать, что при горении металлического натрия образуется не оксид, а пероксид?
Металлы Как доказать, что при горении металлического натрия образуется не оксид, а пероксид?
 Урок 9 класса Сплавы
Урок 9 класса Сплавы
 Сплавы Металлы тоже можно смешивать между собой. Сплав — макроскопически однородный металлический материал, состоящий из смеси двух или большего числа химических элементов, обычно металлов. Такие вещества обладают свойствами, которых раньше не было у их составляющих по отдельность – поэтому сплав, не смесь! ОТЛИЧИЕ СПЛАВА, ОТ ТВЕРДОГО РАСТВОРА
Сплавы Металлы тоже можно смешивать между собой. Сплав — макроскопически однородный металлический материал, состоящий из смеси двух или большего числа химических элементов, обычно металлов. Такие вещества обладают свойствами, которых раньше не было у их составляющих по отдельность – поэтому сплав, не смесь! ОТЛИЧИЕ СПЛАВА, ОТ ТВЕРДОГО РАСТВОРА

