Урок 8 класса. Водород Водород. Химические свойства















8m_2-8.pptx
- Размер: 394.4 Кб
- Автор:
- Количество слайдов: 16
Описание презентации Урок 8 класса. Водород Водород. Химические свойства по слайдам
 Урок 8 класса. Водород
Урок 8 класса. Водород
 Водород. Химические свойства Водород взаимодействует с оксидами некоторых металлов: H 2 + Cu. O = H 2 O + Cu При обычной температуре: H 2 + F 2 = 2 HF + 547 к. Дж На свету : H 2 + Cl 2 = 2 HCl(г) + 185 к. Дж
Водород. Химические свойства Водород взаимодействует с оксидами некоторых металлов: H 2 + Cu. O = H 2 O + Cu При обычной температуре: H 2 + F 2 = 2 HF + 547 к. Дж На свету : H 2 + Cl 2 = 2 HCl(г) + 185 к. Дж
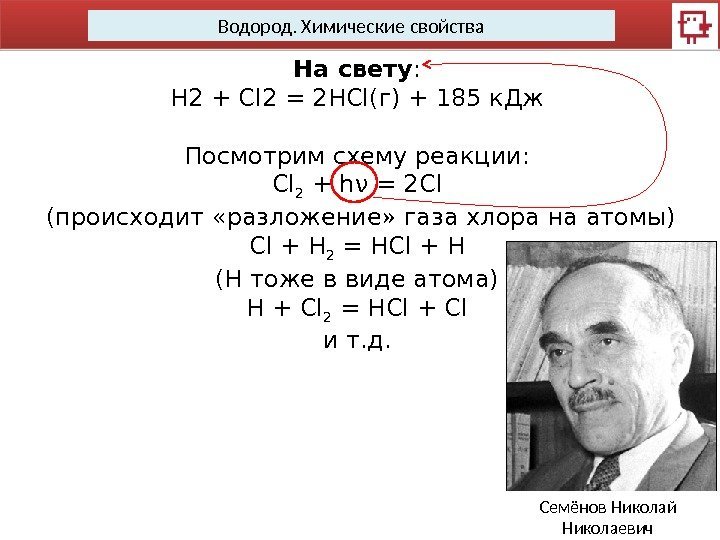
 Водород. Химические свойства На свету : H 2 + Cl 2 = 2 HCl(г) + 185 к. Дж Посмотрим схему реакции: Cl 2 + hν = 2 Cl (происходит «разложение» газа хлора на атомы) Cl + H 2 = HCl + H (H тоже в виде атома) H + Cl 2 = HCl + Cl и т. д. Семёнов Николай Николаевич
Водород. Химические свойства На свету : H 2 + Cl 2 = 2 HCl(г) + 185 к. Дж Посмотрим схему реакции: Cl 2 + hν = 2 Cl (происходит «разложение» газа хлора на атомы) Cl + H 2 = HCl + H (H тоже в виде атома) H + Cl 2 = HCl + Cl и т. д. Семёнов Николай Николаевич
 Водород. Химические свойства При реакции с простыми веществами образуются гидриды: 2 Li + H 2 = 2 LIH (гидрид лития) Гидриды взаимодействуя с водой образуют щёлочь и водород: Na. H + H 2 O = Na. OH + H 2 При нагревании гидриды до температуры плавления: 2 KH = 2 K + H
Водород. Химические свойства При реакции с простыми веществами образуются гидриды: 2 Li + H 2 = 2 LIH (гидрид лития) Гидриды взаимодействуя с водой образуют щёлочь и водород: Na. H + H 2 O = Na. OH + H 2 При нагревании гидриды до температуры плавления: 2 KH = 2 K + H
 Водород. Химические свойства Получение водорода. В промышленности. 1. Электролиз водных растворов солей. 2 H 2 O = H 2 + O 2 2. Пропускание паров воды над раскалённым углём при температуре 1000 С. CO + H 2 O (пар) = CO 2 + H 2 3. Получение из природного газа. СH 4 + H 2 O = CO + 3 H 2 4. Крекинг и риформинг углеводородов.
Водород. Химические свойства Получение водорода. В промышленности. 1. Электролиз водных растворов солей. 2 H 2 O = H 2 + O 2 2. Пропускание паров воды над раскалённым углём при температуре 1000 С. CO + H 2 O (пар) = CO 2 + H 2 3. Получение из природного газа. СH 4 + H 2 O = CO + 3 H 2 4. Крекинг и риформинг углеводородов.
 Водород. Химические свойства Получение водорода. В лаборатории. 1. Получение водорода действием разбавленных кислот на металлы. Zn + 2 HCl = Zn. Cl 2 + H 2 2. Действие щелочей на цинк или алюминий. 2 Al + 2 Na. OH + 6 H 2 O = 2 Na[Al(OH) 4 ] + 3 H 2 3. Гидролиз гидридов. KH + H 2 O = KOH + H 2 4. Взаимодействие кальция с водой. Ca + 2 H 2 O = Ca(OH) 2 + H
Водород. Химические свойства Получение водорода. В лаборатории. 1. Получение водорода действием разбавленных кислот на металлы. Zn + 2 HCl = Zn. Cl 2 + H 2 2. Действие щелочей на цинк или алюминий. 2 Al + 2 Na. OH + 6 H 2 O = 2 Na[Al(OH) 4 ] + 3 H 2 3. Гидролиз гидридов. KH + H 2 O = KOH + H 2 4. Взаимодействие кальция с водой. Ca + 2 H 2 O = Ca(OH) 2 + H
 Водород. Химические свойства Применение водорода. — Получение аммиак. Примерно 50% получаемого водорода используется для получения аммиака (NH 3 ). N 2 +3 H 2 ↔ 2 NH — Получение органических продуктов. Водород используют в процессе синтеза метанола (CH 3 OH). 2 H 2 + CO = CH 3 OH — Переработка нефти. — Производство маргарина.
Водород. Химические свойства Применение водорода. — Получение аммиак. Примерно 50% получаемого водорода используется для получения аммиака (NH 3 ). N 2 +3 H 2 ↔ 2 NH — Получение органических продуктов. Водород используют в процессе синтеза метанола (CH 3 OH). 2 H 2 + CO = CH 3 OH — Переработка нефти. — Производство маргарина.
 Соединения Основные соединения водорода и их названия: H 2 молекулярный водород H 2 O – вода HCl – соляная кислота или хлороводород H 2 S — сероводород Na. H – гидрид натрия
Соединения Основные соединения водорода и их названия: H 2 молекулярный водород H 2 O – вода HCl – соляная кислота или хлороводород H 2 S — сероводород Na. H – гидрид натрия
 Вода. Расстворы Вода. Растворы. В воде растворяется большое количество веществ. Растворами называют однородны системы, состоящие из молекул растворителя и частиц растворенного вещества, между которыми происходят физические и химические взаимодействия.
Вода. Расстворы Вода. Растворы. В воде растворяется большое количество веществ. Растворами называют однородны системы, состоящие из молекул растворителя и частиц растворенного вещества, между которыми происходят физические и химические взаимодействия.
 Вода. Растворы. Если вещество при смешивании образует мутные смеси, они называются взвесями. Взвеси, в которых мелкие частицы твердого вещества равномерно распределены между молекулами воды, называют суспензиями. Взвеси, в которых мелкие капельки какой-либо жидкости равномерно распределены между молекулами другой жидкости, называют эмульсиями.
Вода. Растворы. Если вещество при смешивании образует мутные смеси, они называются взвесями. Взвеси, в которых мелкие частицы твердого вещества равномерно распределены между молекулами воды, называют суспензиями. Взвеси, в которых мелкие капельки какой-либо жидкости равномерно распределены между молекулами другой жидкости, называют эмульсиями.
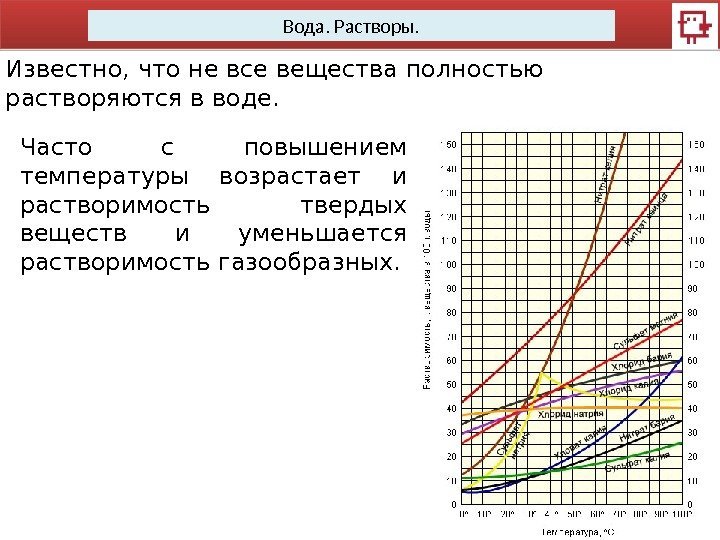
 Вода. Растворы. Известно, что не все вещества полностью растворяются в воде. Часто с повышением температуры возрастает и растворимость твердых веществ и уменьшается растворимость газообразных.
Вода. Растворы. Известно, что не все вещества полностью растворяются в воде. Часто с повышением температуры возрастает и растворимость твердых веществ и уменьшается растворимость газообразных.
 Вода. Растворы. Насыщенные и ненасыщенные растворы. Раствор, в котором данное вещество при данной температуре больше не растворяется, называют насыщенным , а раствор, в котором вещество ещё может растворяться, — ненасыщенным. Растворимость (коэффициент растворимости) – максимально возможное число граммов вещества, которое может раствориться в 100 г растворителя при данной температуре.
Вода. Растворы. Насыщенные и ненасыщенные растворы. Раствор, в котором данное вещество при данной температуре больше не растворяется, называют насыщенным , а раствор, в котором вещество ещё может растворяться, — ненасыщенным. Растворимость (коэффициент растворимости) – максимально возможное число граммов вещества, которое может раствориться в 100 г растворителя при данной температуре.
 Вода. Растворы. Растворимость (коэффициент растворимости) – максимально возможное число граммов вещества, которое может раствориться в 100 г растворителя при данной температуре. Вещества (растворимость при 20 С) Хорошо растворимые малорастворимые Практически нерастворимые Сахар В 1 л воды растворяется 2000 г Гипс В 1 л растворяется 2 г Хлорид серебра Ag. Cl В 1 л растворяется 1. 5 *10 -3 г
Вода. Растворы. Растворимость (коэффициент растворимости) – максимально возможное число граммов вещества, которое может раствориться в 100 г растворителя при данной температуре. Вещества (растворимость при 20 С) Хорошо растворимые малорастворимые Практически нерастворимые Сахар В 1 л воды растворяется 2000 г Гипс В 1 л растворяется 2 г Хлорид серебра Ag. Cl В 1 л растворяется 1. 5 *10 -3 г
 Вода. Растворы. Определение массовой доли растворенного вещества. Отношение массы растворенного вещества к массе раствора называют массовой долей растворенного вещества.
Вода. Растворы. Определение массовой доли растворенного вещества. Отношение массы растворенного вещества к массе раствора называют массовой долей растворенного вещества.
 Вода. Растворы. Пример. В 250 г воды растворено 50 г кристаллогидрата (Fe. SO 4*7 H 2 O). Вычислить массовую долю кристаллогидрата и безводного сульфата железа (II) в растворе.
Вода. Растворы. Пример. В 250 г воды растворено 50 г кристаллогидрата (Fe. SO 4*7 H 2 O). Вычислить массовую долю кристаллогидрата и безводного сульфата железа (II) в растворе.
 Водород. Химические свойства
Водород. Химические свойства

