 Урок 8 класса. Вода Классы неорганических соединений
Урок 8 класса. Вода Классы неорганических соединений
 Вода При разложении воды электрическим током образуются газы: водород (Н 2) и кислород (О 2). Образуется 2 л водорода, который имеет массу 0, 089 г и 1 л кислорода массой 1, 429. Как определить формулу воды, используя эти данные?
Вода При разложении воды электрическим током образуются газы: водород (Н 2) и кислород (О 2). Образуется 2 л водорода, который имеет массу 0, 089 г и 1 л кислорода массой 1, 429. Как определить формулу воды, используя эти данные?
 Вода Химические свойства воды. Вода вступает в реакцию со многими сложными и простыми веществами. С активными металлами: Na + H 2 O = Na. OH + H 2 C оксидами: Ca. O + H 2 O = Ca(OH)2 C неметаллами: t С + H 2 O = CO + H 2
Вода Химические свойства воды. Вода вступает в реакцию со многими сложными и простыми веществами. С активными металлами: Na + H 2 O = Na. OH + H 2 C оксидами: Ca. O + H 2 O = Ca(OH)2 C неметаллами: t С + H 2 O = CO + H 2
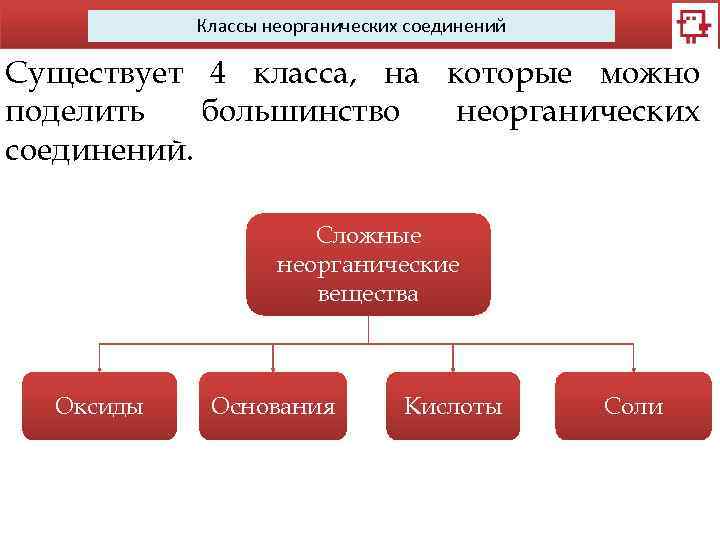 Классы неорганических соединений Существует 4 класса, на которые можно поделить большинство неорганических соединений. Сложные неорганические вещества Оксиды Основания Кислоты Соли
Классы неорганических соединений Существует 4 класса, на которые можно поделить большинство неорганических соединений. Сложные неорганические вещества Оксиды Основания Кислоты Соли
 Классы неорганических соединений Оксиды – это сложные вещества, которые состоят из двух элементов, одним из которых является кислород. Какие оксиды вы знаете?
Классы неорганических соединений Оксиды – это сложные вещества, которые состоят из двух элементов, одним из которых является кислород. Какие оксиды вы знаете?
 Оксиды классифицируются Оксиды Основные Амфотерные кислотные Такие оксиды, которым соответствуют основания, иначе говоря соединения металлов с водой. Ca. O, Cu. O, K 2 O
Оксиды классифицируются Оксиды Основные Амфотерные кислотные Такие оксиды, которым соответствуют основания, иначе говоря соединения металлов с водой. Ca. O, Cu. O, K 2 O
 Оксиды классифицируются Оксиды Основные Амфотерные кислотные Такие оксиды, которым соответствуют кислоты. Если эти оксиды прореагировать с водой получится кислота. P 2 O 5, SO 3, SO 2
Оксиды классифицируются Оксиды Основные Амфотерные кислотные Такие оксиды, которым соответствуют кислоты. Если эти оксиды прореагировать с водой получится кислота. P 2 O 5, SO 3, SO 2
 Оксиды классифицируются Оксиды Основные Амфотерные Кислотные А эти оксиды имеют свойства как основных, так и кислотных. Zn. O, Al 2 O 3, Fe 2 O 3
Оксиды классифицируются Оксиды Основные Амфотерные Кислотные А эти оксиды имеют свойства как основных, так и кислотных. Zn. O, Al 2 O 3, Fe 2 O 3
 Оксиды, которым соответствуют основания, называются основными. Na 2 O + H 2 O =2 Na. OH Как правило, основные оксиды образуют металлы с валентностью меньше 4 х: Na, K, Ca, Li и т. д.
Оксиды, которым соответствуют основания, называются основными. Na 2 O + H 2 O =2 Na. OH Как правило, основные оксиды образуют металлы с валентностью меньше 4 х: Na, K, Ca, Li и т. д.
 Оксиды Названия оксидов. Если, это оксид, в который входит элементы с постоянной валентностью, о ней дополнительно не говорят, если валентность переменная, то её указывают в скобках римскими цифрами – оксид меди (I). Общий вид: ЭО – оксид элемента (I). Примеры: оксид железа (II) – Fe. O Оксид углерода (II) – СО Оксид серы (IV) – SO 2
Оксиды Названия оксидов. Если, это оксид, в который входит элементы с постоянной валентностью, о ней дополнительно не говорят, если валентность переменная, то её указывают в скобках римскими цифрами – оксид меди (I). Общий вид: ЭО – оксид элемента (I). Примеры: оксид железа (II) – Fe. O Оксид углерода (II) – СО Оксид серы (IV) – SO 2
 Оксиды Получение оксидов Горение веществ Простых Сложных 4 Р + 5 O 2 = 2 P 2 O 5 2 C 2 H 2 + 5 O 2 = 4 CO 2 + 2 H 2 O
Оксиды Получение оксидов Горение веществ Простых Сложных 4 Р + 5 O 2 = 2 P 2 O 5 2 C 2 H 2 + 5 O 2 = 4 CO 2 + 2 H 2 O
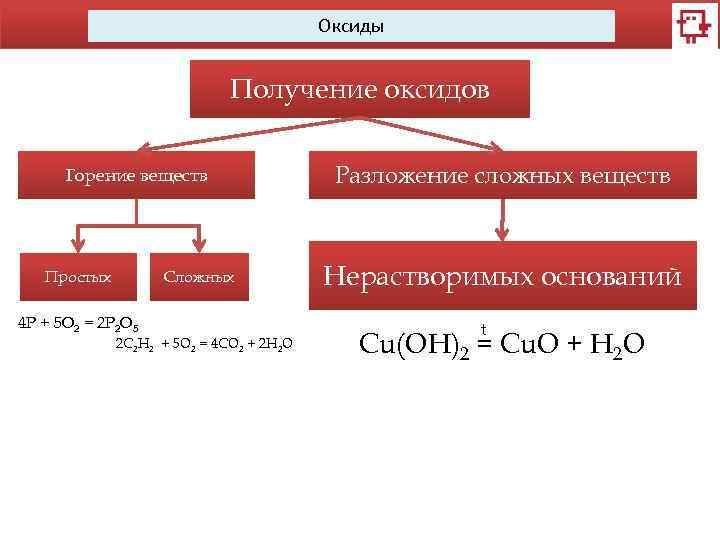 Оксиды Получение оксидов Горение веществ Простых Сложных 4 Р + 5 O 2 = 2 P 2 O 5 2 C 2 H 2 + 5 O 2 = 4 CO 2 + 2 H 2 O Разложение сложных веществ Нерастворимых оснований t Cu(OH)2 = Cu. O + H 2 O
Оксиды Получение оксидов Горение веществ Простых Сложных 4 Р + 5 O 2 = 2 P 2 O 5 2 C 2 H 2 + 5 O 2 = 4 CO 2 + 2 H 2 O Разложение сложных веществ Нерастворимых оснований t Cu(OH)2 = Cu. O + H 2 O
 Оксиды Получение оксидов Разложение сложных веществ Горение веществ Простых Нерастворим ых оснований Сложных 4 Р + 5 O 2 = 2 P 2 O 5 Cu(OH)2 = Cu. O + H 2 O 2 C 2 H 2 + 5 O 2 = 4 CO 2 + 2 H 2 O Кислот t H 2 SO 4 = SO 3 + H 2 O
Оксиды Получение оксидов Разложение сложных веществ Горение веществ Простых Нерастворим ых оснований Сложных 4 Р + 5 O 2 = 2 P 2 O 5 Cu(OH)2 = Cu. O + H 2 O 2 C 2 H 2 + 5 O 2 = 4 CO 2 + 2 H 2 O Кислот t H 2 SO 4 = SO 3 + H 2 O
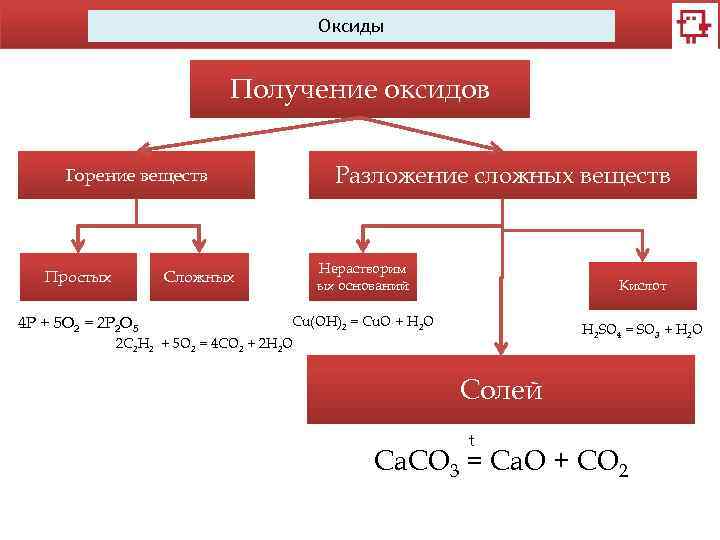 Оксиды Получение оксидов Разложение сложных веществ Горение веществ Простых Нерастворим ых оснований Сложных 4 Р + 5 O 2 = 2 P 2 O 5 Кислот Cu(OH)2 = Cu. O + H 2 O H 2 SO 4 = SO 3 + H 2 O 2 C 2 H 2 + 5 O 2 = 4 CO 2 + 2 H 2 O Солей t Ca. CO 3 = Ca. O + CO 2
Оксиды Получение оксидов Разложение сложных веществ Горение веществ Простых Нерастворим ых оснований Сложных 4 Р + 5 O 2 = 2 P 2 O 5 Кислот Cu(OH)2 = Cu. O + H 2 O H 2 SO 4 = SO 3 + H 2 O 2 C 2 H 2 + 5 O 2 = 4 CO 2 + 2 H 2 O Солей t Ca. CO 3 = Ca. O + CO 2