 Урок 8 класса. Валентность. Атомно-молекулярное учение.
Урок 8 класса. Валентность. Атомно-молекулярное учение.
 Потренируемся 1. В реакции с соляной кислотой один атом металла вытесняет два атома водорода. Как это можно объяснить пользуясь понятием о валентности? 2. Составте химические формулы по схемам: Li. O, Ba. O, PO, Mn. O, Fe. O, BO, Sn. O, HS, KO, NO, PH, Cr. Cl
Потренируемся 1. В реакции с соляной кислотой один атом металла вытесняет два атома водорода. Как это можно объяснить пользуясь понятием о валентности? 2. Составте химические формулы по схемам: Li. O, Ba. O, PO, Mn. O, Fe. O, BO, Sn. O, HS, KO, NO, PH, Cr. Cl
 Атомно-молекулярное учение – учение об атомах и молекулах. Не все вещества состоят из молекул, причем большинство веществ в неорганической химии немолекулярное строение имеют.
Атомно-молекулярное учение – учение об атомах и молекулах. Не все вещества состоят из молекул, причем большинство веществ в неорганической химии немолекулярное строение имеют.
 Атомно-молекулярное учение Положения учения: 1. Существуют вещества с молекулярным немолекулярным строением. и 2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшее расстояния имеются между молекулами газов. 3. Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость возрастает.
Атомно-молекулярное учение Положения учения: 1. Существуют вещества с молекулярным немолекулярным строением. и 2. Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшее расстояния имеются между молекулами газов. 3. Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость возрастает.
 Атомно-молекулярное учение Положения учения: 4. Между молекулами существуют силы взаимного притяжения и отталкивания. Наиболее выражены – в твёрдых вещества, наименее – в газах. 5. Молекулы состоят из атомов, находятся в непрерывном движении. которые, 6. Атомы одного вида отличаются от атомы другого вида свойствами. 7. При физических процессах – молекулы сохраняются, при химических – разрушаются.
Атомно-молекулярное учение Положения учения: 4. Между молекулами существуют силы взаимного притяжения и отталкивания. Наиболее выражены – в твёрдых вещества, наименее – в газах. 5. Молекулы состоят из атомов, находятся в непрерывном движении. которые, 6. Атомы одного вида отличаются от атомы другого вида свойствами. 7. При физических процессах – молекулы сохраняются, при химических – разрушаются.
 Атомно-молекулярное учение Положения учения: 8. У веществ с молекулярным строением в твёрдом состоянии в узлах кристаллической решетки находятся молекулы. Связи между молекулами слабые и при нагревании разрушаются. 9. У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между ними химические связи сильные.
Атомно-молекулярное учение Положения учения: 8. У веществ с молекулярным строением в твёрдом состоянии в узлах кристаллической решетки находятся молекулы. Связи между молекулами слабые и при нагревании разрушаются. 9. У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между ними химические связи сильные.
 Атомно-молекулярное учение Исходя из Учения можно объяснять некоторые физические и химические явления. Температуры плавления Процесс диффузии
Атомно-молекулярное учение Исходя из Учения можно объяснять некоторые физические и химические явления. Температуры плавления Процесс диффузии
 Сохранение массы «Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается, столько присовокупится к другому» . Ломоносов М. В. М М ? Т
Сохранение массы «Все перемены, в натуре случающиеся, такого суть состояния, что сколько чего у одного тела отнимается, столько присовокупится к другому» . Ломоносов М. В. М М ? Т
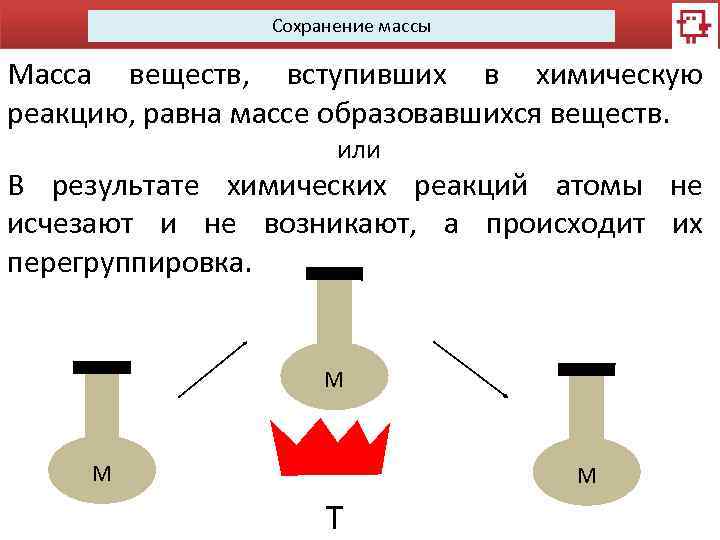 Сохранение массы Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ. или В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка. М М М Т
Сохранение массы Масса веществ, вступивших в химическую реакцию, равна массе образовавшихся веществ. или В результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка. М М М Т
 Сохранение массы Этот закон крайне важен, т. е. приняв такое положение можно проводить количественные расчеты. Задача. Какое количество воды получится, если в реакцию горения водорода вступило 16 г кислорода, а выход реакции 50%?
Сохранение массы Этот закон крайне важен, т. е. приняв такое положение можно проводить количественные расчеты. Задача. Какое количество воды получится, если в реакцию горения водорода вступило 16 г кислорода, а выход реакции 50%?
 Сохранение массы Задача. Какое количество воды получится, если в реакцию горения водорода вступило 16 г кислорода, а выход реакции 50%?
Сохранение массы Задача. Какое количество воды получится, если в реакцию горения водорода вступило 16 г кислорода, а выход реакции 50%?
 Валентность и степень окисления Задача. Даны валентности элементов: Fe (III), Cu (II), H(I), Li(I), U(IV), N(III). Напишите формулы их оксидов.
Валентность и степень окисления Задача. Даны валентности элементов: Fe (III), Cu (II), H(I), Li(I), U(IV), N(III). Напишите формулы их оксидов.
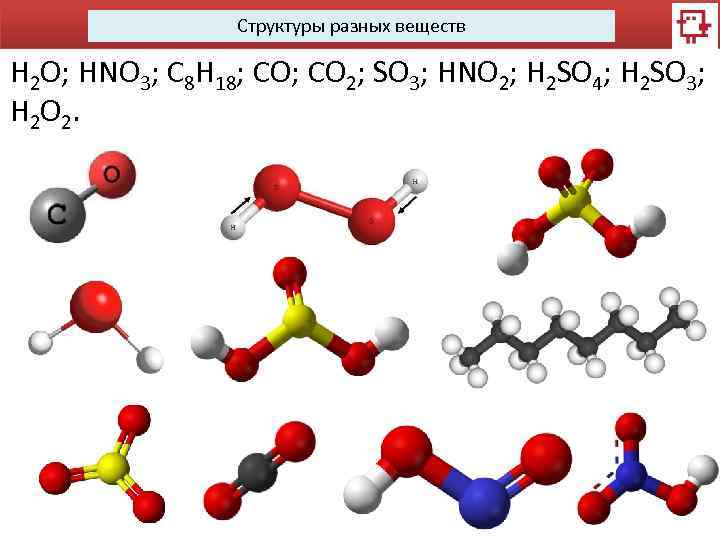 Структуры разных веществ H 2 O; HNO 3; C 8 H 18; CO 2; SO 3; HNO 2; H 2 SO 4; H 2 SO 3; H 2 O 2.
Структуры разных веществ H 2 O; HNO 3; C 8 H 18; CO 2; SO 3; HNO 2; H 2 SO 4; H 2 SO 3; H 2 O 2.