 Урок 8 класса Строение атома 1
Урок 8 класса Строение атома 1
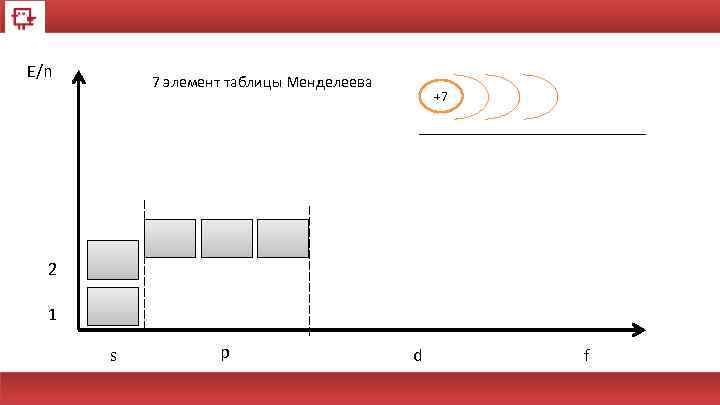 E/n 7 элемент таблицы Менделеева +7 2 1 s p d f
E/n 7 элемент таблицы Менделеева +7 2 1 s p d f
 E/n 3 элемент таблицы Менделеева +3 2 1 s p d f
E/n 3 элемент таблицы Менделеева +3 2 1 s p d f
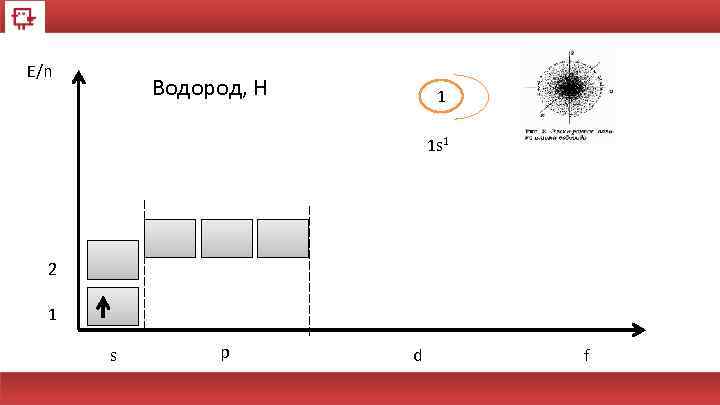 E/n Водород, Н 1 1 s 1 2 1 s p d f
E/n Водород, Н 1 1 s 1 2 1 s p d f
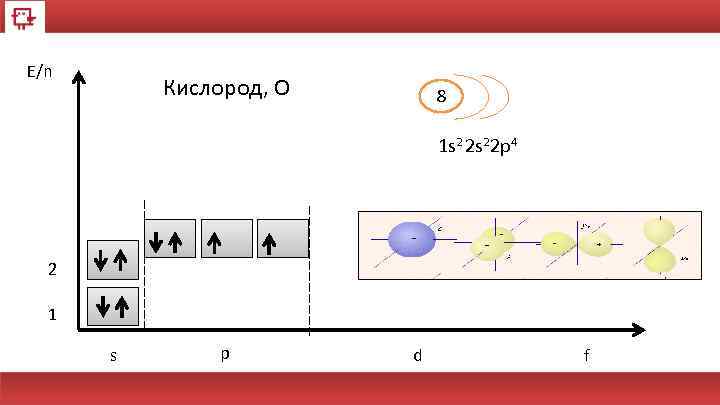 E/n Кислород, О 8 1 s 2 2 s 22 p 4 2 1 s p d f
E/n Кислород, О 8 1 s 2 2 s 22 p 4 2 1 s p d f
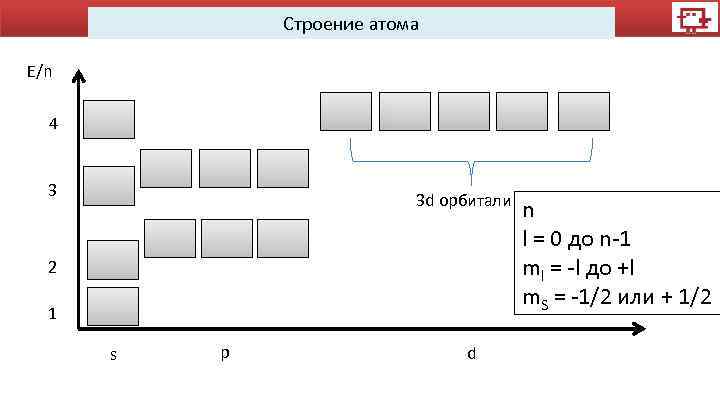 Строение атома E/n 4 3 3 d орбитали 2 1 s p d n l = 0 до n-1 ml = -l до +l m. S = -1/2 или + 1/2
Строение атома E/n 4 3 3 d орбитали 2 1 s p d n l = 0 до n-1 ml = -l до +l m. S = -1/2 или + 1/2
 Потренируемся Рассмотрим на примере первых 14 -ти элементов следующие качества: Электронное строение Количество электронов на внешнем уровне Радиус Валентность Химические свойства Физические свойства 2
Потренируемся Рассмотрим на примере первых 14 -ти элементов следующие качества: Электронное строение Количество электронов на внешнем уровне Радиус Валентность Химические свойства Физические свойства 2
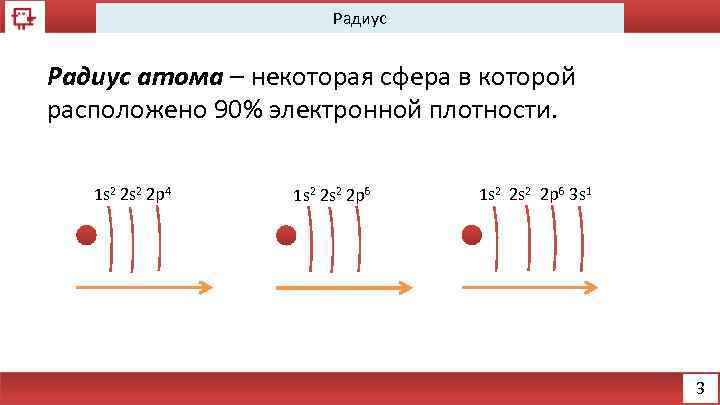 Радиус атома – некоторая сфера в которой расположено 90% электронной плотности. 1 s 2 2 p 4 1 s 2 2 s 2 2 p 6 3 s 1 3
Радиус атома – некоторая сфера в которой расположено 90% электронной плотности. 1 s 2 2 p 4 1 s 2 2 s 2 2 p 6 3 s 1 3
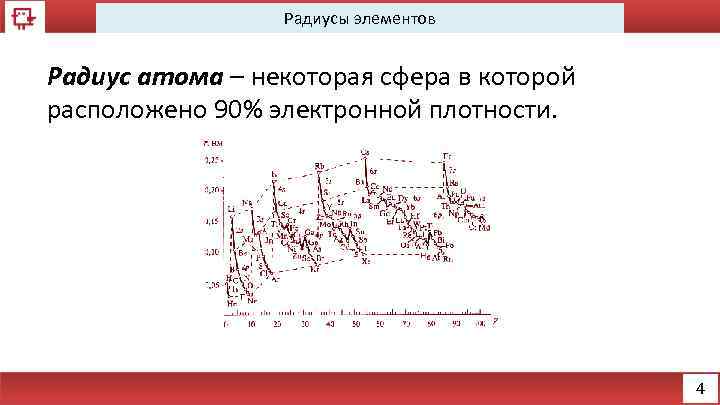 Радиусы элементов Радиус атома – некоторая сфера в которой расположено 90% электронной плотности. 4
Радиусы элементов Радиус атома – некоторая сфера в которой расположено 90% электронной плотности. 4
 Валентность – способность атомов химических элементов вступать в химические соединения с атомами других элементов. Другими словами, это способность атома образовывать определенное число химических связей с другими атомами. 5
Валентность – способность атомов химических элементов вступать в химические соединения с атомами других элементов. Другими словами, это способность атома образовывать определенное число химических связей с другими атомами. 5
 Валентность - способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи. Валентность – способность атомов химических элементов вступать в химические соединения с атомами других элементов. Другими словами, это способность атома образовывать определенное число химических связей с другими атомами. 6
Валентность - способность атома присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи. Валентность – способность атомов химических элементов вступать в химические соединения с атомами других элементов. Другими словами, это способность атома образовывать определенное число химических связей с другими атомами. 6
 Потренируемся 7
Потренируемся 7
 Водород 8
Водород 8
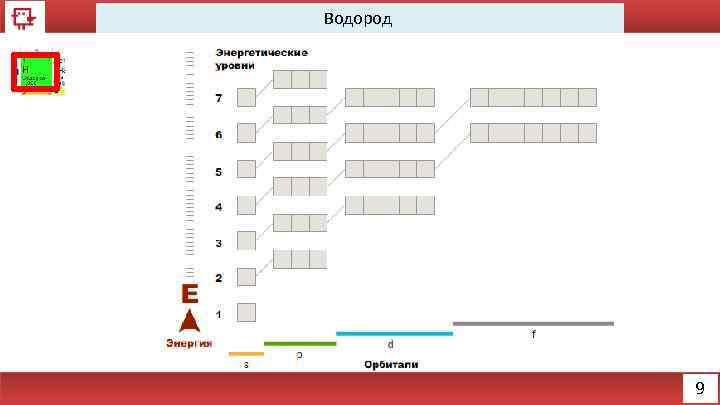 Водород 9
Водород 9
 Водород Количество электронов на внешнем уровне - 1 Радиус - 53 пм (пикометр 10− 12 м. ) Валентность - 1 Химические свойства – образует OH- и Н+ Физические свойства – бесцветный газ 10
Водород Количество электронов на внешнем уровне - 1 Радиус - 53 пм (пикометр 10− 12 м. ) Валентность - 1 Химические свойства – образует OH- и Н+ Физические свойства – бесцветный газ 10
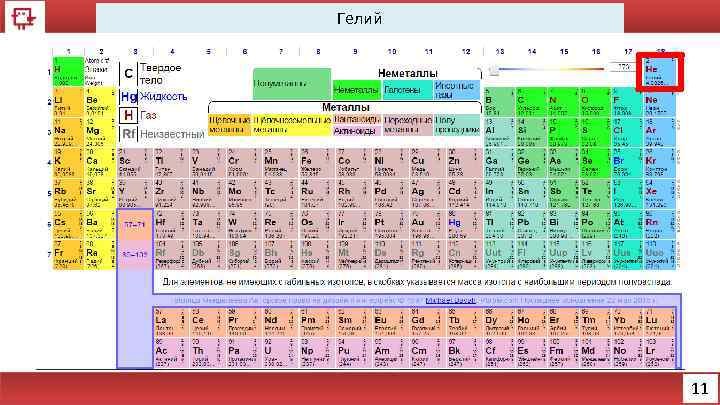 Гелий 11
Гелий 11
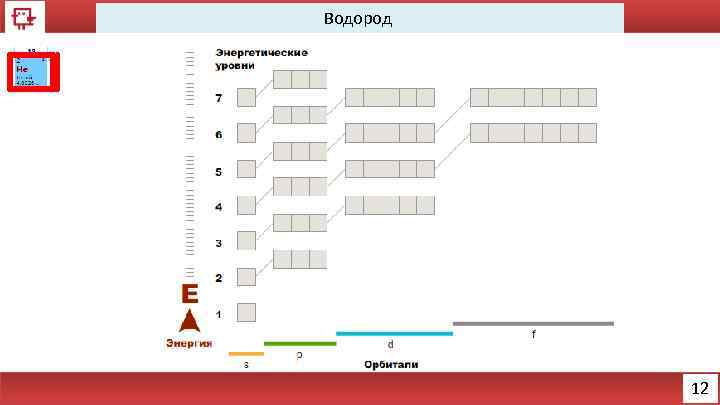 Водород 12
Водород 12
 Гелий Количество электронов на внешнем уровне - 2 Радиус - 31 пм (пикометр 10− 12 м. ) Валентность - 0 Химические свойства –отсутствуют Физические свойства – бесцветный, безвкусный газ 13
Гелий Количество электронов на внешнем уровне - 2 Радиус - 31 пм (пикометр 10− 12 м. ) Валентность - 0 Химические свойства –отсутствуют Физические свойства – бесцветный, безвкусный газ 13
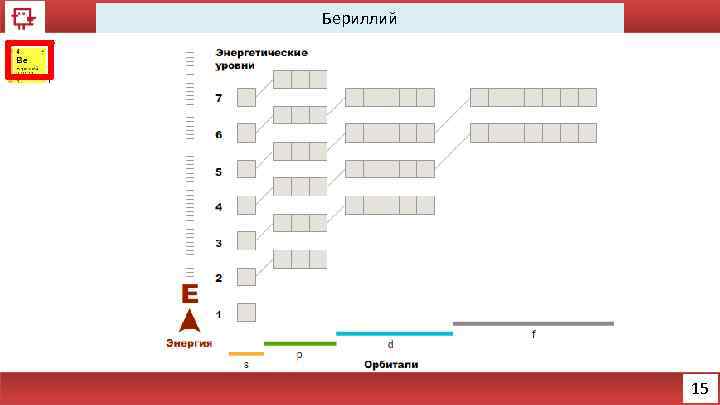
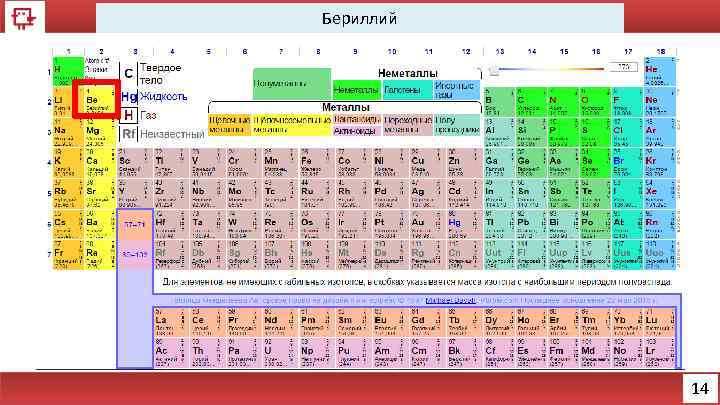 Бериллий 14
Бериллий 14
 Бериллий 15
Бериллий 15
 Бериллий Количество электронов на внешнем уровне - 1 Радиус - 112 пм Валентность - 2 Х. с. : Be+ 2 Na. OH + 2 H 2 O = Na 2[Be(OH)4] Ф. с. – относительно твёрдый, но хрупкий металл серебристобелого цвета. 16
Бериллий Количество электронов на внешнем уровне - 1 Радиус - 112 пм Валентность - 2 Х. с. : Be+ 2 Na. OH + 2 H 2 O = Na 2[Be(OH)4] Ф. с. – относительно твёрдый, но хрупкий металл серебристобелого цвета. 16
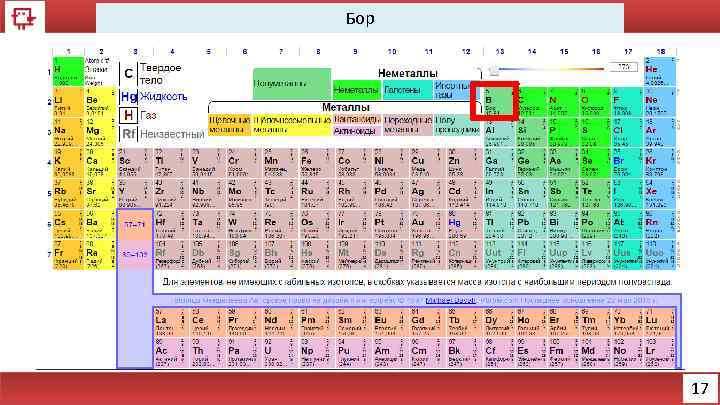 Бор 17
Бор 17
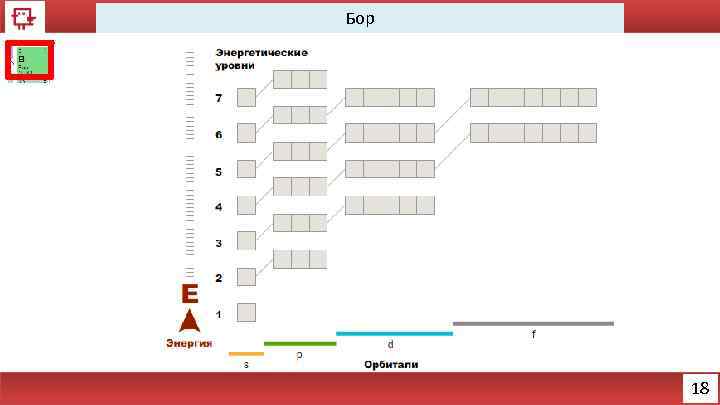 Бор 18
Бор 18
 Бор Количество электронов на внешнем уровне - 3 Радиус - 98 пм Валентность - 3 Х. с. : B 2 O 3 + 3 H 2 O = H 3 BO 3 4 H 3 BO 3 + Na. OH = Na 2 B 4 O 7 Ф. с. – бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество 19
Бор Количество электронов на внешнем уровне - 3 Радиус - 98 пм Валентность - 3 Х. с. : B 2 O 3 + 3 H 2 O = H 3 BO 3 4 H 3 BO 3 + Na. OH = Na 2 B 4 O 7 Ф. с. – бесцветное, серое или красное кристаллическое либо тёмное аморфное вещество 19
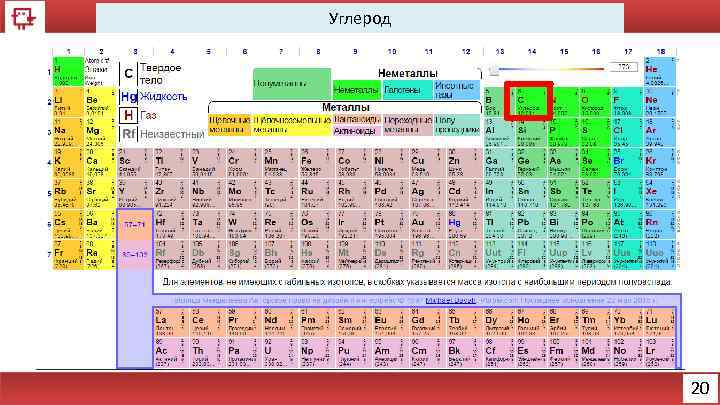 Углерод 20
Углерод 20
 Углерод 21
Углерод 21
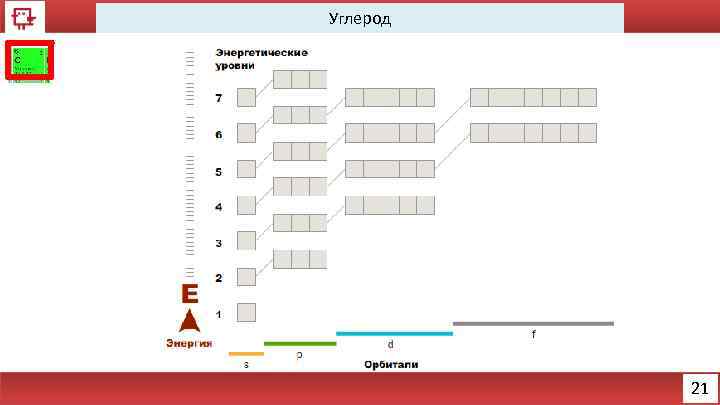
 Углерод Количество электронов на внешнем уровне - 4 Радиус - 91 пм Валентность – 2, 4 Х. с. : С+1/2 О 2 = СО; СО + 1/2 О 2 = СО 2 CO 2 + H 2 O = H 2 CO 3 Ф. с. – Матово-чёрный (графит), либо прозрачный (алмаз) 22
Углерод Количество электронов на внешнем уровне - 4 Радиус - 91 пм Валентность – 2, 4 Х. с. : С+1/2 О 2 = СО; СО + 1/2 О 2 = СО 2 CO 2 + H 2 O = H 2 CO 3 Ф. с. – Матово-чёрный (графит), либо прозрачный (алмаз) 22
 Азот 23
Азот 23
 Азот 24
Азот 24
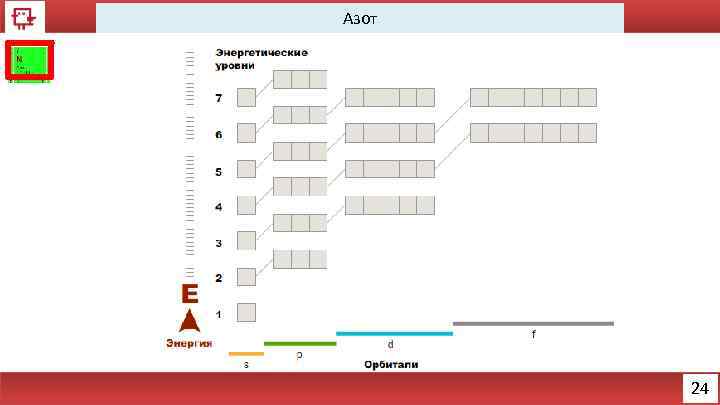
 Азот Количество электронов на внешнем уровне - 5 Радиус - 92 пм Валентность – 3, 4 Х. с. : N 2 O 5 + H 2 O = 2 HNO 3 N 2 O 3 + H 2 O = 2 HNO 2 Ф. с. – газ без цвета, вкуса и запаха. 25
Азот Количество электронов на внешнем уровне - 5 Радиус - 92 пм Валентность – 3, 4 Х. с. : N 2 O 5 + H 2 O = 2 HNO 3 N 2 O 3 + H 2 O = 2 HNO 2 Ф. с. – газ без цвета, вкуса и запаха. 25
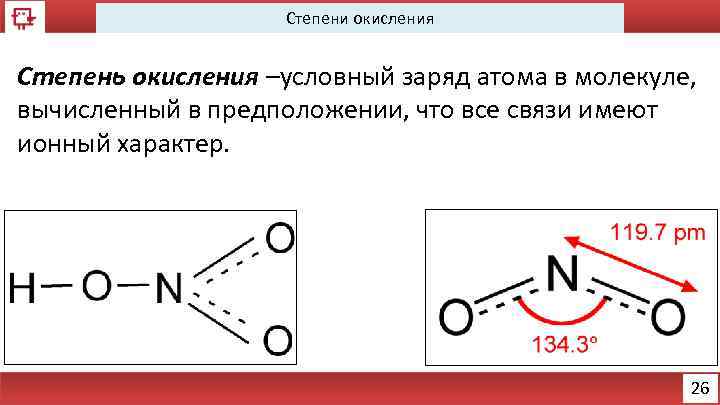 Степени окисления Степень окисления –условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер. 26
Степени окисления Степень окисления –условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют ионный характер. 26
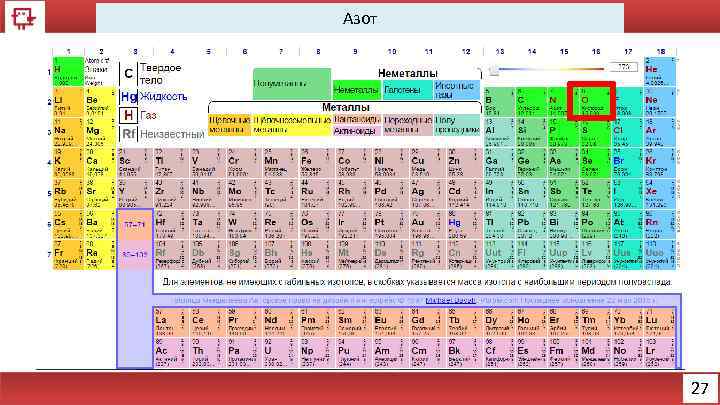 Азот 27
Азот 27
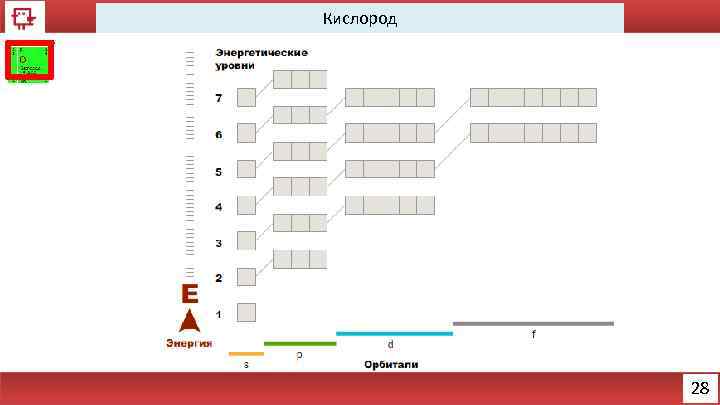 Кислород 28
Кислород 28
 Кислород Количество электронов на внешнем уровне - 6 Радиус - 92 пм Валентность – 2 Х. с. : 2 H 2+ O 2 = 2 H 2 O Ф. с. – газ без цвета, вкуса и запаха. 29
Кислород Количество электронов на внешнем уровне - 6 Радиус - 92 пм Валентность – 2 Х. с. : 2 H 2+ O 2 = 2 H 2 O Ф. с. – газ без цвета, вкуса и запаха. 29
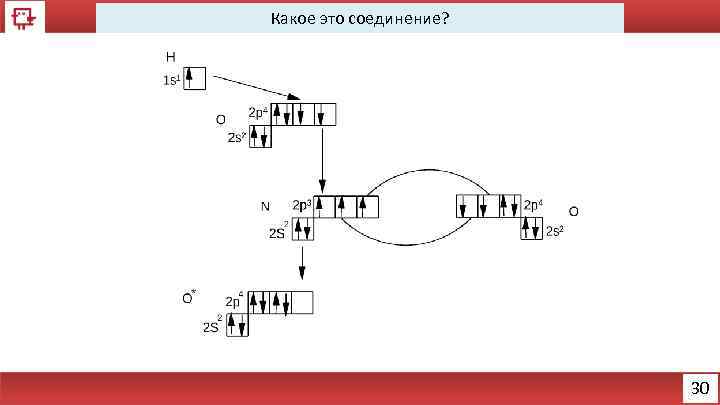 Какое это соединение? 30
Какое это соединение? 30
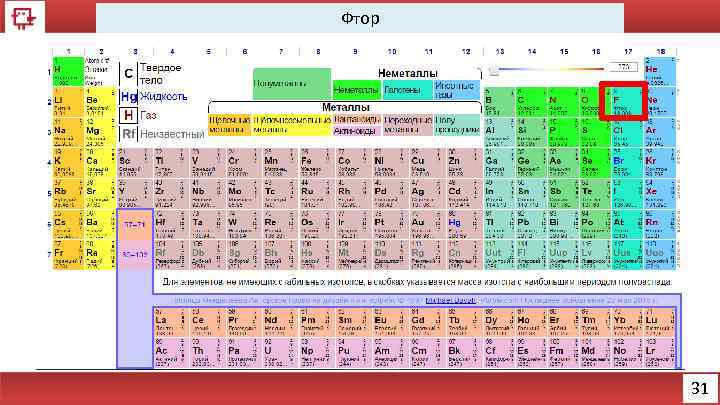 Фтор 31
Фтор 31
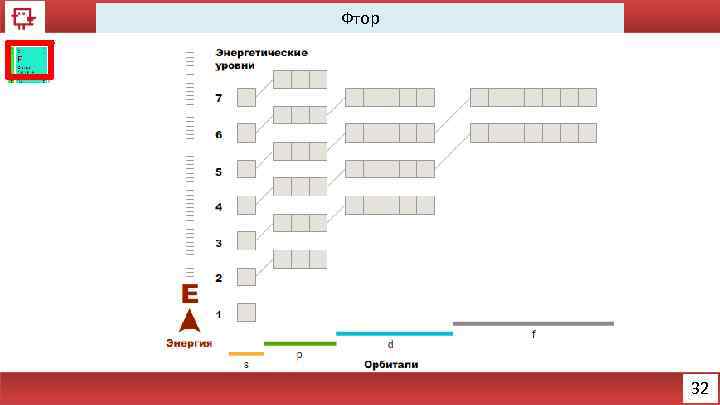 Фтор 32
Фтор 32
 Фтор Количество электронов на внешнем уровне - 7 Радиус - 73 пм Валентность – 1 Х. с. : H 2 + F 2 = 2 HF Xe + F 2 = Xe. F 2 Ф. с. – бесцветный газ 33
Фтор Количество электронов на внешнем уровне - 7 Радиус - 73 пм Валентность – 1 Х. с. : H 2 + F 2 = 2 HF Xe + F 2 = Xe. F 2 Ф. с. – бесцветный газ 33
 Неон 34
Неон 34
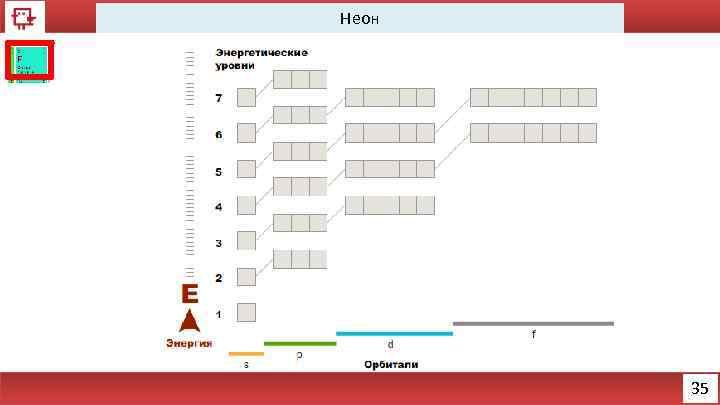 Неон 35
Неон 35
 Неон Количество электронов на внешнем уровне - 8 Радиус – 38 (? ) пм Валентность – не образует соединений Х. с. - отсутствуют Ф. с. – Инертный газ без цвета, вкуса и запаха 36
Неон Количество электронов на внешнем уровне - 8 Радиус – 38 (? ) пм Валентность – не образует соединений Х. с. - отсутствуют Ф. с. – Инертный газ без цвета, вкуса и запаха 36
 Неон 37
Неон 37
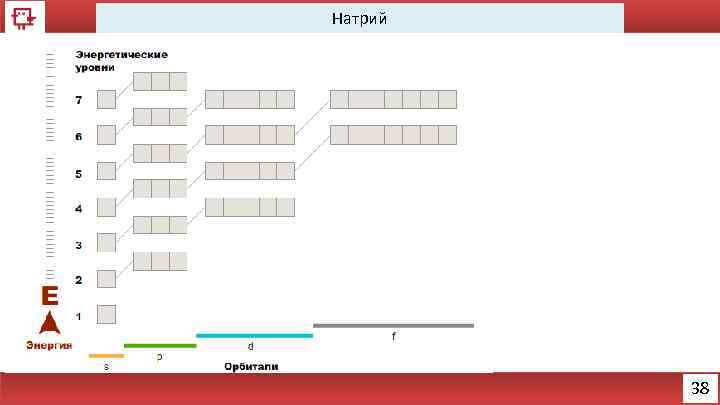 Натрий 38
Натрий 38
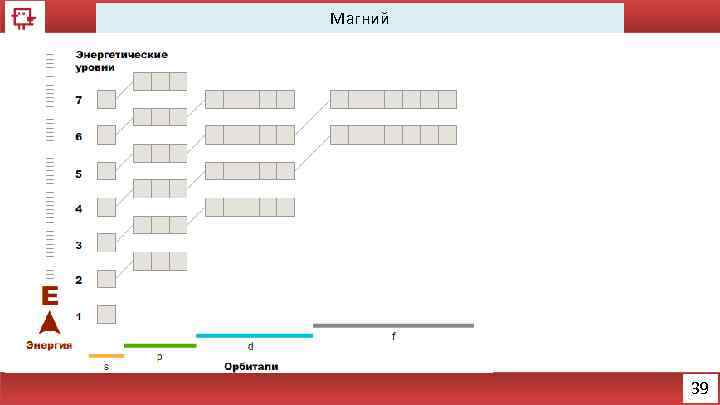 Магний 39
Магний 39
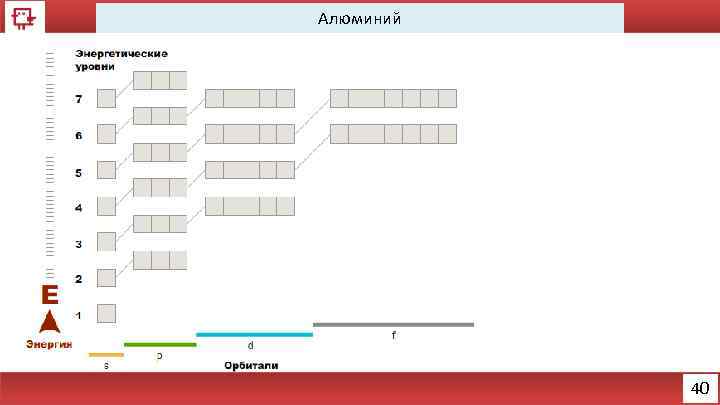 Алюминий 40
Алюминий 40
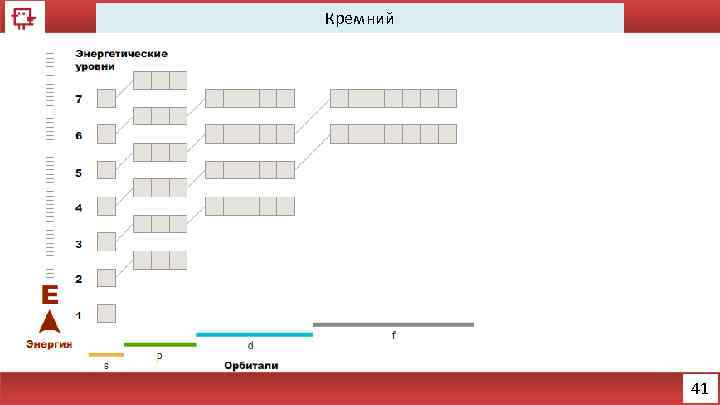 Кремний 41
Кремний 41
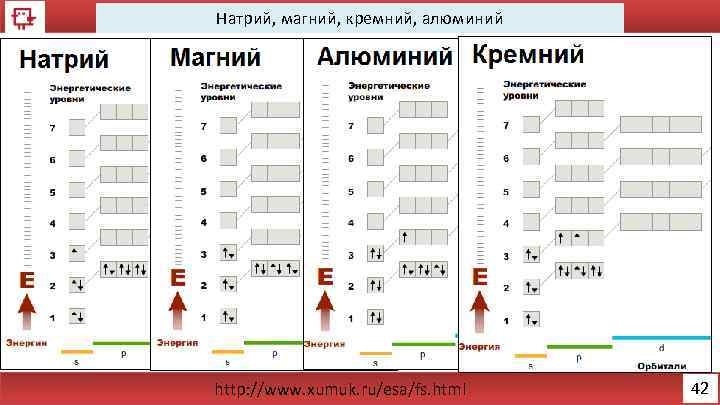 Натрий, магний, кремний, алюминий http: //www. xumuk. ru/esa/fs. html 42
Натрий, магний, кремний, алюминий http: //www. xumuk. ru/esa/fs. html 42


