3_30.ppt
- Количество слайдов: 20
 Урок № 30 Хлороводень (гідроген хлорид). Склад молекули і будова речовини. Фізичні властивості. Добування та застосування хлороводню (гідроген хлориду). Хлоридна кислота. Фізичні та хімічні властивості: взаємодія з металами, з основними та амфотерними оксидами та гідроксидами, солями. Хлориди. Розчинність хлоридів у воді. Якісна реакція на хлоридйони. Застосування хлоридної кислоти та хлоридів. Блаженство тела состоит в здоровье, блаженство ума — в знании. Фалес
Урок № 30 Хлороводень (гідроген хлорид). Склад молекули і будова речовини. Фізичні властивості. Добування та застосування хлороводню (гідроген хлориду). Хлоридна кислота. Фізичні та хімічні властивості: взаємодія з металами, з основними та амфотерними оксидами та гідроксидами, солями. Хлориди. Розчинність хлоридів у воді. Якісна реакція на хлоридйони. Застосування хлоридної кислоти та хлоридів. Блаженство тела состоит в здоровье, блаженство ума — в знании. Фалес
 Урок № 30. Хлороводень та хлоридна кислота • • • Бесіда. 1. Де у повсякденному житті ми зустрічаємось з хлоридною кислотою? 2. Де у природі може зустрічатися НСl? 3. Як отримати НСl ланцюговою реакцією? Які методи управління ланцюговими реакціями існують у техніці? Сl 2 = 2 Сl (инициирование цепи) Сl + Н 2 = НСl + Н (развитие цепи) Н + Сl 2 = НСl + Сl Н + Н = Н 2 (обрыв цепи) Сl + Сl = Сl 2 Сl + Н = НСl
Урок № 30. Хлороводень та хлоридна кислота • • • Бесіда. 1. Де у повсякденному житті ми зустрічаємось з хлоридною кислотою? 2. Де у природі може зустрічатися НСl? 3. Як отримати НСl ланцюговою реакцією? Які методи управління ланцюговими реакціями існують у техніці? Сl 2 = 2 Сl (инициирование цепи) Сl + Н 2 = НСl + Н (развитие цепи) Н + Сl 2 = НСl + Сl Н + Н = Н 2 (обрыв цепи) Сl + Сl = Сl 2 Сl + Н = НСl
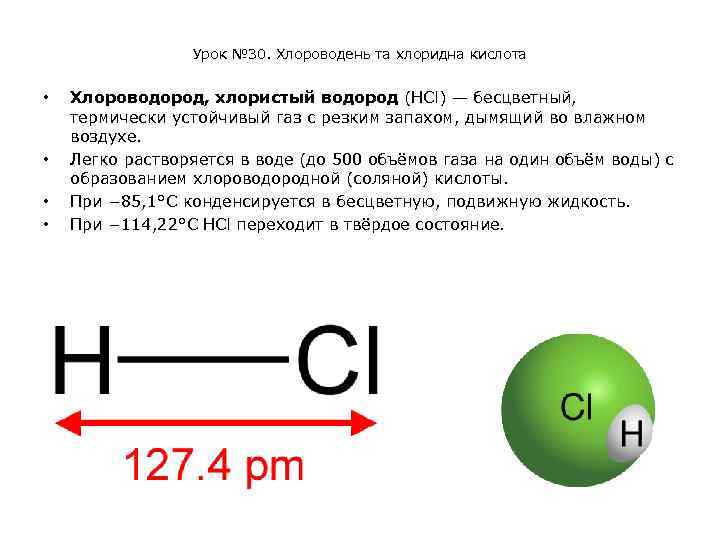 Урок № 30. Хлороводень та хлоридна кислота • • Хлороводород, хлористый водород (HCl) — бесцветный, термически устойчивый газ с резким запахом, дымящий во влажном воздухе. Легко растворяется в воде (до 500 объёмов газа на один объём воды) с образованием хлороводородной (соляной) кислоты. При − 85, 1°C конденсируется в бесцветную, подвижную жидкость. При − 114, 22°C HCl переходит в твёрдое состояние.
Урок № 30. Хлороводень та хлоридна кислота • • Хлороводород, хлористый водород (HCl) — бесцветный, термически устойчивый газ с резким запахом, дымящий во влажном воздухе. Легко растворяется в воде (до 500 объёмов газа на один объём воды) с образованием хлороводородной (соляной) кислоты. При − 85, 1°C конденсируется в бесцветную, подвижную жидкость. При − 114, 22°C HCl переходит в твёрдое состояние.
 Урок № 30. Хлороводень та хлоридна кислота • • Соляная (хлороводородная, хлористоводородная, хлоридная) кислота, хлористый водород — HCl, раствор хлороводорода в воде; сильная одноосновная кислота. Бесцветная (техническая соляная кислота желтоватая из-за примесей Fe, Cl 2 и др. ), «дымящая» на воздухе, едкая жидкость. Максимальная концентрация при 20°C равна 38% по массе, плотность такого раствора 1, 19 г/см³. Соли соляной кислоты называются хлоридами. Благодаря высокой полярности газообразный НСl хорошо растворим в воде (галогеноводороды также хорошо растворимы в спиртах. Например, в 1 л этанола при 17°С может быть растворено 327 л HCl), например в 1 объеме воды при 0°С растворяется 507 объемов НСl. При охлаждении ниже -20°С из водных растворов выделены кристаллогидраты НСl· 2 Н 2 O и т. п. , которые представляют собой галогениды оксония [Н 5 O 2]+Сl. Таким образом, растворение галогеноводородов в воде является химическим процессом.
Урок № 30. Хлороводень та хлоридна кислота • • Соляная (хлороводородная, хлористоводородная, хлоридная) кислота, хлористый водород — HCl, раствор хлороводорода в воде; сильная одноосновная кислота. Бесцветная (техническая соляная кислота желтоватая из-за примесей Fe, Cl 2 и др. ), «дымящая» на воздухе, едкая жидкость. Максимальная концентрация при 20°C равна 38% по массе, плотность такого раствора 1, 19 г/см³. Соли соляной кислоты называются хлоридами. Благодаря высокой полярности газообразный НСl хорошо растворим в воде (галогеноводороды также хорошо растворимы в спиртах. Например, в 1 л этанола при 17°С может быть растворено 327 л HCl), например в 1 объеме воды при 0°С растворяется 507 объемов НСl. При охлаждении ниже -20°С из водных растворов выделены кристаллогидраты НСl· 2 Н 2 O и т. п. , которые представляют собой галогениды оксония [Н 5 O 2]+Сl. Таким образом, растворение галогеноводородов в воде является химическим процессом.
 Урок № 30. Хлороводень та хлоридна кислота • • Синтез НСl Известны четыре основных метода синтеза НСl. 1. Прямой синтез из элементов. Хлор реагирует с водородом со взрывом, что является следствием цепного механизма реакции. Однако если водород поджечь на воздухе, а затем внести в сосуд с хлором, он сгорает без взрыва. Сжигание хлора с водородом является важным промышленным способом получения НСl. Образующийся хлороводород растворяют в воде. Некоторое его количество идет на получение хлористого метила и этила, хлорсульфоновой кислоты. Соляная кислота используется для обработки металлических поверхностей, очистки нефти, гидролиза углеводов, в производстве диоксида хлора. 2. Вытеснение НСl из хлоридов. Взаимодействие поваренной соли с концентрированной серной кислотой при слабом нагревании приводит к образованию кислой соли: Na. Cl + H 2 SO 4(70 -85%) = Na. HSO 4 + HCl Дальнейшее нагревание (t > 530°С) приводит к выделению дополнительного количества газа: Na. HSO 4 + Na. Cl –(t ) Na 2 SO 4 + HCl
Урок № 30. Хлороводень та хлоридна кислота • • Синтез НСl Известны четыре основных метода синтеза НСl. 1. Прямой синтез из элементов. Хлор реагирует с водородом со взрывом, что является следствием цепного механизма реакции. Однако если водород поджечь на воздухе, а затем внести в сосуд с хлором, он сгорает без взрыва. Сжигание хлора с водородом является важным промышленным способом получения НСl. Образующийся хлороводород растворяют в воде. Некоторое его количество идет на получение хлористого метила и этила, хлорсульфоновой кислоты. Соляная кислота используется для обработки металлических поверхностей, очистки нефти, гидролиза углеводов, в производстве диоксида хлора. 2. Вытеснение НСl из хлоридов. Взаимодействие поваренной соли с концентрированной серной кислотой при слабом нагревании приводит к образованию кислой соли: Na. Cl + H 2 SO 4(70 -85%) = Na. HSO 4 + HCl Дальнейшее нагревание (t > 530°С) приводит к выделению дополнительного количества газа: Na. HSO 4 + Na. Cl –(t ) Na 2 SO 4 + HCl
 Урок № 30. Хлороводень та хлоридна кислота • • • Синтез НСl 3. Гидролиз хлоридов неметаллов. Большинство хлоридов неметаллов относятся к соединениям с ковалентной связью и гидролизуются с выделением соответствующего галогеноводорода, например: Si. Cl 4 + 3 Н 2 O = H 2 Si. O 3 + 4 НСl Для получения галогеноводородов часто используют реакции гидролиза галогенидов фосфора РСl 3: РСl 3 + 3 Н 2 O = Н 3 РO 3 + 3 НСl 4. Галогенирование углеводородов. При хлорировании алканов и циклоалканов в качестве побочного продукта образуются галогеноводороды. В некоторых странах, например США, таким методом получают основное количество хлороводорода. СН 4 + Cl 2 = CH 3 Cl + HCl Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород прекрасно растворим в воде. Так, при 0°C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45%. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36 -процентную соляную кислоту.
Урок № 30. Хлороводень та хлоридна кислота • • • Синтез НСl 3. Гидролиз хлоридов неметаллов. Большинство хлоридов неметаллов относятся к соединениям с ковалентной связью и гидролизуются с выделением соответствующего галогеноводорода, например: Si. Cl 4 + 3 Н 2 O = H 2 Si. O 3 + 4 НСl Для получения галогеноводородов часто используют реакции гидролиза галогенидов фосфора РСl 3: РСl 3 + 3 Н 2 O = Н 3 РO 3 + 3 НСl 4. Галогенирование углеводородов. При хлорировании алканов и циклоалканов в качестве побочного продукта образуются галогеноводороды. В некоторых странах, например США, таким методом получают основное количество хлороводорода. СН 4 + Cl 2 = CH 3 Cl + HCl Соляную кислоту получают растворением газообразного хлороводорода в воде. Хлороводород прекрасно растворим в воде. Так, при 0°C 1 объём воды может поглотить 507 объёмов HCl, что соответствует концентрации кислоты 45%. Однако при комнатной температуре растворимость HCl ниже, поэтому на практике обычно используют 36 -процентную соляную кислоту.
 Урок № 30. Хлороводень та хлоридна кислота • • • Химические свойства HCl Взаимодействие с металлами, стоящими в электрохимическом ряду металлов до водорода с образованием соли и выделением газообразного водорода: 2 Na + 2 HCl 2 Na. Cl + H 2 Mg + 2 HCl Mg. Cl 2 + H 2 2 Al + 6 HCl 2 Al. Cl 3 + 3 H 2 Взаимодействие с оксидами металлов с образованием растворимой соли и воды: Mg. O + 2 HCl Mg. Cl 2 + H 2 O Cu. O + 2 HCl Cu. Cl 2 + H 2 O Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации): Na. OH + HCl Na. Cl + H 2 O Zn(OH)2 + 2 HCl Zn. Cl 2 + 2 H 2 O
Урок № 30. Хлороводень та хлоридна кислота • • • Химические свойства HCl Взаимодействие с металлами, стоящими в электрохимическом ряду металлов до водорода с образованием соли и выделением газообразного водорода: 2 Na + 2 HCl 2 Na. Cl + H 2 Mg + 2 HCl Mg. Cl 2 + H 2 2 Al + 6 HCl 2 Al. Cl 3 + 3 H 2 Взаимодействие с оксидами металлов с образованием растворимой соли и воды: Mg. O + 2 HCl Mg. Cl 2 + H 2 O Cu. O + 2 HCl Cu. Cl 2 + H 2 O Взаимодействие с гидроксидами металлов с образованием растворимой соли и воды (реакция нейтрализации): Na. OH + HCl Na. Cl + H 2 O Zn(OH)2 + 2 HCl Zn. Cl 2 + 2 H 2 O
 Урок № 30. Хлороводень та хлоридна кислота
Урок № 30. Хлороводень та хлоридна кислота
 Урок № 30. Хлороводень та хлоридна кислота • • • Химические свойства HCl Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной: Na 2 CO 3 + 2 HCl 2 Na. Cl + H 2 O + CO 2 Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора: 4 HCl (конц. ) + Mn. O 2 = Mn. Cl 2 + 2 H 2 O + Cl 2 , 4 HCl (конц. ) + Pb. O 2 = Pb. Cl 2 + 2 H 2 O. 16 HCl (конц. ) + 2 KMn. O 4 = 2 Mn. Cl 2 + 5 Cl 2 + 8 H 2 O + 2 KCl. 14 НСl(конц. ) + K 2 Сr 2 O 7 = 2 Сr. Сl 3 + 3 Cl 2 + 7 H 2 O + 2 KCl (60 - 80ºC). 4 HCl (конц. ) + Са(Сl. О)2 = 2 Cl 2 + Ca. Cl 2 + 2 H 2 O, 6 HCl (конц. ) + KСl. O 3 = 3 Cl 2 + KCl + 3 H 2 O.
Урок № 30. Хлороводень та хлоридна кислота • • • Химические свойства HCl Взаимодействие с солями металлов, образованных более слабыми кислотами, например угольной: Na 2 CO 3 + 2 HCl 2 Na. Cl + H 2 O + CO 2 Взаимодействие с сильными окислителями (перманганат калия, диоксид марганца) с выделением газообразного хлора: 4 HCl (конц. ) + Mn. O 2 = Mn. Cl 2 + 2 H 2 O + Cl 2 , 4 HCl (конц. ) + Pb. O 2 = Pb. Cl 2 + 2 H 2 O. 16 HCl (конц. ) + 2 KMn. O 4 = 2 Mn. Cl 2 + 5 Cl 2 + 8 H 2 O + 2 KCl. 14 НСl(конц. ) + K 2 Сr 2 O 7 = 2 Сr. Сl 3 + 3 Cl 2 + 7 H 2 O + 2 KCl (60 - 80ºC). 4 HCl (конц. ) + Са(Сl. О)2 = 2 Cl 2 + Ca. Cl 2 + 2 H 2 O, 6 HCl (конц. ) + KСl. O 3 = 3 Cl 2 + KCl + 3 H 2 O.
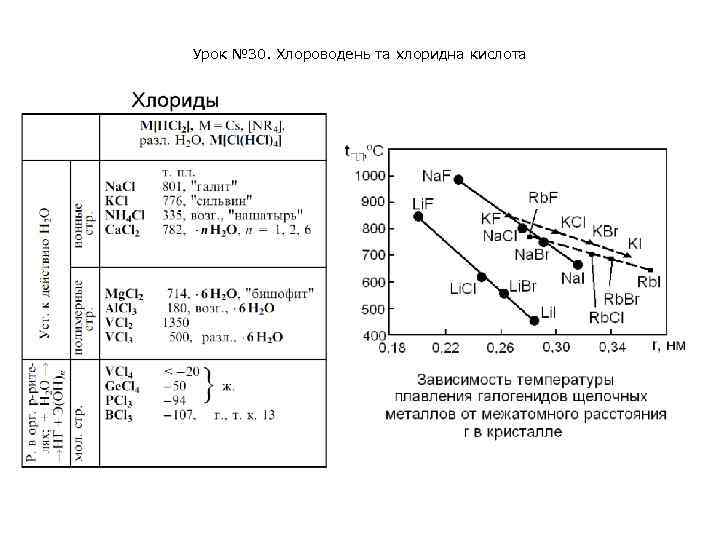
 Урок № 30. Хлороводень та хлоридна кислота • • Хлориды - группа химических соединений, соли хлороводородной (соляной) кислоты HCl. Ионные хлориды - твёрдые кристаллические вещества с высокими температурами плавления, проявляющие основные свойства; ковалентные - газы, жидкости или легкоплавкие твёрдые вещества, имеющие характерные кислотные свойства. Хлориды с промежуточной ионно-ковалентной природой связи проявляют, соответственно, амфотерные свойства. Хлориды разного типа могут взаимодействовать между собой: 2 KCl + Te. Cl 4 = K 2[Te. Cl 6] Большинство хлоридов элементов первой группы при атмосферном давлении кристаллизуются в структурном типе Na. Cl, и лишь для хлорида цезия реализуется более плотная структура (структурный тип Cs. Cl). Значения температур плавления хлоридов элементов первой группы монотонно понижаются с ростом межатомных расстояний в кристалле, которые также определяют и энергию кристаллической решетки. Безводные хлориды алюминия и переходных металлов имеют полимерное строение, связь металл-галоген является преимущественно ковалентной.
Урок № 30. Хлороводень та хлоридна кислота • • Хлориды - группа химических соединений, соли хлороводородной (соляной) кислоты HCl. Ионные хлориды - твёрдые кристаллические вещества с высокими температурами плавления, проявляющие основные свойства; ковалентные - газы, жидкости или легкоплавкие твёрдые вещества, имеющие характерные кислотные свойства. Хлориды с промежуточной ионно-ковалентной природой связи проявляют, соответственно, амфотерные свойства. Хлориды разного типа могут взаимодействовать между собой: 2 KCl + Te. Cl 4 = K 2[Te. Cl 6] Большинство хлоридов элементов первой группы при атмосферном давлении кристаллизуются в структурном типе Na. Cl, и лишь для хлорида цезия реализуется более плотная структура (структурный тип Cs. Cl). Значения температур плавления хлоридов элементов первой группы монотонно понижаются с ростом межатомных расстояний в кристалле, которые также определяют и энергию кристаллической решетки. Безводные хлориды алюминия и переходных металлов имеют полимерное строение, связь металл-галоген является преимущественно ковалентной.
 Урок № 30. Хлороводень та хлоридна кислота
Урок № 30. Хлороводень та хлоридна кислота
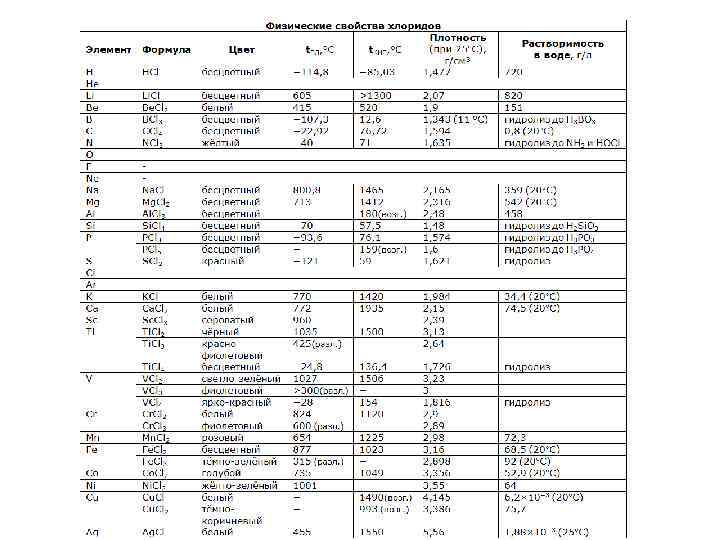
 Урок № 30. Хлороводень та хлоридна кислота • • Ионные хлориды при нормальных условиях не гидролизуются. Рассматривая хлориды переходных и некоторых других металлов, не склонных к образованию чисто ионных соединений, следует различать безводные хлориды и их гидраты. Так, хлорид железа(III) кристаллизуется из водного раствора в виде красно-коричневого гексагидрата Fe. Cl 3 6 Н 2 O, который имеет ионную кристаллическую решетку: [Fe(H 2 O)4 Cl 2]+Cl 2 Н 2 O. При нагревании из него невозможно получить безводный хлорид железа Fe. Cl 3, поскольку при этом протекают сложные реакции гидролиза и образования многоядерных оксо- и гидроксосоединений, аналогично алюминию. Аl. Сl 3 6 Н 2 O = Аl. Сl(ОН)2 + 2 НСl + 4 Н 2 O (100 -200°С), 2(Аl. Сl 3 6 Н 2 O) = Аl 2 O 3 +6 НСl + 9 Н 2 O (200 -450°С). Безводные хлориды, напротив, за редким исключением (хлорид хрома(III)) при попадании в воду гидратируются и кристаллизуются из растворов в форме кристаллогидратов.
Урок № 30. Хлороводень та хлоридна кислота • • Ионные хлориды при нормальных условиях не гидролизуются. Рассматривая хлориды переходных и некоторых других металлов, не склонных к образованию чисто ионных соединений, следует различать безводные хлориды и их гидраты. Так, хлорид железа(III) кристаллизуется из водного раствора в виде красно-коричневого гексагидрата Fe. Cl 3 6 Н 2 O, который имеет ионную кристаллическую решетку: [Fe(H 2 O)4 Cl 2]+Cl 2 Н 2 O. При нагревании из него невозможно получить безводный хлорид железа Fe. Cl 3, поскольку при этом протекают сложные реакции гидролиза и образования многоядерных оксо- и гидроксосоединений, аналогично алюминию. Аl. Сl 3 6 Н 2 O = Аl. Сl(ОН)2 + 2 НСl + 4 Н 2 O (100 -200°С), 2(Аl. Сl 3 6 Н 2 O) = Аl 2 O 3 +6 НСl + 9 Н 2 O (200 -450°С). Безводные хлориды, напротив, за редким исключением (хлорид хрома(III)) при попадании в воду гидратируются и кристаллизуются из растворов в форме кристаллогидратов.
 Хлороводень та хлоридна кислота
Хлороводень та хлоридна кислота
 Урок № 30. Хлороводень та хлоридна кислота • • • • • Методы получения безводных галогенидов. Безводные галогениды можно получить несколькими способами. 1. Прямое взаимодействие металлов с галогенами: Mg + 3 Cl 2 2 Mg. Cl 2 или галогеноводородами: Fe + 2 НСl(г. ) –(t°) Fe. Cl 2 + Н 2 2. Низкотемпературное галогенирование металлов в среде донорных растворителей (спиртов R-ОН, эфиров R-О-R и т. п. ), которое приводит на первой стадии к образованию сольвата: Mg + 2 НСl –(Et. OH) Mg. Cl 2 6 Et. OH + H 2 При нагревании в вакууме происходит десольватация: Mg. Cl 2 6 Et. OH –( 120°С, вакуум) Mg. Cl 2 + 6 Et. OH 3. Хлорирование оксидов с помощью Сl 2 в присутствии угля: Та 2 O 5 + 5 Сl 2 –(t°) 2 Ta. Cl 5 + 5 CO В качестве галогенирующих веществ используют также NH 4 Cl, ССl 4, СОСl 2, Cl. F 3: La 2 O 3 + 6 NH 4 Cl –(t°) 2 La. Cl 3+ 3 H 2 O + 6 NH 3 2 Al 2 O 3 + 3 CCl 4 –(t°) 4 Al. Cl 3 + 3 CO 2 4. Дегидратация кристаллогидратов. В качестве реагента, отнимающего воду, используют хлористый тионил: Ni. Cl 2 6 Н 2 O + 6 SOCl 2 –(t°) Ni. Cl 2 + 6 SO 2 + 12 HCl
Урок № 30. Хлороводень та хлоридна кислота • • • • • Методы получения безводных галогенидов. Безводные галогениды можно получить несколькими способами. 1. Прямое взаимодействие металлов с галогенами: Mg + 3 Cl 2 2 Mg. Cl 2 или галогеноводородами: Fe + 2 НСl(г. ) –(t°) Fe. Cl 2 + Н 2 2. Низкотемпературное галогенирование металлов в среде донорных растворителей (спиртов R-ОН, эфиров R-О-R и т. п. ), которое приводит на первой стадии к образованию сольвата: Mg + 2 НСl –(Et. OH) Mg. Cl 2 6 Et. OH + H 2 При нагревании в вакууме происходит десольватация: Mg. Cl 2 6 Et. OH –( 120°С, вакуум) Mg. Cl 2 + 6 Et. OH 3. Хлорирование оксидов с помощью Сl 2 в присутствии угля: Та 2 O 5 + 5 Сl 2 –(t°) 2 Ta. Cl 5 + 5 CO В качестве галогенирующих веществ используют также NH 4 Cl, ССl 4, СОСl 2, Cl. F 3: La 2 O 3 + 6 NH 4 Cl –(t°) 2 La. Cl 3+ 3 H 2 O + 6 NH 3 2 Al 2 O 3 + 3 CCl 4 –(t°) 4 Al. Cl 3 + 3 CO 2 4. Дегидратация кристаллогидратов. В качестве реагента, отнимающего воду, используют хлористый тионил: Ni. Cl 2 6 Н 2 O + 6 SOCl 2 –(t°) Ni. Cl 2 + 6 SO 2 + 12 HCl
 Урок № 30. Хлороводень та хлоридна кислота • • Качественная реакция на хлорид-ион Нитрат серебра Ag. NO 3 образует с анионом Сl белый творожистый осадок хлорида серебра, нерастворимый в воде и кислотах. Осадок растворяется в аммиаке, при этом образуется комплексная соль серебра [Ag (NН 3)2]Сl. При действии азотной кислоты комплексный ион разрушается и хлорид серебра снова выпадает в осадок. Реакции протекают в такой последовательности: Сl + Ag+ Ag. Cl + 2 NH 3 H 2 O [Ag(NН 3)2]Сl + 2 H 2 O [Ag(NН 3)2]Сl + 2 H+ Ag. Cl + 2 NH 4+ Хлорид серебра также растворяется в водных растворах (NH 4)2 CO 3 с образованием того же комплексного иона [Ag(NН 3)2]+, Na 2 S 2 O 3 с образованием комплексного иона [Ag(S 2 O 3)2]3 -, KCN с образованием комплексного иона [Ag(CN)2] и не растворяется в растворах кислот. Хлорид серебра темнеет на воздухе вследствие частичного восстановления Ag+ до Ag 0.
Урок № 30. Хлороводень та хлоридна кислота • • Качественная реакция на хлорид-ион Нитрат серебра Ag. NO 3 образует с анионом Сl белый творожистый осадок хлорида серебра, нерастворимый в воде и кислотах. Осадок растворяется в аммиаке, при этом образуется комплексная соль серебра [Ag (NН 3)2]Сl. При действии азотной кислоты комплексный ион разрушается и хлорид серебра снова выпадает в осадок. Реакции протекают в такой последовательности: Сl + Ag+ Ag. Cl + 2 NH 3 H 2 O [Ag(NН 3)2]Сl + 2 H 2 O [Ag(NН 3)2]Сl + 2 H+ Ag. Cl + 2 NH 4+ Хлорид серебра также растворяется в водных растворах (NH 4)2 CO 3 с образованием того же комплексного иона [Ag(NН 3)2]+, Na 2 S 2 O 3 с образованием комплексного иона [Ag(S 2 O 3)2]3 -, KCN с образованием комплексного иона [Ag(CN)2] и не растворяется в растворах кислот. Хлорид серебра темнеет на воздухе вследствие частичного восстановления Ag+ до Ag 0.

 Урок № 30. Хлороводень та хлоридна кислота • • Качественная реакция на хлорид-ион Условия проведения реакции. 1. Реакцию следует проводить при р. Н < 7. В щелочном растворе образуется оксид серебра (I), в аммиачной среде осадок не выделяется вследствие образования растворимого комплексного соединения. 2. Должны отсутствовать также и другие комплексообразующие реагенты: цианиды, тиосульфаты, роданиды, нитриты и т. п. , переводящие Ag. Cl в растворимое соединение. 3. Осаждение следует проводить из разбавленных растворов, добавляя неконцентрированные растворы реактивов, чтобы избежать образования комплексных ионов типа [Ag. Cl 2]. 4. Нагревание способствует свертыванию (коагуляции) осадка. 5. В растворе должны отсутствовать ионы Cu+, Au+, Tl+, Pb 2+, [Hg 2]2+, т. к. они тоже образуют с Cl малорастворимые осадки.
Урок № 30. Хлороводень та хлоридна кислота • • Качественная реакция на хлорид-ион Условия проведения реакции. 1. Реакцию следует проводить при р. Н < 7. В щелочном растворе образуется оксид серебра (I), в аммиачной среде осадок не выделяется вследствие образования растворимого комплексного соединения. 2. Должны отсутствовать также и другие комплексообразующие реагенты: цианиды, тиосульфаты, роданиды, нитриты и т. п. , переводящие Ag. Cl в растворимое соединение. 3. Осаждение следует проводить из разбавленных растворов, добавляя неконцентрированные растворы реактивов, чтобы избежать образования комплексных ионов типа [Ag. Cl 2]. 4. Нагревание способствует свертыванию (коагуляции) осадка. 5. В растворе должны отсутствовать ионы Cu+, Au+, Tl+, Pb 2+, [Hg 2]2+, т. к. они тоже образуют с Cl малорастворимые осадки.
 Урок № 30. Хлороводень та хлоридна кислота • • • Применение хлороводорода и соляной кислоты получение хлоридов травление металлов очистка поверхностей сосудов, скважин от карбонатов обработка руд производство каучуков, глутамината Na, соды, Сl 2 и т. д. • • Потребление соляной кислоты (тыс. т) хим. промышленность 320, 7, производство глутамината Na 99, 8, производство соды 54, 8, черная металлургия 50, 0, целлюлозно-бумажная промышленность 22, 2, прочие 80.
Урок № 30. Хлороводень та хлоридна кислота • • • Применение хлороводорода и соляной кислоты получение хлоридов травление металлов очистка поверхностей сосудов, скважин от карбонатов обработка руд производство каучуков, глутамината Na, соды, Сl 2 и т. д. • • Потребление соляной кислоты (тыс. т) хим. промышленность 320, 7, производство глутамината Na 99, 8, производство соды 54, 8, черная металлургия 50, 0, целлюлозно-бумажная промышленность 22, 2, прочие 80.
 Урок № 30. Хлороводень та хлоридна кислота • • Домашнє завдання 1. Вчити навчальний матеріал Біологи – у обсязі навчальної програми Хіміки – властивості ВСІХ сполук хлору 2. Підготовка до семінару «Властивості хлору та його сполук» 3. Виконати завдання
Урок № 30. Хлороводень та хлоридна кислота • • Домашнє завдання 1. Вчити навчальний матеріал Біологи – у обсязі навчальної програми Хіміки – властивості ВСІХ сполук хлору 2. Підготовка до семінару «Властивості хлору та його сполук» 3. Виконати завдання
 Хлороводень та хлоридна кислота
Хлороводень та хлоридна кислота


