 Урок № 29 Хімічні властивості хлору: взаємодія з воднем, металами, водою, лугами, метаном, етиленом і ацетиленом. Поняття про ланцюгову реакцію. Хлорна вода. Застосування хлору. Проблема охорони довкілля від забруднення сполуками Хлору И близость нового, и тайного чего-то Как пропасть горная, на склоне поворота, Меня баюкает и вкрадчиво зовет… К. Бальмонт
Урок № 29 Хімічні властивості хлору: взаємодія з воднем, металами, водою, лугами, метаном, етиленом і ацетиленом. Поняття про ланцюгову реакцію. Хлорна вода. Застосування хлору. Проблема охорони довкілля від забруднення сполуками Хлору И близость нового, и тайного чего-то Как пропасть горная, на склоне поворота, Меня баюкает и вкрадчиво зовет… К. Бальмонт
 Урок № 29. Хімічні властивості хлору • • • 1. Химические свойства хлора Хлор - один из наиболее химически активных элементов, он непосредственно взаимодействует со всеми металлами и большинством неметаллов (образуя хлориды), лишь реакция хлора с О 2, N 2 и Хе требует специальных методов активации – УФ-облучения или электроразряда, в остальных случаях достаточно простого нагревания. На валентном уровне атома хлора содержится 1 неспаренный электрон: 1 s 22 p 63 s 23 p 5, до завершения слоя не хватает 1 электрона, поэтому степень окисления -1 для хлора очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня, атом хлора может проявлять и другие степени окисления (+1, +3, +5, +7). Также известны соединения хлора, в которых хлора имеет степень окисления +4 и +6, например Cl. O 2 и Cl 2 O 6. Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон, в силу этого неустойчивы.
Урок № 29. Хімічні властивості хлору • • • 1. Химические свойства хлора Хлор - один из наиболее химически активных элементов, он непосредственно взаимодействует со всеми металлами и большинством неметаллов (образуя хлориды), лишь реакция хлора с О 2, N 2 и Хе требует специальных методов активации – УФ-облучения или электроразряда, в остальных случаях достаточно простого нагревания. На валентном уровне атома хлора содержится 1 неспаренный электрон: 1 s 22 p 63 s 23 p 5, до завершения слоя не хватает 1 электрона, поэтому степень окисления -1 для хлора очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня, атом хлора может проявлять и другие степени окисления (+1, +3, +5, +7). Также известны соединения хлора, в которых хлора имеет степень окисления +4 и +6, например Cl. O 2 и Cl 2 O 6. Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон, в силу этого неустойчивы.
 Урок № 29. Хімічні властивості хлору • • 1. Химические свойства хлора Несмотря на значительную прочность двухатомных молекул, образуемых галогенами, при определенных условиях возможна диссоциация молекул на атомы, например, Сl 2 ⇄ 2 Сl (гомолитический разрыв связи). Наиболее характерным для галогенов в молекулярном состоянии химическим процессом является участие в окислительновосстановительных реакциях, сопровождающихся разрывом связи X-X с присоединением к нейтральному атому галогена одного электрона X 0 + ē X (гетеролитический разрыв связи). Присоединение электрона к нейтральному атому галогена, приводящее к возникновению иона X с устойчивой 8 -электронной конфигурацией внешней электронной оболочки, достигается в громадном числе реакций взаимодействия Х 2 с металлами и неметаллами.
Урок № 29. Хімічні властивості хлору • • 1. Химические свойства хлора Несмотря на значительную прочность двухатомных молекул, образуемых галогенами, при определенных условиях возможна диссоциация молекул на атомы, например, Сl 2 ⇄ 2 Сl (гомолитический разрыв связи). Наиболее характерным для галогенов в молекулярном состоянии химическим процессом является участие в окислительновосстановительных реакциях, сопровождающихся разрывом связи X-X с присоединением к нейтральному атому галогена одного электрона X 0 + ē X (гетеролитический разрыв связи). Присоединение электрона к нейтральному атому галогена, приводящее к возникновению иона X с устойчивой 8 -электронной конфигурацией внешней электронной оболочки, достигается в громадном числе реакций взаимодействия Х 2 с металлами и неметаллами.
 Урок № 29. Хімічні властивості хлору
Урок № 29. Хімічні властивості хлору
 Урок № 29. Хімічні властивості хлору • • 1. 1. Взаимодействие с водородом На свету или при нагревании хлор активно реагирует (иногда со взрывом) с водородом по радикальному механизму. Смеси хлора с водородом, содержащие от 5, 8 до 88, 3% водорода, взрываются при облучении с образованием хлороводорода. Смесь хлора с водородом в небольших концентрациях горит бесцветным или желто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200°C: Cl 2 + H 2 2 HCl. При смешении равных объемов газов и освещении смеси (или инициировании другими видами энергии) происходит взрыв с образованием НСl. Однако можно провести эту реакцию и в спокойном режиме, если предварительно струю водорода поджечь на воздухе и внести газоотводную трубку с факелом горящего водорода в атмосферу хлора. Механизм реакции:
Урок № 29. Хімічні властивості хлору • • 1. 1. Взаимодействие с водородом На свету или при нагревании хлор активно реагирует (иногда со взрывом) с водородом по радикальному механизму. Смеси хлора с водородом, содержащие от 5, 8 до 88, 3% водорода, взрываются при облучении с образованием хлороводорода. Смесь хлора с водородом в небольших концентрациях горит бесцветным или желто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200°C: Cl 2 + H 2 2 HCl. При смешении равных объемов газов и освещении смеси (или инициировании другими видами энергии) происходит взрыв с образованием НСl. Однако можно провести эту реакцию и в спокойном режиме, если предварительно струю водорода поджечь на воздухе и внести газоотводную трубку с факелом горящего водорода в атмосферу хлора. Механизм реакции:
 Урок № 29. Хімічні властивості хлору • В присутствии Аl. Сl 3 реакция гладко протекает в темноте при 130°С. • Интересна демонстрация горения водорода в атмосфере хлора: иногда во время опыта возникает необычный побочный эффект: раздается гудение. Чаще всего пламя гудит, когда тонкую трубку, по которой подается водород, опускают в заполненный хлором сосуд конической формы; то же справедливо для сферических колб, а вот в цилиндрах пламя обычно не гудит. Это явление назвали «поющим пламенем» .
Урок № 29. Хімічні властивості хлору • В присутствии Аl. Сl 3 реакция гладко протекает в темноте при 130°С. • Интересна демонстрация горения водорода в атмосфере хлора: иногда во время опыта возникает необычный побочный эффект: раздается гудение. Чаще всего пламя гудит, когда тонкую трубку, по которой подается водород, опускают в заполненный хлором сосуд конической формы; то же справедливо для сферических колб, а вот в цилиндрах пламя обычно не гудит. Это явление назвали «поющим пламенем» .
 Урок № 29. Хімічні властивості хлору • • • 1. 2. Взаимодействие с металлами и неметаллами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании): Cl 2 + 2 Na. Cl 3 Cl 2 + 2 Fe. Cl 3 Хлорирование наиболее пассивных к хлору металлов начинается при следующих температурах, °С: Ni 680, Mg 600, Pt 560, W 540, Сr 520, Mo 420, Та 380, Ag 260, Ti 250, Сu и Аl 240, Fe 215. Сера и фтор реагируют с хлором при комнатной температуре, Si - при 200°С, углерод в виде графита устойчив к хлору до 700°С. Сl 2 –(F 2) Cl. F, Cl. F 3, Cl. F 5 (200 -400°С). S + Cl 2 = SCl 2 (до 20°С), 2 S + Cl 2 = S 2 Cl 2 (125 -130°С), 2 S + 2 Cl 2 + O 2 = 2 SCl 2 O (180 -200°С, кат. активный уголь). Реакционная способность оксидов металлов по отношению к хлору (образуются хлориды) значительно ниже, чем у соответствующих металлов, и убывает в ряду: Na 2 O, Ag 2 O, Ca. O, Pb. O, Cd. O, Mn. O, Ni. O, Zn. O, Fe. O, Mg. O, Fe 2 O 3, Zn. O 2, Ti. O 2, Al 2 O 3, Si. O 2. В присутствии углерода температура хлорирования оксидов снижается. 2 Сl 2 + 2 С (кокс) + Ti. O 2 = Ti. Cl 4 + 2 CO (900°С).
Урок № 29. Хімічні властивості хлору • • • 1. 2. Взаимодействие с металлами и неметаллами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании): Cl 2 + 2 Na. Cl 3 Cl 2 + 2 Fe. Cl 3 Хлорирование наиболее пассивных к хлору металлов начинается при следующих температурах, °С: Ni 680, Mg 600, Pt 560, W 540, Сr 520, Mo 420, Та 380, Ag 260, Ti 250, Сu и Аl 240, Fe 215. Сера и фтор реагируют с хлором при комнатной температуре, Si - при 200°С, углерод в виде графита устойчив к хлору до 700°С. Сl 2 –(F 2) Cl. F, Cl. F 3, Cl. F 5 (200 -400°С). S + Cl 2 = SCl 2 (до 20°С), 2 S + Cl 2 = S 2 Cl 2 (125 -130°С), 2 S + 2 Cl 2 + O 2 = 2 SCl 2 O (180 -200°С, кат. активный уголь). Реакционная способность оксидов металлов по отношению к хлору (образуются хлориды) значительно ниже, чем у соответствующих металлов, и убывает в ряду: Na 2 O, Ag 2 O, Ca. O, Pb. O, Cd. O, Mn. O, Ni. O, Zn. O, Fe. O, Mg. O, Fe 2 O 3, Zn. O 2, Ti. O 2, Al 2 O 3, Si. O 2. В присутствии углерода температура хлорирования оксидов снижается. 2 Сl 2 + 2 С (кокс) + Ti. O 2 = Ti. Cl 4 + 2 CO (900°С).
 Урок № 29. Хімічні властивості хлору • • • • 1. 2. Взаимодействие с металлами и неметаллами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании): Cl 2 + 2 Na. Cl 3 Cl 2 + 2 Sb. Cl 3 3 Cl 2 + 2 Fe. Cl 3 Хлорирование наиболее пассивных к хлору металлов начинается при следующих температурах, °С: Ni 680, Mg 600, Pt 560, W 540, Сr 520, Mo 420, Та 380, Ag 260, Ti 250, Сu и Аl 240, Fe 215. Сера и фтор реагируют с хлором при комнатной температуре, Si - при 200°С, углерод в виде графита устойчив к хлору до 700°С. Сl 2 –(F 2) Cl. F, Cl. F 3, Cl. F 5 (200 -400°С). S + Cl 2 = SCl 2 (до 20°С), 2 S + Cl 2 = S 2 Cl 2 (125 -130°С), 2 S + 2 Cl 2 + O 2 = 2 SCl 2 O (180 -200°С, кат. активный уголь). Реакционная способность оксидов металлов по отношению к хлору (образуются хлориды) значительно ниже, чем у соответствующих металлов, и убывает в ряду: Na 2 O, Ag 2 O, Ca. O, Pb. O, Cd. O, Mn. O, Ni. O, Zn. O, Fe. O, Mg. O, Fe 2 O 3, Zn. O 2, Ti. O 2, Al 2 O 3, Si. O 2. В присутствии углерода температура хлорирования оксидов снижается. 2 Сl 2 + 2 С (кокс) + Ti. O 2 = Ti. Cl 4 + 2 CO (900°С).
Урок № 29. Хімічні властивості хлору • • • • 1. 2. Взаимодействие с металлами и неметаллами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании): Cl 2 + 2 Na. Cl 3 Cl 2 + 2 Sb. Cl 3 3 Cl 2 + 2 Fe. Cl 3 Хлорирование наиболее пассивных к хлору металлов начинается при следующих температурах, °С: Ni 680, Mg 600, Pt 560, W 540, Сr 520, Mo 420, Та 380, Ag 260, Ti 250, Сu и Аl 240, Fe 215. Сера и фтор реагируют с хлором при комнатной температуре, Si - при 200°С, углерод в виде графита устойчив к хлору до 700°С. Сl 2 –(F 2) Cl. F, Cl. F 3, Cl. F 5 (200 -400°С). S + Cl 2 = SCl 2 (до 20°С), 2 S + Cl 2 = S 2 Cl 2 (125 -130°С), 2 S + 2 Cl 2 + O 2 = 2 SCl 2 O (180 -200°С, кат. активный уголь). Реакционная способность оксидов металлов по отношению к хлору (образуются хлориды) значительно ниже, чем у соответствующих металлов, и убывает в ряду: Na 2 O, Ag 2 O, Ca. O, Pb. O, Cd. O, Mn. O, Ni. O, Zn. O, Fe. O, Mg. O, Fe 2 O 3, Zn. O 2, Ti. O 2, Al 2 O 3, Si. O 2. В присутствии углерода температура хлорирования оксидов снижается. 2 Сl 2 + 2 С (кокс) + Ti. O 2 = Ti. Cl 4 + 2 CO (900°С).
 Урок № 29. Хімічні властивості хлору • • • 1. 3. Взаимодействие с водой Низкая растворимость галогенов в воде обусловлена слабым взаимодействием неполярных молекул галогенов и полярных молекул воды, а также особенностями строения воды. В кристалле льда каждая молекула воды соединена водородными связями с четырьмя ближайшими к ней молекулами Н 2 O. Поскольку водородная связь Н-O длиннее ковалентной Н-О, то структура льда оказывается рыхлой и содержит много свободных полостей. Этим объясняется низкая плотность льда и способность образовывать клатратные соединения, например 8 Сl 2 46 Н 2 O (устойчиво ниже 9, 6°С). При плавлении льда каркас частично разрушается, а некоторые молекулы воды заполняют пустоты между связанными друг с другом молекулами Н 2 O. При этом плотность жидкой воды и жесткость каркаса увеличивается, а число полостей, где могли бы разместиться молекулы галогенов, уменьшается. Все это приводит к незначительной растворимости хлора, брома и особенно иода в жидкой воде.
Урок № 29. Хімічні властивості хлору • • • 1. 3. Взаимодействие с водой Низкая растворимость галогенов в воде обусловлена слабым взаимодействием неполярных молекул галогенов и полярных молекул воды, а также особенностями строения воды. В кристалле льда каждая молекула воды соединена водородными связями с четырьмя ближайшими к ней молекулами Н 2 O. Поскольку водородная связь Н-O длиннее ковалентной Н-О, то структура льда оказывается рыхлой и содержит много свободных полостей. Этим объясняется низкая плотность льда и способность образовывать клатратные соединения, например 8 Сl 2 46 Н 2 O (устойчиво ниже 9, 6°С). При плавлении льда каркас частично разрушается, а некоторые молекулы воды заполняют пустоты между связанными друг с другом молекулами Н 2 O. При этом плотность жидкой воды и жесткость каркаса увеличивается, а число полостей, где могли бы разместиться молекулы галогенов, уменьшается. Все это приводит к незначительной растворимости хлора, брома и особенно иода в жидкой воде.
 Урок № 29. Хімічні властивості хлору Одновременно с образованием клатратов (физико-химическим процессом) протекают химические реакции взаимодействия с водой, которые сдвигают вправо равновесие: Х 2, газ ⇄ Х 2, р-р, что резко повышает суммарную ( «физическую» плюс «химическую» ) растворимость галогенов в воде. • Хлор химически реагирует с водой не бурно, при этом образуются хлороводород и хлористая кислота Сl 2 + Н 2 О = НСl + НСl. О (равновесие устанавливается в течение суток). • Хлорноватистая кислота на свету разлагается: HCl. O HCl + O. Именно атомарному кислороду приписывают отбеливающий эффект (абсолютно сухой хлор такой способностью не обладает). •
Урок № 29. Хімічні властивості хлору Одновременно с образованием клатратов (физико-химическим процессом) протекают химические реакции взаимодействия с водой, которые сдвигают вправо равновесие: Х 2, газ ⇄ Х 2, р-р, что резко повышает суммарную ( «физическую» плюс «химическую» ) растворимость галогенов в воде. • Хлор химически реагирует с водой не бурно, при этом образуются хлороводород и хлористая кислота Сl 2 + Н 2 О = НСl + НСl. О (равновесие устанавливается в течение суток). • Хлорноватистая кислота на свету разлагается: HCl. O HCl + O. Именно атомарному кислороду приписывают отбеливающий эффект (абсолютно сухой хлор такой способностью не обладает). •
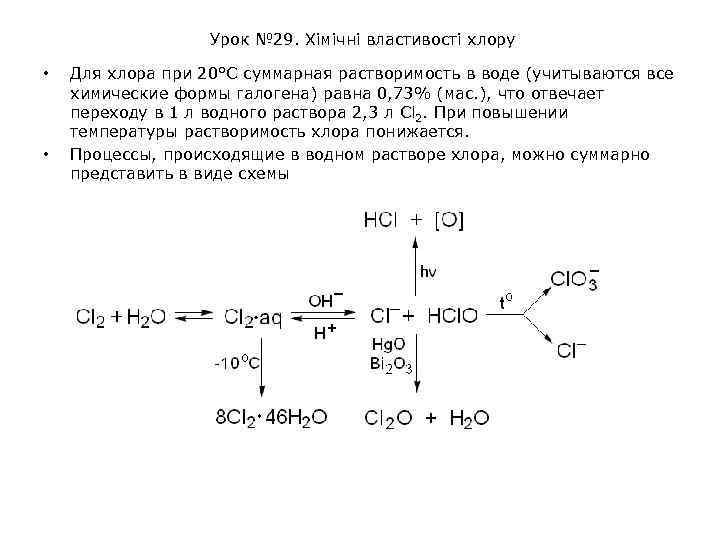 Урок № 29. Хімічні властивості хлору • • Для хлора при 20°С суммарная растворимость в воде (учитываются все химические формы галогена) равна 0, 73% (маc. ), что отвечает переходу в 1 л водного раствора 2, 3 л Cl 2. При повышении температуры растворимость хлора понижается. Процессы, происходящие в водном растворе хлора, можно суммарно представить в виде схемы
Урок № 29. Хімічні властивості хлору • • Для хлора при 20°С суммарная растворимость в воде (учитываются все химические формы галогена) равна 0, 73% (маc. ), что отвечает переходу в 1 л водного раствора 2, 3 л Cl 2. При повышении температуры растворимость хлора понижается. Процессы, происходящие в водном растворе хлора, можно суммарно представить в виде схемы
 Урок № 29. Хімічні властивості хлору • • 1. 4. Взаимодействие со щелочами Как типичные неметаллы, галогены взаимодействуют со щелочами в водных растворах: Cl 2 + 2 Na. OH = Na. Cl + Na. Cl. O + H 2 O (на холоду) Для выделения продуктов реакции и отделения из реакционной смеси хлорида натрия (Na. Cl) используют охлаждение до температуры близкой к 0°C - в этих условиях соль выпадает в осадок. Дальнейшим замораживанием смеси (− 40°C) и последующей кристаллизацией при − 5°C получают пентагидрат гипохлорита натрия Na. OCl· 5 H 2 O. Безводную соль можно получить обезвоживанием в вакууме над концентрированной серной кислотой. Впервые эту реакцию осуществил в 1820 году французский аптекарь Антуан Лабаррак. Получившийся раствор гипохлорита натрия получил название «Eau de Labarraque» ( «лабарракова вода» ). При пропускании хлора в горячий раствор щелочи идет более глубокое диспрпопорционирование: 3 Cl 2 + 6 Na. OH = 5 Na. Cl + Na. Cl. O 3 + 3 H 2 O (t°) Этот метод неприменим для получения хлоратов, поэтому имеет чисто теоретический интерес.
Урок № 29. Хімічні властивості хлору • • 1. 4. Взаимодействие со щелочами Как типичные неметаллы, галогены взаимодействуют со щелочами в водных растворах: Cl 2 + 2 Na. OH = Na. Cl + Na. Cl. O + H 2 O (на холоду) Для выделения продуктов реакции и отделения из реакционной смеси хлорида натрия (Na. Cl) используют охлаждение до температуры близкой к 0°C - в этих условиях соль выпадает в осадок. Дальнейшим замораживанием смеси (− 40°C) и последующей кристаллизацией при − 5°C получают пентагидрат гипохлорита натрия Na. OCl· 5 H 2 O. Безводную соль можно получить обезвоживанием в вакууме над концентрированной серной кислотой. Впервые эту реакцию осуществил в 1820 году французский аптекарь Антуан Лабаррак. Получившийся раствор гипохлорита натрия получил название «Eau de Labarraque» ( «лабарракова вода» ). При пропускании хлора в горячий раствор щелочи идет более глубокое диспрпопорционирование: 3 Cl 2 + 6 Na. OH = 5 Na. Cl + Na. Cl. O 3 + 3 H 2 O (t°) Этот метод неприменим для получения хлоратов, поэтому имеет чисто теоретический интерес.
 Урок № 29. Хімічні властивості хлору • • • 1. 5. Взаимодействие с метаном, этиленом и ацетиленом Хлор реагирует со многими органическими соединениями. Он быстро присоединяется к непредельным соединениям с двойными и тройными углерод-углеродными связями (реакция с ацетиленом идет со взрывом), а на свету – и к бензолу. При определенных условиях хлор может замещать атомы водорода в органических соединениях: R–H + Cl 2 RCl + HCl. Эта реакция сыграла значительную роль в истории органической химии. В 1840 -х французский химик Жан Батист Дюма обнаружил, что при действии хлора на уксусную кислоту с удивительной легкостью идет реакция СН 3 СООН + Cl 2 CH 2 Cl. COOH + HCl. При избытке хлора образуется трихлоруксусная кислота ССl 3 СООН. Однако многие химики отнеслись к работе Дюма недоверчиво. Ведь согласно общепринятой тогда теории Берцелиуса положительно заряженные атомы водорода не могли заместиться отрицательно заряженными атомами хлора. Этого мнения придерживались в то время многие выдающиеся химики, среди которых были Фридрих Вёлер, Юстус Либих и, конечно, сам Берцелиус.
Урок № 29. Хімічні властивості хлору • • • 1. 5. Взаимодействие с метаном, этиленом и ацетиленом Хлор реагирует со многими органическими соединениями. Он быстро присоединяется к непредельным соединениям с двойными и тройными углерод-углеродными связями (реакция с ацетиленом идет со взрывом), а на свету – и к бензолу. При определенных условиях хлор может замещать атомы водорода в органических соединениях: R–H + Cl 2 RCl + HCl. Эта реакция сыграла значительную роль в истории органической химии. В 1840 -х французский химик Жан Батист Дюма обнаружил, что при действии хлора на уксусную кислоту с удивительной легкостью идет реакция СН 3 СООН + Cl 2 CH 2 Cl. COOH + HCl. При избытке хлора образуется трихлоруксусная кислота ССl 3 СООН. Однако многие химики отнеслись к работе Дюма недоверчиво. Ведь согласно общепринятой тогда теории Берцелиуса положительно заряженные атомы водорода не могли заместиться отрицательно заряженными атомами хлора. Этого мнения придерживались в то время многие выдающиеся химики, среди которых были Фридрих Вёлер, Юстус Либих и, конечно, сам Берцелиус.
 Урок № 29. Хімічні властивості хлору • • Чтобы высмеять Дюма, Вёлер передал своему другу Либиху статью от имени некоего Ш. Виндлера (Schwindler – по-немецки мошенник) о новом удачном приложении якобы открытой Дюма реакции. В статье Вёлер с явной издёвкой написал о том, как в уксуснокислом марганце Mn(CH 3 COO)2 удалось все элементы, в соответствии с их валентностью, заместить на хлор, в результате чего получилось желтое кристаллическое вещество, состоящее из одного только хлора. Далее говорилось, что в Англии, последовательно замещая в органических соединениях все атомы на атомы хлора, обычные ткани превращают в хлорные, и что при этом вещи сохраняют свой внешний вид. В сноске было указано, что лондонские лавки бойко торгуют материалом, состоящим из одного хлора, так как этот материал очень хорош для ночных колпаков и теплых подштанников. Либиху шутка понравилась, и он опубликовал ее (на французском языке) от имени Ш. Виндлера всего через несколько страниц после статьи Дюма. Намек получился очень прозрачным. Тем не менее прав оказался все же Дюма.
Урок № 29. Хімічні властивості хлору • • Чтобы высмеять Дюма, Вёлер передал своему другу Либиху статью от имени некоего Ш. Виндлера (Schwindler – по-немецки мошенник) о новом удачном приложении якобы открытой Дюма реакции. В статье Вёлер с явной издёвкой написал о том, как в уксуснокислом марганце Mn(CH 3 COO)2 удалось все элементы, в соответствии с их валентностью, заместить на хлор, в результате чего получилось желтое кристаллическое вещество, состоящее из одного только хлора. Далее говорилось, что в Англии, последовательно замещая в органических соединениях все атомы на атомы хлора, обычные ткани превращают в хлорные, и что при этом вещи сохраняют свой внешний вид. В сноске было указано, что лондонские лавки бойко торгуют материалом, состоящим из одного хлора, так как этот материал очень хорош для ночных колпаков и теплых подштанников. Либиху шутка понравилась, и он опубликовал ее (на французском языке) от имени Ш. Виндлера всего через несколько страниц после статьи Дюма. Намек получился очень прозрачным. Тем не менее прав оказался все же Дюма.
 Урок № 29. Хімічні властивості хлору • • Реакция хлора с органическими соединениями приводит к образованию множества хлорорганических продуктов, среди которых – широко применяющиеся растворители метиленхлорид CH 2 Cl 2, хлороформ CHCl 3, четыреххлористый углерод CCl 4, трихлорэтилен CHCl=CCl 2, тетрахлорэтилен C 2 Cl 4. В присутствии влаги хлор обесцвечивает зеленые листья растений, многие красители. Этим пользовались еще в XVIII в. для отбеливания тканей. Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода. CH 3 Cl CH 2 Cl 2 CHCl 3 CCl 4
Урок № 29. Хімічні властивості хлору • • Реакция хлора с органическими соединениями приводит к образованию множества хлорорганических продуктов, среди которых – широко применяющиеся растворители метиленхлорид CH 2 Cl 2, хлороформ CHCl 3, четыреххлористый углерод CCl 4, трихлорэтилен CHCl=CCl 2, тетрахлорэтилен C 2 Cl 4. В присутствии влаги хлор обесцвечивает зеленые листья растений, многие красители. Этим пользовались еще в XVIII в. для отбеливания тканей. Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить УФ-светом или нагреть. Хлорирование метана не останавливается на стадии получения метилхлорида (если взяты эквимолярные количества хлора и метана), а приводит к образованию всех возможных продуктов замещения, от метилхлорида до тетрахлоруглерода. CH 3 Cl CH 2 Cl 2 CHCl 3 CCl 4
 Урок № 29. Хімічні властивості хлору • • • Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
Урок № 29. Хімічні властивості хлору • • • Хлорирование других алканов приводит к смеси продуктов замещения водорода у разных атомов углерода. Соотношение продуктов хлорирования зависит от температуры. Скорость хлорирования первичных, вторичных и третичных атомов зависит от температуры, при низкой температуре скорость убывает в ряду: третичный, вторичный, первичный. При повышении температуры разница между скоростями уменьшается до тех пор, пока не становится одинаковой. Кроме кинетического фактора на распределение продуктов хлорирования оказывает влияние статистический фактор: вероятность атаки хлором третичного атома углерода в 3 раза меньше, чем первичного и в два раза меньше чем вторичного. Таким образом хлорирование алканов является нестереоселективной реакцией, исключая случаи, когда возможен только один продукт монохлорирования.
 Урок № 29. Хімічні властивості хлору • • • Галогенирование - это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно - за один этап замещается не более одного атома водорода: 1. CH 4 + Cl 2 CH 3 Cl + HCl (хлорметан) 2. CH 3 Cl + Cl 2 CH 2 Cl 2 + HCl (дихлорметан) 3. CH 2 Cl 2 + Cl 2 CHCl 3 + HCl (трихлорметан) 4. CHCl 3 + Cl 2 CCl 4 + HCl (тетрахлорметан). Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, замещая у них атом водорода, в результате этого образуются метильные радикалы СН 3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы. Механизм реакции:
Урок № 29. Хімічні властивості хлору • • • Галогенирование - это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атому галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно - за один этап замещается не более одного атома водорода: 1. CH 4 + Cl 2 CH 3 Cl + HCl (хлорметан) 2. CH 3 Cl + Cl 2 CH 2 Cl 2 + HCl (дихлорметан) 3. CH 2 Cl 2 + Cl 2 CHCl 3 + HCl (трихлорметан) 4. CHCl 3 + Cl 2 CCl 4 + HCl (тетрахлорметан). Под действием света молекула хлора распадается на радикалы, затем они атакуют молекулы алкана, замещая у них атом водорода, в результате этого образуются метильные радикалы СН 3, которые сталкиваются с молекулами хлора, разрушая их и образуя новые радикалы. Механизм реакции:
 Урок № 29. Хімічні властивості хлору • Хлорирование этена легко протекает в газовой фазе: • Присоединение хлора к ацетилену происходит с меньшей скоростью, чем к этилену, в две стадии, которые отличаются друг от друга скоростью. При этом образуется смесь цис- и преимущественно трансаддуктов: • Хлорирование чаще всего проводят в растворителях с целью избегания взрыва, т. к. ацетилен сгорает, т. е. окисляется, в атмосфере хлора по радикально-цепному механизму.
Урок № 29. Хімічні властивості хлору • Хлорирование этена легко протекает в газовой фазе: • Присоединение хлора к ацетилену происходит с меньшей скоростью, чем к этилену, в две стадии, которые отличаются друг от друга скоростью. При этом образуется смесь цис- и преимущественно трансаддуктов: • Хлорирование чаще всего проводят в растворителях с целью избегания взрыва, т. к. ацетилен сгорает, т. е. окисляется, в атмосфере хлора по радикально-цепному механизму.
 Урок № 29. Хімічні властивості хлору • • • ЦЕПНЫЕ РЕАКЦИИ – химические реакции, идущие путем последовательности одних и тех же элементарных стадий, на каждой из которых возникает одна или несколько активных частиц (атомов, свободных радикалов, ион-радикалов). По цепному механизму протекают реакции крекинга, горения, полимеризации и ряд других реакций Цепи Боденштейна – Нернста. К концу 19 в. была разработана важнейшая глава физической химии – учение о равновесиях химических реакций (химическая термодинамика). Стало возможным рассчитывать, на какую максимально возможную глубину может пройти конкретная реакция при данных условиях. Одновременно создавалось учение о скоростях химических процессов – химическая кинетика. Накопленные ко второй половине 19 в. многочисленные экспериментальные данные можно было объяснить на основании закона действующих масс и уравнения Аррениуса. В то же время появлялись факты, которые невозможно было объяснить ни одной из существовавших теорий. Одной из самых загадочных оказалась очень простая с виду реакция водорода с хлором: H 2 + Cl 2 2 HCl.
Урок № 29. Хімічні властивості хлору • • • ЦЕПНЫЕ РЕАКЦИИ – химические реакции, идущие путем последовательности одних и тех же элементарных стадий, на каждой из которых возникает одна или несколько активных частиц (атомов, свободных радикалов, ион-радикалов). По цепному механизму протекают реакции крекинга, горения, полимеризации и ряд других реакций Цепи Боденштейна – Нернста. К концу 19 в. была разработана важнейшая глава физической химии – учение о равновесиях химических реакций (химическая термодинамика). Стало возможным рассчитывать, на какую максимально возможную глубину может пройти конкретная реакция при данных условиях. Одновременно создавалось учение о скоростях химических процессов – химическая кинетика. Накопленные ко второй половине 19 в. многочисленные экспериментальные данные можно было объяснить на основании закона действующих масс и уравнения Аррениуса. В то же время появлялись факты, которые невозможно было объяснить ни одной из существовавших теорий. Одной из самых загадочных оказалась очень простая с виду реакция водорода с хлором: H 2 + Cl 2 2 HCl.
 Урок № 29. Хімічні властивості хлору • • В 1845 английский химик Джон Дрепер обнаружил, что под действием солнечного света хлор приобретает особую активность в реакции с водородом. Еще более удивительный факт обнаружили в 1857 немецкий химик Роберт Бунзен и его ученик из Англии Генри Роско. Оказалось, что некоторые примеси даже в самых малых концентрациях могут оказать огромное влияние на скорость этой реакции. Например, малые добавки кислорода замедляли ее в сотни раз. Это был парадоксальный результат, так кислород сам прекрасно реагирует с водородом. Обнаружились и другие непонятные явления. Например, скорость реакции зависела от материала стенки сосуда и даже от его размеров. В стройном, казалось бы, учении о скоростях реакций появилась брешь, и никто не знал, как с ней справиться. А реакция водорода с хлором преподносила ученым все новые сюрпризы. В начале 20 в. Альберт Эйнштейн сформулировал закон, согласно которому каждый поглощенный квант света (фотон) вызывает изменения лишь в одной молекуле. Экспериментально несложно измерить число прореагировавших (или образовавшихся) молекул и число поглощенных в реакции квантов света. Отношение этих величин называется квантовым выходом реакции. Так, если на каждый поглощенный реагентами квант света образуется одна молекула продукта, то квантовый выход такой реакции равен единице.
Урок № 29. Хімічні властивості хлору • • В 1845 английский химик Джон Дрепер обнаружил, что под действием солнечного света хлор приобретает особую активность в реакции с водородом. Еще более удивительный факт обнаружили в 1857 немецкий химик Роберт Бунзен и его ученик из Англии Генри Роско. Оказалось, что некоторые примеси даже в самых малых концентрациях могут оказать огромное влияние на скорость этой реакции. Например, малые добавки кислорода замедляли ее в сотни раз. Это был парадоксальный результат, так кислород сам прекрасно реагирует с водородом. Обнаружились и другие непонятные явления. Например, скорость реакции зависела от материала стенки сосуда и даже от его размеров. В стройном, казалось бы, учении о скоростях реакций появилась брешь, и никто не знал, как с ней справиться. А реакция водорода с хлором преподносила ученым все новые сюрпризы. В начале 20 в. Альберт Эйнштейн сформулировал закон, согласно которому каждый поглощенный квант света (фотон) вызывает изменения лишь в одной молекуле. Экспериментально несложно измерить число прореагировавших (или образовавшихся) молекул и число поглощенных в реакции квантов света. Отношение этих величин называется квантовым выходом реакции. Так, если на каждый поглощенный реагентами квант света образуется одна молекула продукта, то квантовый выход такой реакции равен единице.
 Урок № 29. Хімічні властивості хлору • • Однако экспериментально измеренные квантовые выходы многих реакций не соответствовали закону квантовой эквивалентности. В 1913 один из основоположников химической кинетики немецкий химик Макс Боденштейн измерил квантовый выход фотохимической реакции водорода с хлором H 2 + Cl 2 2 HCl. Результат оказался невероятным: число молекул HCl, образовавшихся при поглощении смесью одного кванта света, в некоторых условиях достигал миллиона! Боденштейн объяснил этот поразительный результат единственным разумным методом: каждый поглощенный квант света «запускает» длинную цепочку превращений, в которой реагируют сотни тысяч молекул исходных веществ (H 2 и Cl 2), превращаясь в молекулы продукта реакции (HCl). Это похоже на то, как выстроенные в ряд костяшки домино быстро, как по команде, падают одна за другой, если удачно толкнуть первую из них. Боденштейном были сформулированы и основные принципы протекания нового типа химических превращений – цепных реакций. Эти реакции обязательно имеют три стадии: 1) зарождение цепи, когда происходит образование активных частиц; 2) продолжение (развитие) цепи; 3) обрыв цепи.
Урок № 29. Хімічні властивості хлору • • Однако экспериментально измеренные квантовые выходы многих реакций не соответствовали закону квантовой эквивалентности. В 1913 один из основоположников химической кинетики немецкий химик Макс Боденштейн измерил квантовый выход фотохимической реакции водорода с хлором H 2 + Cl 2 2 HCl. Результат оказался невероятным: число молекул HCl, образовавшихся при поглощении смесью одного кванта света, в некоторых условиях достигал миллиона! Боденштейн объяснил этот поразительный результат единственным разумным методом: каждый поглощенный квант света «запускает» длинную цепочку превращений, в которой реагируют сотни тысяч молекул исходных веществ (H 2 и Cl 2), превращаясь в молекулы продукта реакции (HCl). Это похоже на то, как выстроенные в ряд костяшки домино быстро, как по команде, падают одна за другой, если удачно толкнуть первую из них. Боденштейном были сформулированы и основные принципы протекания нового типа химических превращений – цепных реакций. Эти реакции обязательно имеют три стадии: 1) зарождение цепи, когда происходит образование активных частиц; 2) продолжение (развитие) цепи; 3) обрыв цепи.
 Урок № 29. Хімічні властивості хлору • • Зарождение цепей в тепловой реакции происходит в результате диссоциации молекул при нагревании. В фотохимической реакции зарождение цепей происходит при поглощении кванта света. На стадии продолжения цепи образуются молекулы продуктов реакции и одновременно появляется новая активная частица, способная продолжать цепь. На стадии обрыва происходит исчезновение (дезактивация) активной частицы. При сильном нагреве или при интенсивном освещении ультрафиолетовым светом цепная реакция водорода с хлором идет со взрывом. Но если температура не очень высокая или интенсивность света невелика, реакция идет спокойно. Основываясь на этом факте, Боденштейн выдвинул очень важный принцип стационарной концентрации промежуточных продуктов цепных реакций. В соответствии с этим принципом, скорость генерирования активных частиц на стадии зарождения равна скорости их исчезновения на стадии обрыва. Действительно, если бы скорость обрыва была больше скорости зарождения цепей, число активных частиц снизилось бы до нуля, и реакция прекратилась бы сама собой. В случае же преобладания скорости зарождения, число активных частиц росло бы со временем, что привело бы к взрыву.
Урок № 29. Хімічні властивості хлору • • Зарождение цепей в тепловой реакции происходит в результате диссоциации молекул при нагревании. В фотохимической реакции зарождение цепей происходит при поглощении кванта света. На стадии продолжения цепи образуются молекулы продуктов реакции и одновременно появляется новая активная частица, способная продолжать цепь. На стадии обрыва происходит исчезновение (дезактивация) активной частицы. При сильном нагреве или при интенсивном освещении ультрафиолетовым светом цепная реакция водорода с хлором идет со взрывом. Но если температура не очень высокая или интенсивность света невелика, реакция идет спокойно. Основываясь на этом факте, Боденштейн выдвинул очень важный принцип стационарной концентрации промежуточных продуктов цепных реакций. В соответствии с этим принципом, скорость генерирования активных частиц на стадии зарождения равна скорости их исчезновения на стадии обрыва. Действительно, если бы скорость обрыва была больше скорости зарождения цепей, число активных частиц снизилось бы до нуля, и реакция прекратилась бы сама собой. В случае же преобладания скорости зарождения, число активных частиц росло бы со временем, что привело бы к взрыву.
 Урок № 29. Хімічні властивості хлору • • Однако выяснение химического механизма для каждой стадии реакции водорода с хлором оказалось трудной задачей. Боденштейн предположил теорию энергетического разветвления: образующиеся в первичной реакции молекулы HCl несут избыточную энергию и потому способствуют протеканию дальнейших реакций, передавая избыток энергии молекулам исходных веществ. Однако эта теория в данном случае оказалась неверной. Правильный механизм реакции дал в 1918 немецкий физикохимик лауреат Нобелевской премии Вальтер Нернст. Он предположил, что активными частицами являются атомы водорода и хлора; при этом схема цепной реакции выглядела так. Зарождение цепи происходит при термической диссоциации молекул хлора при высокой температуре или же при поглощении ими квантов света при комнатной температуре: Cl 2 ⇄ 2 Cl. Далее следуют две быстро повторяющиеся одна за другой стадии продолжения цепи: Cl + H 2 HCl + H и H + Cl 2 HCl + Cl. Обрыв цепей происходит, когда активные атомы водорода или хлора реагируют с молекулами примеси, или «прилипают» к стенке сосуда, или реагируют (рекомбинируют) друг с другом, превращаясь в неактивные молекулы H 2 и Cl 2.
Урок № 29. Хімічні властивості хлору • • Однако выяснение химического механизма для каждой стадии реакции водорода с хлором оказалось трудной задачей. Боденштейн предположил теорию энергетического разветвления: образующиеся в первичной реакции молекулы HCl несут избыточную энергию и потому способствуют протеканию дальнейших реакций, передавая избыток энергии молекулам исходных веществ. Однако эта теория в данном случае оказалась неверной. Правильный механизм реакции дал в 1918 немецкий физикохимик лауреат Нобелевской премии Вальтер Нернст. Он предположил, что активными частицами являются атомы водорода и хлора; при этом схема цепной реакции выглядела так. Зарождение цепи происходит при термической диссоциации молекул хлора при высокой температуре или же при поглощении ими квантов света при комнатной температуре: Cl 2 ⇄ 2 Cl. Далее следуют две быстро повторяющиеся одна за другой стадии продолжения цепи: Cl + H 2 HCl + H и H + Cl 2 HCl + Cl. Обрыв цепей происходит, когда активные атомы водорода или хлора реагируют с молекулами примеси, или «прилипают» к стенке сосуда, или реагируют (рекомбинируют) друг с другом, превращаясь в неактивные молекулы H 2 и Cl 2.
 Урок № 29. Хімічні властивості хлору • • В последующем было показано, что атомы водорода намного активнее атомов хлора; соответственно атомы водорода реагируют намного быстрее и потому их стационарная концентрация значительно ниже. Так, при комнатной температуре стационарная концентрация атомов водорода примерно в 100 раз меньше, чем атомов хлора. В результате вероятность встречи двух атомов водорода или атомов водорода и атомов хлора намного меньше, чем для двух атомов хлора, поэтому практически единственной реакцией обрыва цепей является рекомбинация атомов хлора: Cl + Cl 2. Если давление в реакционном сосуде очень мало, а его размеры невелики, активные частицы могу достигнуть стенки сосуда еще до того, как прореагируют с молекулами H 2 и Cl 2; в этих условиях важную роль может приобрести обрыв цепей на стенках реакционного сосуда.
Урок № 29. Хімічні властивості хлору • • В последующем было показано, что атомы водорода намного активнее атомов хлора; соответственно атомы водорода реагируют намного быстрее и потому их стационарная концентрация значительно ниже. Так, при комнатной температуре стационарная концентрация атомов водорода примерно в 100 раз меньше, чем атомов хлора. В результате вероятность встречи двух атомов водорода или атомов водорода и атомов хлора намного меньше, чем для двух атомов хлора, поэтому практически единственной реакцией обрыва цепей является рекомбинация атомов хлора: Cl + Cl 2. Если давление в реакционном сосуде очень мало, а его размеры невелики, активные частицы могу достигнуть стенки сосуда еще до того, как прореагируют с молекулами H 2 и Cl 2; в этих условиях важную роль может приобрести обрыв цепей на стенках реакционного сосуда.
 Урок № 29. Хімічні властивості хлоруу • • Схема Нернста была подтверждена разными экспериментами. Один из самых остроумных провел английский физикохимик Майкл Поляни. В его опытах струя водорода проходила над слегка подогретым металлическим натрием и уносила с собой некоторое очень небольшое количество его паров. Затем струя попадала в темноте в сосуд с хлором. При температуре опыта чистый водород с хлором не реагировал, но ничтожная примесь паров натрия полностью меняла дело: шла быстрая реакция образования хлороводорода. Здесь роль инициатора цепной реакции вместо света играет натрий: Na + Cl 2 Na. Cl + Cl. Подобно тому, как в фотохимической реакции на каждый поглощенный квант света приходится очень много прореагировавших молекул, так и здесь на каждый прореагировавший атом натрия приходится много образовавшихся молекул HCl. Аналогичные результаты Поляни получил для реакции хлора с метаном. В этом случае реакции инициирования и обрыва цепей были такими же, как в реакции хлора с водородом, а реакции продолжения цепи выглядели так: Cl· + CH 4 HCl + ·CH 3 и ·CH 3 + Cl 2 CH 4 + Cl·. В этих реакциях также участвуют частицы с неспаренными электронами (обозначены точкой) – свободные радикалы.
Урок № 29. Хімічні властивості хлоруу • • Схема Нернста была подтверждена разными экспериментами. Один из самых остроумных провел английский физикохимик Майкл Поляни. В его опытах струя водорода проходила над слегка подогретым металлическим натрием и уносила с собой некоторое очень небольшое количество его паров. Затем струя попадала в темноте в сосуд с хлором. При температуре опыта чистый водород с хлором не реагировал, но ничтожная примесь паров натрия полностью меняла дело: шла быстрая реакция образования хлороводорода. Здесь роль инициатора цепной реакции вместо света играет натрий: Na + Cl 2 Na. Cl + Cl. Подобно тому, как в фотохимической реакции на каждый поглощенный квант света приходится очень много прореагировавших молекул, так и здесь на каждый прореагировавший атом натрия приходится много образовавшихся молекул HCl. Аналогичные результаты Поляни получил для реакции хлора с метаном. В этом случае реакции инициирования и обрыва цепей были такими же, как в реакции хлора с водородом, а реакции продолжения цепи выглядели так: Cl· + CH 4 HCl + ·CH 3 и ·CH 3 + Cl 2 CH 4 + Cl·. В этих реакциях также участвуют частицы с неспаренными электронами (обозначены точкой) – свободные радикалы.
 Урок № 29. Хімічні властивості хлору • Многие реакции с участием свободных радикалов оказались цепными, механизм которых в общих чертах был сходен с механизмом реакции водорода с хлором. По цепному механизму протекают реакции расщепления при высоких температурах (пиролиза) углеводородов, например, этана: C 2 H 6 C 2 H 4 + H 2; подобные реакции имеют большое значение при промышленной переработке углеводородов нефти. Цепными оказались реакции окисления органических соединений кислородом, реакции присоединения к непредельным соединениям галогенов (хлора и брома), бромоводорода и других соединений, реакции полимеризации, ряд других процессов. Цепные реакции полимеризации интересны тем, что в них стадии продолжения цепи оставляют за собой «реальные цепи» в виде связанных друг с другом остатков мономерных звеньев. В загустевшем и затвердевшем полимере (например, в полистироле или в полиметилметакрилате – «органическом стекле» ) иногда можно обнаружить концевые свободные радикалы, которым из-за высокой вязкости не удалось прореагировать со свободной молекулой мономера.
Урок № 29. Хімічні властивості хлору • Многие реакции с участием свободных радикалов оказались цепными, механизм которых в общих чертах был сходен с механизмом реакции водорода с хлором. По цепному механизму протекают реакции расщепления при высоких температурах (пиролиза) углеводородов, например, этана: C 2 H 6 C 2 H 4 + H 2; подобные реакции имеют большое значение при промышленной переработке углеводородов нефти. Цепными оказались реакции окисления органических соединений кислородом, реакции присоединения к непредельным соединениям галогенов (хлора и брома), бромоводорода и других соединений, реакции полимеризации, ряд других процессов. Цепные реакции полимеризации интересны тем, что в них стадии продолжения цепи оставляют за собой «реальные цепи» в виде связанных друг с другом остатков мономерных звеньев. В загустевшем и затвердевшем полимере (например, в полистироле или в полиметилметакрилате – «органическом стекле» ) иногда можно обнаружить концевые свободные радикалы, которым из-за высокой вязкости не удалось прореагировать со свободной молекулой мономера.
 Урок № 29. Хімічні властивості хлору • • Цепи Семенова – Хиншелвуда В конце 1924 в Ленинградском Физико-техническом институте, в Лаборатории электронной химии, которой заведовал Н. Н. Семенов, начали измерять интенсивность свечения паров фосфора при их окислении кислородом. В первых же опытах молодая выпускница университета Зинаида Вальта и ее непосредственный руководитель, Ю. Б. Харитон натолкнулись на совершенно неожиданное явление. Оказалось, что когда кислорода мало, реакция окисления фосфора вообще не идет. Но стоит давлению кислорода превысить некоторое критическое значение, начиналось интенсивное окисление с испусканием света. До этого теория предполагала, что скорость реакции должна плавно увеличиваться с увеличением концентрации. Здесь же – резкий переход от полного отсутствия реакции к очень быстрому процессу при ничтожном изменении давления. Выяснился еще один, совсем уже странный факт: при давлении ниже критического, т. е. в отсутствие реакции, достаточно было ввести в сосуд аргон, чтобы произошла яркая вспышка. Получалось, что инертный газ аргон, не способный ни к каким химическим реакциям, делал кислород реакционноспособным! Это было уже настоящим чудом. . .
Урок № 29. Хімічні властивості хлору • • Цепи Семенова – Хиншелвуда В конце 1924 в Ленинградском Физико-техническом институте, в Лаборатории электронной химии, которой заведовал Н. Н. Семенов, начали измерять интенсивность свечения паров фосфора при их окислении кислородом. В первых же опытах молодая выпускница университета Зинаида Вальта и ее непосредственный руководитель, Ю. Б. Харитон натолкнулись на совершенно неожиданное явление. Оказалось, что когда кислорода мало, реакция окисления фосфора вообще не идет. Но стоит давлению кислорода превысить некоторое критическое значение, начиналось интенсивное окисление с испусканием света. До этого теория предполагала, что скорость реакции должна плавно увеличиваться с увеличением концентрации. Здесь же – резкий переход от полного отсутствия реакции к очень быстрому процессу при ничтожном изменении давления. Выяснился еще один, совсем уже странный факт: при давлении ниже критического, т. е. в отсутствие реакции, достаточно было ввести в сосуд аргон, чтобы произошла яркая вспышка. Получалось, что инертный газ аргон, не способный ни к каким химическим реакциям, делал кислород реакционноспособным! Это было уже настоящим чудом. . .
 Урок № 29. Хімічні властивості хлору • • Позже выяснилось, что кислород может полностью терять свою активность не только при снижении, но и при повышении давления выше некоторого критического значения. Этот второй (верхний) предел давления кислорода существенно зависел от примесей различных веществ. Некоторые из таких примесей делали «пассивный» кислород весьма активным, вызывающим горение фосфора. Такое поведение противоречило всем существовавшим тогда представлениям о механизмах и скоростях химических реакций. Результаты странных экспериментов, без какой-либо попытки их объяснения, были опубликованы в немецком «Физическом журнале» . Последствия были быстры и неутешительны: работа подверглась крайне острой критике со стороны знаменитого Боденштейна, который к тому времени считался главой мировой химической кинетики. Он написал, что все результаты по окислению фосфора являются не открытием, а иллюзией и указал даже на ее причину – неправильную конструкцию установки, в которой проводились опыты. В заключение своей короткой статьи Боденштейн отмечал, что так называемые «предельные» явления неоднократно наблюдались в прошлом для разных реакций, но при проверке каждый раз оказывалось, что все они связаны с различными экспериментальными ошибками.
Урок № 29. Хімічні властивості хлору • • Позже выяснилось, что кислород может полностью терять свою активность не только при снижении, но и при повышении давления выше некоторого критического значения. Этот второй (верхний) предел давления кислорода существенно зависел от примесей различных веществ. Некоторые из таких примесей делали «пассивный» кислород весьма активным, вызывающим горение фосфора. Такое поведение противоречило всем существовавшим тогда представлениям о механизмах и скоростях химических реакций. Результаты странных экспериментов, без какой-либо попытки их объяснения, были опубликованы в немецком «Физическом журнале» . Последствия были быстры и неутешительны: работа подверглась крайне острой критике со стороны знаменитого Боденштейна, который к тому времени считался главой мировой химической кинетики. Он написал, что все результаты по окислению фосфора являются не открытием, а иллюзией и указал даже на ее причину – неправильную конструкцию установки, в которой проводились опыты. В заключение своей короткой статьи Боденштейн отмечал, что так называемые «предельные» явления неоднократно наблюдались в прошлом для разных реакций, но при проверке каждый раз оказывалось, что все они связаны с различными экспериментальными ошибками.
 Урок № 29. Хімічні властивості хлору • • Возражения были очень серьезны. Но тщательная проверка (уже без Харитона – он был в заграничной командировке и без Вальта – она перешла в другой институт) показала правильность первой публикации. Более того, были получены новые, не менее «еретические» данные. Оказалось, например, что критическое давление кислорода сильно зависит от размеров реакционного сосуда. Семенов почувствовал, что стоит на пороге открытия. Он понимал, что реакция является цепной, наподобие реакции водорода с хлором. Однако механизм цепной реакции Боденштейна – Нернста, основанный на «принципе домино» , никогда не приводил (и не мог приводить) к критическим явлениям. Здесь было что-то иное. Одновременно в этом направлении начал работать в Англии Сирил Хиншелвуд. В обеих лабораториях критические явления были обнаружены в реакциях горения водорода и ряда других веществ. Оказалось, например, что в стеклянных термостойких сосудах при температурах 500– 600°С реакция водорода с кислородом не идет вовсе, пока давление не достигнет 3– 4 мм рт. ст. Когда давление превышало этот нижний предел, внезапно начиналась быстрая реакция, сопровождающаяся свечением. Но самое поразительное явление заключалось в том, что пламя можно было потушить, просто повысив давление. При температуре же ниже 400°С воспламенение в чистой смеси водорода с кислородом не наблюдалось ни при каких давлениях. Однако достаточно было добавить к смеси инертный газ, как происходила вспышка!
Урок № 29. Хімічні властивості хлору • • Возражения были очень серьезны. Но тщательная проверка (уже без Харитона – он был в заграничной командировке и без Вальта – она перешла в другой институт) показала правильность первой публикации. Более того, были получены новые, не менее «еретические» данные. Оказалось, например, что критическое давление кислорода сильно зависит от размеров реакционного сосуда. Семенов почувствовал, что стоит на пороге открытия. Он понимал, что реакция является цепной, наподобие реакции водорода с хлором. Однако механизм цепной реакции Боденштейна – Нернста, основанный на «принципе домино» , никогда не приводил (и не мог приводить) к критическим явлениям. Здесь было что-то иное. Одновременно в этом направлении начал работать в Англии Сирил Хиншелвуд. В обеих лабораториях критические явления были обнаружены в реакциях горения водорода и ряда других веществ. Оказалось, например, что в стеклянных термостойких сосудах при температурах 500– 600°С реакция водорода с кислородом не идет вовсе, пока давление не достигнет 3– 4 мм рт. ст. Когда давление превышало этот нижний предел, внезапно начиналась быстрая реакция, сопровождающаяся свечением. Но самое поразительное явление заключалось в том, что пламя можно было потушить, просто повысив давление. При температуре же ниже 400°С воспламенение в чистой смеси водорода с кислородом не наблюдалось ни при каких давлениях. Однако достаточно было добавить к смеси инертный газ, как происходила вспышка!
 Урок № 29. Хімічні властивості хлору • • • Все эти новые явления были объяснены Семеновым (и независимо Хиншелвудом) в предположении о разветвляющихся цепях. Если в реакции водорода с хлором на каждой стадии продолжения цепи одна активная частица расходуется и одна – появляется (неразветвленная цепь), то в реакции водорода (и других реагентов) с кислородом на одну исчезнувшую активную частицу образуется две или более новых, например, H + O 2 OH + O O + H 2 OH + H 2 O + H Если сложить эти три последовательные реакции, получим Н + О 2 + 2 Н 2 ОН + 2 Н , то есть одна активная частица превращается в три. В результате число активных центров стремительно нарастает (цепи разветвляются), и если скорость обрыва цепей недостаточно велика, реакция очень быстро переходит во взрывной режим (при небольшом давлении вместо взрыва наблюдается вспышка). Такие реакции, идущие с увеличение числа активных частиц, назвали разветвленноцепными. Если учесть, что эти процессы сильно экзотермичны, а для реакции каждой активной частицы с молекулой исходного вещества требуются миллиардные доли секунды, то легко понять, почему разветвленно-цепные реакции при больших концентрациях (давлениях) реагентов вызывают разрушительные взрывы.
Урок № 29. Хімічні властивості хлору • • • Все эти новые явления были объяснены Семеновым (и независимо Хиншелвудом) в предположении о разветвляющихся цепях. Если в реакции водорода с хлором на каждой стадии продолжения цепи одна активная частица расходуется и одна – появляется (неразветвленная цепь), то в реакции водорода (и других реагентов) с кислородом на одну исчезнувшую активную частицу образуется две или более новых, например, H + O 2 OH + O O + H 2 OH + H 2 O + H Если сложить эти три последовательные реакции, получим Н + О 2 + 2 Н 2 ОН + 2 Н , то есть одна активная частица превращается в три. В результате число активных центров стремительно нарастает (цепи разветвляются), и если скорость обрыва цепей недостаточно велика, реакция очень быстро переходит во взрывной режим (при небольшом давлении вместо взрыва наблюдается вспышка). Такие реакции, идущие с увеличение числа активных частиц, назвали разветвленноцепными. Если учесть, что эти процессы сильно экзотермичны, а для реакции каждой активной частицы с молекулой исходного вещества требуются миллиардные доли секунды, то легко понять, почему разветвленно-цепные реакции при больших концентрациях (давлениях) реагентов вызывают разрушительные взрывы.
 Урок № 29. Хімічні властивості хлору • Важно отметить, что лавина разветвленно-цепной реакции очень быстро заканчивается: спустя доли секунды после ее начала для продолжения реакции уже не хватает исходных веществ – они почти все превратились в продукты реакции. Здесь можно привести такую аналогию: по «разветвленно-цепному механизму» распространяются различные слухи, если каждый узнавший новость расскажет ее более чем одному человеку. И так же, как слухи и сплетни, быстро распространяются, но и быстро заканчиваются разнообразные «разветвленно-цепные» финансовые и прочие пирамиды (типа знаменитой «Властилины» , МММ, «писем счастья» и т. п. ), различные «заманчивые» предложения за 100 рублей заработать 100 тысяч и другие аферы, требующие на каждом этапе привлечения новых «клиентов» . С первого взгляда все выглядит честно, но в пирамиду быстро вовлекается все большее число участников, и вскоре не хватает «исходных веществ» – некому больше покупать акции, и они стремительно обесцениваются. Подобные финансовые пирамиды еще в 19 в. были в ходу в разных странах; во Франции их называли «снежным комом» , у нас – лавиной. Их механизм (и математическое описание) весьма напоминают разветвленно-цепные химические реакции.
Урок № 29. Хімічні властивості хлору • Важно отметить, что лавина разветвленно-цепной реакции очень быстро заканчивается: спустя доли секунды после ее начала для продолжения реакции уже не хватает исходных веществ – они почти все превратились в продукты реакции. Здесь можно привести такую аналогию: по «разветвленно-цепному механизму» распространяются различные слухи, если каждый узнавший новость расскажет ее более чем одному человеку. И так же, как слухи и сплетни, быстро распространяются, но и быстро заканчиваются разнообразные «разветвленно-цепные» финансовые и прочие пирамиды (типа знаменитой «Властилины» , МММ, «писем счастья» и т. п. ), различные «заманчивые» предложения за 100 рублей заработать 100 тысяч и другие аферы, требующие на каждом этапе привлечения новых «клиентов» . С первого взгляда все выглядит честно, но в пирамиду быстро вовлекается все большее число участников, и вскоре не хватает «исходных веществ» – некому больше покупать акции, и они стремительно обесцениваются. Подобные финансовые пирамиды еще в 19 в. были в ходу в разных странах; во Франции их называли «снежным комом» , у нас – лавиной. Их механизм (и математическое описание) весьма напоминают разветвленно-цепные химические реакции.
 Урок № 29. Хімічні властивості хлору • • Семенов и Хиншелвуд дали такое объяснение изученным процессам. При низких давлениях большинство активных частиц – атомов, свободных радикалов, не успев столкнуться со многими молекулами реагентов и «размножиться» , долетают до стенки реакционного сосуда и «погибают» на них – цепи обрываются. Чем меньше диаметр реактора, тем больше у радикалов шансов достичь его стенок. Вот откуда зависимость от размеров сосуда! С повышением концентрации шансов столкнуться с молекулами реагентов для радикалов становится больше, чем шансов достичь стенки – возникает лавина реакций. Это объясняет существование нижнего предела по давлению. Молекулы инертного газа, по меткому выражению Семенова, «путаясь в ногах» у активной частицы, замедляют ее движение к стенке; так объясняется удивительное влияние аргона на величину критического давления. Когда же достигается верхний предел по давлению, цепи снова обрываются быстрее, чем происходит их разветвление; однако причина обрыва цепей здесь иная – активные радикалы исчезают в результате «взаимного уничтожения» – рекомбинации в объеме сосуда (скорость этой реакции очень быстро увеличивается с ростом давления). Таким образом, все экспериментальные факты получили логичное объяснение в рамках теории разветвленной цепной реакции. В 1956 Н. Н. Семенов и С. Хиншелвуд за эти исследования получили Нобелевскую премию по химии.
Урок № 29. Хімічні властивості хлору • • Семенов и Хиншелвуд дали такое объяснение изученным процессам. При низких давлениях большинство активных частиц – атомов, свободных радикалов, не успев столкнуться со многими молекулами реагентов и «размножиться» , долетают до стенки реакционного сосуда и «погибают» на них – цепи обрываются. Чем меньше диаметр реактора, тем больше у радикалов шансов достичь его стенок. Вот откуда зависимость от размеров сосуда! С повышением концентрации шансов столкнуться с молекулами реагентов для радикалов становится больше, чем шансов достичь стенки – возникает лавина реакций. Это объясняет существование нижнего предела по давлению. Молекулы инертного газа, по меткому выражению Семенова, «путаясь в ногах» у активной частицы, замедляют ее движение к стенке; так объясняется удивительное влияние аргона на величину критического давления. Когда же достигается верхний предел по давлению, цепи снова обрываются быстрее, чем происходит их разветвление; однако причина обрыва цепей здесь иная – активные радикалы исчезают в результате «взаимного уничтожения» – рекомбинации в объеме сосуда (скорость этой реакции очень быстро увеличивается с ростом давления). Таким образом, все экспериментальные факты получили логичное объяснение в рамках теории разветвленной цепной реакции. В 1956 Н. Н. Семенов и С. Хиншелвуд за эти исследования получили Нобелевскую премию по химии.
 Урок № 29. Хімічні властивості хлору • • Теория разветвленно-цепных реакций имеет большое практическое значение, так как объясняет поведение многих промышленно важных процессов, таких как горение, крекинг нефти, воспламенение горючей смеси в двигателях внутреннего сгорания. Наличие верхнего и нижнего пределов по давлению означает, что смеси кислорода с водородом, метаном, другими горючими газами взрываются лишь при их определенных соотношениях. Например, смеси водорода с воздухом взрываются при содержании водорода от 4 до 75%, а смеси метана с воздухом – при содержании метана от 5 до 15%. Вот почему так опасны утечки газа: если метана в воздухе окажется больше 5%, взрыв может наступить даже от крошечной искры в выключателе при включении или выключении света на кухне. Особое значение цепные процессы приобрели в связи с работой физиков по получению ядерной энергии. Оказалось, что деление урана, плутония, других расщепляющихся материалов подчиняется тем же закономерностям, что и разветвленно-цепные химические реакции. Так, реакция деления урана вызывается нейтронами, которые расщепляют ядра урана с выделением огромной энергии. Разветвление цепи происходит за счет того, при расщеплении ядра выделяются несколько активных частиц – нейтронов, способных к расщеплению новых ядер.
Урок № 29. Хімічні властивості хлору • • Теория разветвленно-цепных реакций имеет большое практическое значение, так как объясняет поведение многих промышленно важных процессов, таких как горение, крекинг нефти, воспламенение горючей смеси в двигателях внутреннего сгорания. Наличие верхнего и нижнего пределов по давлению означает, что смеси кислорода с водородом, метаном, другими горючими газами взрываются лишь при их определенных соотношениях. Например, смеси водорода с воздухом взрываются при содержании водорода от 4 до 75%, а смеси метана с воздухом – при содержании метана от 5 до 15%. Вот почему так опасны утечки газа: если метана в воздухе окажется больше 5%, взрыв может наступить даже от крошечной искры в выключателе при включении или выключении света на кухне. Особое значение цепные процессы приобрели в связи с работой физиков по получению ядерной энергии. Оказалось, что деление урана, плутония, других расщепляющихся материалов подчиняется тем же закономерностям, что и разветвленно-цепные химические реакции. Так, реакция деления урана вызывается нейтронами, которые расщепляют ядра урана с выделением огромной энергии. Разветвление цепи происходит за счет того, при расщеплении ядра выделяются несколько активных частиц – нейтронов, способных к расщеплению новых ядер.
 Урок № 29. Хімічні властивості хлору • • • • • 1. 6. Другие свойства хлора Действием хлора на аммиак можно получить трёххлористый азот: 4 NH 3 + 3 Cl 2 NCl 3 + 3 NH 4 Cl Хлор вытесняет менее активные галогены из их солей: Сl 2 (разб. ) + 2 Na. I (хол. ) = 2 Na. Cl + I 2 , 3 Сl 2 (конц. ) + Na. I (гор. ) + 3 Н 2 О = 6 НСl + Na. IO 3. Хлор является окислителем по отношению ко многим сложным веществам: Cl 2 + H 2 S 2 HCl + S Сl 2 + 3 Н 2 О 2 (конц. ) = 2 HCl + 2 Н 2 О + O 2. Сl 2 + 2 Ag. Cl. O 3 (насыщ. ). = 2 Ag. Cl + O 2 + 2 Cl. O 2 , Cl 2 + 2(Na. Cl. O 2· 3 Н 2 О) = 2 Na. Cl + 2 Сl. O 2 + 6 Н 2 О (комн. ). 3 Сl 2 + NH 4 Cl (насыщ. ) = Cl 3 N + 4 HCl (60 -70°С) 2 Сl 2 + Н 2 О + Hg. O = Hg. Cl 2 + 2 HCl. O (0 -5°С), 2 Сl 2(г) + Hg. O = Hg. Cl 2 + Cl 2 O (0°С). При реакции с монооксидом углерода образуется фосген: Cl 2 + CO COCl 2 Хлорированием сухого гидроксида кальция получают хлорную известь: Cl 2 + Ca(OH)2 Ca. Cl(OCl) + H 2 O
Урок № 29. Хімічні властивості хлору • • • • • 1. 6. Другие свойства хлора Действием хлора на аммиак можно получить трёххлористый азот: 4 NH 3 + 3 Cl 2 NCl 3 + 3 NH 4 Cl Хлор вытесняет менее активные галогены из их солей: Сl 2 (разб. ) + 2 Na. I (хол. ) = 2 Na. Cl + I 2 , 3 Сl 2 (конц. ) + Na. I (гор. ) + 3 Н 2 О = 6 НСl + Na. IO 3. Хлор является окислителем по отношению ко многим сложным веществам: Cl 2 + H 2 S 2 HCl + S Сl 2 + 3 Н 2 О 2 (конц. ) = 2 HCl + 2 Н 2 О + O 2. Сl 2 + 2 Ag. Cl. O 3 (насыщ. ). = 2 Ag. Cl + O 2 + 2 Cl. O 2 , Cl 2 + 2(Na. Cl. O 2· 3 Н 2 О) = 2 Na. Cl + 2 Сl. O 2 + 6 Н 2 О (комн. ). 3 Сl 2 + NH 4 Cl (насыщ. ) = Cl 3 N + 4 HCl (60 -70°С) 2 Сl 2 + Н 2 О + Hg. O = Hg. Cl 2 + 2 HCl. O (0 -5°С), 2 Сl 2(г) + Hg. O = Hg. Cl 2 + Cl 2 O (0°С). При реакции с монооксидом углерода образуется фосген: Cl 2 + CO COCl 2 Хлорированием сухого гидроксида кальция получают хлорную известь: Cl 2 + Ca(OH)2 Ca. Cl(OCl) + H 2 O
 Урок № 29. Хімічні властивості хлору
Урок № 29. Хімічні властивості хлору
 Урок № 29. Хімічні властивості хлору • • 3. Хлорная вода, раствор хлора в воде. Получают в хлораторе пропусканием хлора в воду до насыщения (1 объём воды растворяет при 20°C около 2, 2 объёма газообразного хлора). При охлаждении хлорной воды из неё выпадает гидрат хлора — соединение переменного состава Cl 2 n. H 2 O (где n = 6 8) — жёлтые кристаллы, плавящиеся с разложением при 9, 6°С. При обычной температуре до 50% растворённого в хлорной воде хлора подвергается гидролизу: Cl 2 + H 2 O ⇄ HCl. O + HCl; образующаяся HCl. O разлагается на свету на O 2 и HCl. Хлорная вода — сильный окислитель, применяется для обеззараживания вод и отбелки тканей. История применения веществ, содержащих активный хлор, насчитывает более двух столетий. Вскоре после открытия хлора шведским химиком Шееле в 1774 г. обнаружилось, что под действием этого газа смоченные водой желтоватые и некрасивые ткани из растительных волокон – льна или хлопка приобретают замечательную белизну. Впервые применил хлор для беления тканей и бумаги французский химик Клод Луи Бертолле. В своем имении в Аркее он открыл в 1785 г. фабрику по отбелке холста хлором, на которой работали, в частности, его сын вместе с молодым учеником Бертолле Гей-Люссаком.
Урок № 29. Хімічні властивості хлору • • 3. Хлорная вода, раствор хлора в воде. Получают в хлораторе пропусканием хлора в воду до насыщения (1 объём воды растворяет при 20°C около 2, 2 объёма газообразного хлора). При охлаждении хлорной воды из неё выпадает гидрат хлора — соединение переменного состава Cl 2 n. H 2 O (где n = 6 8) — жёлтые кристаллы, плавящиеся с разложением при 9, 6°С. При обычной температуре до 50% растворённого в хлорной воде хлора подвергается гидролизу: Cl 2 + H 2 O ⇄ HCl. O + HCl; образующаяся HCl. O разлагается на свету на O 2 и HCl. Хлорная вода — сильный окислитель, применяется для обеззараживания вод и отбелки тканей. История применения веществ, содержащих активный хлор, насчитывает более двух столетий. Вскоре после открытия хлора шведским химиком Шееле в 1774 г. обнаружилось, что под действием этого газа смоченные водой желтоватые и некрасивые ткани из растительных волокон – льна или хлопка приобретают замечательную белизну. Впервые применил хлор для беления тканей и бумаги французский химик Клод Луи Бертолле. В своем имении в Аркее он открыл в 1785 г. фабрику по отбелке холста хлором, на которой работали, в частности, его сын вместе с молодым учеником Бертолле Гей-Люссаком.
 Урок № 29. Хімічні властивості хлору • В 19 в. было обнаружено, что хлорная вода обладает не только отбеливающим, но и дезинфицирующим действием. Впервые в этом качестве ее начали использовать в 1846 в одном из госпиталей в Вене, где была введена практика для врачей ополаскивать руки хлорной водой. После того, как в 1888 г. на Международном гигиеническом конгрессе в Вене было признано, что заразные болезни, в том числе холера, могут распространяться с питьевой водой, начались планомерные поиски наиболее эффективного способа обеззараживания воды. И когда в больших городах появился водопровод, хлору нашли новое применение – дезинфицировать питьевую воду. Впервые для этой цели его применили в Нью-Йорке в 1895 г. , а в настоящее время для хлорирования воды расходуют ежегодно сотни тысяч тонн хлора. Хлор легко растворяется в воде, убивая в ней все живое. При этом выяснилось, что свободная хлорноватистая кислота почти в 300 раз более активна, чем гипохлорит-ионы Cl. O–; объясняется это уникальной способностью HCl. O проникать в бактерии через их мембраны.
Урок № 29. Хімічні властивості хлору • В 19 в. было обнаружено, что хлорная вода обладает не только отбеливающим, но и дезинфицирующим действием. Впервые в этом качестве ее начали использовать в 1846 в одном из госпиталей в Вене, где была введена практика для врачей ополаскивать руки хлорной водой. После того, как в 1888 г. на Международном гигиеническом конгрессе в Вене было признано, что заразные болезни, в том числе холера, могут распространяться с питьевой водой, начались планомерные поиски наиболее эффективного способа обеззараживания воды. И когда в больших городах появился водопровод, хлору нашли новое применение – дезинфицировать питьевую воду. Впервые для этой цели его применили в Нью-Йорке в 1895 г. , а в настоящее время для хлорирования воды расходуют ежегодно сотни тысяч тонн хлора. Хлор легко растворяется в воде, убивая в ней все живое. При этом выяснилось, что свободная хлорноватистая кислота почти в 300 раз более активна, чем гипохлорит-ионы Cl. O–; объясняется это уникальной способностью HCl. O проникать в бактерии через их мембраны.
 Урок № 29. Хімічні властивості хлору • Хлорирование оказалось самым простым и дешевым способом обеззараживания воды. Поскольку обнаружить в воде болезнетворные бактерии непросто (для этого требуются сложные лабораторные исследования), обычно бактериальную безопасность воды после ее обработки хлором контролируют по косвенному признаку: числу неопасных, но хорошо различимых в микроскоп микроорганизмов – кишечных палочек. Если после хлорирования в 1 мл воды остается не более 3 палочек, то можно считать, что менее устойчивые болезнетворные бактерии полностью уничтожены. Обычно на один кубометр воды требуется примерно 1, 5– 2 г хлора. Но иногда хлора добавляют больше, чем обычно; это бывает, например, весной, во время паводка, когда талые воды смывают в реки и остатки удобрений с полей, и прочие загрязнители воды. Поэтому содержание активного хлора в водопроводной воде может изменяться в довольно широких пределах. Избыток хлора придает воде неприятный запах, особенно при ее нагревании, когда растворимость хлора снижается. Ничтожные концентрации хлора в питьевой воде не представляют опасности для здоровья, хотя пить такую воду неприятно. Проще всего избавиться от остатков хлора в водопроводной воде, выдержав её несколько часов в открытой посуде или доведя до кипения: из кипящей воды хлор улетучится быстро и без остатка.
Урок № 29. Хімічні властивості хлору • Хлорирование оказалось самым простым и дешевым способом обеззараживания воды. Поскольку обнаружить в воде болезнетворные бактерии непросто (для этого требуются сложные лабораторные исследования), обычно бактериальную безопасность воды после ее обработки хлором контролируют по косвенному признаку: числу неопасных, но хорошо различимых в микроскоп микроорганизмов – кишечных палочек. Если после хлорирования в 1 мл воды остается не более 3 палочек, то можно считать, что менее устойчивые болезнетворные бактерии полностью уничтожены. Обычно на один кубометр воды требуется примерно 1, 5– 2 г хлора. Но иногда хлора добавляют больше, чем обычно; это бывает, например, весной, во время паводка, когда талые воды смывают в реки и остатки удобрений с полей, и прочие загрязнители воды. Поэтому содержание активного хлора в водопроводной воде может изменяться в довольно широких пределах. Избыток хлора придает воде неприятный запах, особенно при ее нагревании, когда растворимость хлора снижается. Ничтожные концентрации хлора в питьевой воде не представляют опасности для здоровья, хотя пить такую воду неприятно. Проще всего избавиться от остатков хлора в водопроводной воде, выдержав её несколько часов в открытой посуде или доведя до кипения: из кипящей воды хлор улетучится быстро и без остатка.
 Урок № 29. Хімічні властивості хлору • • Но если вода загрязнена некоторыми отходами химических производств, хлорирование ее может привести к нежелательным последствиям. Например, при хлорировании фенола могут образоваться дихлорфенолы, обладающие запахом в исключительно малых концентрациях – всего 1 мг в 10 тоннах воды! Еще в 1974 Агентство по защите окpужающей сpеды в США обследовало водоснабжение Нового Оpлеана и обнаpужило в питьевой воде 66 различных хлорорганических соединений (правда, по большей части в очень малых концентрациях – не более 1 мг на тонну). Некоторые примеси в воде после их хлорирования превращаются в чрезвычайно токсичные соединения (например, диоксины). Поэтому более перспективно вместо хлорирования применять озонирование воды. Хлорируют не только питьевую, но и сточные воды, чтобы патогенные микроорганизмы не попали в реки. Используют хлор и его соединения и для дезинфекции воды в бассейнах.
Урок № 29. Хімічні властивості хлору • • Но если вода загрязнена некоторыми отходами химических производств, хлорирование ее может привести к нежелательным последствиям. Например, при хлорировании фенола могут образоваться дихлорфенолы, обладающие запахом в исключительно малых концентрациях – всего 1 мг в 10 тоннах воды! Еще в 1974 Агентство по защите окpужающей сpеды в США обследовало водоснабжение Нового Оpлеана и обнаpужило в питьевой воде 66 различных хлорорганических соединений (правда, по большей части в очень малых концентрациях – не более 1 мг на тонну). Некоторые примеси в воде после их хлорирования превращаются в чрезвычайно токсичные соединения (например, диоксины). Поэтому более перспективно вместо хлорирования применять озонирование воды. Хлорируют не только питьевую, но и сточные воды, чтобы патогенные микроорганизмы не попали в реки. Используют хлор и его соединения и для дезинфекции воды в бассейнах.
 Урок № 29. Хімічні властивості хлору • • • Гипохлориты щелочных металлов. Жавелевая вода. Иметь дело с газом, да еще таким ядовитым, как хлор, неудобно и опасно. В 1789 г. Бертолле вместо хлорной воды, выделяющей хлор, начал для той же цели использовать щелочной отбеливающий раствор. Такой раствор получали путем пропускания хлора в калиевый щелок – раствор поташа (карбоната калия) до насыщения его хлором. Раствор получил название жавелевой воды (в то время Жавель был пригородом Парижа; в настоящее время это один из парижских районов). Отбеливающий раствор, получаемый действием хлора на раствор соды (карбоната натрия), получил название лабарраковой воды – по имени парижского аптекаря Антуана Жермена Лабаррака; его начали использовать с 1820 г. Впоследствии оба раствора обычно называли одинаково – жавелевой водой, а на практике применяли только более дешевую натриевую соль. Ее получали хлорированием раствора соды. В результате гидролиза карбоната натрия образуется щелочь: Na 2 СО 3 + Н 2 О ⇄ Na. НСО 3 + Na. ОН, которая обратимо реагирует с хлором с образованием хлорида и гипохлорита – натриевой соли хлорноватистой кислоты: Cl 2 + 2 Na. OH ⇄ Na. Cl. O + Na. Cl + Н 2 О.
Урок № 29. Хімічні властивості хлору • • • Гипохлориты щелочных металлов. Жавелевая вода. Иметь дело с газом, да еще таким ядовитым, как хлор, неудобно и опасно. В 1789 г. Бертолле вместо хлорной воды, выделяющей хлор, начал для той же цели использовать щелочной отбеливающий раствор. Такой раствор получали путем пропускания хлора в калиевый щелок – раствор поташа (карбоната калия) до насыщения его хлором. Раствор получил название жавелевой воды (в то время Жавель был пригородом Парижа; в настоящее время это один из парижских районов). Отбеливающий раствор, получаемый действием хлора на раствор соды (карбоната натрия), получил название лабарраковой воды – по имени парижского аптекаря Антуана Жермена Лабаррака; его начали использовать с 1820 г. Впоследствии оба раствора обычно называли одинаково – жавелевой водой, а на практике применяли только более дешевую натриевую соль. Ее получали хлорированием раствора соды. В результате гидролиза карбоната натрия образуется щелочь: Na 2 СО 3 + Н 2 О ⇄ Na. НСО 3 + Na. ОН, которая обратимо реагирует с хлором с образованием хлорида и гипохлорита – натриевой соли хлорноватистой кислоты: Cl 2 + 2 Na. OH ⇄ Na. Cl. O + Na. Cl + Н 2 О.
 Урок № 29. Хімічні властивості хлору • • Такой отбеливающий раствор, содержащий смесь хлорида и гипохлорита, был очень неустойчивым, и его надо было применять непосредственно на месте получения. Причина нестабильности заключалась в присутствии в растворе при невысоких значениях р. Н значительных количеств хлорноватистой кислоты HCl. O. Поэтому со временем жавелевую воду стали получать путем насыщения хлором сильной щелочи – гидроксида натрия. Полученный раствор, содержащий небольшой (0, 3%) избыток Na. OH, был намного стабильнее. В настоящее время для получения гипохлорита натрия используют электролиз растворов хлорида натрия без диафрагмы. При этом первичные продукты электролиза – Cl 2 и Na. OH реагируют непосредственно в электролитической ванне. Преимущество этого процесса в том, что хлорид натрия, один из продуктов реакции Cl 2 + 2 Na. OH Na. Cl. O + Na. Cl + Н 2 О, снова подвергается электролизу, так что суммарное уравнение процесса становится таким: Na. Cl + H 2 O Na. Cl. O + H 2. Обычно жавелевая вода содержит от 8 до 15% активного хлора. Повышению его концентрации препятствует побочная реакция окисления гипохлорит-ионов на аноде: 6 Cl. O– + 3 H 2 O – 6ē 2 Cl. O 3– + 4 Cl– + 6 H+ + 1, 5 O 2.
Урок № 29. Хімічні властивості хлору • • Такой отбеливающий раствор, содержащий смесь хлорида и гипохлорита, был очень неустойчивым, и его надо было применять непосредственно на месте получения. Причина нестабильности заключалась в присутствии в растворе при невысоких значениях р. Н значительных количеств хлорноватистой кислоты HCl. O. Поэтому со временем жавелевую воду стали получать путем насыщения хлором сильной щелочи – гидроксида натрия. Полученный раствор, содержащий небольшой (0, 3%) избыток Na. OH, был намного стабильнее. В настоящее время для получения гипохлорита натрия используют электролиз растворов хлорида натрия без диафрагмы. При этом первичные продукты электролиза – Cl 2 и Na. OH реагируют непосредственно в электролитической ванне. Преимущество этого процесса в том, что хлорид натрия, один из продуктов реакции Cl 2 + 2 Na. OH Na. Cl. O + Na. Cl + Н 2 О, снова подвергается электролизу, так что суммарное уравнение процесса становится таким: Na. Cl + H 2 O Na. Cl. O + H 2. Обычно жавелевая вода содержит от 8 до 15% активного хлора. Повышению его концентрации препятствует побочная реакция окисления гипохлорит-ионов на аноде: 6 Cl. O– + 3 H 2 O – 6ē 2 Cl. O 3– + 4 Cl– + 6 H+ + 1, 5 O 2.
 Урок № 29. Хімічні властивості хлору • • Гипохлорит натрия (в виде кристаллогидратов) был выделен из его раствора путем отгонки воды без нагрева – при пониженном давлении. При этом сначала выделяются кристаллы состава Na. Cl. O· 5 H 2 O, которые при дальнейшем высушивании переходят в Na. Cl. O·H 2 O. При нагревании до 70 о. С эта соль разлагается со взрывом. Чистый Na. Cl. O содержит теоретически 95, 2% активного хлора. Все гипохлориты – сильные окислители, особенно в щелочном растворе. Так, в кислой среде они окисляют иодиды до иода, в нейтральной – до иодата IO 3–, в щелочной – до периодата IO 4–. Хлорноватистая кислота очень слабая, слабее даже угольной. Поэтому на воздухе из растворов гипохлоритов происходит частичное выделение этой кислоты под действием углекислого газа: Na. OCl + CO 2 ⇄ Na. HCO 3 + HCl. O. Отбеливающее действие гипохлоритов основано на окислении хлорноватистой кислотой различных загрязняющих ткань веществ. В отсутствие углекислого газа жавелевая вода тоже разлагается. Так, при комнатной температуре в водном растворе за сутки разлагается около 0, 1% Na. Cl. O. В присутствии щелочей скорость разложения замедляется. Концентрированные растворы Na. Cl. O выпускаются промышленностью в большом количестве – сотни тысяч тонн ежегодно. Его применяют как дезинфицирующее средство, для обеззараживания воды, для отбеливания тканей, бумаги, в химических синтезах, в зубоврачебной практике – для дезинфицирования каналов и отбеливания зубов. Более легкий гипохлорит лития содержит в чистом виде 121, 6% активного хлора. Его применяют в производстве стиральных порошков, для дезинфекции воды в бассейнах.
Урок № 29. Хімічні властивості хлору • • Гипохлорит натрия (в виде кристаллогидратов) был выделен из его раствора путем отгонки воды без нагрева – при пониженном давлении. При этом сначала выделяются кристаллы состава Na. Cl. O· 5 H 2 O, которые при дальнейшем высушивании переходят в Na. Cl. O·H 2 O. При нагревании до 70 о. С эта соль разлагается со взрывом. Чистый Na. Cl. O содержит теоретически 95, 2% активного хлора. Все гипохлориты – сильные окислители, особенно в щелочном растворе. Так, в кислой среде они окисляют иодиды до иода, в нейтральной – до иодата IO 3–, в щелочной – до периодата IO 4–. Хлорноватистая кислота очень слабая, слабее даже угольной. Поэтому на воздухе из растворов гипохлоритов происходит частичное выделение этой кислоты под действием углекислого газа: Na. OCl + CO 2 ⇄ Na. HCO 3 + HCl. O. Отбеливающее действие гипохлоритов основано на окислении хлорноватистой кислотой различных загрязняющих ткань веществ. В отсутствие углекислого газа жавелевая вода тоже разлагается. Так, при комнатной температуре в водном растворе за сутки разлагается около 0, 1% Na. Cl. O. В присутствии щелочей скорость разложения замедляется. Концентрированные растворы Na. Cl. O выпускаются промышленностью в большом количестве – сотни тысяч тонн ежегодно. Его применяют как дезинфицирующее средство, для обеззараживания воды, для отбеливания тканей, бумаги, в химических синтезах, в зубоврачебной практике – для дезинфицирования каналов и отбеливания зубов. Более легкий гипохлорит лития содержит в чистом виде 121, 6% активного хлора. Его применяют в производстве стиральных порошков, для дезинфекции воды в бассейнах.
 Урок № 29. Хімічні властивості хлору • Интересна и необычна реакция гипохлоритов с пероксидом водорода в щелочных растворах: Cl. O– + H 2 O 2 H 2 O + Cl– + O 2). Необычность ее в том, что энергия этой экзотермической реакции частично выделяется на молекулах кислорода, который образуется в электронновозбужденном состоянии (такой кислород называется синглетным). Энергия возбуждения составляет 95 к. Дж/моль. При столкновении двух возбужденных молекул кислорода обе они переходят в основное состояние, а их избыточная энергия излучается в виде красного света с длиной волны 634 нм. Свечение, вызванное химической реакцией, называется хемилюминесценцией. Один химик неожиданно наблюдал это свечение, когда попытался вывести чернильное пятно с белого банного полотенца. Смочив пятно отбеливающим раствором, содержащим гипохлорит, он неожиданно увидел слабое розовое свечение, которое продолжалось более минуты. Оказалось, что ранее полотенце отбеливали другим средством, содержащим Н 2 О 2, и частично пероксид остался на ткани, несмотря на полоскание и сушку.
Урок № 29. Хімічні властивості хлору • Интересна и необычна реакция гипохлоритов с пероксидом водорода в щелочных растворах: Cl. O– + H 2 O 2 H 2 O + Cl– + O 2). Необычность ее в том, что энергия этой экзотермической реакции частично выделяется на молекулах кислорода, который образуется в электронновозбужденном состоянии (такой кислород называется синглетным). Энергия возбуждения составляет 95 к. Дж/моль. При столкновении двух возбужденных молекул кислорода обе они переходят в основное состояние, а их избыточная энергия излучается в виде красного света с длиной волны 634 нм. Свечение, вызванное химической реакцией, называется хемилюминесценцией. Один химик неожиданно наблюдал это свечение, когда попытался вывести чернильное пятно с белого банного полотенца. Смочив пятно отбеливающим раствором, содержащим гипохлорит, он неожиданно увидел слабое розовое свечение, которое продолжалось более минуты. Оказалось, что ранее полотенце отбеливали другим средством, содержащим Н 2 О 2, и частично пероксид остался на ткани, несмотря на полоскание и сушку.
 Урок № 29. Хімічні властивості хлору • • • Хлорная известь В Англии, в Ланкашире, с 18 в. применяли для отбеливания тканей вещество, получаемое действием хлора на другой щелочной раствор – известковое молоко. В 1788 г. английский химик Смитсон Теннант получил патент на получение сухого «отбеливающего порошка» путем абсорбции хлора гашеной известью (гидроксидом кальция). Этот порошок получил название белильной (или хлорной) извести. В 1799 г. в Глазго началось производство хлорной извести; за первый год ее получили 52 тонны. Гашеная известь стоила очень дешево, а вот хлор был дорог. В начале 19 в. , одна тонна хлорной извести стоила 1300 золотых рублей; через сто лет ее цена снизилась в 30 раз, а сейчас это очень дешевое вещество. Состав хлорной извести долгое время был неизвестен. Английский химик Уильям Одлинг, один из предшественников Д. И. Менделеева по открытию периодического закона, предположил, что хлорная известь – это смешанная соль, хлорид-гипохлорит кальция Ca(OCl)Cl. Однако состав этого вещества сложнее и зависит от способа получения. Сначала в реакции хлора с гидроксидом кальция образуется основной гипохлорит Ca(OCl)2· 2 Ca(OH)2 в смеси с основным хлоридом Ca. Cl 2·Ca(OH)2·H 2 O. При дальнейшем хлорировании первое из этих соединений постепенно превращается в Ca(OCl)2. В результате получается сложная смесь, состоящая из Ca(OCl)Cl, Ca(Cl. O)2, Ca. Cl 2, Ca(OH)2 и более сложных соединений на их основе.
Урок № 29. Хімічні властивості хлору • • • Хлорная известь В Англии, в Ланкашире, с 18 в. применяли для отбеливания тканей вещество, получаемое действием хлора на другой щелочной раствор – известковое молоко. В 1788 г. английский химик Смитсон Теннант получил патент на получение сухого «отбеливающего порошка» путем абсорбции хлора гашеной известью (гидроксидом кальция). Этот порошок получил название белильной (или хлорной) извести. В 1799 г. в Глазго началось производство хлорной извести; за первый год ее получили 52 тонны. Гашеная известь стоила очень дешево, а вот хлор был дорог. В начале 19 в. , одна тонна хлорной извести стоила 1300 золотых рублей; через сто лет ее цена снизилась в 30 раз, а сейчас это очень дешевое вещество. Состав хлорной извести долгое время был неизвестен. Английский химик Уильям Одлинг, один из предшественников Д. И. Менделеева по открытию периодического закона, предположил, что хлорная известь – это смешанная соль, хлорид-гипохлорит кальция Ca(OCl)Cl. Однако состав этого вещества сложнее и зависит от способа получения. Сначала в реакции хлора с гидроксидом кальция образуется основной гипохлорит Ca(OCl)2· 2 Ca(OH)2 в смеси с основным хлоридом Ca. Cl 2·Ca(OH)2·H 2 O. При дальнейшем хлорировании первое из этих соединений постепенно превращается в Ca(OCl)2. В результате получается сложная смесь, состоящая из Ca(OCl)Cl, Ca(Cl. O)2, Ca. Cl 2, Ca(OH)2 и более сложных соединений на их основе.
 Урок № 29. Хімічні властивості хлору • • Чистый гипохлорит кальция (впервые он был получен в 1875) – бесцветные кристаллы, устойчивые в отсутствие влаги и углекислого газа. При нагревании выше 50°С он разлагается с выделением кислорода. Химически чистое соединение содержит 99, 2% активного хлора; присутствие в техническом продукте основного хлорида кальция снижает это значение до 50– 70%, а присутствие влаги ускоряет разложение. Значительно большее распространение получила хлорная известь (другое название – белильная известь). Ее получают хлорированием сухого Ca(OH)2. Получаемый продукт обычно содержит 28– 36% активного хлора. Из-за медленного разложения, особенно во влажном состоянии, он всегда пахнет хлором. При хранении хлорной извести теряется до 10% активного хлора в год. Разложение ускоряется с повышением влажности и температуры, при освещении, в присутствии тяжелых металлов и углекислого газа. Раствор хлорной извести, стоящий на солнечном свету, за сутки теряет до 5% активного хлора. Применяют хлорную известь для отбеливания тканей, целлюлозы, бумаги, для очистки нефтепродуктов, дезинфекции сточных вод. В лаборатории ее можно использовать для получения хлора.
Урок № 29. Хімічні властивості хлору • • Чистый гипохлорит кальция (впервые он был получен в 1875) – бесцветные кристаллы, устойчивые в отсутствие влаги и углекислого газа. При нагревании выше 50°С он разлагается с выделением кислорода. Химически чистое соединение содержит 99, 2% активного хлора; присутствие в техническом продукте основного хлорида кальция снижает это значение до 50– 70%, а присутствие влаги ускоряет разложение. Значительно большее распространение получила хлорная известь (другое название – белильная известь). Ее получают хлорированием сухого Ca(OH)2. Получаемый продукт обычно содержит 28– 36% активного хлора. Из-за медленного разложения, особенно во влажном состоянии, он всегда пахнет хлором. При хранении хлорной извести теряется до 10% активного хлора в год. Разложение ускоряется с повышением влажности и температуры, при освещении, в присутствии тяжелых металлов и углекислого газа. Раствор хлорной извести, стоящий на солнечном свету, за сутки теряет до 5% активного хлора. Применяют хлорную известь для отбеливания тканей, целлюлозы, бумаги, для очистки нефтепродуктов, дезинфекции сточных вод. В лаборатории ее можно использовать для получения хлора.
 Урок № 29. Хімічні властивості хлору • • • В России хлорную известь производили с 1890 на заводе Ушакова близ Елабуги на Каме. А до этого всего за три года было импортировано 15 тыс. т хлорной извести на сумму 1, 25 млн. рублей. Несмотря на относительно низкое содержание активного хлора и неустойчивость при хранении, хлорную известь еще производят в довольно больших количествах – в основном в развивающихся странах. В США ее производство достигло максимума в 1923 (133 тыс. т), а уже через 30 лет снизилось в шесть раз за счет производства более эффективных средств, содержащих активный хлор. Другие соединения с активным хлором. Отбеливающим действием, помимо хлорноватистой кислоты и ее солей, обладает также хлористая кислота HCl. O 2 и ее соли – хлориты. Кислота эта слабая и неустойчивая, особенно в кислой среде; ее распад идет по уравнению 4 HCl. O 2 HCl. O 3 + 2 Cl. O 2 + HCl + H 2 O. Под действием света, как и в случае HCl. O, выделяется кислород: 10 HCl. O 2 2 HCl. O 3 + 2 HCl. O 4 + 6 HCl + 3 O 2. При получении гипохлоритов действием хлора на щелочи хлориты не накапливаются из-за быстрой реакции Cl. O 2– + Cl. O– Cl. O 3– + Cl–. Получают хлориты действием ангидрида хлористой кислоты на щелочи: 2 Cl. O 2 + 2 Na. OH Na. Cl. O 2 + Na. Cl. O 3 + H 2 O. Одновременно образуется хлорат – соль хлорноватой кислоты HCl. O 3. Из солей хлористой кислоты применяют в основном хлорит натрия Na. Cl. O 2 (содержание активного хлора 156, 8%), который используют для быстрого отбеливания искусственного волокна.
Урок № 29. Хімічні властивості хлору • • • В России хлорную известь производили с 1890 на заводе Ушакова близ Елабуги на Каме. А до этого всего за три года было импортировано 15 тыс. т хлорной извести на сумму 1, 25 млн. рублей. Несмотря на относительно низкое содержание активного хлора и неустойчивость при хранении, хлорную известь еще производят в довольно больших количествах – в основном в развивающихся странах. В США ее производство достигло максимума в 1923 (133 тыс. т), а уже через 30 лет снизилось в шесть раз за счет производства более эффективных средств, содержащих активный хлор. Другие соединения с активным хлором. Отбеливающим действием, помимо хлорноватистой кислоты и ее солей, обладает также хлористая кислота HCl. O 2 и ее соли – хлориты. Кислота эта слабая и неустойчивая, особенно в кислой среде; ее распад идет по уравнению 4 HCl. O 2 HCl. O 3 + 2 Cl. O 2 + HCl + H 2 O. Под действием света, как и в случае HCl. O, выделяется кислород: 10 HCl. O 2 2 HCl. O 3 + 2 HCl. O 4 + 6 HCl + 3 O 2. При получении гипохлоритов действием хлора на щелочи хлориты не накапливаются из-за быстрой реакции Cl. O 2– + Cl. O– Cl. O 3– + Cl–. Получают хлориты действием ангидрида хлористой кислоты на щелочи: 2 Cl. O 2 + 2 Na. OH Na. Cl. O 2 + Na. Cl. O 3 + H 2 O. Одновременно образуется хлорат – соль хлорноватой кислоты HCl. O 3. Из солей хлористой кислоты применяют в основном хлорит натрия Na. Cl. O 2 (содержание активного хлора 156, 8%), который используют для быстрого отбеливания искусственного волокна.
 Урок № 29. Хімічні властивості хлору • • Для отбеливания древесной целлюлозы, растительных и животных жиров, стерилизации и дезодорации воды применяют также диоксид хлора. Чистый Cl. O 2 содержит 262, 8% активного хлора. Это, пожалуй, рекорд для соединений, имеющих практическое значение. Теоретически же из хлорсодержащих соединений на первое место выходит хлорный ангидрид Cl 2 O 7 – 310%. Дезинфицирующие и моющие свойства сочетает в себе хлорированный тринатрийфосфат состава Na 3 PO 4· 1/4 Na. Cl. O· 11 H 2 O, содержащий 4, 7% активного хлора. Его добавляют в средства для мытья посуды, стерилизации фруктов и овощей в пищевой промышленности. Применяют, в основном для дезинфекции, и органические соединения, содержащие активный хлор – хлорамин Б (производное бензолсульфокислоты) C 6 H 5 SO 2 N(Na)Cl· 3 H 2 O, дихлорамин Б C 6 H 5 SO 2 NCl 2, хлорамин Т (производное толуолсульфокислоты) CH 3 C 6 H 4 SO 2 N(Na)Cl· 3 H 2 O, дихлорамин Т CH 3 C 6 H 4 SO 2 NCl 2, пантоцид HOOC 6 H 4 SO 2 NCl 2. Хлорамины – сильные окислители и хлорирующие агенты, обладают запахом хлора. При действии влаги гидролизуются с выделением хлорноватистой кислоты.
Урок № 29. Хімічні властивості хлору • • Для отбеливания древесной целлюлозы, растительных и животных жиров, стерилизации и дезодорации воды применяют также диоксид хлора. Чистый Cl. O 2 содержит 262, 8% активного хлора. Это, пожалуй, рекорд для соединений, имеющих практическое значение. Теоретически же из хлорсодержащих соединений на первое место выходит хлорный ангидрид Cl 2 O 7 – 310%. Дезинфицирующие и моющие свойства сочетает в себе хлорированный тринатрийфосфат состава Na 3 PO 4· 1/4 Na. Cl. O· 11 H 2 O, содержащий 4, 7% активного хлора. Его добавляют в средства для мытья посуды, стерилизации фруктов и овощей в пищевой промышленности. Применяют, в основном для дезинфекции, и органические соединения, содержащие активный хлор – хлорамин Б (производное бензолсульфокислоты) C 6 H 5 SO 2 N(Na)Cl· 3 H 2 O, дихлорамин Б C 6 H 5 SO 2 NCl 2, хлорамин Т (производное толуолсульфокислоты) CH 3 C 6 H 4 SO 2 N(Na)Cl· 3 H 2 O, дихлорамин Т CH 3 C 6 H 4 SO 2 NCl 2, пантоцид HOOC 6 H 4 SO 2 NCl 2. Хлорамины – сильные окислители и хлорирующие агенты, обладают запахом хлора. При действии влаги гидролизуются с выделением хлорноватистой кислоты.
 Урок № 29. Хімічні властивості хлору
Урок № 29. Хімічні властивості хлору
 Урок № 29. Хімічні властивості хлору Гипохлорит натрия применяется в процессе антисептической обработки и чистки зубных каналов перед пломбированием и частичного расширения за счет растворения органической основы дентина.
Урок № 29. Хімічні властивості хлору Гипохлорит натрия применяется в процессе антисептической обработки и чистки зубных каналов перед пломбированием и частичного расширения за счет растворения органической основы дентина.
 Урок № 29. Хімічні властивості хлору ЭКО-50 - установка по производству гипохлорита натрия Установки для производства дезинфицирующего раствора широкого спектра действия. Установка вырабатывает концентрированный раствор гипохлорита натрия методом электролиза водного раствора поваренной соли непосредственно на месте потребления.
Урок № 29. Хімічні властивості хлору ЭКО-50 - установка по производству гипохлорита натрия Установки для производства дезинфицирующего раствора широкого спектра действия. Установка вырабатывает концентрированный раствор гипохлорита натрия методом электролиза водного раствора поваренной соли непосредственно на месте потребления.
 Урок № 29. Хімічні властивості хлору Благодаря низкой стоимости и тому, что гипохлориты являются сильными окислителями, их применяют как отбеливающее средство в текстильной, бумажной, целлюлозной промышленности, для дезинфекции питьевых и сточных вод и др.
Урок № 29. Хімічні властивості хлору Благодаря низкой стоимости и тому, что гипохлориты являются сильными окислителями, их применяют как отбеливающее средство в текстильной, бумажной, целлюлозной промышленности, для дезинфекции питьевых и сточных вод и др.
 Урок № 29. Хімічні властивості хлору • • • 4. Применение хлора. Хлор применяют во многих отраслях промышленности, науки и бытовых нужд: В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают: изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы. Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1, 2 -дихлорэтан. Отбеливающие свойства хлора известны с давних времен, хотя не сам хлор «отбеливает» , а атомарный кислород, который образуется при распаде хлорноватистой кислоты: Cl 2 + H 2 O HCl + HCl. O 2 HCl + O • . Этот способ отбеливания тканей, бумаги, картона используется уже несколько веков. Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасные для растений. На получение средств защиты растений расходуется значительная часть производимого хлора. Один из самых важных инсектицидов — гексахлорциклогексан (часто называемый гексахлораном). Это вещество впервые синтезировано ещё в 1825 г. Фарадеем, но практическое применение нашло только через 100 с лишним лет — в 30 -х годах ХХ столетия.
Урок № 29. Хімічні властивості хлору • • • 4. Применение хлора. Хлор применяют во многих отраслях промышленности, науки и бытовых нужд: В производстве поливинилхлорида, пластикатов, синтетического каучука, из которых изготавливают: изоляцию для проводов, оконный профиль, упаковочные материалы, одежду и обувь, линолеум и грампластинки, лаки, аппаратуру и пенопласты, игрушки, детали приборов, строительные материалы. Поливинилхлорид производят полимеризацией винилхлорида, который сегодня чаще всего получают из этилена сбалансированным по хлору методом через промежуточный 1, 2 -дихлорэтан. Отбеливающие свойства хлора известны с давних времен, хотя не сам хлор «отбеливает» , а атомарный кислород, который образуется при распаде хлорноватистой кислоты: Cl 2 + H 2 O HCl + HCl. O 2 HCl + O • . Этот способ отбеливания тканей, бумаги, картона используется уже несколько веков. Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасные для растений. На получение средств защиты растений расходуется значительная часть производимого хлора. Один из самых важных инсектицидов — гексахлорциклогексан (часто называемый гексахлораном). Это вещество впервые синтезировано ещё в 1825 г. Фарадеем, но практическое применение нашло только через 100 с лишним лет — в 30 -х годах ХХ столетия.
 Урок № 29. Хімічні властивості хлоруу • • • 4. Применение хлора. Использовался как боевое отравляющее вещество, а также для производства других боевых отравляющих веществ: иприт, фосген. Для обеззараживания воды — «хлорирования» . Наиболее распространённый способ обеззараживания питьевой воды; основан на способности свободного хлора и его соединений угнетать ферментные системы микроорганизмов катализирующие окислительновосстановительные процессы. Для обеззараживания питьевой воды применяют: хлор, двуокись хлора, хлорамин и хлорную известь. Сан. Пи. Н 2. 1. 4. 1074 -01 устанавливает следующие пределы (коридор)допустимого содержания свободного остаточного хлора в питьевой воде централизованного водоснабжения 0. 3 — 0. 5 мг/л. Ряд учёных и даже политиков в России критикуют саму концепцию хлорирования водопроводной воды, но альтернативы дезинфицирующему последействию соединений хлора предложить не могут. Материалы, из которых изготовлены водопроводные трубы, по разному взаимодействуют с хлорированной водопроводной водой.
Урок № 29. Хімічні властивості хлоруу • • • 4. Применение хлора. Использовался как боевое отравляющее вещество, а также для производства других боевых отравляющих веществ: иприт, фосген. Для обеззараживания воды — «хлорирования» . Наиболее распространённый способ обеззараживания питьевой воды; основан на способности свободного хлора и его соединений угнетать ферментные системы микроорганизмов катализирующие окислительновосстановительные процессы. Для обеззараживания питьевой воды применяют: хлор, двуокись хлора, хлорамин и хлорную известь. Сан. Пи. Н 2. 1. 4. 1074 -01 устанавливает следующие пределы (коридор)допустимого содержания свободного остаточного хлора в питьевой воде централизованного водоснабжения 0. 3 — 0. 5 мг/л. Ряд учёных и даже политиков в России критикуют саму концепцию хлорирования водопроводной воды, но альтернативы дезинфицирующему последействию соединений хлора предложить не могут. Материалы, из которых изготовлены водопроводные трубы, по разному взаимодействуют с хлорированной водопроводной водой.
 Урок № 29. Хімічні властивості хлору • • • Свободный хлор в водопроводной воде существенно сокращает срок службы трубопроводов на основе полиолефинов: полиэтиленовых труб различного вида, в том числе сшитого полиэтилена, большие известного как ПЕКС (PEX, PE-X). В США для контроля допуска трубопроводов из полимерных материалов к использованию в водопроводах с хлорированной водой вынуждены были принять 3 стандарта: ASTM F 2023 применительно к трубам из сшитого полиэтилена (PEX) и горячей хлорированной воде, ASTM F 2263 применительно к полиэтиленовым трубам всем и хлорированной воде и ASTM F 2330 применительно к многослойным (металлополимерным) трубам и горячей хлорированной воде. В части долговечности при взаимодействии с хлорированной водой положительные результаты демонстрируют медные водопроводные трубы. В пищевой промышленности зарегистрирован в качестве пищевой добавки E 925. В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений. В металлургии для производства чистых металлов: титана, олова, тантала, ниобия. Как индикатор солнечных нейтрино в хлор-аргонных детекторах. Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов.
Урок № 29. Хімічні властивості хлору • • • Свободный хлор в водопроводной воде существенно сокращает срок службы трубопроводов на основе полиолефинов: полиэтиленовых труб различного вида, в том числе сшитого полиэтилена, большие известного как ПЕКС (PEX, PE-X). В США для контроля допуска трубопроводов из полимерных материалов к использованию в водопроводах с хлорированной водой вынуждены были принять 3 стандарта: ASTM F 2023 применительно к трубам из сшитого полиэтилена (PEX) и горячей хлорированной воде, ASTM F 2263 применительно к полиэтиленовым трубам всем и хлорированной воде и ASTM F 2330 применительно к многослойным (металлополимерным) трубам и горячей хлорированной воде. В части долговечности при взаимодействии с хлорированной водой положительные результаты демонстрируют медные водопроводные трубы. В пищевой промышленности зарегистрирован в качестве пищевой добавки E 925. В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений. В металлургии для производства чистых металлов: титана, олова, тантала, ниобия. Как индикатор солнечных нейтрино в хлор-аргонных детекторах. Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов.
 Урок № 29. Хімічні властивості хлору • • • Домашнє завдання 1. Вчити навчальний матеріал Біологи – у обсязі навчальної програми Хіміки – властивості ВСІХ сполук хлору 2. Підготовка до семінару «Властивості хлору та його сполук» 3. Виконати завдання
Урок № 29. Хімічні властивості хлору • • • Домашнє завдання 1. Вчити навчальний матеріал Біологи – у обсязі навчальної програми Хіміки – властивості ВСІХ сполук хлору 2. Підготовка до семінару «Властивості хлору та його сполук» 3. Виконати завдання


