урок2.pptx
- Количество слайдов: 24
 Урок 2 « Непредельные углеводороды. Циклоалканы» Тухватуллина Румия Захидовна 1 14. 02. 2018
Урок 2 « Непредельные углеводороды. Циклоалканы» Тухватуллина Румия Захидовна 1 14. 02. 2018
 Алкены *Алкены ( олефины, этиленовые УВ) Cn. H 2 n, n>2 Тухватуллина Румия Захидовна 2 14. 02. 2018
Алкены *Алкены ( олефины, этиленовые УВ) Cn. H 2 n, n>2 Тухватуллина Румия Захидовна 2 14. 02. 2018
 * Физические свойства С 2 -С 4 газы, С 5 -С 16 жидкости, С>19 твердые, р<1 г/см , мало растворимы в воде, Ткип. (н)>Tкип. (разв. ) Ткип. (цис)>Tкип. (транс) Тухватуллина Румия Захидовна 3 14. 02. 2018
* Физические свойства С 2 -С 4 газы, С 5 -С 16 жидкости, С>19 твердые, р<1 г/см , мало растворимы в воде, Ткип. (н)>Tкип. (разв. ) Ткип. (цис)>Tкип. (транс) Тухватуллина Румия Захидовна 3 14. 02. 2018
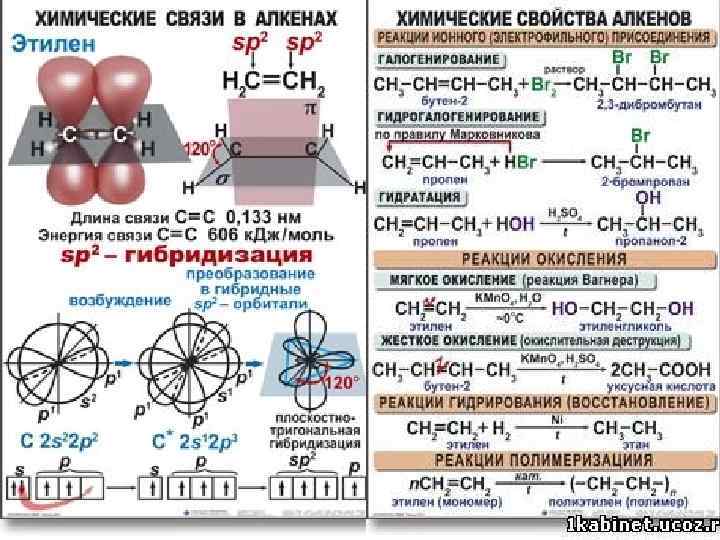 Тухватуллина Румия Захидовна 4 14. 02. 2018
Тухватуллина Румия Захидовна 4 14. 02. 2018
 *Активны из-за наличия непрочной π- связи *Характерны реакции присоединения *Гидрирование( присоединение водорода) СН 3 -СН=СН 2 +Н 2→ CH 3 -CH 2 -CH 3(кат. Ni) пропен пропан §Галогенирование( +Hal 2 ) СН 3 -СН=СН 2 +Br 2 → CH 3 -CHBr-CH 2 Br пропен 1, 2 - дибромпропан качественная реакция Гидрогалогенирование( +HHal) CH 2=CH 2 + HCl→ CH 3 – CH 2 Cl этен хлорэтан Тухватуллина Румия Захидовна 5 14. 02. 2018
*Активны из-за наличия непрочной π- связи *Характерны реакции присоединения *Гидрирование( присоединение водорода) СН 3 -СН=СН 2 +Н 2→ CH 3 -CH 2 -CH 3(кат. Ni) пропен пропан §Галогенирование( +Hal 2 ) СН 3 -СН=СН 2 +Br 2 → CH 3 -CHBr-CH 2 Br пропен 1, 2 - дибромпропан качественная реакция Гидрогалогенирование( +HHal) CH 2=CH 2 + HCl→ CH 3 – CH 2 Cl этен хлорэтан Тухватуллина Румия Захидовна 5 14. 02. 2018
 * Присоединение галогенводородов к несимметричным алкенам происходит по правилу В. В. Марковникова * Правило Марковникова !!! При присоединении полярных молекул (НHal, H 2 O) к несимметричным алкенам атом водорода присоединяется к атому углерода у кратной связи, связанному с большим числом атомов водорода. CH 3 -CH=CH 2 +HBr →CH 3 -CHBr-CH 3 пропен 2 -бромпропан Гидратация (+Н 2 О) происходит по правилу Марковникова СН 2=СН 2 +Н 2 О →СН 3 -СН 2 ОН (в кислой среде при нагревании) этанол (первичный спирт) СН 2=СН-СН 2 -СН 3+Н 2 О→СН 3 -СНОН-СН 2 -СН 3 бутен-1 бутанол-2 ( вторичный спирт ) II. Реакция окисления Горение: а) полное ( избыток О 2) С 2 Н 4 +3 О 2 → 2 СО 2 +2 Н 2 О Тухватуллина Румия Захидовна 6 14. 02. 2018
* Присоединение галогенводородов к несимметричным алкенам происходит по правилу В. В. Марковникова * Правило Марковникова !!! При присоединении полярных молекул (НHal, H 2 O) к несимметричным алкенам атом водорода присоединяется к атому углерода у кратной связи, связанному с большим числом атомов водорода. CH 3 -CH=CH 2 +HBr →CH 3 -CHBr-CH 3 пропен 2 -бромпропан Гидратация (+Н 2 О) происходит по правилу Марковникова СН 2=СН 2 +Н 2 О →СН 3 -СН 2 ОН (в кислой среде при нагревании) этанол (первичный спирт) СН 2=СН-СН 2 -СН 3+Н 2 О→СН 3 -СНОН-СН 2 -СН 3 бутен-1 бутанол-2 ( вторичный спирт ) II. Реакция окисления Горение: а) полное ( избыток О 2) С 2 Н 4 +3 О 2 → 2 СО 2 +2 Н 2 О Тухватуллина Румия Захидовна 6 14. 02. 2018
 б) неполное( недостаток кислорода) C 2 H 4 +2 O 2→ 2 CO + 2 H 2 O C 2 H 4 + O 2→ 2 C +2 H 2 O в)под действием окислителей типа KMn. O 4, K 2 Cr 2 O 7 CH 2=CH 2 + ( O ) + H 2 O----- CH 2 – CH 2 l l OH OH !!! качественная реакция алкилирование (присоединение алканов) кат. Al. Cl 3, Al. Br 3, HF, H 2 SO 4 CH 2=CH 2+ CH 3 -CH 2 -CH 3→-CH 3 -CH 2 -CH 3 и СH 3 -CH 2 -CH-CH 3 l пентан CH 3 2 -метилбутан Тухватуллина Румия Захидовна 7 14. 02. 2018
б) неполное( недостаток кислорода) C 2 H 4 +2 O 2→ 2 CO + 2 H 2 O C 2 H 4 + O 2→ 2 C +2 H 2 O в)под действием окислителей типа KMn. O 4, K 2 Cr 2 O 7 CH 2=CH 2 + ( O ) + H 2 O----- CH 2 – CH 2 l l OH OH !!! качественная реакция алкилирование (присоединение алканов) кат. Al. Cl 3, Al. Br 3, HF, H 2 SO 4 CH 2=CH 2+ CH 3 -CH 2 -CH 3→-CH 3 -CH 2 -CH 3 и СH 3 -CH 2 -CH-CH 3 l пентан CH 3 2 -метилбутан Тухватуллина Румия Захидовна 7 14. 02. 2018
 * Назовите по систематической номенклатуре: СН 2=СН-С(СН 3)2 СН 3 а) 3, 3 –диметилбутен-2, б) 2 -диметилбутен -3, в) 2, 2 - диметилбутен -3, г) 3, 3 - диметилбутен-1 * Бромэтан может быть превращен в этилен: а) взаимодействием с натрием б)взаимодействием со спиртовым раствором щелочи в) нагреванием с серной кислотой г) взаимодействием с водородом * Реакция присоединения воды называется а)гидрирования б) дегидратация в) гидратация г) дегидрирования * Какие вещества, названия которых приведены ниже, являются между собой гомологами? а) этен б) 2 -метилпропен в) 1, 2 - дихлорпропен г) 1 -хлорпропен * Укажите названия алкенов, для которых возможна геометрическая изомерия: а) 1, 1 -дихлорэтен б) 1, 2 -дихлорэтен в) винилхлорид г) бутен -2 Укажите значение относительной молекулярной массы для алкена с 6 -ю атомами углерода в молекуле: а) 86 б) 84 в) 82 г) 80 Укажите типы реакций, в которые может вступать пропен: а) полимеризации б) гидратации в) гидрирования г ) окисления В отличие от пропана пропен реагирует Тухватуллина Румия Захидовна 8 а) бромом б) бромной водой в) водой г) водородом 14. 02. 2018
* Назовите по систематической номенклатуре: СН 2=СН-С(СН 3)2 СН 3 а) 3, 3 –диметилбутен-2, б) 2 -диметилбутен -3, в) 2, 2 - диметилбутен -3, г) 3, 3 - диметилбутен-1 * Бромэтан может быть превращен в этилен: а) взаимодействием с натрием б)взаимодействием со спиртовым раствором щелочи в) нагреванием с серной кислотой г) взаимодействием с водородом * Реакция присоединения воды называется а)гидрирования б) дегидратация в) гидратация г) дегидрирования * Какие вещества, названия которых приведены ниже, являются между собой гомологами? а) этен б) 2 -метилпропен в) 1, 2 - дихлорпропен г) 1 -хлорпропен * Укажите названия алкенов, для которых возможна геометрическая изомерия: а) 1, 1 -дихлорэтен б) 1, 2 -дихлорэтен в) винилхлорид г) бутен -2 Укажите значение относительной молекулярной массы для алкена с 6 -ю атомами углерода в молекуле: а) 86 б) 84 в) 82 г) 80 Укажите типы реакций, в которые может вступать пропен: а) полимеризации б) гидратации в) гидрирования г ) окисления В отличие от пропана пропен реагирует Тухватуллина Румия Захидовна 8 а) бромом б) бромной водой в) водой г) водородом 14. 02. 2018
 * Получение алкенов. 1)Крекинг нефтепродуктов С 16 Н 34 --- С 8 Н 18 + С 8 Н 16( t ) 2) Дегидрирование алканов ( де + гидр + ирование= удалять +водород + + действие) Cn. H 2 n+2 → Cn. H 2 n + H 2 ( t, kat. ) Отщепление водорода. 3) Гидрирование алкинов Cn. H 2 n-2+ H 2 → Cn. H 2 n ( kat. Ni, Pt ) 4)Дегидратация спиртов (t, kat: H 2 SO 4, H 3 PO 4, Al 2 O 3, Zn. Cl 2) CH 3 -CH 2 OH →CH 2=CH 2 +H 2 O (170 , Н 2 SO 4 конц. ) При дегидратации спиртов атом водорода отщепляется от атома углерода, связанного с наименьшим числом атомов водорода (правило А. М. Зайцева). !!! Тухватуллина Румия Захидовна 9 14. 02. 2018
* Получение алкенов. 1)Крекинг нефтепродуктов С 16 Н 34 --- С 8 Н 18 + С 8 Н 16( t ) 2) Дегидрирование алканов ( де + гидр + ирование= удалять +водород + + действие) Cn. H 2 n+2 → Cn. H 2 n + H 2 ( t, kat. ) Отщепление водорода. 3) Гидрирование алкинов Cn. H 2 n-2+ H 2 → Cn. H 2 n ( kat. Ni, Pt ) 4)Дегидратация спиртов (t, kat: H 2 SO 4, H 3 PO 4, Al 2 O 3, Zn. Cl 2) CH 3 -CH 2 OH →CH 2=CH 2 +H 2 O (170 , Н 2 SO 4 конц. ) При дегидратации спиртов атом водорода отщепляется от атома углерода, связанного с наименьшим числом атомов водорода (правило А. М. Зайцева). !!! Тухватуллина Румия Захидовна 9 14. 02. 2018
 5) Дегидрогалогенирование моногалогеналканов (-HHal) действием твердой щелочи или ее спиртового раствора. Происходит по правилу Зайцева: СН 3 -СН 2 -С(СН 3)Cl-CH 3 + KOH→CH 3 -CH=C(CH 3)-CH 3 + 2 -метил-2 -хлорбутан 2 -метилбутен-2 KCl + H 2 O !!!! 6) Дегалогенирование (-2 Наl) дигалогеналканов с атомами галогена у соседних атомов «С» действием Z n или Mq. CH 3 -CH 2 -CHBr-CH 3 + Zn →CH 3 -CH 2 -CH=CH-CH 3 +Zn. Br 2 2, 3 -дибромпентан пентен-2 Вместо цинка может быть использован натрий или магний. Наза Тухватуллина Румия Захидовна 10 14. 02. 2018
5) Дегидрогалогенирование моногалогеналканов (-HHal) действием твердой щелочи или ее спиртового раствора. Происходит по правилу Зайцева: СН 3 -СН 2 -С(СН 3)Cl-CH 3 + KOH→CH 3 -CH=C(CH 3)-CH 3 + 2 -метил-2 -хлорбутан 2 -метилбутен-2 KCl + H 2 O !!!! 6) Дегалогенирование (-2 Наl) дигалогеналканов с атомами галогена у соседних атомов «С» действием Z n или Mq. CH 3 -CH 2 -CHBr-CH 3 + Zn →CH 3 -CH 2 -CH=CH-CH 3 +Zn. Br 2 2, 3 -дибромпентан пентен-2 Вместо цинка может быть использован натрий или магний. Наза Тухватуллина Румия Захидовна 10 14. 02. 2018
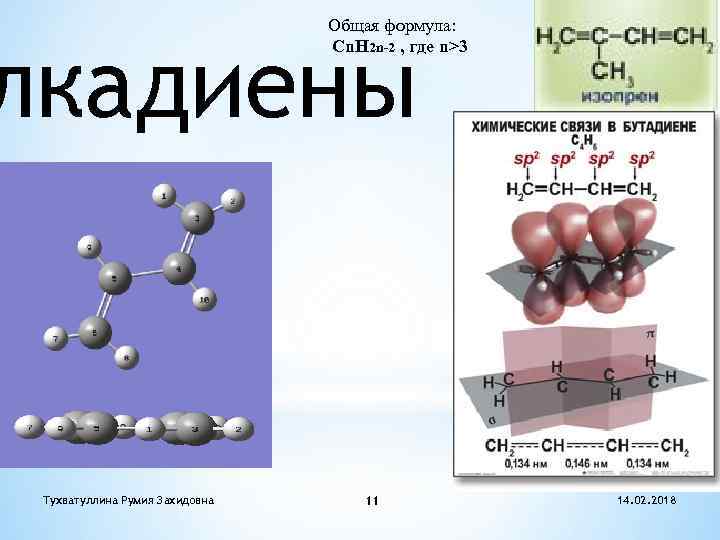 Общая формула: Cn. H 2 n-2 , где n>3 лкадиены Тухватуллина Румия Захидовна 11 14. 02. 2018
Общая формула: Cn. H 2 n-2 , где n>3 лкадиены Тухватуллина Румия Захидовна 11 14. 02. 2018
 Диены с кумулированными связями Две двойные связи находятся у одного атома углерода СН 2=С=СН 2 пропадиен (аллен) Диены с сопряженными связями Двойные связи разделены одной одинарной связью СН 2=СН-СН=СН 2 бутадиен-1, 3 Диены с изолированными связями Двойные связи разделены двумя или более одинарными связями СН 2=СН-СН 2 -СН=СН 2 пентадиен-1, 4 Тухватуллина Румия Захидовна 12 14. 02. 2018
Диены с кумулированными связями Две двойные связи находятся у одного атома углерода СН 2=С=СН 2 пропадиен (аллен) Диены с сопряженными связями Двойные связи разделены одной одинарной связью СН 2=СН-СН=СН 2 бутадиен-1, 3 Диены с изолированными связями Двойные связи разделены двумя или более одинарными связями СН 2=СН-СН 2 -СН=СН 2 пентадиен-1, 4 Тухватуллина Румия Захидовна 12 14. 02. 2018
 * Изомерия и номенклатура 1)Структурная изомерия цепи СН 3 гексадиен-2, 4 СН 3 -СН=С(СН 3)-СН=СН 2 3 -метилпентадиен-1, 3 2)Структурная изомерия взаимного положения двойных связей СН 3 гексадиен-1, 4 СН 2=СН-СН 2 -СН=СН 2 гексадиен-1, 5 3) Пространственная изомерия СН 3 -СН=СН- СН 2=СН-СН 2 -СН=СН- 4) Межклассовая изомерия СН=С-СН 2 -СН 3 гексин-1 и его изомеры Изомерия и номенклатура диенов на примере диенового углеводорода с эмпирической формулой С 6 Н 10 Назад Тухватуллина Румия Захидовна 13 14. 02. 2018
* Изомерия и номенклатура 1)Структурная изомерия цепи СН 3 гексадиен-2, 4 СН 3 -СН=С(СН 3)-СН=СН 2 3 -метилпентадиен-1, 3 2)Структурная изомерия взаимного положения двойных связей СН 3 гексадиен-1, 4 СН 2=СН-СН 2 -СН=СН 2 гексадиен-1, 5 3) Пространственная изомерия СН 3 -СН=СН- СН 2=СН-СН 2 -СН=СН- 4) Межклассовая изомерия СН=С-СН 2 -СН 3 гексин-1 и его изомеры Изомерия и номенклатура диенов на примере диенового углеводорода с эмпирической формулой С 6 Н 10 Назад Тухватуллина Румия Захидовна 13 14. 02. 2018
 * 1)Каталитическое дегидрирование а) алканов СН 3 -СН 2 –СН 3 →СН 2=СН-СН=СН 2 +2 Н 2 (условия: Cr 2 O 3/Al 2 O 3, 700) б)алкенов СН 2=СН-СН 2 -СН 3 -→ СН 2=СН-СН=СН 2 + Н 2 2) По способу Лебедева. 2 С 2 Н 5 ОН →СН 2=СН-СН=СН 2+2 Н 2 О+Н 2 !!! Назад Тухватуллина Румия Захидовна 14 14. 02. 2018
* 1)Каталитическое дегидрирование а) алканов СН 3 -СН 2 –СН 3 →СН 2=СН-СН=СН 2 +2 Н 2 (условия: Cr 2 O 3/Al 2 O 3, 700) б)алкенов СН 2=СН-СН 2 -СН 3 -→ СН 2=СН-СН=СН 2 + Н 2 2) По способу Лебедева. 2 С 2 Н 5 ОН →СН 2=СН-СН=СН 2+2 Н 2 О+Н 2 !!! Назад Тухватуллина Румия Захидовна 14 14. 02. 2018
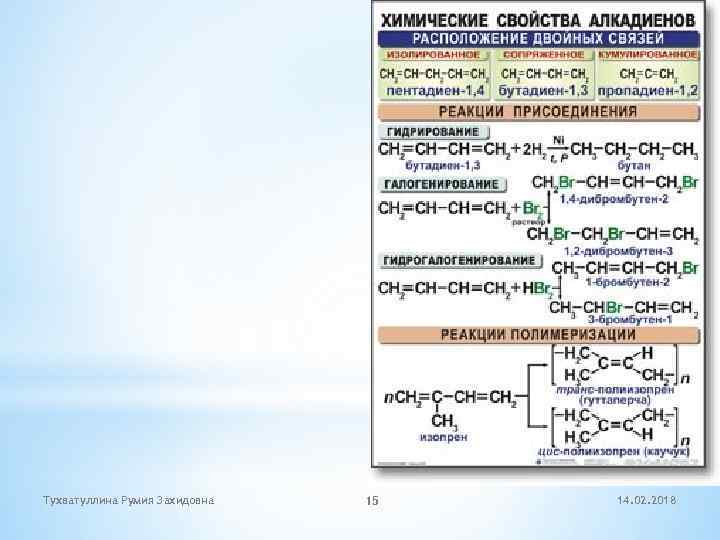 Тухватуллина Румия Захидовна 15 14. 02. 2018
Тухватуллина Румия Захидовна 15 14. 02. 2018
 * Тухватуллина Румия Захидовна Алкадиены 1. Укажите число - связей в молекуле 1, 3 - бутадиена: а) 8 б) 9 в) 7 г) 5 2. Молярная масса алкадиена равна 82 г/моль. Сколько атомов водорода содержится в молекуле алкадиена? а) 10 б) 12 в) 14 г) 8 3) В молекуле алкадиена 6 атомов углерода. Укажите значение относительной молекулярной массы алкадиена: а) 86 б) 84 в) 82 г) 80 4) Какой продукт преимущественно образуется при взаимодействии 1 моль 1, 3 - бутадиена с 1 моль брома при комнатной температуре а) 1, 4 –дибромбутен-2 б) 1, 2 –дибромбутен-1 в) 3, 4 –дибромбутен-1 г) 1, 2, 3, 4 – тетрабромбутан 5) Укажите схемы реакций, в которых продуктом может быть 1, 3 –бутадиен а) СН 3 -СН(СН 3) – СН 2 –СН 3 ---- (дегидрирование) б) СН 3 –СН 2 СН 3 ---( кат. t) в) 2 СН 3 – СН 2 Cl + 2 Na ---- ( t) г) 2 С 2 Н 5 ОН ----- (кат, t ) 6) С какими веществами реагирует 1, 3 –бутадиен? а) бром б ) водород в ) кислород г ) хлороводород 7) При полном гидрировании бутадиена -1, 3 образуется: а) бутен б) бутан в) изопрен г) бутен-2 8) Реакцией Лебедева называется реакция получения: а) 1. 3 - бутадиена из этилена б) 1, 3 –бутадиена из винилхлорида в) 1, 3 –бутадиена из бутана г) 1, 3 –бутадиена из этанола 9) В результате вулканизации каучука можно получить: а) гуттаперчу б) резину в) эбонит г) фенопласт 10) Укажите формулу элементарного звена бутадиенового каучука: 14. 02. 2018 16 а) СН 2=СН-СН=СН 2 б) -СН 2 -СН-СН-СН 2 в) -СН 2 -СН=СН-СН 2 г ) -СН 2=СН –СН=СН 2 -
* Тухватуллина Румия Захидовна Алкадиены 1. Укажите число - связей в молекуле 1, 3 - бутадиена: а) 8 б) 9 в) 7 г) 5 2. Молярная масса алкадиена равна 82 г/моль. Сколько атомов водорода содержится в молекуле алкадиена? а) 10 б) 12 в) 14 г) 8 3) В молекуле алкадиена 6 атомов углерода. Укажите значение относительной молекулярной массы алкадиена: а) 86 б) 84 в) 82 г) 80 4) Какой продукт преимущественно образуется при взаимодействии 1 моль 1, 3 - бутадиена с 1 моль брома при комнатной температуре а) 1, 4 –дибромбутен-2 б) 1, 2 –дибромбутен-1 в) 3, 4 –дибромбутен-1 г) 1, 2, 3, 4 – тетрабромбутан 5) Укажите схемы реакций, в которых продуктом может быть 1, 3 –бутадиен а) СН 3 -СН(СН 3) – СН 2 –СН 3 ---- (дегидрирование) б) СН 3 –СН 2 СН 3 ---( кат. t) в) 2 СН 3 – СН 2 Cl + 2 Na ---- ( t) г) 2 С 2 Н 5 ОН ----- (кат, t ) 6) С какими веществами реагирует 1, 3 –бутадиен? а) бром б ) водород в ) кислород г ) хлороводород 7) При полном гидрировании бутадиена -1, 3 образуется: а) бутен б) бутан в) изопрен г) бутен-2 8) Реакцией Лебедева называется реакция получения: а) 1. 3 - бутадиена из этилена б) 1, 3 –бутадиена из винилхлорида в) 1, 3 –бутадиена из бутана г) 1, 3 –бутадиена из этанола 9) В результате вулканизации каучука можно получить: а) гуттаперчу б) резину в) эбонит г) фенопласт 10) Укажите формулу элементарного звена бутадиенового каучука: 14. 02. 2018 16 а) СН 2=СН-СН=СН 2 б) -СН 2 -СН-СН-СН 2 в) -СН 2 -СН=СН-СН 2 г ) -СН 2=СН –СН=СН 2 -
 Общая формула: Cn. H 2 n-2, n>2 Алкины Тухватуллина Румия Захидовна 17 14. 02. 2018
Общая формула: Cn. H 2 n-2, n>2 Алкины Тухватуллина Румия Захидовна 17 14. 02. 2018
 *Изомерия *Углеродного скелета с «С» >5 CНΞС-СН 2 -СН 3 бутин-1 СНΞС-СН –СН 3 3 -метилбутин-1 *Положения тройной (кратной) связи СНΞС-СН 2 -СН 3 бутин-1 СН 3 -СΞС-СН 3 бутин-2 *Классов соединений (алкадиены) СНΞС-СН 2 -СН 3 бутин-1 СН 2=СН-СН=СН 2 бутадиен-1, 3 * Пространственной изомерии нет Тухватуллина Румия Захидовна 18 14. 02. 2018
*Изомерия *Углеродного скелета с «С» >5 CНΞС-СН 2 -СН 3 бутин-1 СНΞС-СН –СН 3 3 -метилбутин-1 *Положения тройной (кратной) связи СНΞС-СН 2 -СН 3 бутин-1 СН 3 -СΞС-СН 3 бутин-2 *Классов соединений (алкадиены) СНΞС-СН 2 -СН 3 бутин-1 СН 2=СН-СН=СН 2 бутадиен-1, 3 * Пространственной изомерии нет Тухватуллина Румия Захидовна 18 14. 02. 2018
 *Номенклатура * АН → ИН *Выбор главной цепи и начало нумерации определяется тройной связью *Правила составления названий алкинов по международной номенклатуре аналогичны правилам для алкенов. Тухватуллина Румия Захидовна 19 14. 02. 2018
*Номенклатура * АН → ИН *Выбор главной цепи и начало нумерации определяется тройной связью *Правила составления названий алкинов по международной номенклатуре аналогичны правилам для алкенов. Тухватуллина Румия Захидовна 19 14. 02. 2018
 *Физические свойства *С 2 -С 4 -газы, С 5 -С 16 -жидкости, С>17 твердые вещества, растворимость в воде небольшая, но больше чем у алкенов и алканов, р<1 г/ см, Ткип( Н) > Т кип (разв), с увеличением Мr Tкип увеличивается. Тухватуллина Румия Захидовна 20 14. 02. 2018
*Физические свойства *С 2 -С 4 -газы, С 5 -С 16 -жидкости, С>17 твердые вещества, растворимость в воде небольшая, но больше чем у алкенов и алканов, р<1 г/ см, Ткип( Н) > Т кип (разв), с увеличением Мr Tкип увеличивается. Тухватуллина Румия Захидовна 20 14. 02. 2018
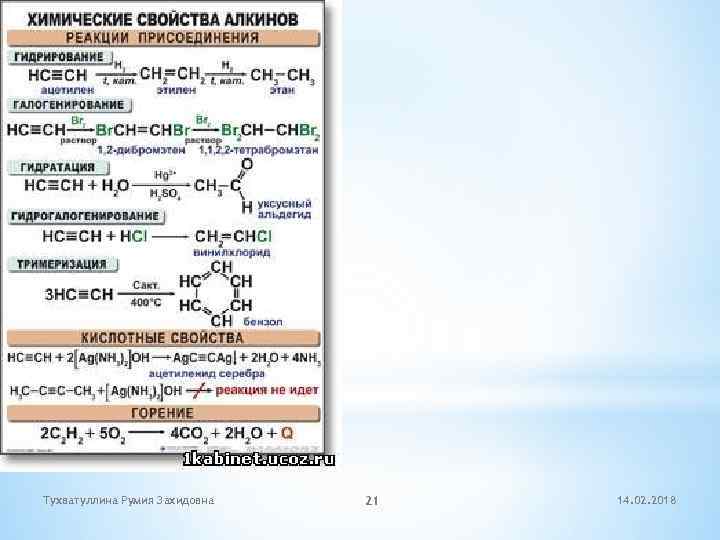 Тухватуллина Румия Захидовна 21 14. 02. 2018
Тухватуллина Румия Захидовна 21 14. 02. 2018
 * Получение алкинов * Пиролиз метана (метановый способ) . В 1868 г. М. Бертло, пропуская через метан электрический разряд, обнаружил в смеси образующихся газов ацетилен. 2 СН 4 →С 2 Н 2 + 3 Н 2 * Дегидрогалогенирование дигалогеналканов В 60 -х гг. XIXв. Молодым русским ученым М. Мясникову и В. Савичу удалось получить ацетилен взаимодействием 1, 2 -дибромэтана с кипящим спиртовым раствором гидроксида калия СН 2 Br-CH 2 Br +KOH (спирт. р-р) →CH 2=CHBr +KBr +H 2 O CH 2=CHBr + KOH (спирт. р-р) →С 2 Н 2 +KBr + H 2 O * Карбидный способ В 1836 г. английский химик Э. Дэви получил бесцветный газ, горящий красноватым коптящим пламенем при действии воды на карбид кальция Ca. C 2 + 2 H 2 O → Ca(OH)2 +C 2 H 2 (ацетилен) Тухватуллина Румия Захидовна 22 14. 02. 2018
* Получение алкинов * Пиролиз метана (метановый способ) . В 1868 г. М. Бертло, пропуская через метан электрический разряд, обнаружил в смеси образующихся газов ацетилен. 2 СН 4 →С 2 Н 2 + 3 Н 2 * Дегидрогалогенирование дигалогеналканов В 60 -х гг. XIXв. Молодым русским ученым М. Мясникову и В. Савичу удалось получить ацетилен взаимодействием 1, 2 -дибромэтана с кипящим спиртовым раствором гидроксида калия СН 2 Br-CH 2 Br +KOH (спирт. р-р) →CH 2=CHBr +KBr +H 2 O CH 2=CHBr + KOH (спирт. р-р) →С 2 Н 2 +KBr + H 2 O * Карбидный способ В 1836 г. английский химик Э. Дэви получил бесцветный газ, горящий красноватым коптящим пламенем при действии воды на карбид кальция Ca. C 2 + 2 H 2 O → Ca(OH)2 +C 2 H 2 (ацетилен) Тухватуллина Румия Захидовна 22 14. 02. 2018
 *Применение ацетилена Свойство Уравнение Применение 1. горение 2 C 2 H 2 + 5 O 2 4 CO 2 + 2 H 2 O + Q t ДО 3000 С Автогенная сварка и резка металлов 2. галогенирование C 2 H 2 + 2 Cl 2 CHCl 2 - CHCl 2 Растворители, получение других производных 3. гидрогалогенирование C 2 H 2 + HCI Для производства поливинилхлорида (кожзаменитель и т. п) 4. гидратация C 2 H 2 + H 2 O Получение уксусного альдегида, уксксной кислоты ( лаки, лекарства и др. ) 5. замещение C 2 H 2 +2 Ag. NO 3+2 NH 4 OH Ag. CΞCAg +2 NH 4 NO 3 +2 H 2 O Ацетилениды – взрывчатые вещества. Тухватуллина Румия Захидовна CH 2=CHCI n. CH 2=CHCI ( -CH 2 -CHCI-)n 23 14. 02. 2018
*Применение ацетилена Свойство Уравнение Применение 1. горение 2 C 2 H 2 + 5 O 2 4 CO 2 + 2 H 2 O + Q t ДО 3000 С Автогенная сварка и резка металлов 2. галогенирование C 2 H 2 + 2 Cl 2 CHCl 2 - CHCl 2 Растворители, получение других производных 3. гидрогалогенирование C 2 H 2 + HCI Для производства поливинилхлорида (кожзаменитель и т. п) 4. гидратация C 2 H 2 + H 2 O Получение уксусного альдегида, уксксной кислоты ( лаки, лекарства и др. ) 5. замещение C 2 H 2 +2 Ag. NO 3+2 NH 4 OH Ag. CΞCAg +2 NH 4 NO 3 +2 H 2 O Ацетилениды – взрывчатые вещества. Тухватуллина Румия Захидовна CH 2=CHCI n. CH 2=CHCI ( -CH 2 -CHCI-)n 23 14. 02. 2018
 Cn. H 2 n иклоалканы Тухватуллина Румия Захидовна 24 14. 02. 2018
Cn. H 2 n иклоалканы Тухватуллина Румия Захидовна 24 14. 02. 2018


