урок 28 Осн_уравн.pptx
- Количество слайдов: 18
 Уравнение состояния го но а льгаз еа ид Урок 27
Уравнение состояния го но а льгаз еа ид Урок 27
 Д. И. Менделеев «Посев научный взойдет для жатвы народной»
Д. И. Менделеев «Посев научный взойдет для жатвы народной»
 Что такое идеальный газ? Назовите условия, при которых газ можно считать идеальным Что называется концентрацией? объясните физический смысл основного уравнения молекулярн окинетическо й теории. Подумай…
Что такое идеальный газ? Назовите условия, при которых газ можно считать идеальным Что называется концентрацией? объясните физический смысл основного уравнения молекулярн окинетическо й теории. Подумай…
 Вопрос - ответ Опорные точки температурной шкалы Цельсия Термоскоп Галилея T = t+273, 15 t = T – 273, 15 0 K = - 273, 15 o. C
Вопрос - ответ Опорные точки температурной шкалы Цельсия Термоскоп Галилея T = t+273, 15 t = T – 273, 15 0 K = - 273, 15 o. C
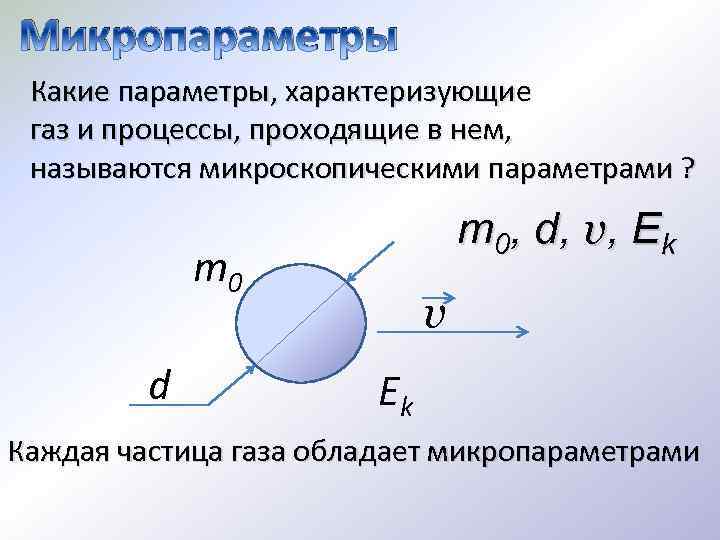 Микропараметры Какие параметры, характеризующие газ и процессы, проходящие в нем, называются микроскопическими параметрами ? m 0, d, v, Ek m 0 d v Ek Каждая частица газа обладает микропараметрами
Микропараметры Какие параметры, характеризующие газ и процессы, проходящие в нем, называются микроскопическими параметрами ? m 0, d, v, Ek m 0 d v Ek Каждая частица газа обладает микропараметрами
 Макропараметры Какие параметры, характеризующие газ, и процессы, проходящие в нем называются макроскопическими параметрами ? Если состояние газа не меняется, то не меняются и эти параметры. ? Назовите макропараметр характеризующие газ P, V, T
Макропараметры Какие параметры, характеризующие газ, и процессы, проходящие в нем называются макроскопическими параметрами ? Если состояние газа не меняется, то не меняются и эти параметры. ? Назовите макропараметр характеризующие газ P, V, T
 Связь абсолютной шкалы и шкалы Цельсия • T = t + 273 • Абсолютная температура – мера средней кинетической энергии молекул. Средняя кинетическая энергия поступательного движения молекул газа пропорциональна абсолютной температуре k –постоянная Больцмана k = 1, 38 * 10 -23 Дж/K P=nk. T
Связь абсолютной шкалы и шкалы Цельсия • T = t + 273 • Абсолютная температура – мера средней кинетической энергии молекул. Средняя кинетическая энергия поступательного движения молекул газа пропорциональна абсолютной температуре k –постоянная Больцмана k = 1, 38 * 10 -23 Дж/K P=nk. T
 Связь макропараметров P V T
Связь макропараметров P V T
 Уравнение Клапейрона Клапейрон Бенуа Поль Эмиль Работы Клапейрона посвящены тепловым процессам. В 1834 он ввел в термодинамику графический метод, представив в геометрической форме рассуждения Карно. В том же году вывел уравнение состояния идеального газа (уравнение Клапейрона), объединяющее закон Бойля – Мариотта, закон Гей. Люссака и закон Авогадро. Это было наиболее простое соотношение, применимое с определенной степенью точности к реальным газам при низких давлениях и высоких температурах (в 1874 оно было обобщено. Менделеевым и теперь известно как уравнение Менделеева – Клапейрона).
Уравнение Клапейрона Клапейрон Бенуа Поль Эмиль Работы Клапейрона посвящены тепловым процессам. В 1834 он ввел в термодинамику графический метод, представив в геометрической форме рассуждения Карно. В том же году вывел уравнение состояния идеального газа (уравнение Клапейрона), объединяющее закон Бойля – Мариотта, закон Гей. Люссака и закон Авогадро. Это было наиболее простое соотношение, применимое с определенной степенью точности к реальным газам при низких давлениях и высоких температурах (в 1874 оно было обобщено. Менделеевым и теперь известно как уравнение Менделеева – Клапейрона).
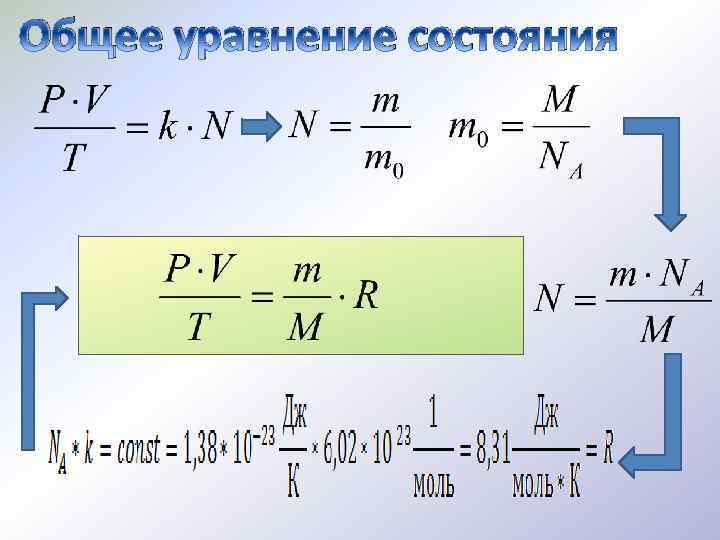 Общее уравнение состояния
Общее уравнение состояния
 Уравнение Менделеева - Клапейрона Менделеев Дмитрий Иванович В 1869– 1871 изложил основы учения о периодичности, открыл периодический закон и разработал периодическую систему химических элементов. Нашел (1874) общее уравнение состояния идеального газа,
Уравнение Менделеева - Клапейрона Менделеев Дмитрий Иванович В 1869– 1871 изложил основы учения о периодичности, открыл периодический закон и разработал периодическую систему химических элементов. Нашел (1874) общее уравнение состояния идеального газа,
 Подумай… Для одного моля идеального газа при нормальных условиях Для произвольного числа моль идеального газа при нормальных условиях
Подумай… Для одного моля идеального газа при нормальных условиях Для произвольного числа моль идеального газа при нормальных условиях
 Подумай… Что называют уравнени ем состояния системы? Чему равна универсальная газовая постоянная в СИ? Как запишется уравнение состояния для одного моля? равен объем одного моля любого газа при нормальн ых условиях?
Подумай… Что называют уравнени ем состояния системы? Чему равна универсальная газовая постоянная в СИ? Как запишется уравнение состояния для одного моля? равен объем одного моля любого газа при нормальн ых условиях?
 Это важно • Уравнение состояния - первое из замечательных обобщений в физике, с помощью которых свойства разных веществ выражаются через одни и те же основные величины. Именно к этому стремиться физика - к нахождению общих законов, не зависящих от тех или иных веществ. Газы, существенно простые по своей природе, дали первый пример такого обобщения.
Это важно • Уравнение состояния - первое из замечательных обобщений в физике, с помощью которых свойства разных веществ выражаются через одни и те же основные величины. Именно к этому стремиться физика - к нахождению общих законов, не зависящих от тех или иных веществ. Газы, существенно простые по своей природе, дали первый пример такого обобщения.
 Решение задач № 1 Как изменится давление газа при уменьшении в 4 раза его объема и увеличении температуры в 1, 5 раза? Решение: P 1 V 1/T 1=P 2 V 2 / T 2; Дано: V 1=4 V 2; T 2=1, 5 T 1; P 2/P 1 = V 1 T 2 / V 2 T 1; Найти: P 2/P 1 -? P 2 / P 1=4∙ 1, 5=6; Ответ: Увеличится в 6 раз;
Решение задач № 1 Как изменится давление газа при уменьшении в 4 раза его объема и увеличении температуры в 1, 5 раза? Решение: P 1 V 1/T 1=P 2 V 2 / T 2; Дано: V 1=4 V 2; T 2=1, 5 T 1; P 2/P 1 = V 1 T 2 / V 2 T 1; Найти: P 2/P 1 -? P 2 / P 1=4∙ 1, 5=6; Ответ: Увеличится в 6 раз;
 Решение задач № 2 В сосуде вместимостью 500 см 3 содержится 0, 89 г водорода при температуре 17 о. С. Определите давление газа. Дано: V=500 см 3 = 500∙ 10 -6 м 3 = 5∙ 10 -4 м 3; m=0, 89 г=8, 9∙ 10 -4 кг; t=17 о. С=290 К; МН 2=2∙ 10 -3 кг/моль Найти: P-? Решение: ; R=8, 31 Дж/моль∙К; P=8, 9∙ 10 -4∙ 8, 31∙ 290 / 2∙ 10 -3∙ 5∙ 10 -4 = 2, 14∙ 106 (Па) = =2, 14 (МПа); Ответ: 2, 14 МПа;
Решение задач № 2 В сосуде вместимостью 500 см 3 содержится 0, 89 г водорода при температуре 17 о. С. Определите давление газа. Дано: V=500 см 3 = 500∙ 10 -6 м 3 = 5∙ 10 -4 м 3; m=0, 89 г=8, 9∙ 10 -4 кг; t=17 о. С=290 К; МН 2=2∙ 10 -3 кг/моль Найти: P-? Решение: ; R=8, 31 Дж/моль∙К; P=8, 9∙ 10 -4∙ 8, 31∙ 290 / 2∙ 10 -3∙ 5∙ 10 -4 = 2, 14∙ 106 (Па) = =2, 14 (МПа); Ответ: 2, 14 МПа;
 Решение задач № 3 В сосуде емкостью 25, 6 л находится 1, 04 кг азота при давлении 3, 5 МПа. Определить температуру газа. Дано: V= 25, 6 л = 25, 6∙ 10 -3 м 3; m=1, 04 кг; Р=3, 5 МПа=3, 5∙ 106 Па; МN 2=28∙ 10 -3 кг/моль Найти: T-? Решение: PV / T=(m / M)∙R; T = PVM / m. R; R=8, 31 Дж/моль∙К; T=3, 5∙ 106∙ 25, 6∙ 10 -3∙ 28∙ 10 -3/1, 04∙ 8, 31= 290 K; Ответ: Т= 290 K или t =17 o. C;
Решение задач № 3 В сосуде емкостью 25, 6 л находится 1, 04 кг азота при давлении 3, 5 МПа. Определить температуру газа. Дано: V= 25, 6 л = 25, 6∙ 10 -3 м 3; m=1, 04 кг; Р=3, 5 МПа=3, 5∙ 106 Па; МN 2=28∙ 10 -3 кг/моль Найти: T-? Решение: PV / T=(m / M)∙R; T = PVM / m. R; R=8, 31 Дж/моль∙К; T=3, 5∙ 106∙ 25, 6∙ 10 -3∙ 28∙ 10 -3/1, 04∙ 8, 31= 290 K; Ответ: Т= 290 K или t =17 o. C;
 Д. И. Менделеев «Посев научный взойдет для жатвы народной»
Д. И. Менделеев «Посев научный взойдет для жатвы народной»


