презентация ХИТ .ppt
- Количество слайдов: 30
 Уравнение Нернста n где R-универсальная газовая постоянная, равная 8. 31 Дж/(моль*K); n T-абсолютная температура; n F-число Фарадея, равное 96500 Кл/моль; n n-число молей электронов, участвующих в процессе.
Уравнение Нернста n где R-универсальная газовая постоянная, равная 8. 31 Дж/(моль*K); n T-абсолютная температура; n F-число Фарадея, равное 96500 Кл/моль; n n-число молей электронов, участвующих в процессе.
 n формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным (ln. N = 2, 303 lg. N), то при T=298 K получим
n формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным (ln. N = 2, 303 lg. N), то при T=298 K получим
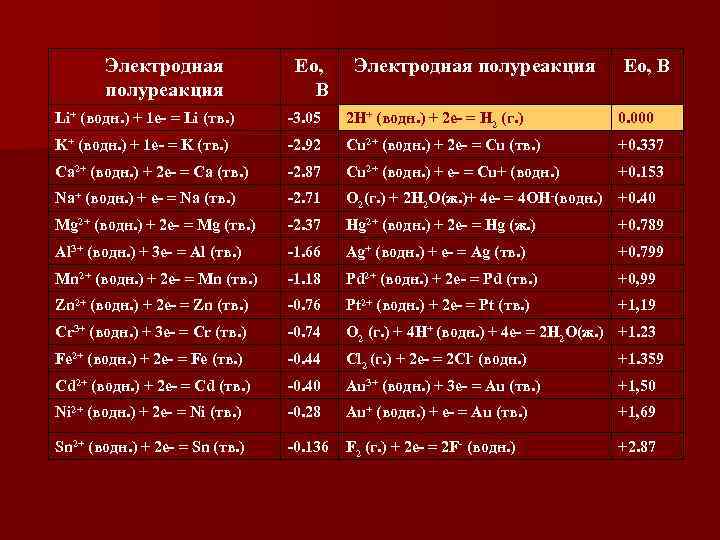 Электродная полуреакция Ео, В Li+ (водн. ) + 1 e- = Li (тв. ) -3. 05 2 H+ (водн. ) + 2 e- = H 2 (г. ) 0. 000 K+ (водн. ) + 1 e- = K (тв. ) -2. 92 Cu 2+ (водн. ) + 2 e- = Сu (тв. ) +0. 337 Ca 2+ (водн. ) + 2 e- = Ca (тв. ) -2. 87 Cu 2+ (водн. ) + e- = Сu+ (водн. ) +0. 153 Na+ (водн. ) + e- = Na (тв. ) -2. 71 O 2(г. ) + 2 H 2 O(ж. )+ 4 e- = 4 OH-(водн. ) +0. 40 Mg 2+ (водн. ) + 2 e- = Mg (тв. ) -2. 37 Hg 2+ (водн. ) + 2 e- = Hg (ж. ) +0. 789 Al 3+ (водн. ) + 3 e- = Al (тв. ) -1. 66 Ag+ (водн. ) + e- = Ag (тв. ) +0. 799 Mn 2+ (водн. ) + 2 e- = Mn (тв. ) -1. 18 Pd 2+ (водн. ) + 2 e- = Pd (тв. ) +0, 99 Zn 2+ (водн. ) + 2 e- = Zn (тв. ) -0. 76 Pt 2+ (водн. ) + 2 e- = Pt (тв. ) +1, 19 Cr 3+ (водн. ) + 3 e- = Cr (тв. ) -0. 74 O 2 (г. ) + 4 H+ (водн. ) + 4 e- = 2 H 2 O(ж. ) +1. 23 Fe 2+ (водн. ) + 2 e- = Fe (тв. ) -0. 44 Cl 2 (г. ) + 2 e- = 2 Cl- (водн. ) +1. 359 Cd 2+ (водн. ) + 2 e- = Cd (тв. ) -0. 40 Au 3+ (водн. ) + 3 e- = Au (тв. ) +1, 50 Ni 2+ (водн. ) + 2 e- = Ni (тв. ) -0. 28 Au+ (водн. ) + e- = Au (тв. ) +1, 69 Sn 2+ (водн. ) + 2 e- = Sn (тв. ) -0. 136 F 2 (г. ) + 2 e- = 2 F- (водн. ) +2. 87
Электродная полуреакция Ео, В Li+ (водн. ) + 1 e- = Li (тв. ) -3. 05 2 H+ (водн. ) + 2 e- = H 2 (г. ) 0. 000 K+ (водн. ) + 1 e- = K (тв. ) -2. 92 Cu 2+ (водн. ) + 2 e- = Сu (тв. ) +0. 337 Ca 2+ (водн. ) + 2 e- = Ca (тв. ) -2. 87 Cu 2+ (водн. ) + e- = Сu+ (водн. ) +0. 153 Na+ (водн. ) + e- = Na (тв. ) -2. 71 O 2(г. ) + 2 H 2 O(ж. )+ 4 e- = 4 OH-(водн. ) +0. 40 Mg 2+ (водн. ) + 2 e- = Mg (тв. ) -2. 37 Hg 2+ (водн. ) + 2 e- = Hg (ж. ) +0. 789 Al 3+ (водн. ) + 3 e- = Al (тв. ) -1. 66 Ag+ (водн. ) + e- = Ag (тв. ) +0. 799 Mn 2+ (водн. ) + 2 e- = Mn (тв. ) -1. 18 Pd 2+ (водн. ) + 2 e- = Pd (тв. ) +0, 99 Zn 2+ (водн. ) + 2 e- = Zn (тв. ) -0. 76 Pt 2+ (водн. ) + 2 e- = Pt (тв. ) +1, 19 Cr 3+ (водн. ) + 3 e- = Cr (тв. ) -0. 74 O 2 (г. ) + 4 H+ (водн. ) + 4 e- = 2 H 2 O(ж. ) +1. 23 Fe 2+ (водн. ) + 2 e- = Fe (тв. ) -0. 44 Cl 2 (г. ) + 2 e- = 2 Cl- (водн. ) +1. 359 Cd 2+ (водн. ) + 2 e- = Cd (тв. ) -0. 40 Au 3+ (водн. ) + 3 e- = Au (тв. ) +1, 50 Ni 2+ (водн. ) + 2 e- = Ni (тв. ) -0. 28 Au+ (водн. ) + e- = Au (тв. ) +1, 69 Sn 2+ (водн. ) + 2 e- = Sn (тв. ) -0. 136 F 2 (г. ) + 2 e- = 2 F- (водн. ) +2. 87
 Задача. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, погруженных в растворы своих солей с концентрацией 0, 1 моль/л.
Задача. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из пластин кадмия и магния, погруженных в растворы своих солей с концентрацией 0, 1 моль/л.
 Решение n Выберем табличное значение стандартного электродного потенциала магния, который равен: Е 0 Mg / Mg 2+ = -2, 37 В и кадмия Е 0 Cd / Cd 2+ = -0, 40 В. n Схема гальванического элемента: -(A) Mg / Mg 2+, 10 -1 моль/л // Cd 2+, 10 -1 моль/л / Cd (K) + , электродные реакции: К: Cd 0 + 2 е → Cd 2+ (восстановление) А: Mg 2+ – 2 е → Mg 0 (окисление). n
Решение n Выберем табличное значение стандартного электродного потенциала магния, который равен: Е 0 Mg / Mg 2+ = -2, 37 В и кадмия Е 0 Cd / Cd 2+ = -0, 40 В. n Схема гальванического элемента: -(A) Mg / Mg 2+, 10 -1 моль/л // Cd 2+, 10 -1 моль/л / Cd (K) + , электродные реакции: К: Cd 0 + 2 е → Cd 2+ (восстановление) А: Mg 2+ – 2 е → Mg 0 (окисление). n
 Классификация ХИТ 1. гальванические элементы (первичные ХИТ), которые изза необратимости протекающих в них реакций, невозможно перезарядить; 2. электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить; 3. топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Классификация ХИТ 1. гальванические элементы (первичные ХИТ), которые изза необратимости протекающих в них реакций, невозможно перезарядить; 2. электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить; 3. топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
 По типу используемого электролита химические источники тока делятся на n кислотные (например свинцово- кислотный аккумулятор, свинцовоплавиковый элемент), n щелочные (например ртутно-кадмиевый элемент, никель-цинковый аккумулятор) , n солевые (например, марганцевомагниевый элемент, цинк-хлорный аккумулятор).
По типу используемого электролита химические источники тока делятся на n кислотные (например свинцово- кислотный аккумулятор, свинцовоплавиковый элемент), n щелочные (например ртутно-кадмиевый элемент, никель-цинковый аккумулятор) , n солевые (например, марганцевомагниевый элемент, цинк-хлорный аккумулятор).
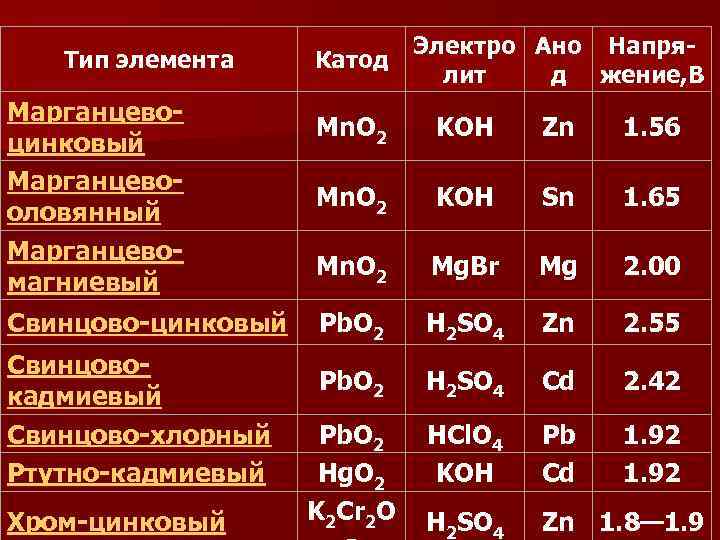 Тип элемента Марганцевоцинковый Марганцевооловянный Марганцевомагниевый Свинцово-цинковый Свинцовокадмиевый Свинцово-хлорный Ртутно-кадмиевый Хром-цинковый Электро Ано Напря. Катод лит д жение, В Mn. O 2 KOH Zn 1. 56 Mn. O 2 KOH Sn 1. 65 Mn. O 2 Mg. Br Mg 2. 00 Pb. O 2 H 2 SO 4 Zn 2. 55 Pb. O 2 H 2 SO 4 Cd 2. 42 Pb. O 2 Hg. O 2 K 2 Cr 2 O HCl. O 4 KOH Pb Cd 1. 92 H 2 SO 4 Zn 1. 8— 1. 9
Тип элемента Марганцевоцинковый Марганцевооловянный Марганцевомагниевый Свинцово-цинковый Свинцовокадмиевый Свинцово-хлорный Ртутно-кадмиевый Хром-цинковый Электро Ано Напря. Катод лит д жение, В Mn. O 2 KOH Zn 1. 56 Mn. O 2 KOH Sn 1. 65 Mn. O 2 Mg. Br Mg 2. 00 Pb. O 2 H 2 SO 4 Zn 2. 55 Pb. O 2 H 2 SO 4 Cd 2. 42 Pb. O 2 Hg. O 2 K 2 Cr 2 O HCl. O 4 KOH Pb Cd 1. 92 H 2 SO 4 Zn 1. 8— 1. 9
 Свинцово-кислотный аккумулятор — наиболее распространенный на сегодняшний день тип аккумуляторов, изобретен в 1859 году французским физиком . Гастоном Планте
Свинцово-кислотный аккумулятор — наиболее распространенный на сегодняшний день тип аккумуляторов, изобретен в 1859 году французским физиком . Гастоном Планте
 Химическая реакция: Катод: Анод: n Принцип действия Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в сернокислотной среде. Во время разряда происходит восстановление диоксида свинца на катоде и окисление свинца на аноде. При заряде протекают обратные реакции, к которым в конце заряда добавляется реакция электролиза воды, сопровождающаяся выделением кислорода на положительном электроде и водорода — на отрицательном.
Химическая реакция: Катод: Анод: n Принцип действия Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в сернокислотной среде. Во время разряда происходит восстановление диоксида свинца на катоде и окисление свинца на аноде. При заряде протекают обратные реакции, к которым в конце заряда добавляется реакция электролиза воды, сопровождающаяся выделением кислорода на положительном электроде и водорода — на отрицательном.
 Устройство n Элемент свинцово-кислого аккумулятора состоит из положительных и отрицательных электродов, сепараторов (разделительных решеток) и электролита. Положительные электроды представляют собой свинцовую решётку, а активным веществом является окись свинца (Pb. O 2). Отрицательные электроды также представляют собой свинцовую решётку, а активным веществом является губчатый свинец (Pb).
Устройство n Элемент свинцово-кислого аккумулятора состоит из положительных и отрицательных электродов, сепараторов (разделительных решеток) и электролита. Положительные электроды представляют собой свинцовую решётку, а активным веществом является окись свинца (Pb. O 2). Отрицательные электроды также представляют собой свинцовую решётку, а активным веществом является губчатый свинец (Pb).
 На практике в свинец решёток добавляют сурьму в количестве 1 -2 % для повышения прочности. Электроды погружены в электролит, состоящий из разбавленной серной кислоты (H 2 SO 4). Наибольшая проводимость этого раствора при комнатной температуре (что означает наименьшее внутреннее сопротивление и наименьшие внутренние потери) достигается при его плотности 1, 26 г/см 3. Однако на практике, часто в районах с холодным климатом применяются и более высокие концентрации серной кислоты, до 1, 29 − 1, 31 г/см 3. (Это делается потому, что при разряде свинцово-кислотного аккумулятора плотность электролита падает, и температура его замерзания, т. о, становится выше, разряженный аккумулятор может не выдержать холода. ) n В новых версиях свинцовые пластины (решетки) заменяют вспененным карбоном, покрытым тонкой свинцовой пленкой, а жидкий электролит может быть желирован силикагелем до пастообразного состояния. n
На практике в свинец решёток добавляют сурьму в количестве 1 -2 % для повышения прочности. Электроды погружены в электролит, состоящий из разбавленной серной кислоты (H 2 SO 4). Наибольшая проводимость этого раствора при комнатной температуре (что означает наименьшее внутреннее сопротивление и наименьшие внутренние потери) достигается при его плотности 1, 26 г/см 3. Однако на практике, часто в районах с холодным климатом применяются и более высокие концентрации серной кислоты, до 1, 29 − 1, 31 г/см 3. (Это делается потому, что при разряде свинцово-кислотного аккумулятора плотность электролита падает, и температура его замерзания, т. о, становится выше, разряженный аккумулятор может не выдержать холода. ) n В новых версиях свинцовые пластины (решетки) заменяют вспененным карбоном, покрытым тонкой свинцовой пленкой, а жидкий электролит может быть желирован силикагелем до пастообразного состояния. n
 n n n Параметры Удельная энергоемкость (Вт·ч/кг): около 3040 Вт·ч/кг. Удельная энергоплотность (Вт·ч/дм³): около 60 -75 Вт·ч/дм³. ЭДС: 2, 1 В. Рабочая температура: от минус 40 до плюс 40
n n n Параметры Удельная энергоемкость (Вт·ч/кг): около 3040 Вт·ч/кг. Удельная энергоплотность (Вт·ч/дм³): около 60 -75 Вт·ч/дм³. ЭДС: 2, 1 В. Рабочая температура: от минус 40 до плюс 40
 Хранение Свинцово-кислотные аккумуляторы необходимо хранить в заряженном состоянии. Хранение аккумуляторов при температуре выше 30 °C не рекомендуется. n Хранение свинцово-кислотных аккумуляторов в разряженном состоянии приводит к быстрой потере ее работоспособности. n
Хранение Свинцово-кислотные аккумуляторы необходимо хранить в заряженном состоянии. Хранение аккумуляторов при температуре выше 30 °C не рекомендуется. n Хранение свинцово-кислотных аккумуляторов в разряженном состоянии приводит к быстрой потере ее работоспособности. n
 Литий-ионный аккумулятор n Литий-ионный аккумулятор (Li-ion) — тип электрического аккумулятора, широко распространённый в современной бытовой электронной технике. В настоящее время это самый популярный тип аккумуляторов в таких устройствах как сотовые телефоны, ноутбуки, цифровые фотоаппараты. Более совершенная конструкция литий-ионного аккумулятора называется литий-полимерным аккумулятором. Первый литий-ионный аккумулятор разработала корпорация Sony в 1991 году.
Литий-ионный аккумулятор n Литий-ионный аккумулятор (Li-ion) — тип электрического аккумулятора, широко распространённый в современной бытовой электронной технике. В настоящее время это самый популярный тип аккумуляторов в таких устройствах как сотовые телефоны, ноутбуки, цифровые фотоаппараты. Более совершенная конструкция литий-ионного аккумулятора называется литий-полимерным аккумулятором. Первый литий-ионный аккумулятор разработала корпорация Sony в 1991 году.
 При заряде литий-ионных аккумуляторов протекают следующие реакции: n на положительных пластинах: Li. Co. O 2 → Li 1 -x. Co. O 2 + x. Li+ + xen на отрицательных пластинах: С + x. Li+ + xe- → CLix n При разряде протекают обратные реакции.
При заряде литий-ионных аккумуляторов протекают следующие реакции: n на положительных пластинах: Li. Co. O 2 → Li 1 -x. Co. O 2 + x. Li+ + xen на отрицательных пластинах: С + x. Li+ + xe- → CLix n При разряде протекают обратные реакции.
 Литий-ионный аккумулятор
Литий-ионный аккумулятор
 Характеристики n Энергетическая плотность: 110. . . 160 Вт. ч / кг Внутреннее сопротивление: 150 . . . 250 м. Ом (для батареи 7, 2 В) Число циклов заряд/разряд до потери ёмкости на 80%: 500 -1000 Время быстрого заряда: 2 -4 часа Допустимый перезаряд: очень низкий Саморазряд при комнатной температуре: 10% в месяц Напряжение в элементе: 3, 6 В n Диапазон рабочих температур: -20 - +60 °С n n n
Характеристики n Энергетическая плотность: 110. . . 160 Вт. ч / кг Внутреннее сопротивление: 150 . . . 250 м. Ом (для батареи 7, 2 В) Число циклов заряд/разряд до потери ёмкости на 80%: 500 -1000 Время быстрого заряда: 2 -4 часа Допустимый перезаряд: очень низкий Саморазряд при комнатной температуре: 10% в месяц Напряжение в элементе: 3, 6 В n Диапазон рабочих температур: -20 - +60 °С n n n
 Недостатки n Li-ion аккумуляторы могут быть опасны при разрушении корпуса аккумулятора, и при неаккуратном обращении могут иметь более короткий жизненный цикл в сравнении с другими типами аккумуляторов. Глубокий разряд полностью выводит из строя литийионный аккумулятор. Попытки заряда таких аккумуляторов могут повлечь за собой взрыв.
Недостатки n Li-ion аккумуляторы могут быть опасны при разрушении корпуса аккумулятора, и при неаккуратном обращении могут иметь более короткий жизненный цикл в сравнении с другими типами аккумуляторов. Глубокий разряд полностью выводит из строя литийионный аккумулятор. Попытки заряда таких аккумуляторов могут повлечь за собой взрыв.
 n Оптимальные условия хранения Li- ion-аккумуляторов достигаются при 70%-ом заряде от ёмкости аккумулятора. n Li-ion аккумулятор подвержен старению (если он не используется: уже через два года аккумулятор теряет большую часть своей ёмкости).
n Оптимальные условия хранения Li- ion-аккумуляторов достигаются при 70%-ом заряде от ёмкости аккумулятора. n Li-ion аккумулятор подвержен старению (если он не используется: уже через два года аккумулятор теряет большую часть своей ёмкости).
 Топливный элемент
Топливный элемент
 n Топливные элементы — это электрохимические устройства, и у них нет такого жёсткого ограничения на КПД, как у тепловых машин . Соответственно, они могут иметь очень высокий коэффициент преобразования химической энергии в электрическую. n Принцип разделения потоков топлива и горючего n Обычно в низкотемпературных топливных элементах используются: водород со стороны анода и кислород на стороне катода (водородный элемент) или метанол и кислород воздуха.
n Топливные элементы — это электрохимические устройства, и у них нет такого жёсткого ограничения на КПД, как у тепловых машин . Соответственно, они могут иметь очень высокий коэффициент преобразования химической энергии в электрическую. n Принцип разделения потоков топлива и горючего n Обычно в низкотемпературных топливных элементах используются: водород со стороны анода и кислород на стороне катода (водородный элемент) или метанол и кислород воздуха.
 На катализаторе анода молекулярный водород диссоциирует и теряет электроны. Протоны проводятся через мембрану к катоду, но электроны отдаются во внешнюю цепь, так как мембрана не пропускает электроны. n На катализаторе катода, молекула кислорода соединяется с электроном (который подводится из внешних коммуникаций) и пришедшим протоном, и образует воду, которая является единственным продуктом реакции (в виде пара и/или жидкости). n
На катализаторе анода молекулярный водород диссоциирует и теряет электроны. Протоны проводятся через мембрану к катоду, но электроны отдаются во внешнюю цепь, так как мембрана не пропускает электроны. n На катализаторе катода, молекула кислорода соединяется с электроном (который подводится из внешних коммуникаций) и пришедшим протоном, и образует воду, которая является единственным продуктом реакции (в виде пара и/или жидкости). n
 Топливные элементы не могут хранить электрическую энергию, как гальванические или аккумуляторные батареи, но для некоторых применений, таких как работающие изолированно от электрической системы электростанции, использующие непостоянные источники энергии (солнце, ветер), они совместно с электролизерами и емкостями для хранения топлива (напр. водорода), образуют устройство для хранения энергии. Общий КПД такой установки (преобразование электрической энергии в водород, и обратно в электрическую энергию) 30 -40 %. n Мембрана обеспечивает проводимость протонов, но не электронов. Она может быть полимерной (Нафион, полиацетилен и др. ) или керамической (оксидной и др. ). n
Топливные элементы не могут хранить электрическую энергию, как гальванические или аккумуляторные батареи, но для некоторых применений, таких как работающие изолированно от электрической системы электростанции, использующие непостоянные источники энергии (солнце, ветер), они совместно с электролизерами и емкостями для хранения топлива (напр. водорода), образуют устройство для хранения энергии. Общий КПД такой установки (преобразование электрической энергии в водород, и обратно в электрическую энергию) 30 -40 %. n Мембрана обеспечивает проводимость протонов, но не электронов. Она может быть полимерной (Нафион, полиацетилен и др. ) или керамической (оксидной и др. ). n
 Топливный элемент
Топливный элемент
 Преимущества водородных топливных элементов Высокий КПД n Экологичность n Компактные размеры n Топливные элементы легче и занимают меньший размер, чем традиционные источники питания. Топливные элементы производят меньше шума, меньше нагреваются, более эффективны с точки зрения потребления топлива. Это становится особенно актуальным в военных приложениях. n Проблемы топливных элементов
Преимущества водородных топливных элементов Высокий КПД n Экологичность n Компактные размеры n Топливные элементы легче и занимают меньший размер, чем традиционные источники питания. Топливные элементы производят меньше шума, меньше нагреваются, более эффективны с точки зрения потребления топлива. Это становится особенно актуальным в военных приложениях. n Проблемы топливных элементов
 Большинство элементов при работе выделяют то или иное количество тепла. Это требует создания сложных технических устройств для утилизации тепла (паровые турбины и пр. ), а также организации потоков топлива и окислителя, систем управления отбираемой мощностью, долговечности мембран, отравления катализаторов некоторыми побочными продуктами окисления топлива и других задач. Но при этом же высокая температура процесса позволяет производить тепловую энергию, что существенно увеличивает КПД энергетической установки. n Также существует проблема получения водорода и хранения водорода. Во-первых, он должен быть достаточно чистый, чтобы не произошло быстрого отравления катализатора, во-вторых, достаточно дешёвый, чтобы его стоимость была рентабельна для конечного потребителя. n
Большинство элементов при работе выделяют то или иное количество тепла. Это требует создания сложных технических устройств для утилизации тепла (паровые турбины и пр. ), а также организации потоков топлива и окислителя, систем управления отбираемой мощностью, долговечности мембран, отравления катализаторов некоторыми побочными продуктами окисления топлива и других задач. Но при этом же высокая температура процесса позволяет производить тепловую энергию, что существенно увеличивает КПД энергетической установки. n Также существует проблема получения водорода и хранения водорода. Во-первых, он должен быть достаточно чистый, чтобы не произошло быстрого отравления катализатора, во-вторых, достаточно дешёвый, чтобы его стоимость была рентабельна для конечного потребителя. n
 n Существует множество способов производства водорода, но в настоящее время около 50% водорода, производимого во всём мире, получают из природного газа. Все остальные способы пока дорогостоящи. . Существует мнение, что с ростом цен на энергоносители стоимость водорода также растёт, т. к. он является вторичным энергоносителем. Но себестоимость энергии, производимой из возобновляемых источников, постоянно снижается. К сожалению, в водороде, произведённом из природного газа, будет присутствовать СО, отравляющий катализатор. Поэтому для уменьшения отравления катализатора необходимо повысить температуру топливного элемента. Уже при температуре 160°С в топливе может присутствовать 1%СО.
n Существует множество способов производства водорода, но в настоящее время около 50% водорода, производимого во всём мире, получают из природного газа. Все остальные способы пока дорогостоящи. . Существует мнение, что с ростом цен на энергоносители стоимость водорода также растёт, т. к. он является вторичным энергоносителем. Но себестоимость энергии, производимой из возобновляемых источников, постоянно снижается. К сожалению, в водороде, произведённом из природного газа, будет присутствовать СО, отравляющий катализатор. Поэтому для уменьшения отравления катализатора необходимо повысить температуру топливного элемента. Уже при температуре 160°С в топливе может присутствовать 1%СО.
 Применение топливных элементов n n n n n Стационарные приложения производство электрической энергии (на электрических станциях), аварийные источники энергии, автономное электроснабжение, Транспорт электромобили, автотранспорт, морской транспорт, железнодорожный транспорт, горная и шахтная техника вспомогательный транспорт (складские погрузчики, аэродромная техника и т. д. )
Применение топливных элементов n n n n n Стационарные приложения производство электрической энергии (на электрических станциях), аварийные источники энергии, автономное электроснабжение, Транспорт электромобили, автотранспорт, морской транспорт, железнодорожный транспорт, горная и шахтная техника вспомогательный транспорт (складские погрузчики, аэродромная техника и т. д. )
 n n n Бортовое питание авиация, космос, подводные лодки, морской транспорт, n n Мобильные устройства портативная электроника, питание сотовых телефонов, зарядные устройства для армии
n n n Бортовое питание авиация, космос, подводные лодки, морской транспорт, n n Мобильные устройства портативная электроника, питание сотовых телефонов, зарядные устройства для армии


