Сварочное производство_13_Физхимия.pptx
- Количество слайдов: 28
 Ур. ФУ Кафедра Технологии сварочного производства Расчеты металлургических процессов при сварке необходимы для прогнозирования состава и свойств сварных соединений Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Расчеты металлургических процессов при сварке необходимы для прогнозирования состава и свойств сварных соединений Физико-химические расчеты
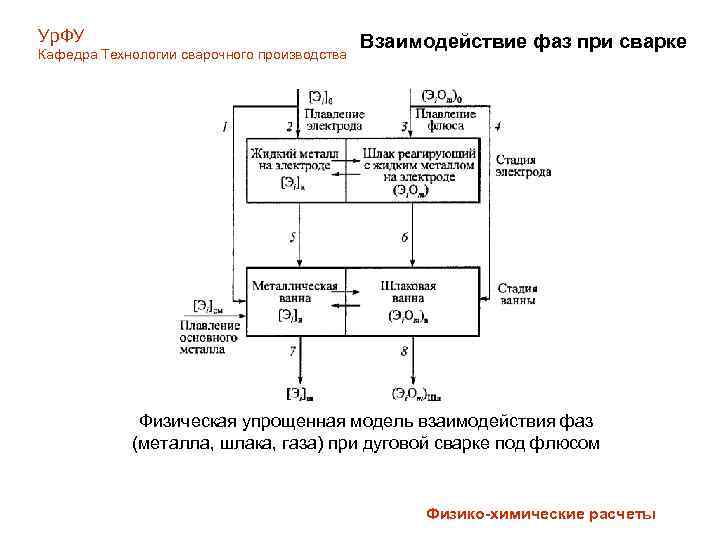 Ур. ФУ Кафедра Технологии сварочного производства Взаимодействие фаз при сварке Физическая упрощенная модель взаимодействия фаз (металла, шлака, газа) при дуговой сварке под флюсом Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Взаимодействие фаз при сварке Физическая упрощенная модель взаимодействия фаз (металла, шлака, газа) при дуговой сварке под флюсом Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Состав металла шва зависит от химических реакций между фазами: металлом, шлаком и газом. Обычно равновесие между фазами установиться не успевает. Однако, высокие температуры, развитая поверхность взаимодействия и специфические гидродинамические условия приводят к тому, что иногда концентрации реагентов оказываются достаточно близкими к равновесным. Термодинамические расчеты полезны для оценки направления протекания реакций и степени отклонения их от равновесия Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Состав металла шва зависит от химических реакций между фазами: металлом, шлаком и газом. Обычно равновесие между фазами установиться не успевает. Однако, высокие температуры, развитая поверхность взаимодействия и специфические гидродинамические условия приводят к тому, что иногда концентрации реагентов оказываются достаточно близкими к равновесным. Термодинамические расчеты полезны для оценки направления протекания реакций и степени отклонения их от равновесия Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ уравнение изотермы химической реакции: GТ = RT (ln. Пai – ln. KP), где GТ – изменение энергии Гиббса, Дж/моль; R – универсальная газовая постоянная, равная 8, 31 Дж/(К моль); Т – температура, К; Пai – произведение активностей (концентраций) компонентов при заданных условиях; КР – константа равновесия реакции (соотношение равновесных концентраций) при заданной температуре. Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ уравнение изотермы химической реакции: GТ = RT (ln. Пai – ln. KP), где GТ – изменение энергии Гиббса, Дж/моль; R – универсальная газовая постоянная, равная 8, 31 Дж/(К моль); Т – температура, К; Пai – произведение активностей (концентраций) компонентов при заданных условиях; КР – константа равновесия реакции (соотношение равновесных концентраций) при заданной температуре. Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Расчет константы равновесия реакции Основным уравнением для вычисления константы равновесия является следующее: где Н 0 Т, S 0 Т – изменение в реакции стандартных энтальпии и энтропии при данной температуре Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Расчет константы равновесия реакции Основным уравнением для вычисления константы равновесия является следующее: где Н 0 Т, S 0 Т – изменение в реакции стандартных энтальпии и энтропии при данной температуре Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Расчет константы равновесия реакции При условии, что: v в исследуемом температурном интервале отсутствуют фазовые переходы; v начальная температура в системе равна 298 К (25⁰С); v зависимость теплоемкости от температуры определяется уравнением СР = а + b. T + c T 2 Имеем: Н 0 Т = Н 0298 + а (Т – 298) + b (Т 2 – 2982)/2 – с (1/Т – 1/298) S 0 Т = S 0298 + а ln(T/298) + b (Т – 298) – 2 с (1/T 2 – 1/2982) Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Расчет константы равновесия реакции При условии, что: v в исследуемом температурном интервале отсутствуют фазовые переходы; v начальная температура в системе равна 298 К (25⁰С); v зависимость теплоемкости от температуры определяется уравнением СР = а + b. T + c T 2 Имеем: Н 0 Т = Н 0298 + а (Т – 298) + b (Т 2 – 2982)/2 – с (1/Т – 1/298) S 0 Т = S 0298 + а ln(T/298) + b (Т – 298) – 2 с (1/T 2 – 1/2982) Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Расчет константы равновесия реакции При отсутствии температурной зависимости теплоемкости температуры можно использовать уравнение Улиха: G 0 Т от = Н 0298 – Т S 0298 – СР 298 Т (ln. T/298 + 298/T – 1) Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Расчет константы равновесия реакции При отсутствии температурной зависимости теплоемкости температуры можно использовать уравнение Улиха: G 0 Т от = Н 0298 – Т S 0298 – СР 298 Т (ln. T/298 + 298/T – 1) Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Расчет активностей компонентов в металле Связь активности с концентрацией компонента в растворе устанавливается через коэффициент активности: где i – коэффициент активности; Ni – мольная (атомная) доля; [i] – массовая концентрация; Мi – молекулярная (атомная) масса компонента i Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Расчет активностей компонентов в металле Связь активности с концентрацией компонента в растворе устанавливается через коэффициент активности: где i – коэффициент активности; Ni – мольная (атомная) доля; [i] – массовая концентрация; Мi – молекулярная (атомная) масса компонента i Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Расчет активностей компонентов в металле Для определения коэффициента активности компонента в многокомпонентном расплаве, учитывающего влияние других компонентов часто применяют метод с применением параметров взаимодействия Вагнера Для стандартного состояния (1 мас. % компонента i в бинарном растворе) выражение для расчета коэффициента активности имеет вид где γi – коэффициент активности компонента i в многокомпонентном растворе; eji и rji – коэффициенты взаимодействия первого и второго порядка; [j] – массовая концентрация компонента в %% Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Расчет активностей компонентов в металле Для определения коэффициента активности компонента в многокомпонентном расплаве, учитывающего влияние других компонентов часто применяют метод с применением параметров взаимодействия Вагнера Для стандартного состояния (1 мас. % компонента i в бинарном растворе) выражение для расчета коэффициента активности имеет вид где γi – коэффициент активности компонента i в многокомпонентном растворе; eji и rji – коэффициенты взаимодействия первого и второго порядка; [j] – массовая концентрация компонента в %% Физико-химические расчеты
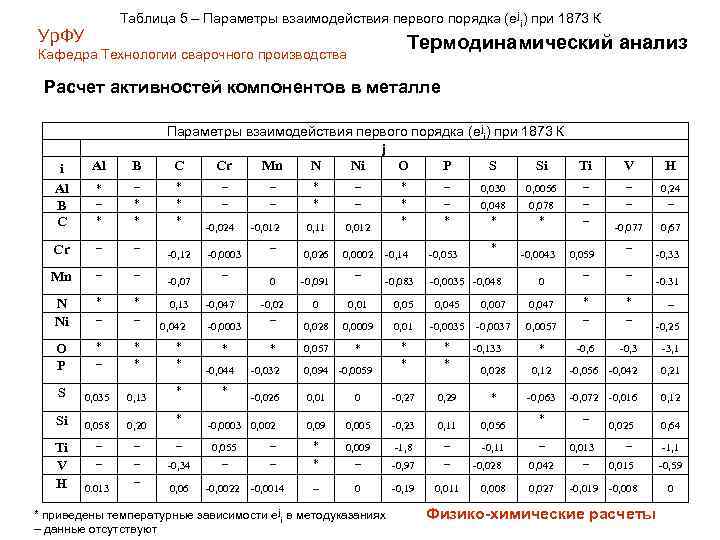 Таблица 5 – Параметры взаимодействия первого порядка (еji) при 1873 К Ур. ФУ Термодинамический анализ Кафедра Технологии сварочного производства Расчет активностей компонентов в металле Параметры взаимодействия первого порядка (еji) при 1873 К j C Cr Mn N Ni O P S Si i Al B C Al B * – – * – 0, 030 * * – – * – * * * 0, 11 0, 012 * * 0, 048 * Cr – – 0, 026 0, 0002 Mn – – N Ni * * – – O P * * * – * * S 0, 035 0, 13 Si 0, 058 0, 20 – – – -0, 34 0, 055 – 0, 06 -0, 0022 Ti V Н 0. 013 – -0, 12 -0, 07 0, 13 0, 042 * * -0, 024 -0, 0003 – -0, 047 -0, 0003 * -0, 044 * -0, 012 – – * -0, 14 -0, 053 -0, 083 -0, 0035 -0, 048 Ti V Н 0, 0056 – – 0, 078 * – – 0, 24 – -0, 077 0, 67 -0, 0043 0 -0, 091 -0, 02 – 0 0, 01 0, 05 0, 045 0, 007 0, 047 0, 028 0, 0009 0, 01 -0, 0035 -0, 0037 0, 0057 0, 057 * * * -0, 032 0, 094 -0, 0059 -0, 026 0, 01 0 -0, 27 0, 09 0, 005 – * 0, 009 – – 0 -0, 0003 0, 002 -0, 0014 * приведены температурные зависимости еji в методуказаниях – данные отсутствуют -0, 133 0 * – 0, 059 – -0, 33 – – * * – – -0, 6 -0, 3 -3, 1 -0. 31 – -0, 25 0, 028 0, 12 -0, 056 -0, 042 0, 21 0, 29 * -0, 063 -0, 072 -0, 016 0, 12 -0, 23 0, 11 0, 056 -1, 8 – -0, 11 -0, 97 – -0, 19 0, 011 -0, 028 0, 008 * – – 0, 025 0, 64 – -1, 1 0, 015 -0, 59 0, 042 0, 013 – 0, 027 -0, 019 -0, 008 Физико-химические расчеты 0
Таблица 5 – Параметры взаимодействия первого порядка (еji) при 1873 К Ур. ФУ Термодинамический анализ Кафедра Технологии сварочного производства Расчет активностей компонентов в металле Параметры взаимодействия первого порядка (еji) при 1873 К j C Cr Mn N Ni O P S Si i Al B C Al B * – – * – 0, 030 * * – – * – * * * 0, 11 0, 012 * * 0, 048 * Cr – – 0, 026 0, 0002 Mn – – N Ni * * – – O P * * * – * * S 0, 035 0, 13 Si 0, 058 0, 20 – – – -0, 34 0, 055 – 0, 06 -0, 0022 Ti V Н 0. 013 – -0, 12 -0, 07 0, 13 0, 042 * * -0, 024 -0, 0003 – -0, 047 -0, 0003 * -0, 044 * -0, 012 – – * -0, 14 -0, 053 -0, 083 -0, 0035 -0, 048 Ti V Н 0, 0056 – – 0, 078 * – – 0, 24 – -0, 077 0, 67 -0, 0043 0 -0, 091 -0, 02 – 0 0, 01 0, 05 0, 045 0, 007 0, 047 0, 028 0, 0009 0, 01 -0, 0035 -0, 0037 0, 0057 0, 057 * * * -0, 032 0, 094 -0, 0059 -0, 026 0, 01 0 -0, 27 0, 09 0, 005 – * 0, 009 – – 0 -0, 0003 0, 002 -0, 0014 * приведены температурные зависимости еji в методуказаниях – данные отсутствуют -0, 133 0 * – 0, 059 – -0, 33 – – * * – – -0, 6 -0, 3 -3, 1 -0. 31 – -0, 25 0, 028 0, 12 -0, 056 -0, 042 0, 21 0, 29 * -0, 063 -0, 072 -0, 016 0, 12 -0, 23 0, 11 0, 056 -1, 8 – -0, 11 -0, 97 – -0, 19 0, 011 -0, 028 0, 008 * – – 0, 025 0, 64 – -1, 1 0, 015 -0, 59 0, 042 0, 013 – 0, 027 -0, 019 -0, 008 Физико-химические расчеты 0
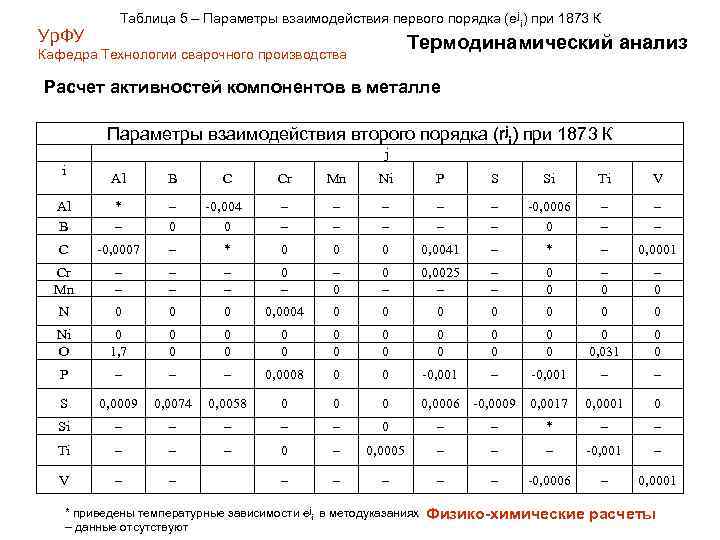 Ур. ФУ Таблица 5 – Параметры взаимодействия первого порядка (еji) при 1873 К Термодинамический анализ Кафедра Технологии сварочного производства Расчет активностей компонентов в металле Параметры взаимодействия второго порядка (rji) при 1873 К j i Al B C Cr Mn Ni P S Si Ti V Al B * – – 0 -0, 004 0 – – – – – -0, 0006 0 – – C -0, 0007 – * 0 0, 0041 – * – 0, 0001 Cr Mn – – – 0 0 – 0, 0025 – – – 0 0 – 0 N 0 0, 0004 0 0 0 0 Ni O 0 1, 7 0 0 0 0 0, 031 0 0 P – – – 0, 0008 0 0 -0, 001 – – S 0, 0009 0, 0074 0, 0058 0 0, 0006 -0, 0009 0, 0017 0, 0001 0 Si – – – 0 – – * – – Ti – – – 0, 0005 – – – -0, 001 – V – – – – -0, 0006 – 0, 0001 * приведены температурные зависимости еji в методуказаниях – данные отсутствуют Физико-химические расчеты
Ур. ФУ Таблица 5 – Параметры взаимодействия первого порядка (еji) при 1873 К Термодинамический анализ Кафедра Технологии сварочного производства Расчет активностей компонентов в металле Параметры взаимодействия второго порядка (rji) при 1873 К j i Al B C Cr Mn Ni P S Si Ti V Al B * – – 0 -0, 004 0 – – – – – -0, 0006 0 – – C -0, 0007 – * 0 0, 0041 – * – 0, 0001 Cr Mn – – – 0 0 – 0, 0025 – – – 0 0 – 0 N 0 0, 0004 0 0 0 0 Ni O 0 1, 7 0 0 0 0 0, 031 0 0 P – – – 0, 0008 0 0 -0, 001 – – S 0, 0009 0, 0074 0, 0058 0 0, 0006 -0, 0009 0, 0017 0, 0001 0 Si – – – 0 – – * – – Ti – – – 0, 0005 – – – -0, 001 – V – – – – -0, 0006 – 0, 0001 * приведены температурные зависимости еji в методуказаниях – данные отсутствуют Физико-химические расчеты
 Ур. ФУ Таблица 5 – Параметры взаимодействия первого порядка (еji) при 1873 К Кафедра Технологии сварочного производства Термодинамический анализ Расчет активностей компонентов в металле * приведены температурные зависимости еji в методуказаниях – данные отсутствуют Физико-химические расчеты
Ур. ФУ Таблица 5 – Параметры взаимодействия первого порядка (еji) при 1873 К Кафедра Технологии сварочного производства Термодинамический анализ Расчет активностей компонентов в металле * приведены температурные зависимости еji в методуказаниях – данные отсутствуют Физико-химические расчеты
 Ур. ФУ Таблица 5 – Параметры взаимодействия первого порядка (еji) при 1873 К Кафедра Технологии сварочного производства Термодинамический анализ Расчет активностей компонентов в шлаке Для шлака произвольного состава выражение для коэффициента активности компонента i Здесь х – ионные доли компонентов; Q – энергии смешения, Дж/моль. Необходимо иметь в виду, что Qii = 0 * приведены температурные зависимости еji в методуказаниях – данные отсутствуют Физико-химические расчеты
Ур. ФУ Таблица 5 – Параметры взаимодействия первого порядка (еji) при 1873 К Кафедра Технологии сварочного производства Термодинамический анализ Расчет активностей компонентов в шлаке Для шлака произвольного состава выражение для коэффициента активности компонента i Здесь х – ионные доли компонентов; Q – энергии смешения, Дж/моль. Необходимо иметь в виду, что Qii = 0 * приведены температурные зависимости еji в методуказаниях – данные отсутствуют Физико-химические расчеты
 Ур. ФУ Таблица 5 – Параметры взаимодействия первого порядка (еji) при 1873 К Кафедра Технологии сварочного производства Термодинамический анализ Расчет активностей компонентов в шлаке Ионные доли компонентов где: (i) – содержание i компонента в шлаке, мас. %; i – число катионов в молекуле компонента (положительных ионов), Mi – молекулярная масса компонента Активность компонента * приведены температурные зависимости еji в методуказаниях – данные отсутствуют Физико-химические расчеты
Ур. ФУ Таблица 5 – Параметры взаимодействия первого порядка (еji) при 1873 К Кафедра Технологии сварочного производства Термодинамический анализ Расчет активностей компонентов в шлаке Ионные доли компонентов где: (i) – содержание i компонента в шлаке, мас. %; i – число катионов в молекуле компонента (положительных ионов), Mi – молекулярная масса компонента Активность компонента * приведены температурные зависимости еji в методуказаниях – данные отсутствуют Физико-химические расчеты
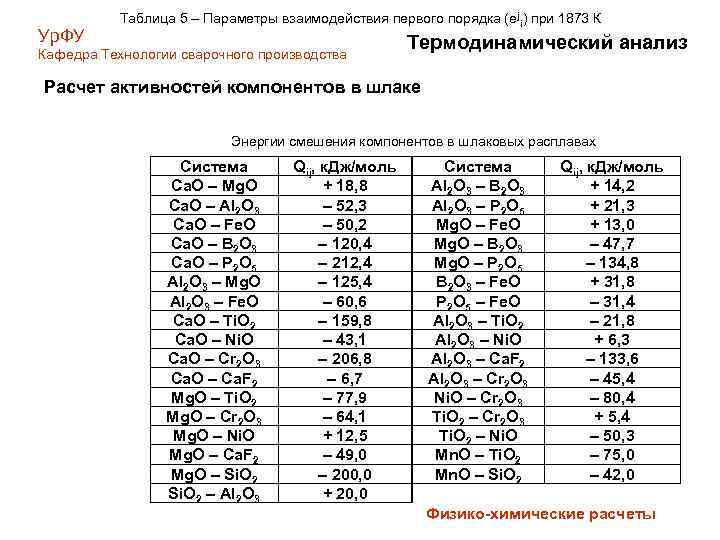 Ур. ФУ Таблица 5 – Параметры взаимодействия первого порядка (еji) при 1873 К Кафедра Технологии сварочного производства Термодинамический анализ Расчет активностей компонентов в шлаке Энергии смешения компонентов в шлаковых расплавах Система Ca. O – Mg. O Ca. O – Al 2 O 3 Ca. O – Fe. O Ca. O – B 2 O 3 Ca. O – P 2 O 5 Al 2 O 3 – Mg. O Al 2 O 3 – Fe. O Ca. O – Ti. O 2 Ca. O – Ni. O Ca. O – Cr 2 O 3 Ca. O – Ca. F 2 Mg. O – Ti. O 2 Mg. O – Cr 2 O 3 Mg. O – Ni. O Mg. O – Ca. F 2 Mg. O – Si. O 2 – Al 2 O 3 Qij, к. Дж/моль + 18, 8 – 52, 3 – 50, 2 – 120, 4 – 212, 4 – 125, 4 – 60, 6 – 159, 8 – 43, 1 – 206, 8 – 6, 7 – 77, 9 – 64, 1 + 12, 5 – 49, 0 – 200, 0 + 20, 0 Система Al 2 O 3 – B 2 O 3 Al 2 O 3 – P 2 O 5 Mg. O – Fe. O Mg. O – B 2 O 3 Mg. O – P 2 O 5 B 2 O 3 – Fe. O P 2 O 5 – Fe. O Al 2 O 3 – Ti. O 2 Al 2 O 3 – Ni. O Al 2 O 3 – Ca. F 2 Al 2 O 3 – Cr 2 O 3 Ni. O – Cr 2 O 3 Ti. O 2 – Ni. O Mn. O – Ti. O 2 Mn. O – Si. O 2 Qij, к. Дж/моль + 14, 2 + 21, 3 + 13, 0 – 47, 7 – 134, 8 + 31, 8 – 31, 4 – 21, 8 + 6, 3 – 133, 6 – 45, 4 – 80, 4 + 5, 4 – 50, 3 – 75, 0 – 42, 0 Физико-химические расчеты
Ур. ФУ Таблица 5 – Параметры взаимодействия первого порядка (еji) при 1873 К Кафедра Технологии сварочного производства Термодинамический анализ Расчет активностей компонентов в шлаке Энергии смешения компонентов в шлаковых расплавах Система Ca. O – Mg. O Ca. O – Al 2 O 3 Ca. O – Fe. O Ca. O – B 2 O 3 Ca. O – P 2 O 5 Al 2 O 3 – Mg. O Al 2 O 3 – Fe. O Ca. O – Ti. O 2 Ca. O – Ni. O Ca. O – Cr 2 O 3 Ca. O – Ca. F 2 Mg. O – Ti. O 2 Mg. O – Cr 2 O 3 Mg. O – Ni. O Mg. O – Ca. F 2 Mg. O – Si. O 2 – Al 2 O 3 Qij, к. Дж/моль + 18, 8 – 52, 3 – 50, 2 – 120, 4 – 212, 4 – 125, 4 – 60, 6 – 159, 8 – 43, 1 – 206, 8 – 6, 7 – 77, 9 – 64, 1 + 12, 5 – 49, 0 – 200, 0 + 20, 0 Система Al 2 O 3 – B 2 O 3 Al 2 O 3 – P 2 O 5 Mg. O – Fe. O Mg. O – B 2 O 3 Mg. O – P 2 O 5 B 2 O 3 – Fe. O P 2 O 5 – Fe. O Al 2 O 3 – Ti. O 2 Al 2 O 3 – Ni. O Al 2 O 3 – Ca. F 2 Al 2 O 3 – Cr 2 O 3 Ni. O – Cr 2 O 3 Ti. O 2 – Ni. O Mn. O – Ti. O 2 Mn. O – Si. O 2 Qij, к. Дж/моль + 14, 2 + 21, 3 + 13, 0 – 47, 7 – 134, 8 + 31, 8 – 31, 4 – 21, 8 + 6, 3 – 133, 6 – 45, 4 – 80, 4 + 5, 4 – 50, 3 – 75, 0 – 42, 0 Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Определение равновесных концентраций компонентов Равновесные концентрации реагентов для заданной реакции при определенной температуре можно найти, используя выражение для константы равновесия Сложность выполнения расчета в основном определяется записью константы равновесия. Выражения для Кр наиболее распространенных реакций, протекающих при сварке сталей, приведены в табл. 8 методических указаний к КП по ТСП Например: [C] + 2[O] = {CO 2} [Fe] + [O] = (Fe. O) ½[Si] + (Fe. O) = [Fe] + ½(Si. O 2) [Mn] + (Fe. O) = [Fe] + (Mn. O) Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Определение равновесных концентраций компонентов Равновесные концентрации реагентов для заданной реакции при определенной температуре можно найти, используя выражение для константы равновесия Сложность выполнения расчета в основном определяется записью константы равновесия. Выражения для Кр наиболее распространенных реакций, протекающих при сварке сталей, приведены в табл. 8 методических указаний к КП по ТСП Например: [C] + 2[O] = {CO 2} [Fe] + [O] = (Fe. O) ½[Si] + (Fe. O) = [Fe] + ½(Si. O 2) [Mn] + (Fe. O) = [Fe] + (Mn. O) Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Определение равновесных концентраций компонентов Пример: определить равновесную с углеродом концентрацию кислорода в жидкой стали 18 Х 2 Н 4 А (Состав стали (мас. %): 0, 18 С, 2 Cr, 4 Ni) при Р = 1 атм и Т = 1873 К. Концентрации всех компонентов стали считать постоянными [C] + [O] = {CO} Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Определение равновесных концентраций компонентов Пример: определить равновесную с углеродом концентрацию кислорода в жидкой стали 18 Х 2 Н 4 А (Состав стали (мас. %): 0, 18 С, 2 Cr, 4 Ni) при Р = 1 атм и Т = 1873 К. Концентрации всех компонентов стали считать постоянными [C] + [O] = {CO} Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Определение равновесных концентраций компонентов е. Сr. С = -0, 024; е. Ni. С = 0, 012; е. OС = -0, 34; е. СO = -0, 42; е. Сr. O = -0, 046; е. Ni. O = 0, 006; е. OO = -0, 174. Lg(γC ) = 0, 14 0, 18 – 0, 024 2 + 0, 012 4 = 0, 025 γ C = 1, 06 Lg(γ O ) = – 0, 42 0, 18 – 0, 046 2 + 0, 006 4 = – 0. 144 γ O = 0, 72 Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Определение равновесных концентраций компонентов е. Сr. С = -0, 024; е. Ni. С = 0, 012; е. OС = -0, 34; е. СO = -0, 42; е. Сr. O = -0, 046; е. Ni. O = 0, 006; е. OO = -0, 174. Lg(γC ) = 0, 14 0, 18 – 0, 024 2 + 0, 012 4 = 0, 025 γ C = 1, 06 Lg(γ O ) = – 0, 42 0, 18 – 0, 046 2 + 0, 006 4 = – 0. 144 γ O = 0, 72 Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Определение равновесных концентраций компонентов Равновесная концентрация кислорода Уточнение результата - учет влияния найденной концентрации [O] на коэффициенты активности C и O путем введения в уравнения соответствующих слагаемых Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Определение равновесных концентраций компонентов Равновесная концентрация кислорода Уточнение результата - учет влияния найденной концентрации [O] на коэффициенты активности C и O путем введения в уравнения соответствующих слагаемых Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Определение равновесных концентраций компонентов Практический интерес представляет задача определения равновесных концентраций при заданных исходных составах и количествах металла и шлака (флюса). Здесь, в дополнение к уравнению для константы равновесия, необходимо составить уравнения материальных балансов элементов Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Определение равновесных концентраций компонентов Практический интерес представляет задача определения равновесных концентраций при заданных исходных составах и количествах металла и шлака (флюса). Здесь, в дополнение к уравнению для константы равновесия, необходимо составить уравнения материальных балансов элементов Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Определение равновесных концентраций компонентов Пример: найти равновесное содержание марганца в сплаве (99 Fe; 1 Мn) после взаимодействия его с флюсом ФЦ-9 (40 Mn. O, 1 Fe. O) при температуре 1700 0 С. Отношение массы шлака к массе металла равно 0, 5. Из условия сохранения количества марганца в системе металл-шлак и для реакции: Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Определение равновесных концентраций компонентов Пример: найти равновесное содержание марганца в сплаве (99 Fe; 1 Мn) после взаимодействия его с флюсом ФЦ-9 (40 Mn. O, 1 Fe. O) при температуре 1700 0 С. Отношение массы шлака к массе металла равно 0, 5. Из условия сохранения количества марганца в системе металл-шлак и для реакции: Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Определение равновесных концентраций компонентов Пример: найти равновесное содержание марганца в сплаве (99 Fe; 1 Мn) после взаимодействия его с флюсом ФЦ-9 (40 Mn. O; 1, 0 Fe. O) при температуре 1700 0 С. Отношение массы шлака к массе металла равно 0, 5. Константа равновесия [Mn] ≈ 2, 3 мас. %, (Mn. O) ≈ 36, 7 мас. %, (Fe. O) ≈ 4, 4 мас. %. Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Определение равновесных концентраций компонентов Пример: найти равновесное содержание марганца в сплаве (99 Fe; 1 Мn) после взаимодействия его с флюсом ФЦ-9 (40 Mn. O; 1, 0 Fe. O) при температуре 1700 0 С. Отношение массы шлака к массе металла равно 0, 5. Константа равновесия [Mn] ≈ 2, 3 мас. %, (Mn. O) ≈ 36, 7 мас. %, (Fe. O) ≈ 4, 4 мас. %. Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Оценка основности шлака (флюса) и его окислительной способности Основность шлака (В) определяется по соотношению концентрации основных и кислых оксидов в нем. Флюсы классифицируются по значению величины В: - В >1 – основные; - В < 1 – кислые; - В 1 – нейтральные Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Оценка основности шлака (флюса) и его окислительной способности Основность шлака (В) определяется по соотношению концентрации основных и кислых оксидов в нем. Флюсы классифицируются по значению величины В: - В >1 – основные; - В < 1 – кислые; - В 1 – нейтральные Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Оценка основности шлака (флюса) и его окислительной способности Формула Международного института сварки: Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Оценка основности шлака (флюса) и его окислительной способности Формула Международного института сварки: Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Оценка основности шлака (флюса) и его окислительной способности Способ Н. Н. Потапова: По АФ сварочные флюсы разделены на следующие группы: v высокоактивные (АФ 0, 6) – для сварки низкоуглеродистых сталей; v активные (АФ = 0, 6 – 0, 3) – для сварки низколегированных сталей; v малоактивные (АФ = 0, 3 – 0, 1) – для сварки средне- и высоколегированных сталей; v пассивные (АФ 0, 1) – для сварки высоколегированных аустенитных сплавов и сталей с низким содержанием феррита Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Оценка основности шлака (флюса) и его окислительной способности Способ Н. Н. Потапова: По АФ сварочные флюсы разделены на следующие группы: v высокоактивные (АФ 0, 6) – для сварки низкоуглеродистых сталей; v активные (АФ = 0, 6 – 0, 3) – для сварки низколегированных сталей; v малоактивные (АФ = 0, 3 – 0, 1) – для сварки средне- и высоколегированных сталей; v пассивные (АФ 0, 1) – для сварки высоколегированных аустенитных сплавов и сталей с низким содержанием феррита Физико-химические расчеты
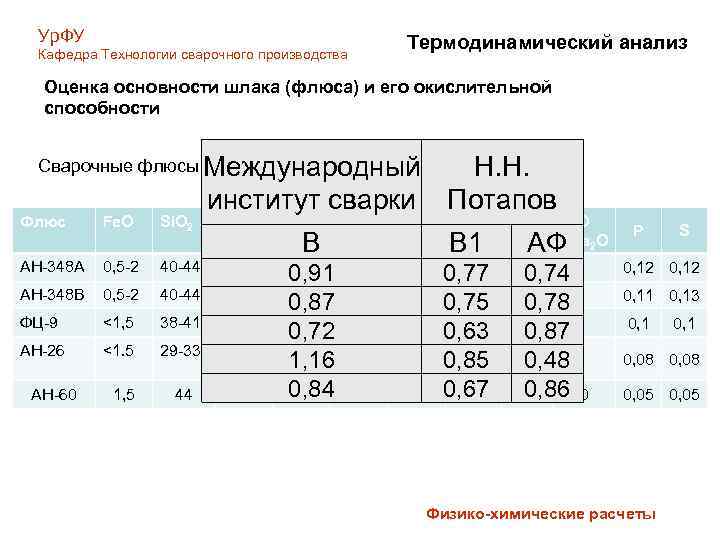 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Оценка основности шлака (флюса) и его окислительной способности Сварочные флюсы Международный (ГОСТ 52222 -2004) Флюс Fe. O Si. O 2 AH-348 A 0, 5 -2 АН-348 В институт сварки Mn. O Ca. O 40 -44 31 -38 <12 0, 5 -2 40 -44 31 -38 ФЦ-9 <1, 5 38 -41 АН-26 <1. 5 29 -33 2, 5 -4 44 39 АН-60 1, 5 B Mg. O 0, 91 <6 <12 0, 87 <6 <8 0, 72 <3 4 -8 1, 16 15 -18 0, 84 3 8 Al 2 O 3 <6 Н. Н. Потапов Ca. F 2 B 1 3 -6 0, 77 <6 3 -6 0, 75 10 -13 2 -3 0, 63 19 -23 20 -24 0, 85 6 0, 67 8 Ti. O 2 K 2 O +Na 2 O АФ - 0, 74 0, 5 -6 0, 78 0, 87 0, 48 0, 86 0 P S 0, 12 0, 11 0, 13 0, 1 0, 08 0 0, 05 Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Оценка основности шлака (флюса) и его окислительной способности Сварочные флюсы Международный (ГОСТ 52222 -2004) Флюс Fe. O Si. O 2 AH-348 A 0, 5 -2 АН-348 В институт сварки Mn. O Ca. O 40 -44 31 -38 <12 0, 5 -2 40 -44 31 -38 ФЦ-9 <1, 5 38 -41 АН-26 <1. 5 29 -33 2, 5 -4 44 39 АН-60 1, 5 B Mg. O 0, 91 <6 <12 0, 87 <6 <8 0, 72 <3 4 -8 1, 16 15 -18 0, 84 3 8 Al 2 O 3 <6 Н. Н. Потапов Ca. F 2 B 1 3 -6 0, 77 <6 3 -6 0, 75 10 -13 2 -3 0, 63 19 -23 20 -24 0, 85 6 0, 67 8 Ti. O 2 K 2 O +Na 2 O АФ - 0, 74 0, 5 -6 0, 78 0, 87 0, 48 0, 86 0 P S 0, 12 0, 11 0, 13 0, 1 0, 08 0 0, 05 Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Расчет изменения содержания основных элементов в расплавленном металле Способ Н. Н. Потапова: Для флюса АН-60 и металла c 0, 2%Si Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Расчет изменения содержания основных элементов в расплавленном металле Способ Н. Н. Потапова: Для флюса АН-60 и металла c 0, 2%Si Физико-химические расчеты
 Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Расчет изменения содержания основных элементов в расплавленном металле Способ Н. Н. Потапова: Для флюса типа АН-60 и металла c 0, 5%Mn Физико-химические расчеты
Ур. ФУ Кафедра Технологии сварочного производства Термодинамический анализ Расчет изменения содержания основных элементов в расплавленном металле Способ Н. Н. Потапова: Для флюса типа АН-60 и металла c 0, 5%Mn Физико-химические расчеты


