занятие 9-1.ppt
- Количество слайдов: 35
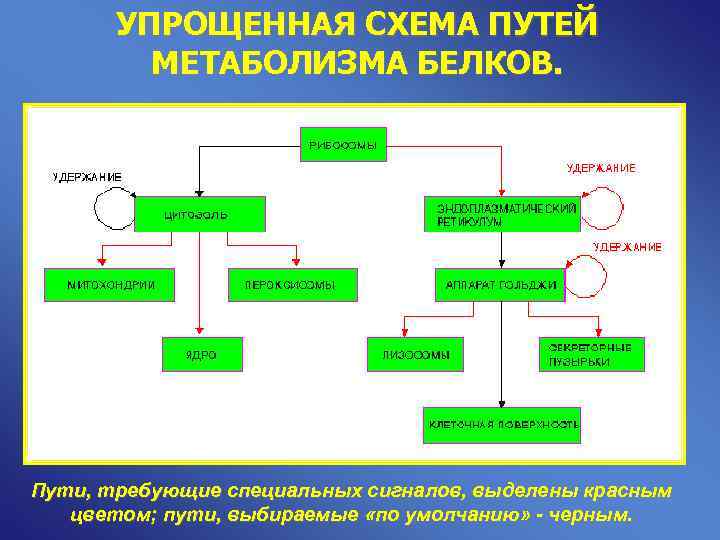
УПРОЩЕННАЯ СХЕМА ПУТЕЙ МЕТАБОЛИЗМА БЕЛКОВ. Пути, требующие специальных сигналов, выделены красным цветом; пути, выбираемые «по умолчанию» - черным.
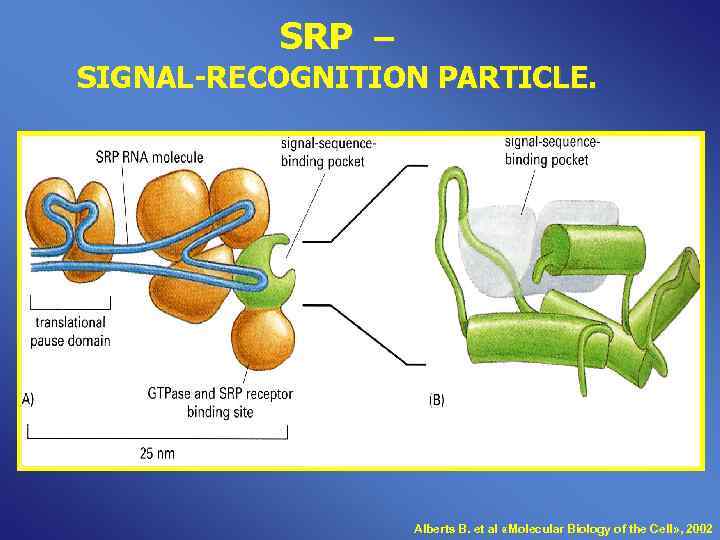
SRP – SIGNAL-RECOGNITION PARTICLE. Alberts B. et al «Molecular Biology of the Cell» , 2002
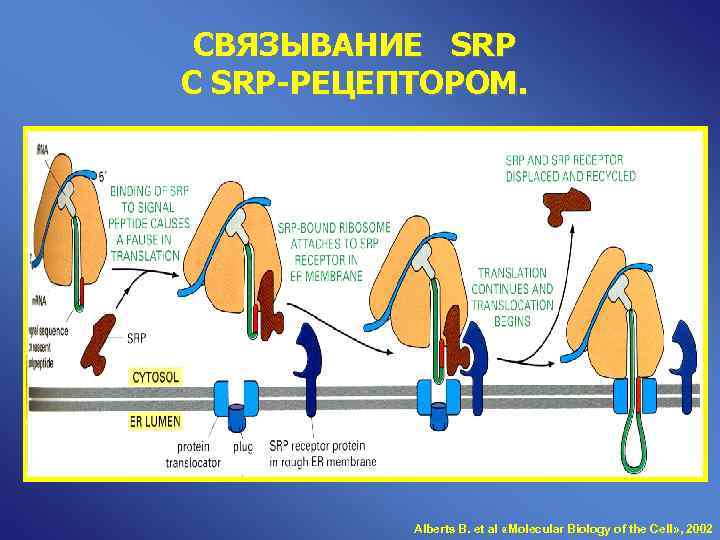
СВЯЗЫВАНИЕ SRP С SRP-РЕЦЕПТОРОМ. Alberts B. et al «Molecular Biology of the Cell» , 2002
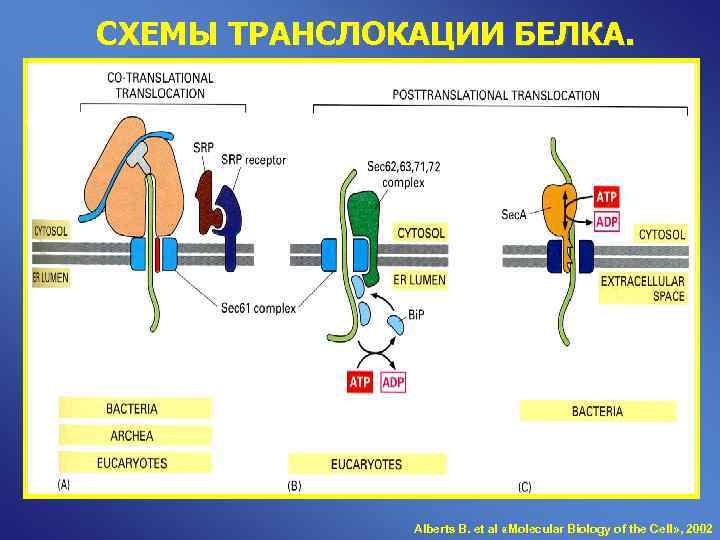
СХЕМЫ ТРАНСЛОКАЦИИ БЕЛКА. Alberts B. et al «Molecular Biology of the Cell» , 2002
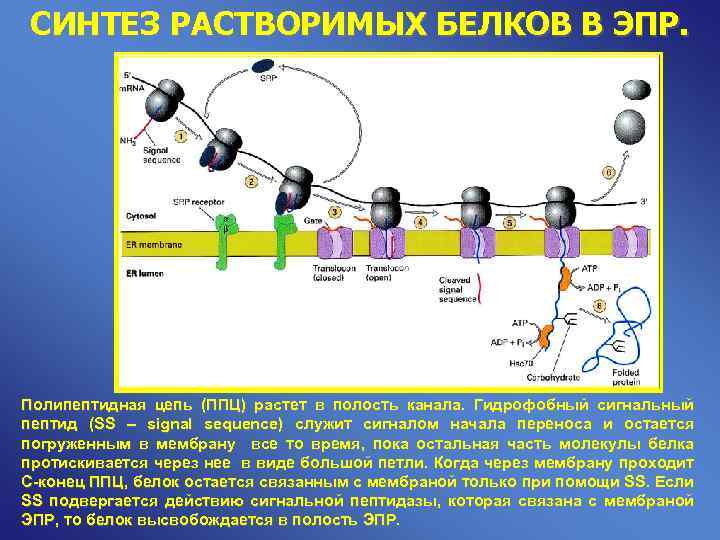
СИНТЕЗ РАСТВОРИМЫХ БЕЛКОВ В ЭПР. Полипептидная цепь (ППЦ) растет в полость канала. Гидрофобный сигнальный пептид (SS – signal sequence) служит сигналом начала переноса и остается погруженным в мембрану все то время, пока остальная часть молекулы белка протискивается через нее в виде большой петли. Когда через мембрану проходит С-конец ППЦ, белок остается связанным с мембраной только при помощи SS. Если SS подвергается действию сигнальной пептидазы, которая связана с мембраной ЭПР, то белок высвобождается в полость ЭПР.
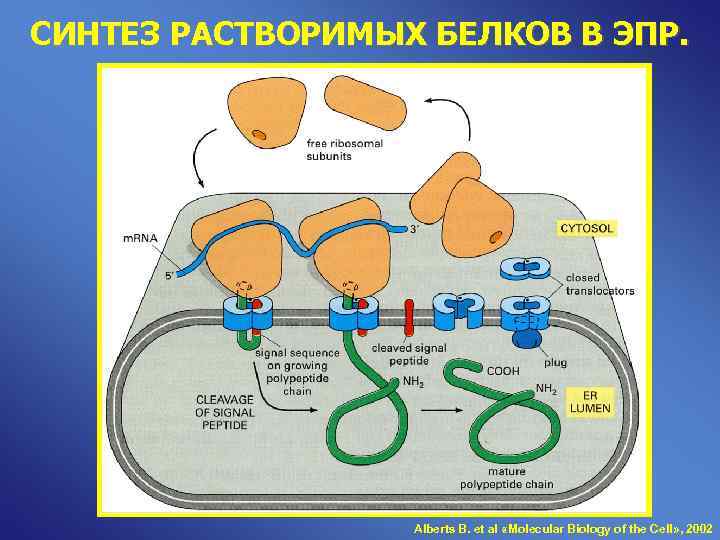
СИНТЕЗ РАСТВОРИМЫХ БЕЛКОВ В ЭПР. Alberts B. et al «Molecular Biology of the Cell» , 2002
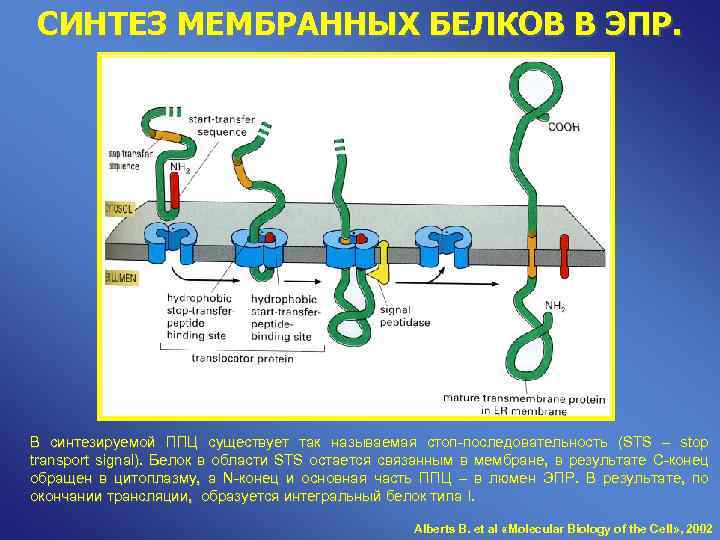
СИНТЕЗ МЕМБРАННЫХ БЕЛКОВ В ЭПР. В синтезируемой ППЦ существует так называемая стоп-последовательность (STS – stop transport signal). Белок в области STS остается связанным в мембране, в результате С-конец обращен в цитоплазму, а N-конец и основная часть ППЦ – в люмен ЭПР. В результате, по окончании трансляции, образуется интегральный белок типа I. Alberts B. et al «Molecular Biology of the Cell» , 2002
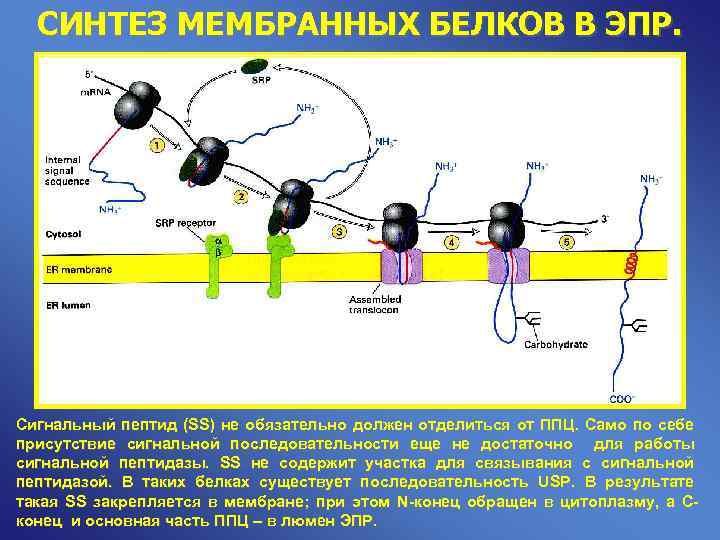
СИНТЕЗ МЕМБРАННЫХ БЕЛКОВ В ЭПР. Сигнальный пептид (SS) не обязательно должен отделиться от ППЦ. Само по себе присутствие сигнальной последовательности еще не достаточно для работы сигнальной пептидазы. SS не содержит участка для связывания с сигнальной пептидазой. В таких белках существует последовательность USP. В результате такая SS закрепляется в мембране; при этом N-конец обращен в цитоплазму, а С- конец и основная часть ППЦ – в люмен ЭПР.
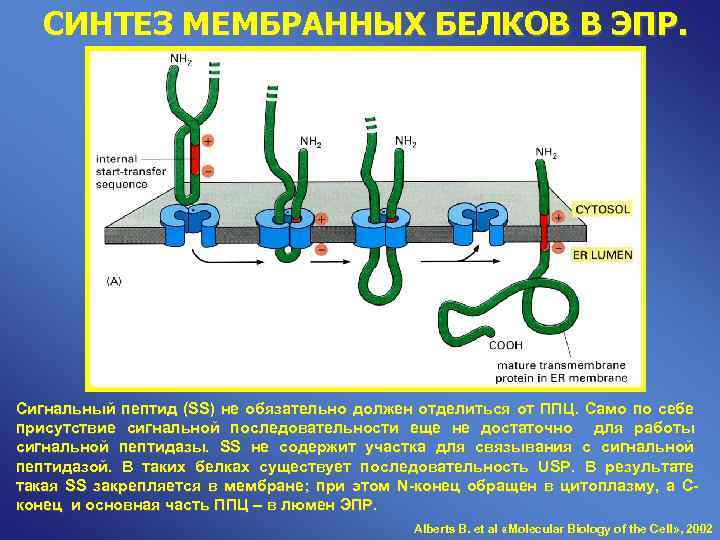
СИНТЕЗ МЕМБРАННЫХ БЕЛКОВ В ЭПР. Сигнальный пептид (SS) не обязательно должен отделиться от ППЦ. Само по себе присутствие сигнальной последовательности еще не достаточно для работы сигнальной пептидазы. SS не содержит участка для связывания с сигнальной пептидазой. В таких белках существует последовательность USP. В результате такая SS закрепляется в мембране; при этом N-конец обращен в цитоплазму, а С- конец и основная часть ППЦ – в люмен ЭПР. Alberts B. et al «Molecular Biology of the Cell» , 2002
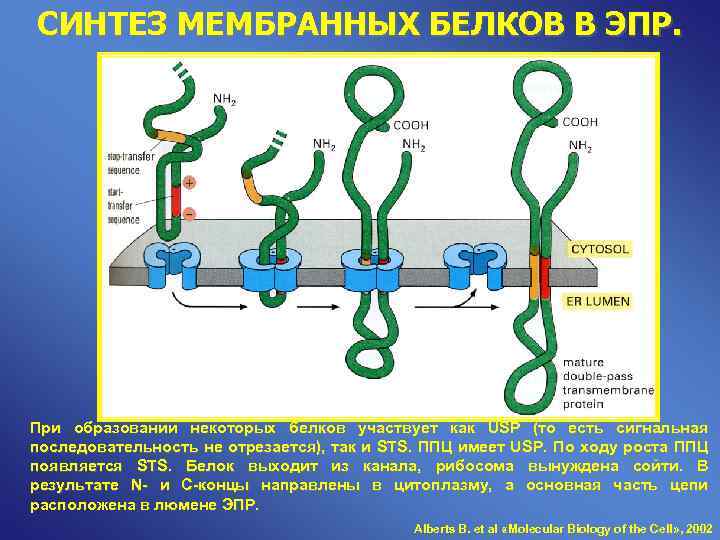
СИНТЕЗ МЕМБРАННЫХ БЕЛКОВ В ЭПР. При образовании некоторых белков участвует как USP (то есть сигнальная последовательность не отрезается), так и STS. ППЦ имеет USP. По ходу роста ППЦ появляется STS. Белок выходит из канала, рибосома вынуждена сойти. В результате N- и С-концы направлены в цитоплазму, а основная часть цепи расположена в люмене ЭПР. Alberts B. et al «Molecular Biology of the Cell» , 2002
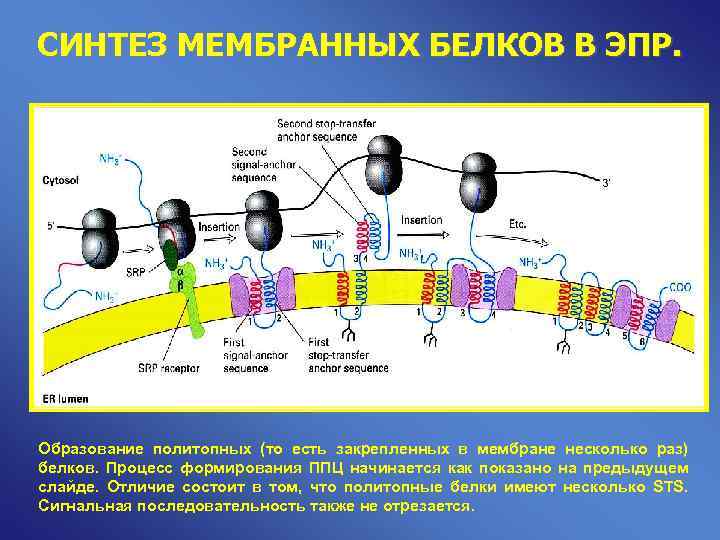
СИНТЕЗ МЕМБРАННЫХ БЕЛКОВ В ЭПР. Образование политопных (то есть закрепленных в мембране несколько раз) белков. Процесс формирования ППЦ начинается как показано на предыдущем слайде. Отличие состоит в том, что политопные белки имеют несколько STS. Сигнальная последовательность также не отрезается.

СИНТЕЗ МЕМБРАННЫХ БЕЛКОВ В ЭПР. ОБРАЗОВАНИЕ ПОЛИТОПНЫХ БЕЛКОВ. РОДОПСИН Alberts B. et al «Molecular Biology of the Cell» , 2002
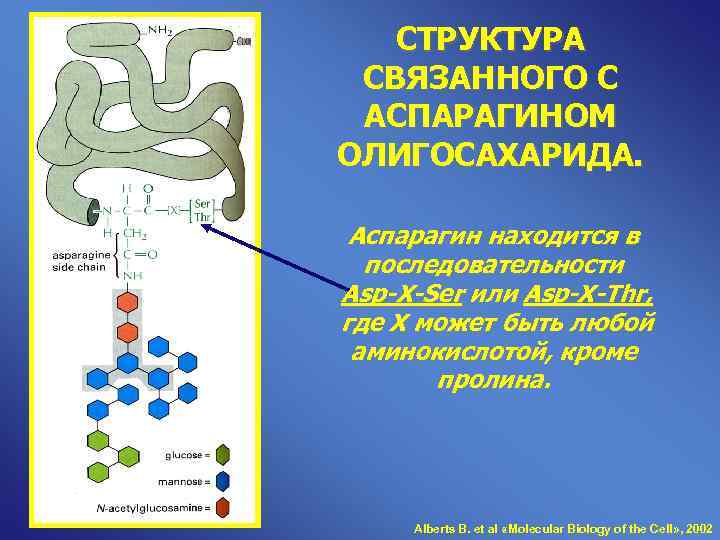
СТРУКТУРА СВЯЗАННОГО С АСПАРАГИНОМ ОЛИГОСАХАРИДА. Аспарагин находится в последовательности Asp-X-Ser или Asp-X-Thr, где Х может быть любой аминокислотой, кроме пролина. Alberts B. et al «Molecular Biology of the Cell» , 2002
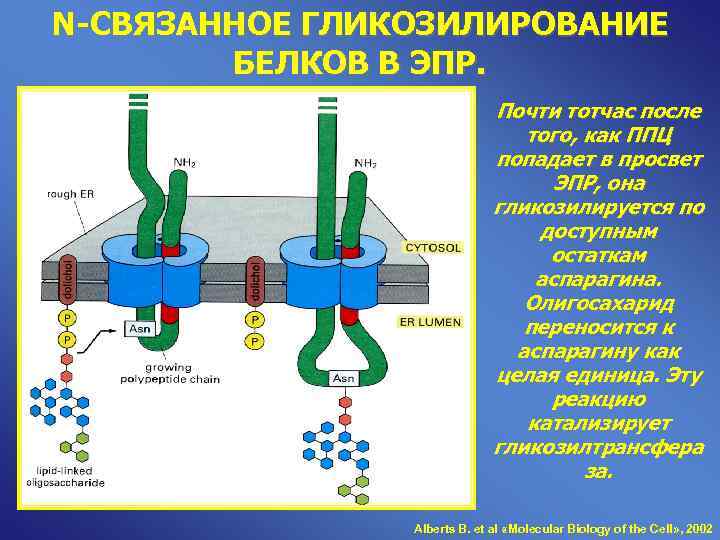
N-СВЯЗАННОЕ ГЛИКОЗИЛИРОВАНИЕ БЕЛКОВ В ЭПР. Почти тотчас после того, как ППЦ попадает в просвет ЭПР, она гликозилируется по доступным остаткам аспарагина. Олигосахарид переносится к аспарагину как целая единица. Эту реакцию катализирует гликозилтрансфера за. Alberts B. et al «Molecular Biology of the Cell» , 2002
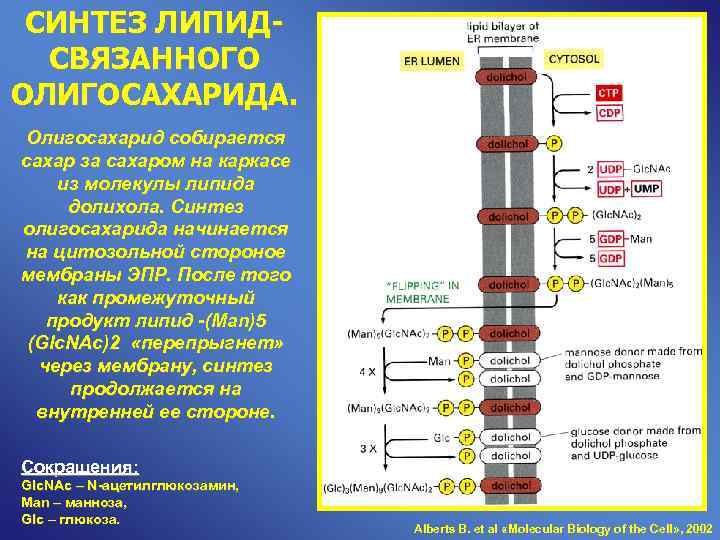
СИНТЕЗ ЛИПИД- СВЯЗАННОГО ОЛИГОСАХАРИДА. Олигосахарид собирается сахар за сахаром на каркасе из молекулы липида долихола. Синтез олигосахарида начинается на цитозольной стороное мембраны ЭПР. После того как промежуточный продукт липид -(Man)5 (Glc. NAc)2 «перепрыгнет» через мембрану, синтез продолжается на внутренней ее стороне. Сокращения: Glc. NAc – N-ацетилглюкозамин, Man – манноза, Glc – глюкоза. Alberts B. et al «Molecular Biology of the Cell» , 2002
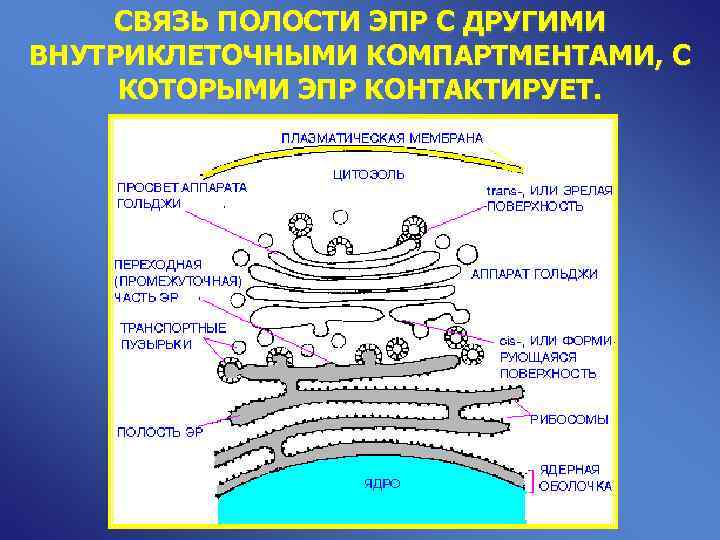
СВЯЗЬ ПОЛОСТИ ЭПР С ДРУГИМИ ВНУТРИКЛЕТОЧНЫМИ КОМПАРТМЕНТАМИ, С КОТОРЫМИ ЭПР КОНТАКТИРУЕТ.

АППАРАТ ГОЛЬДЖИ. Камилло Гольджи
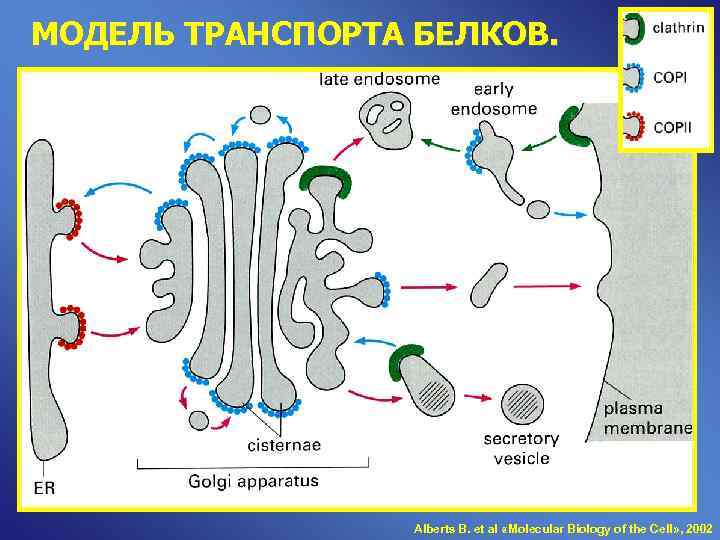
МОДЕЛЬ ТРАНСПОРТА БЕЛКОВ. Alberts B. et al «Molecular Biology of the Cell» , 2002
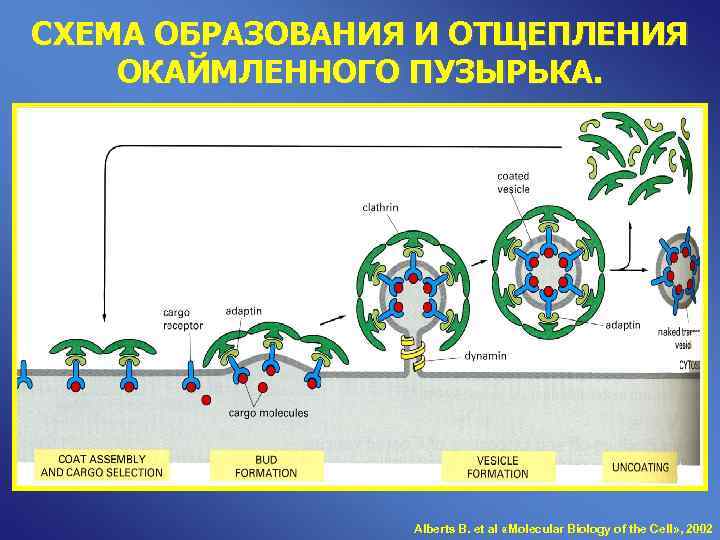
СХЕМА ОБРАЗОВАНИЯ И ОТЩЕПЛЕНИЯ ОКАЙМЛЕННОГО ПУЗЫРЬКА. Alberts B. et al «Molecular Biology of the Cell» , 2002
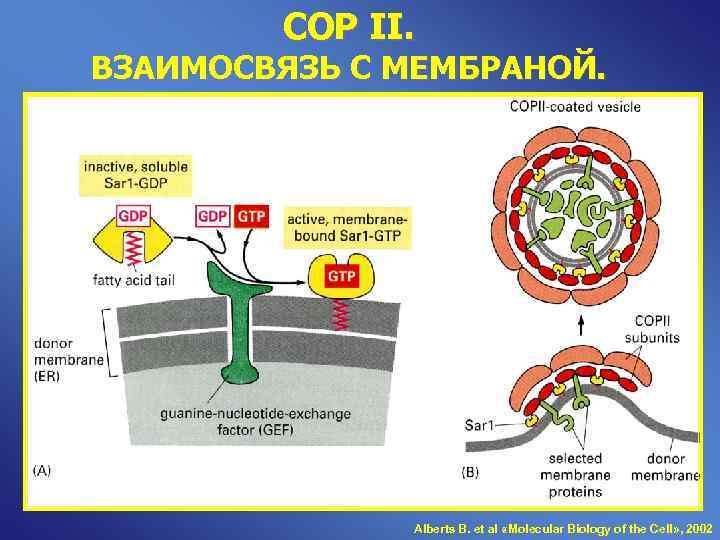
COP II. ВЗАИМОСВЯЗЬ С МЕМБРАНОЙ. Alberts B. et al «Molecular Biology of the Cell» , 2002
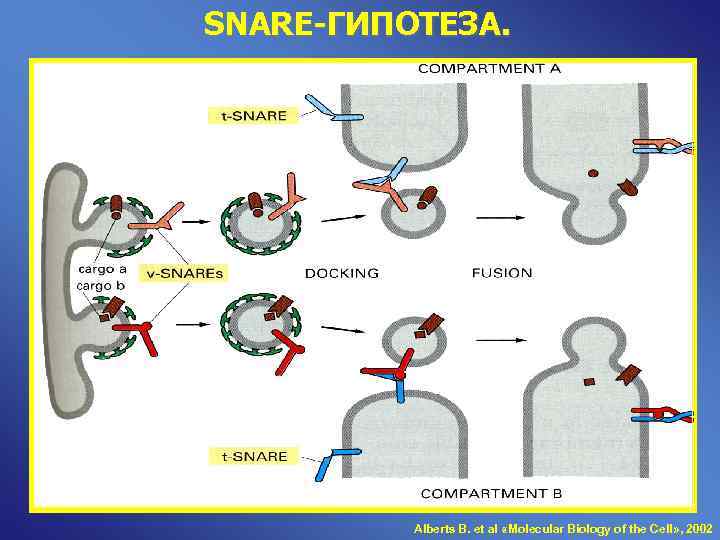
SNARE-ГИПОТЕЗА. Alberts B. et al «Molecular Biology of the Cell» , 2002
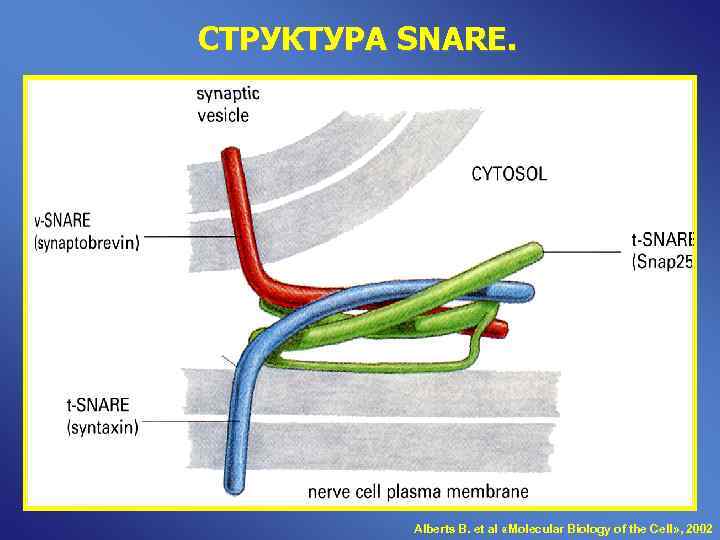
СТРУКТУРА SNARE. Alberts B. et al «Molecular Biology of the Cell» , 2002
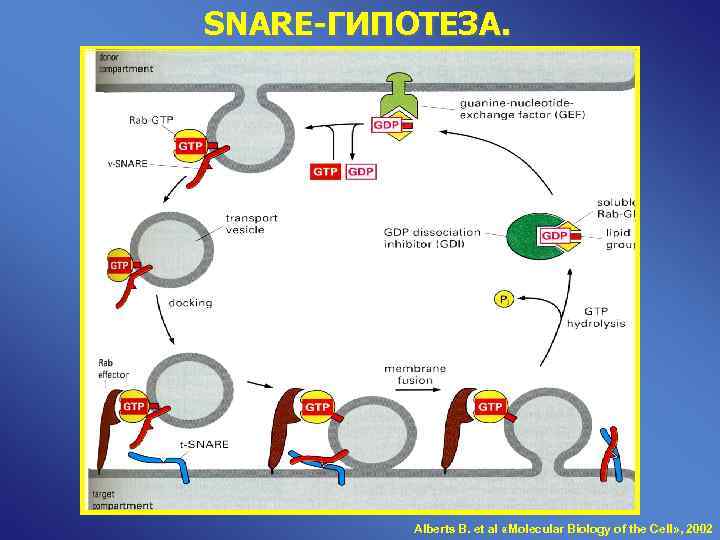
SNARE-ГИПОТЕЗА. Alberts B. et al «Molecular Biology of the Cell» , 2002
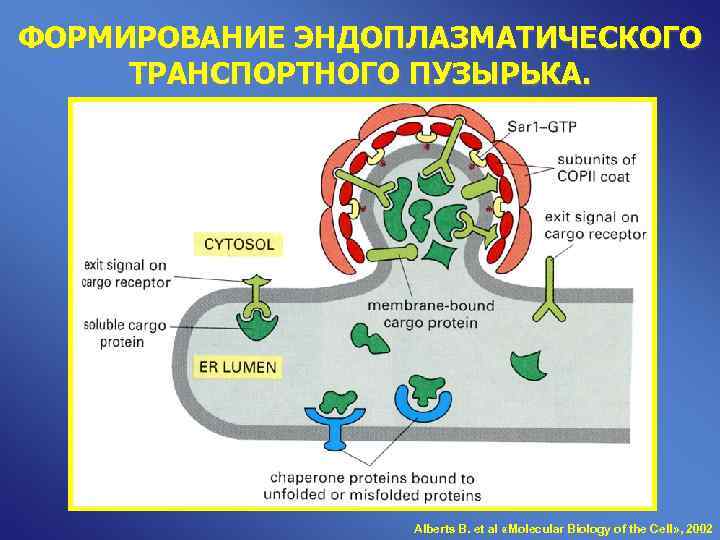
ФОРМИРОВАНИЕ ЭНДОПЛАЗМАТИЧЕСКОГО ТРАНСПОРТНОГО ПУЗЫРЬКА. Alberts B. et al «Molecular Biology of the Cell» , 2002
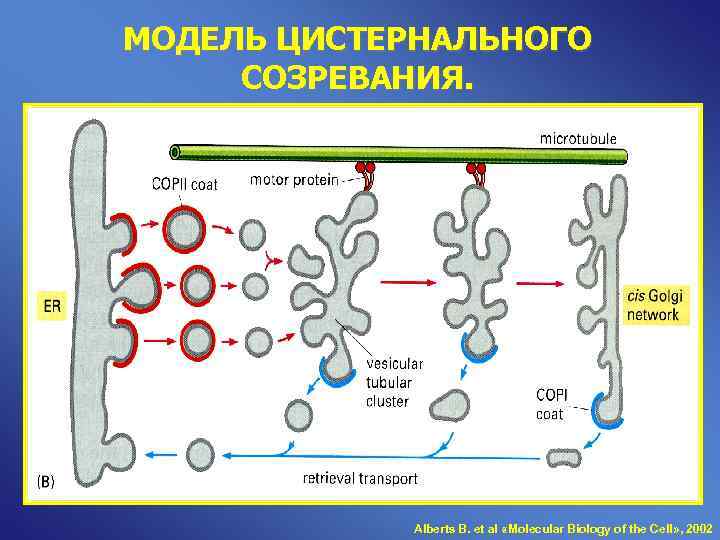
МОДЕЛЬ ЦИСТЕРНАЛЬНОГО СОЗРЕВАНИЯ. Alberts B. et al «Molecular Biology of the Cell» , 2002
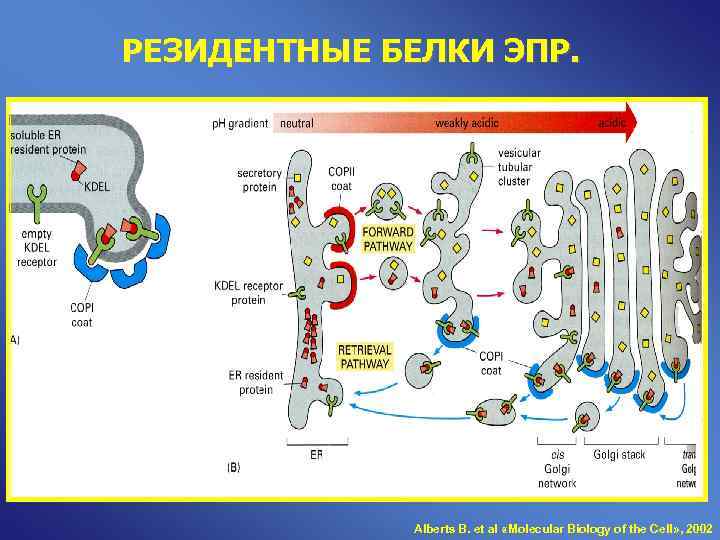
РЕЗИДЕНТНЫЕ БЕЛКИ ЭПР. Alberts B. et al «Molecular Biology of the Cell» , 2002
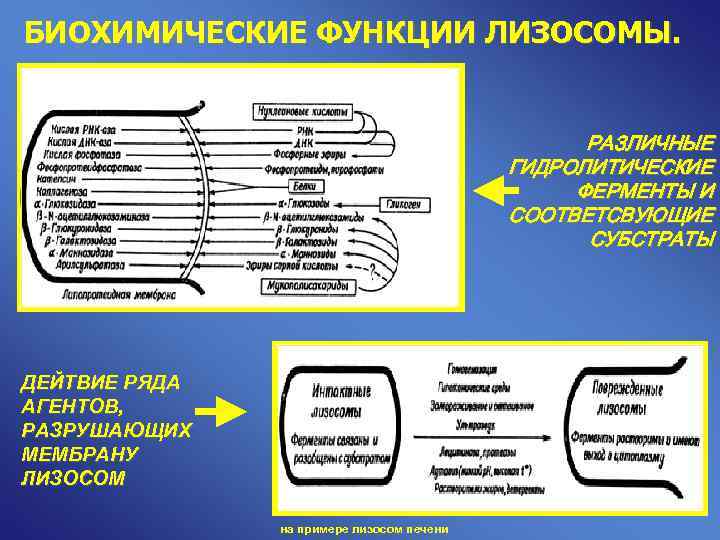
БИОХИМИЧЕСКИЕ ФУНКЦИИ ЛИЗОСОМЫ. РАЗЛИЧНЫЕ ГИДРОЛИТИЧЕСКИЕ ФЕРМЕНТЫ И СООТВЕТСВУЮЩИЕ СУБСТРАТЫ ДЕЙТВИЕ РЯДА АГЕНТОВ, РАЗРУШАЮЩИХ МЕМБРАНУ ЛИЗОСОМ на примере лизосом печени
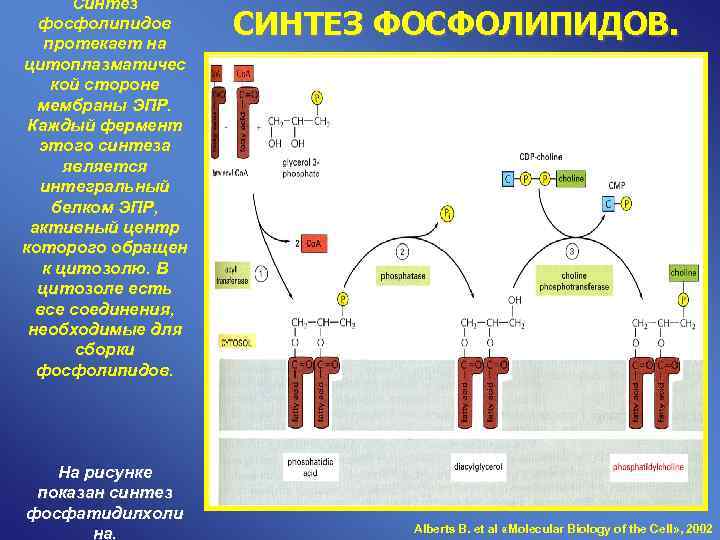
Синтез фосфолипидов протекает на СИНТЕЗ ФОСФОЛИПИДОВ. цитоплазматичес кой стороне мембраны ЭПР. Каждый фермент этого синтеза является интегральный белком ЭПР, активный центр которого обращен к цитозолю. В цитозоле есть все соединения, необходимые для сборки фосфолипидов. На рисунке показан синтез фосфатидилхоли Alberts B. et al «Molecular Biology of the Cell» , 2002 на.
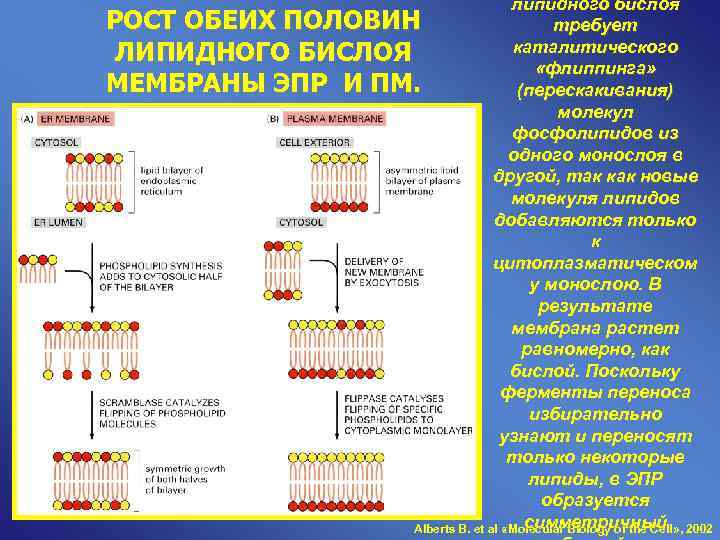
липидного бислоя РОСТ ОБЕИХ ПОЛОВИН требует ЛИПИДНОГО БИСЛОЯ каталитического «флиппинга» МЕМБРАНЫ ЭПР И ПМ. (перескакивания) молекул фосфолипидов из одного монослоя в другой, так как новые молекуля липидов добавляются только к цитоплазматическом у монослою. В результате мембрана растет равномерно, как бислой. Поскольку ферменты переноса избирательно узнают и переносят только некоторые липиды, в ЭПР образуется симметричный Alberts B. et al «Molecular Biology of the Cell» , 2002
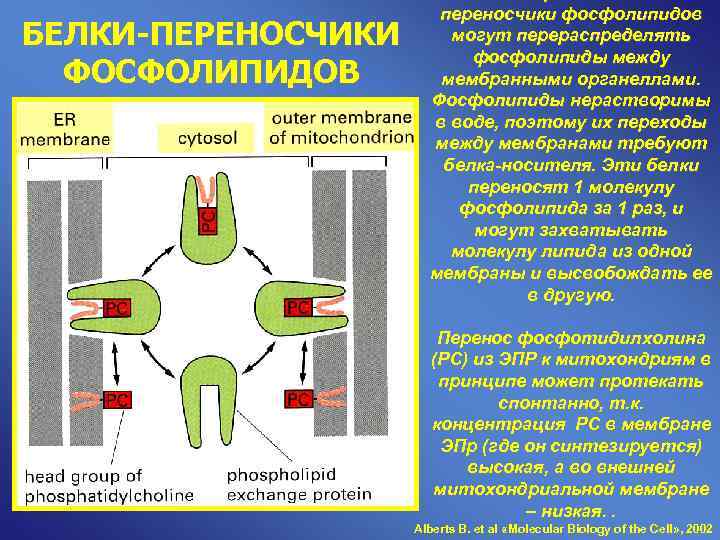
переносчики фосфолипидов БЕЛКИ-ПЕРЕНОСЧИКИ могут перераспределять фосфолипиды между ФОСФОЛИПИДОВ мембранными органеллами. Фосфолипиды нерастворимы в воде, поэтому их переходы между мембранами требуют белка-носителя. Эти белки переносят 1 молекулу фосфолипида за 1 раз, и могут захватывать молекулу липида из одной мембраны и высвобождать ее в другую. Перенос фосфотидилхолина (РС) из ЭПР к митохондриям в принципе может протекать спонтанно, т. к. концентрация РС в мембране ЭПр (где он синтезируется) высокая, а во внешней митохондриальной мембране – низкая. . Alberts B. et al «Molecular Biology of the Cell» , 2002
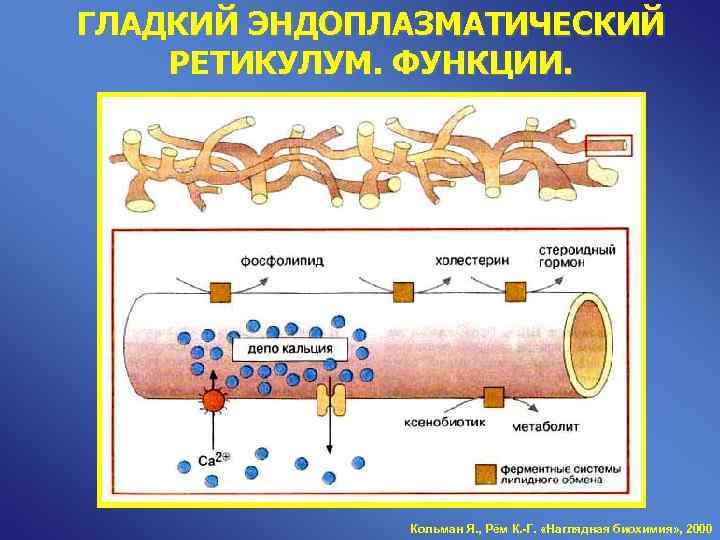
ГЛАДКИЙ ЭНДОПЛАЗМАТИЧЕСКИЙ РЕТИКУЛУМ. ФУНКЦИИ. Кольман Я. , Рём К. -Г. «Наглядная биохимия» , 2000
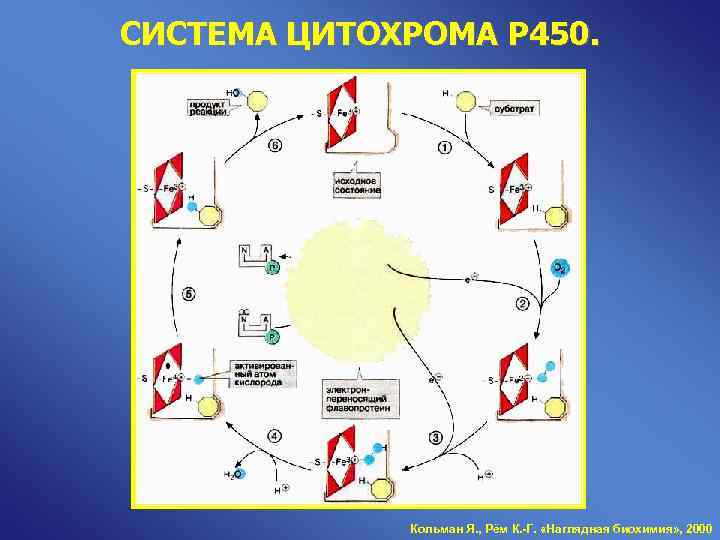
СИСТЕМА ЦИТОХРОМА Р 450. Кольман Я. , Рём К. -Г. «Наглядная биохимия» , 2000
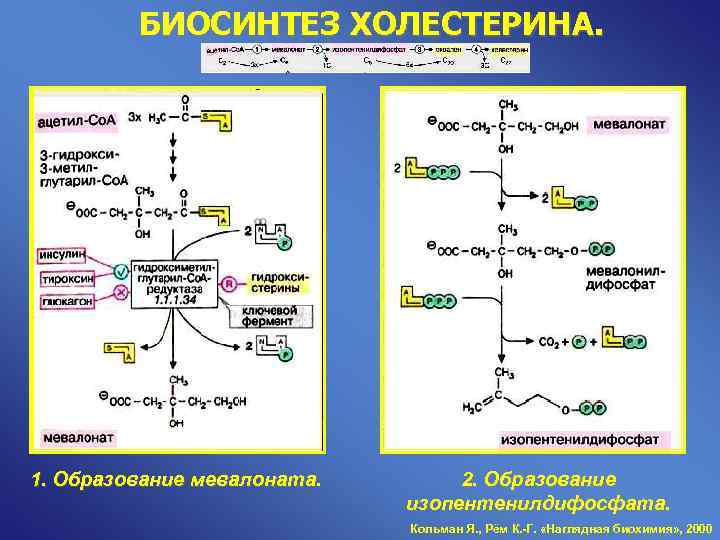
БИОСИНТЕЗ ХОЛЕСТЕРИНА. 1. Образование мевалоната. 2. Образование изопентенилдифосфата. Кольман Я. , Рём К. -Г. «Наглядная биохимия» , 2000
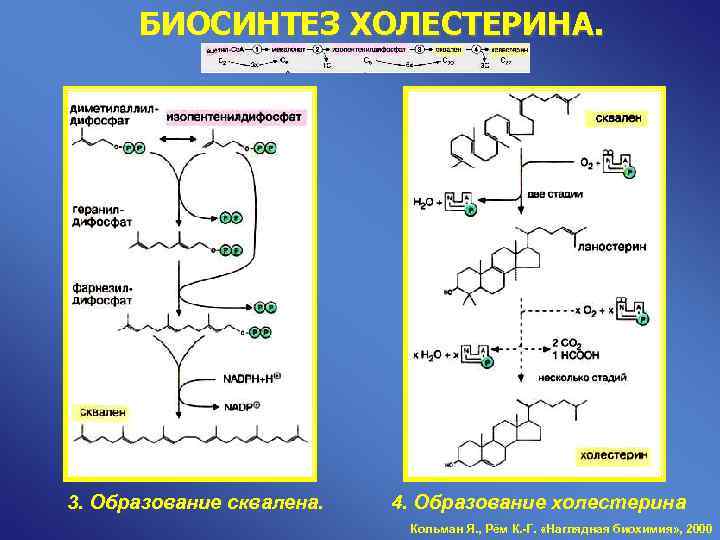
БИОСИНТЕЗ ХОЛЕСТЕРИНА. 3. Образование сквалена. 4. Образование холестерина Кольман Я. , Рём К. -Г. «Наглядная биохимия» , 2000

Продолжение см. в презентации «Занятие 9 -2» .
занятие 9-1.ppt