Аэрация и масштабирование.ppt
- Количество слайдов: 78

Управление аэрацией, перемешиванием и масштабирование аэробных микробиологических процессов

Основные технологические параметры аэробных процессов ферментации • • • Штамм Среда Температура р. Н Субстратные подпитки Аэрация и перемешивание

Факторы, связанные с аэрацией-перемешиванием • Конструкция ферментёра и перемешивающего устройства • Скорость подачи аэрирующего воздуха • Частота вращения вала мешалки • Концентрация растворённого кислорода • Интенсивность дыхания культуры • Неравномерное распределение условий по рабочему объёму аппарата

Главный параметр микроокружения микробных клеток • Температура, р. Н, концентрации компонентов питательной среды поддерживаются одинаковыми независимо от типа и размера аппарата • Основным параметром микроокружения в аэробных процессах, зависящим от аэрации, перемешивания и конструкции ферментёра, является концентрация растворённого кислорода - (C) • Микробные клетки потребляют не газообразный кислород из пузырей воздуха, а только растворённый в жидкости кислород

Необходимость аэрации • Кислород нельзя «загрузить» впрок, как другие субстраты. Даже «запас» полностью насыщенной кислородом воздуха жидкости промышленные культуры микроорганизмов «съедают» за 5 – 10 секунд • Поэтому требуется непрерывная подача воздуха в аппарат и интенсивная массопередача «газ – жидкость» , компенсирующая непрерывное потребление кислорода микроорганизмами

Равновесная концентрация растворённого кислорода • Растворимость кислорода в водных растворах (C*) очень мала. При насыщении воздухом она составляет от 2 до 7 [мг О 2 /л] в зависимости от концентрации солей и других веществ в жидкости. • По закону Генри равновесная концентрация * зависит от p. O г растворённого кислорода C 2 – парциального давления в газе, который находится в равновесии с жидкостью.

Закон Генри • C* = Н ∙ p. O 2 г • Н – константа Генри [мг О 2 / л∙(атм. О 2)] • p. O 2 г – парциальное давление кислорода в газе [атм. О 2] • Величина Н зависит от температуры и содержания в жидкости растворённых веществ

Устройство датчика р. О 2 1 –стеклянный корпус 2 –фторопластовый вкладыш с отверстиями 8 3 – платиновый электрод (катод), выполненный в виде спирали из проволоки, накладываемой на фторопластовый вкладыш с натянутой на него газопроницаемой мембраной 4 - газопроницаемая мембрана 9 5 5 – уплотняющая эпоксидная смола 6 – свинцовый электрод (анод) 7 – резиновый штуцер 8 – изолированные электрические провода в эмалевой изоляции 9 – соединительная трубка Внутренняя полость датчика заполнена раствором ацетатного буфера 7 1 8 6 2 3 5 4

Принцип работы датчика растворённого кислорода • На платиновом электроде, погружённом в раствор ацетатного буфера, происходит электрохимическая реакция восстановления кислорода. В результате в электрической цепи возникает ток, пропорциональный скорости реакции. • Концентрация (и парциальное давление) растворённого кислорода на поверхности электрода (и в жидкости на внутренней поверхности мембраны) равны нулю. • Скорость поступления кислорода через мембрану пропорциональна разнице парциальных давлений по обе стороны мембраны. Весь поступивпий кислород восстанавливается на катоде. Поэтому скорость реакции и скорость тока пропорциональны p. O 2 в жидкости

Полярографические датчики растворённого кислорода • Полярографические мембранные датчики измеряют НЕ концентрацию растворённого кислорода, а парциальное давление кислорода в газовой фазе, находящейся в равновесии с измеряемой жидкостью • Например, датчик покажет одну и ту же величину при насыщении воздухом дистиллированной воды или концентрированного раствора поваренной соли, хотя концентрация растворённого кислорода в этих жидкостях различается более чем в 4 раза

Метрология датчиков р. О 2 в процессах ферментации • Обычно в процессе ферментации не происходит заметного изменения общей концентрации растворённых солей и других веществ. Поэтому показания датчика р. О 2 можно использовать для оценки концентрации растворённого кислорода. • Часто показания датчика градуируют в % насыщения (обычно - насыщения воздухом при атмосферном давлении)

Способ градуировки датчика растворённого кислорода • Зависимость выходного сигнала датчика от величины р. О 2 имеет линейный характер. Поэтому достаточно иметь 2 реперные точки: при полном насыщении жидкости кислородом воздуха и при нулевой концентрации в ней растворённого кислорода. • Первую точку можно получить продуванием воздуха через сосуд с водопроводной водой в течение 15 -20 минут. • Вторую – продуванием азота или внесением датчика в сосуд с раствором сульфита натрия.

Градуировочная характеристика Ток датчика imax Тонкая мембрана imax i 0 Толстая мембрана 0 20 40 60 % насыщения 80 100 р. О 2

Влияние растворённого кислорода на развитие микробной культуры μ Обычно Редко 0 Cкр (Регулируемая концентрация) C

Задача управления процессом по растворённому кислороду • Концентрацию растворённого кислорода в ферментёре необходимо поддерживать на уровне не менее Cкр , то есть в диапазоне, когда кислорода «достаточно» , и его дальнейшее увеличение не требуется • При этом предполагается, что поддерживается требуемая обеспеченность культуры кислородом, а концентрация растворённого кислорода Cкр принимается как показатель, характеризующий такую обеспеченность

Варианты систем автоматического регулирования р. О 2 • Датчик связан с регулятором, воздействующим на клапан подачи воздуха в ферментёр. • Датчик связан с исполнительным механизмом, воздействующим на скорость вращения мешалки. • При максимальной скорости подачи воздуха и скорости вращения мешалки иногда дополнительно подключают воздействие на регулятор давления воздуха в аппарате.

Различие измеряемой и действующей на клетку концентрацией кислорода • На микробную клетку действует концентрация растворённого кислорода непосредственно на поверхности клетки • В то же время измеряется (и регулируется) концентрация растворённого кислорода в основной массе жидкости • Между этими величинами существуют различия, которые необходимо оценить

Профиль кислорода вне клетки Микробная клетка Жидкость Расстояние от центра клетки

Массопередача кислорода в слое жидкости у поверхности клетки Удельный поток кислорода q. O на единицу поверхности 2 клетки: q. O 2 = [qm∙(4/3)π∙R 3∙ρ] / [4π∙R 2] = (qm ∙ρ∙R) / 3, где qm – максимальная удельная скорость потребления кислорода в пересчёте на массу микробной клетки • ρ – плотность биомассы • R – радиус клетки • (4/3)π∙R 3 - объём клетки (сферической) • 4π∙R 2 – площадь поверхности клетки

Градиент концентрации кислорода в слое жидкости у поверхности клетки • CS = CL - ∆CS , где • CL - концентрация кислорода в жидкости • CS - концентрация кислорода на поверхности клетки • ∆CS - градиент концентрации кислорода в слое жидкости на поверхности клетки • ∆CS = (qm ∙ρ∙R) / 3 Kж-т

Коэффициент массопередачи «жидкость – биомасса» - Kж-т • Для чистой диффузии: Kж-т = (DO ) 2 где DO - коэффициент диффузии 2 кислорода в жидкости • Для турбулентной диффузии: Kж-т = (DТ ) / R, где DТ - коэффициент турбулентной диффузии кислорода в жидкости /R,

Результаты расчётов • Расчёты, проведенные Финном (1954) для дрожжевых клеток , показывают, что даже при отсутствии перемешивания (чистая диффузия) разница концентрации кислорода на поверхности клетки и в основной массе жидкости не превышает 1% насыщения. Ясно, что при наличии перемешивания эта разница будет ещё меньше. • Только для больших клеток (растительных, животных) величина ∆CS становится заметной, хотя из-за медленного роста и малого потребления кислорода и здесь она невелика

Проблема масштабирования • Масштабирование – воспроизведение результатов процесса в аппарате другого масштаба и/или конструкции. • В практике разработки биотехнологических производств очень часто встречаются ситуации, когда соблюдение одних и тех же условий (штамм, среда, температура, р. Н) в аппаратах производственного и лабораторного масштаба дают совершенно разные результаты

Главный параметр микроокружения микробных клеток • Температура, р. Н, концентрации компонентов питательной среды поддерживаются одинаковыми независимо от типа и размера аппарата • Основным параметром микроокружения в аэробных процессах, зависящим от аэрации, перемешивания и конструкции ферментёра, является концентрация растворённого кислорода - (C) • Микробные клетки потребляют не газообразный кислород из пузырей воздуха, а только растворённый в жидкости кислород

Связь условий массопередачи с концентрацией растворённого кислорода • QO 2 = KLa ( C* - C) • Qo 2 – скорость потребления кислорода (интенсивность дыхания) • C - текущая концентрация растворённого кислорода • C* - концентрация растворённого кислорода в жидкости при её насыщении воздухом • KLa – объёмный коэффициент массопередачи по кислороду • Отсюда C = C * - (Q O 2 / K L a )

Масштабирование по C и KLa • Простейший способ масштабирования – поддержание профиля во времени концентрации растворённого кислорода С, полученного в опытном ферментёре, в аппарате, где этот процесс должен быть воспроизведён. • Практически те же результаты получаются, если в сравниваемых аппаратах обеспечить равенство коэффициентов массопередачи по кислороду KLa.

Определение базовой величины коэффициента массопередачи • Обычно предварительные эксперименты по технологии процесса ферментации проводят в колбах или лабораторных ферментёрах при различном перемешивании и аэрации • Выбирают те условия, при которых получены наилучшие результаты по выходу целевого продукта • Для этого аппарата (или колбы) необходимо экспериментально определить при этих условиях величину KLa – «базовую» , которую в дальнейшем надо будет воспроизводить в аппаратах промышленных – другой конструкции и масштаба

Способы экспериментального определения величины KLa • Сульфитный с химическим определением количества окисленного сульфита натрия • Сульфитный с определением количества прореагировавшего кислорода балансовым методом с помощью газоанализатора и регулятора • Сульфитный с определением времени окисления загруженной порции сульфита по снижению и возрастанию концентрации растворённого кислорода

СУЛЬФИТНЫЙ МЕТОД • Предварительно готовится модельная жидкость - раствор сульфита натрия Na 2 SO 3 • Жидкость заливается в аппарат или колбу и в течение определённого отрезка времени устанавливаются изучаемые условия аэрации и перемешивания • В растворе протекает реакция окисления: • 2 Na 2 SO 3 + О 2 = 2 Na 2 SO 4 • Затем в пробе раствора йодометрическим методом определяют концентрацию непрореагировавшего Na 2 SO 3 и вычисляют по реакции количество вступившего в реакцию кислорода

Сульфитный метод по времени окисления навески сульфита C C* 0 ∆t t

Динамический способ определения величины KLa • Динамический способ, в котором воду или модельную жидкость насыщают кислородом за счёт аэрации воздухом или обескислороживают за счёт подачи азота с измерением кривой изменения концентрации растворённого кислорода С : • d. C/dt = KLa ∙ (C* - C) • KLa = - (1/t)∙ ln (1 – C/C*)

Кривая насыщения жидкости кислородом воздуха C C* 0 t

Динамический способ «толчок давления» • Динамический метод имеет неудобство – необходимо иметь два газа с различным содержанием кислорода. И если один из них (воздух) – всегда «под рукой» , то азот в нужных количествах обеспечить трудно. • Но разное парциальное давление в воздухе можно создать за счёт повышения или снижения давления воздуха в аппарате (при этом быстрого). • Это позволяет использовать процедуру динамического метода даже в промышленности

Балансовый способ • Балансовый метод прямого определения величины KLa в процессе ферментации с определением концентрации С растворённого кислорода в культуральной жидкости и скорости потребления кислорода QO 2 путём измерения концентрации кислорода в выходящем из ферментёра воздухе CO 2 Г вых и расхода воздуха F через аппарат: • KLa = F ∙ (CO 2 Г вх - CO 2 Г вых ) / ( C* - C )

Техника масштабирования по KLa • Для аппаратов с мешалками обычно используют упрощённую форму зависимости KLa от конструктивных и режимных параметров аппарата: • KLa = K 0 (N/V)a (F/A)b, где • N – механическая мощность перемешивания • F – объёмный расход воздуха • A - площадь поперечного сечения аппарата • V - рабочий объём жидкости в аппарате • K 0 , a и b – коэффициенты

Мощность механического перемешивания • N = KN ∙ρ ∙n 3∙d. М 5 , где • n – скорость вращения мешалки • d. М – диаметр лопастей мешалки • ρ - плотность жидкости • KN - коэффициент мощности, зависящий от конструкции и числа ярусов мешалки

Мицелиальные микроорганизмы • Мицелиальные микроорганизмы обычно существуют в виде микроколоний (микробных агломератов) , в которых связанные между собой гифы образуют сложную структуру • Снабжение кислородом клеток микроорганизмов, находящихся внутри агломерата, происходит через внешнюю поверхность агломерата и далее путём диффузии по каналам, образуемым промежутками между гифами мицелия микроорганизмов • Принимается, что объем, занимаемый клетками микроорганизмов, пренебрежимо мал по сравнению с общим объемом агломерата, и его можно не учитывать.

Виды морфологии растущего в ферментёре мицелия

К выводу уравнений для расчёта профиля кислорода в агломерате

Уравнение распределения кислорода по глубине микробного агломерата • Текущая концентрация кислорода С в агломерате сферической формы для любого значения расстояния r от центра агломерата в стационарном состоянии определяется дифференциальным уравнением

Принятые допущения • В этом уравнении обозначения переменных упрощены ( Q = QO 2 , D = DO 2 ) • Принято, что скорость потребления кислорода зависит от его концентрации по уравнению Михаэлиса-Ментен • Q = Qm∙C / (KC + C) • Qm – константа максимальной скорости потребления кислорода • KC – константа Михаэлиса

Краевые условия • Профиль распределения кислорода по глубине микробного агломерата можно найти численными методами при граничных условиях • C = CR при r = R • d. C / dr = 0 при r = 0 • Здесь R – радиус микробного агломерата • CR - концентрация кислорода на поверхности микробного агломерата

Варианты профиля распределения кислорода по глубине агломерата Агломерат Жидкость 1, 2, 3, 4, 5 - удельная скорость потребления кислорода внутри агломерата в порядке возрастания

Интегральная скорость потребления кислорода микробным агломератом • Поскольку концентрация кислорода в разных частях агломерата различна, то и скорость его потребления неравномерна • Интегральную скорость для всего агломерата можно определить по формуле:

Варианты зависимости Ǭ(CR) у микробного агломерата (Средняя скорость потребления кислорода агломератом) 1, 2, 3, 4 - удельная скорость потребления кислорода 1 2 3 4 Концентрация кислорода на поверхности агломерата

Аппроксимация интегральных зависимостей Ǭ(CR) • Результаты численных расчётов хорошо аппроксимируются уравнением Михаэлиса-Ментен • Ǭ = Qm∙CR / (K′C + CR ) • По сравнению с «истинной» кинетикой в этом уравнении принято CR вместо C и Ǭ вместо Q. Интересно, что при этом константа Qm сохраняется такой же, как в «истинной» кинетике, но «искажённая» или «кажущаяся» константа K′C сильно отличается от «истинной» KC • K′ C = KC (1+0, 0175 Da ), где Da – критерий Дамкёлера для агломерата

Критерий Дамкёлера • Критерий Дамкёлера для микробного агломерата можно вычислить по формуле • Da = Qm∙R 2/ (D∙KC ) • Величину Qm можно найти по формуле • Qm = qm ∙X , где X – концентрация биомассы в микробном агломерате и qm – максимальная удельная скорость потребления кислорода в пересчёте на биомассу

Сравнение «кажущейся» и «истинной» констант Михаэлиса • Расчёты, проведенные для типичных условий культивирования мицелиальных микроорганизмов, показали, что величина «кажущейся» (макрокинетической) константы превышают «истинную» (то есть кинетическую) константу в сотни, а иногда и в тысячи раз • Соответственно изменяется и критическая концентрация растворённого кислорода

Градиент концентрации кислорода у поверхности микробного агломерата • Для микробного агломерата можно рассчитать градиент концентрации кислорода на его поверхности ∆CS = (qm∙X∙R)/3 Kж-т Расчёты показывают, что его величина значительно больше, чем для одиночной микробной клетки. Реально в аппарате измеряется не CR , а концентрация кислорода в основной массе жидкости CL : CL = CR + ∆CS Таким образом, критическая концентрация кислорода для микробных агломератов зависит не только от их размера, но и от условий перемешивания.

Сегрегация в ферментационных жидкостях • Перемешивание никогда не бывает полностью идеальным. • Жидкость, содержащая растворенные компоненты питательной среды, нерастворимые частицы (например, муку), микроорганизмы и их микроколонии, не перемешивается до молекулярного уровня и даже до уровня отдельных клеток или их микроколоний. • В соответствии с теорией Данквертса перемешивание происходит до размеров «жидких частиц» , соизмеримых с наименьшим масштабом турбулентных пульсаций

Следствия сегрегации • В результате рабочий объем аппарата распадается на множество сегрегированных неперемешиваемых объемов жидкости, функционирующих как отдельные биореакторы-агломераты. • Размеры агломератов больше размеров отдельных клеток, или микроколоний, или жестких сцеплений микроколоний. В принципе такого рода агломераты – неперемешиваемые объемы жидкости – существуют в любой, особенно вязкой, жидкости ( «жидкие частицы» по Данквертсу). • Распределение кислорода в таких неперемешиваемых объёмах жидкости аналогично рассмотренному выше для микробных агломератов с фиксированными размерами

Масштаб сегрегации • Размер неперемешиваемого объема жидкости (например, диаметр Da агломерата сферической формы) принимается соизмеримым с масштабом наименьших турбулентных пульсаций λ по Колмогорову: • Da = 2 R ≈ λ = (μ 3/ ε∙ ρ3)0, 25 • Здесь μ и ρ – динамическая вязкость и плотность жидкости • ε – диссипация энергии (= N / V )

Диапазон изменения параметров в мицелиальных ферментациях • В периодических процессах мицелиальных ферментаций основные параметры, от которых зависит критическая концентрация растворённого кислорода, изменяются в следующих пределах: • Вязкость – от 1… 5 до 300… 800 м. Па*с • Концентрация биомассы – в 10. . . 15 раз • Qm – от 0, 3 до 10 г/ л в час

р. О 2 как критерий обеспеченности микроорганизмов кислородом • Перечисленные параметры влияют на макрокинетическую константу Михаэлиса и, как следствие, на критическую концентрацию растворённого кислорода, которая сильно изменяется в ходе процесса. • Таким образом, концентрация растворенного кислорода не является однозначным показателем эффективности протекания процесса с точки зрения обеспеченности культуры кислородом. Даже 100%-ное насыщение жидкости кислородом не гарантирует, что внутри агломератов не будет кислородного голодания!

Относительная интенсивность дыхания культуры • Для большинства мицелиальных ферментаций интегральная интенсивность дыхания агломератов Ǭ значительно меньше максимально возможной интенсивности дыхания Qm • Именно соотношение Qотн = Ǭ / Qm наиболее адекватно характеризует обеспеченность культуры кислородом

Зависимость Qотн от размера агломерата при различных Qm

Зависимость Qотн от максимальной скорости Qm при различных размерах агломерата

Алгоритм максимального дыхания культуры • Поддержание максимального дыхания культуры в периодическом процессе ферментации предусматривает пробные тестовые изменения аэрации или скорости вращения мешалки и определение величины воздействия, при котором дальнейшее его повышение не вызывает возрастания интенсивности дыхания • Такие тестовые испытания проводятся через определённые промежутки времени в течение всего процесса ферментации • Максимальное дыхание – это и есть параметр, фиксирующий наилучшую возможную для данного аппарата обеспеченность кислородом в данном процессе

Процедура определения оптимальной скорости вращения мешалки Интенсивность дыхания культуры Скорость вращения мешалки 1 2 3 4 5 6 7 Время ферментации

Неравномерность турбулентности в ферментёре • Уровень турбулентности в ферментёре неодинаков в разных частях аппарата и существенно отличается от средней величины диссипации энергии εср • Если стремиться к тому, чтобы турбулентность была равномерной (изотропной) и к тому же везде обеспечивала высокое относительное дыхание, то это повлечёт за собой значительное повышение энергозатрат и усложнение конструкции аппарата • Более целесообразно использовать эффект комбинации зон интенсивного перемешивания и циркуляционных потоков

Распределение диссипации энергии (ε/εср) в ферментёре

Рисунок 2. 2. Циркуляционная модель Зона циркуляции Зона интенсивного перемешивания Зона циркуляции

Радиальное и осевое течение жидкости в ферментёре Радиальное течение Осевое течение

Динамика изменения концентрации кислорода зоне перемешивания • Объём зоны интенсивного перемешивания обычно не превышает 10% от общего объёма, занятого жидкостью в ферментёре • В зоне интенсивного перемешивания размер микробных агломератов мал, и они насыщаются кислородом до высоких концентраций • При переходе в зону циркуляции малоразмерные агломераты объединяются в более крупные, и в каждом из них в начале пути концентрация кислорода практически одинакова на поверхности и в глубине агломерата

Динамика изменения концентрации кислорода в циркуляционном контуре • По мере прохождения циркуляционного контура происходит непрерывное снижение концентрации кислорода в агломерате из-за его потребления и недостаточного снабжения им через поверхность «циркуляционных» агломератов большого размера (из-за низкой турбулентности в циркуляционном контуре) • При входе в зону интенсивного перемешивания происходит насыщение кислородом – и в итоге изменение концентрации кислорода у клеток имеет пилообразный характер

Динамика изменения концентрации растворённого кислорода в агломерате 1 -й цикл циркуляции 2 -й цикл циркуляции

Изменение профиля кислорода на разной глубине агломерата • На предыдущем слайде показана средняя концентрация кислорода в агломерате для разных моментов времени • Фактически на разной глубине имеют место разные профили изменения концентрации кислорода во времени. Расчёты по таким профилям представлены на следующем слайде

Динамика кислорода на разной глубине микробного агломерата

Усреднение по циклам циркуляции • Ниже представлены расчётные данные, в которых определена зависимость средней по циклу величины Qотн от времени циркуляции при различной турбулентности (и, соответственно, размере агломерата) в циркуляционном контуре. • Расчёт проведен по формуле:

Зависимость Qотн от времени циркуляции при различных R

Зависимость Qотн от R при различном времени циркуляции

Сравнение моделей изотропной турбулентности и циркуляционной • Если вкладываемую мощность механического перемешивания равномерно распределить по аппарату (т. е. создать изотропную турбулентность), среднее интегральное значение дыхания Qотн определяется исходя из стационарного профиля распределения кислорода по глубине одинаковых для всего аппарата агломератов. • В случае циркуляционной модели, кроме различий в размерах агломератов, профиль кислорода в каждом из них является нестационарным и изменяется во времени. • Расчёты показывают, что при одинаковой вкладываемой мощности циркуляционная модель даёт значительно более высокие результаты (в 2 и более раз)

Предложения по модификации ферментационных аппаратов • Разделение рабочего объёма жидкости в аппарате на две зоны: зону интенсивного перемешивания и зону циркуляции. • В зоне перемешивания использовать турбинную мешалку с высокой локальной диссипацией энергии • Для создания циркуляционного потока использовать мешалки с осевым течением жидкости, в которых вся энергия должна быть сосредоточена на обеспечении наиболее быстрой циркуляции жидкости.

Смысл модификации • Каждый элемент жидкости вместе с находящимися в нем микроорганизмами периодически попадает в зону интенсивного перемешивания, насыщается в ней кислородом, а затем в течение определенного времени (времени циркуляции ) может либо вообще не снабжаться кислородом, либо снабжаться в наименьшей степени.
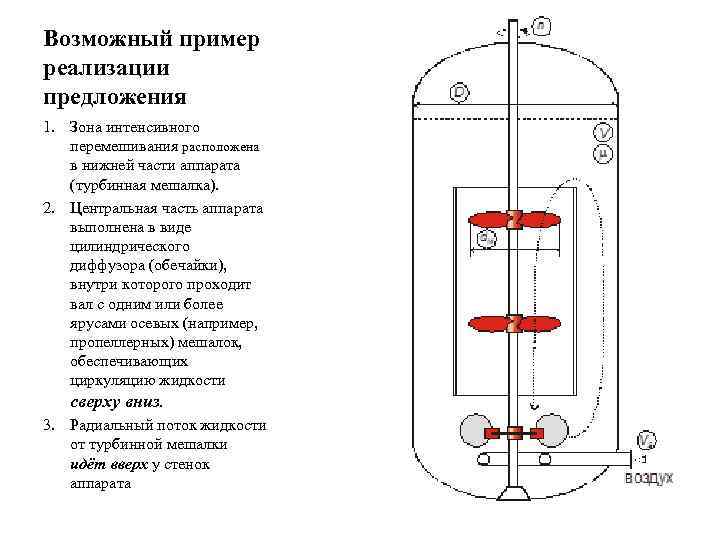
Возможный пример реализации предложения 1. Зона интенсивного перемешивания расположена в нижней части аппарата (турбинная мешалка). 2. Центральная часть аппарата выполнена в виде цилиндрического диффузора (обечайки), внутри которого проходит вал с одним или более ярусами осевых (например, пропеллерных) мешалок, обеспечивающих циркуляцию жидкости сверху вниз. 3. Радиальный поток жидкости от турбинной мешалки идёт вверх у стенок аппарата

Другие варианты «кислородного» масштабного перехода • «Суррогаты» KLa : удельная мощность перемешивания (N/V), фиктивная линейная скорость воздуха (F/A), удельный объёмный расход воздуха (F/V), центробежный критерий Рейнольдса, время полного перемешивания τпер • Произведение (Kla)∙C*, позволяющее учитывать высоту столба жидкости в ферментёре

Учёт механолабильности микробных культур • Для предотвращения прямого механического воздействия мешалки на микробные клетки при расчётах используется ограничение по окружной линейной скорости лопастей мешалки: • • где n vокр = π∙d. М∙n, – частота вращения мешалки

Учёт влияния СО 2 • В некоторых аэробных процессах наряду с воздействием на культуру растворённого кислорода имеет место ингибирование при повышении концентрации СО 2 (в жидкости = в газе) выше определённого значения • В этих случаях расход воздуха прирасчёте ферментёра принимают не ниже величины, при которой возникает такая критическая концентрация
Аэрация и масштабирование.ppt